Застосування анаболічних андрогенних стероїдів поза медичними показаннями: від фізіологічних ефектів до корекції спровокованого ними гіпогонадизму
Підготувала канд. мед. наук Тетяна Можина
В ендокринології існує небагато тем, які викликають таку велику кількість наукових і суспільних суперечок, як використання анаболічних андрогенних стероїдів (ААС) поза медичними показаннями з метою покращення спортивних результатів, фізичного стану, сексуальної функції або зовнішнього вигляду. Суперечки підігріваються обмеженістю даних щодо наслідків тривалого застосування ААС, ефективної корекції синдрому скасування ААС, а також зростанням поширеності їх використання в усьому світі.
Згідно з даними декількох систематичних аналізів у 2014 р. 2,9-4,0 млн американців віком 13-50 років приймали ААС [14], причому показник глобальної поширеності застосування ААС протягом життя становив 3,3% (в осіб чоловічої статі – 6,4%, у жінок – 1,6%) [17]. Усього через 6 років 36,6% іранських жінок-бодібілдерів отримували ААС [10], а у 2024 р. вже 53,05% чоловіків та 41,99% жінок, які використовували фізичне навантаження під час тренувань, приймали ААС [11], причому 25% чоловіків мали ознаки хвороб, спровокованих прийомом ААС [5].
Окрім спортивної медицини, ААС широко використовуються в педіатричній і дорослій ендокринології при чоловічому гіпогонадизмі з метою проведення тестостеронозамісної терапії (ТЗТ), застосовуються для стимуляції затриманого статевого розвитку або швидкого закриття епіфізарних зон у разі синдрому Марфана, конституціональної високорослості, лікування крипторхізму [2]. На відміну від ТЗТ, метою якої є відновлення вмісту тестостерону до нормативного фізіологічного рівня з досягненням еугонадального стану, нетерапевтичне застосування ААС спрямоване на досягнення певного результату без урахування подальших змін.
Фізіологічні ефекти ААС
Найвідомішим природним представником ААС є тестостерон; метаболізм цієї жиророзчинної молекули відбувається з утворенням так званих активних метаболітів, як-от дигідротестостерон та естрадіол. Тестостерон забезпечує статеву диференціацію, впливає на м’язи, кісткову тканину, сперматогенез, еритропоез, потенцію/лібідо, ліпідний обмін, психічний настрій. Дигідротестостерон чинить значний вплив на статеву диференціацію, сексуальність, вторинні статеві ознаки, сперматогенез, передміхурову залозу; під впливом естрадіолу перебувають кісткова тканина, закриття епіфізарних зон росту, регуляція настрою, ліпідного обміну, функціональної активності передміхурової залози [2].
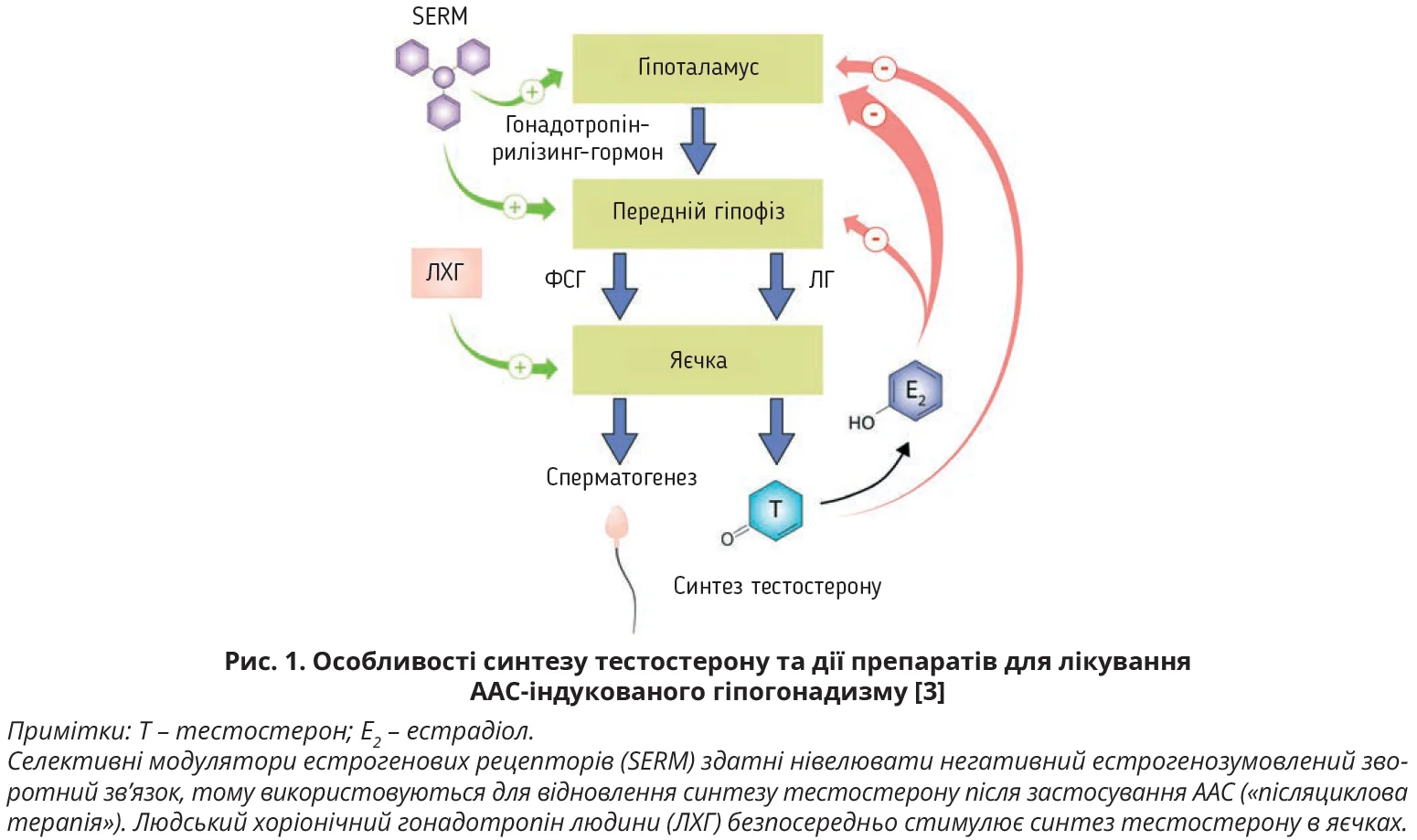
Як нейроендокринний гормон, тестостерон є частиною гіпоталамо-гіпофізарно-гонадної осі, яка також включає лютеїнізувальний (ЛГ) і фолікулостимулювальний гормон (ФСГ) (рис. 1). Гіпоталамус виділяє гонадотропін-рилізинг-гормон, який стимулює секрецію ФСГ, ЛГ у гіпофізі, що зумовлює секрецію гонадами тестостерону в чоловіків або естрадіолу, прогестерону в жінок. Регуляція гіпоталамо-гіпофізарно-гонадної осі відбувається відповідно до принципу негативного зворотного зв’язку залежно від рівня циркулювального тестостерону: при його підвищенні знижується активність гіпоталамо-гіпофізарно-гонадної осі, припиняється ендогенний синтез ФСГ, ЛГ, тестостерону [2].
Завдяки своїм фізіологічним андрогенним і анаболічним ефектам тестостерон забезпечує статеве дозрівання чоловіків, сприяючи росту волосся, активності сальних залоз, дозріванню сперми й появі лібідо, збільшенню синтезу білка та зменшенню його розпаду, підвищенню ліполітичної активності, зменшенню відсотка жиру в організмі та зростанню сухої маси тіла.
Побічна дія ААС
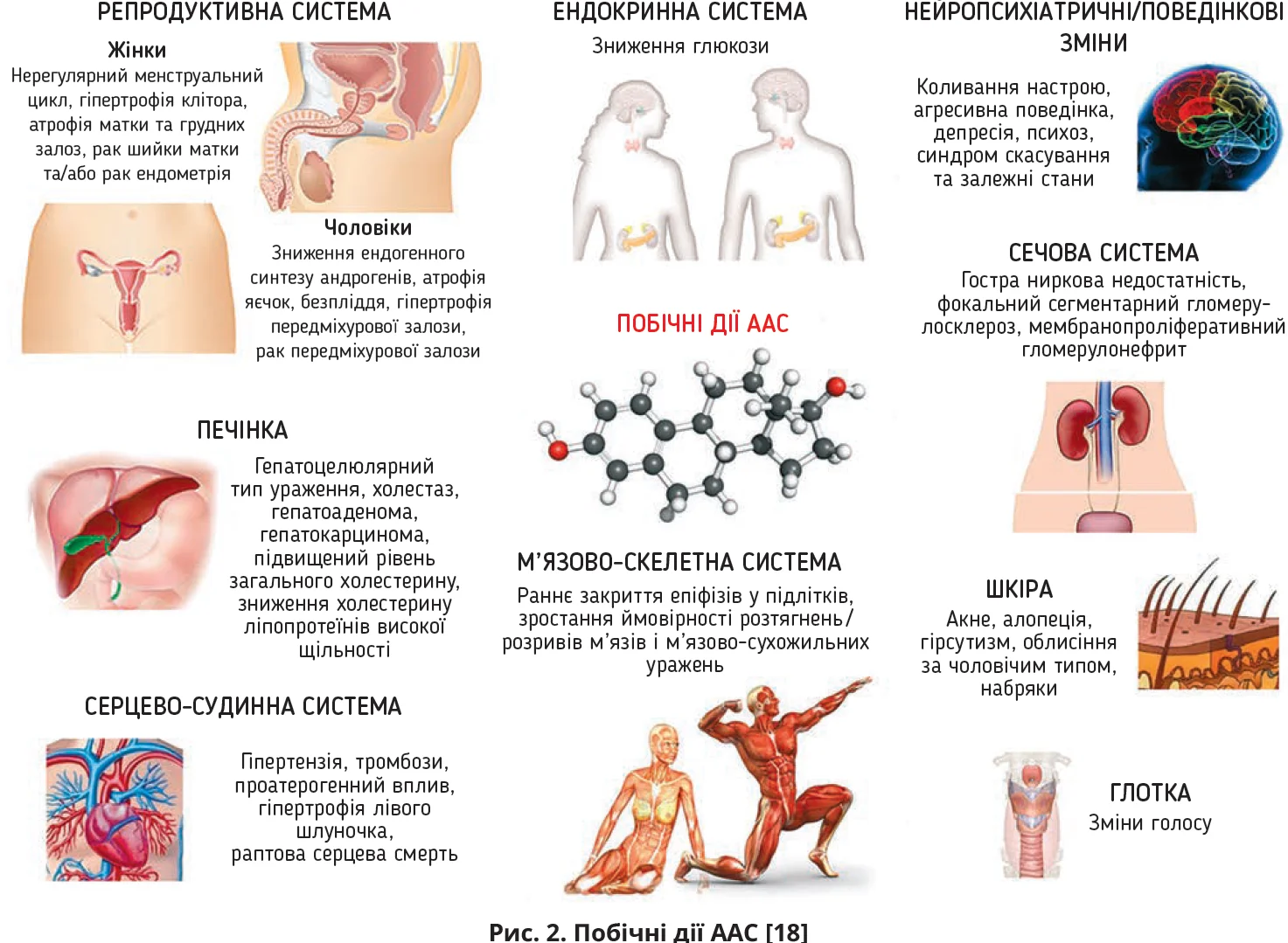
Тривале й неконтрольоване застосування ААС, особливо в надвеликих дозах, асоційоване з виникненням значних ризиків для здоров’я та життя: доведено негативний вплив на ендокринну, репродуктивну, серцево-судинну, легеневу, гепатобіліарну, нервову системи, а також вуглеводний (розвиток інсулінорезистентності), білковий і жировий обміни (рис. 2).
Застосування тестостерону при нормальній функції яєчок зумовлює зниження секреції власного тестостерону з атрофією яєчок, пригніченням сперматогенезу. Призначення навіть незначних доз ААС дівчатам/жінкам супроводжується низкою конституціональних змін: швидкою вірилізацією з появою гірсутизму, облисіння / загального гіпертрихозу, акне, зниженням тембру голосу, зменшенням молочних залоз, порушенням менструального циклу з розвитком аменореї, псевдогермафродитизму.
Використання ААС супроводжується непередбаченими коливаннями настрою, підвищеною збудженістю, агресивністю, депресією, які провокують порушення внутрішньородинних і соціальних зв’язків, появу суїцидальних думок [19] і насильницьких дій щодо інших [21].
Окрім цього, ААС призводять до розвитку кардіоміопатії [8], гіпертрофії лівого шлуночка та небезпечних для життя аритмій [20], а також стимулюють ренін-ангіотензин-альдостеронову систему, посилюють синтез ендотеліну, активних форм кисню, профібротичних, проапоптичних медіаторів і запальних цитокінів, що спричиняє розвиток артеріальної гіпертензії, зниження швидкості клубочкової фільтрації, порушення функції канальців і розвиток гострого/хронічного ураження нирок [4].
Прийом ААС призводить до зменшення рівнів ФСГ та ЛГ, які залишаються низькими протягом 3-6 місяців після припинення прийому ААС, відновлення їх концентрацій відбувається протягом 1 року [13]. Відмова від ААС не супроводжується миттєвим відновленням умісту загального тестостерону, він залишається низьким навіть протягом року після скасування ААС [13]. Застосування ААС асоціюється зі зниженням лібідо, еректильною дисфункцією [13], атрофією яєчок, оліго-/азооспермією, порушенням рухливості та морфології сперматозоїдів із подальшим розвитком ААС-індукованого безпліддя [6]. Після скасування ААС перші позитивні зміни в якості спермі відбуваються протягом 4 місяців, а для повного відновлення вироблення сперматозоїдів може знадобитися понад рік [15]; деякі спеціалісти вважають, що остаточне нівелювання негативного впливу на сперматогенез відбувається протягом 3 років [6].
Окремою проблемою застосування ААС є використання підробок, частка яких на чорному ринку становить 36%, неякісних препаратів – 37% [12]. Такі засоби можуть зовсім не містити активної речовини або містити її в іншій кількості, ніж зазначено на етикетці, мати у своєму складі невідповідний активний компонент або не всі / більше активних речовин, аніж зазначено на етикетці [12]. Застосування таких фальсифікованих/неякісних засобів частіше призводить до виникнення побічних дій, супроводжується поганою переносимістю та нестабільним/непередбачуваним клінічним ефектом.
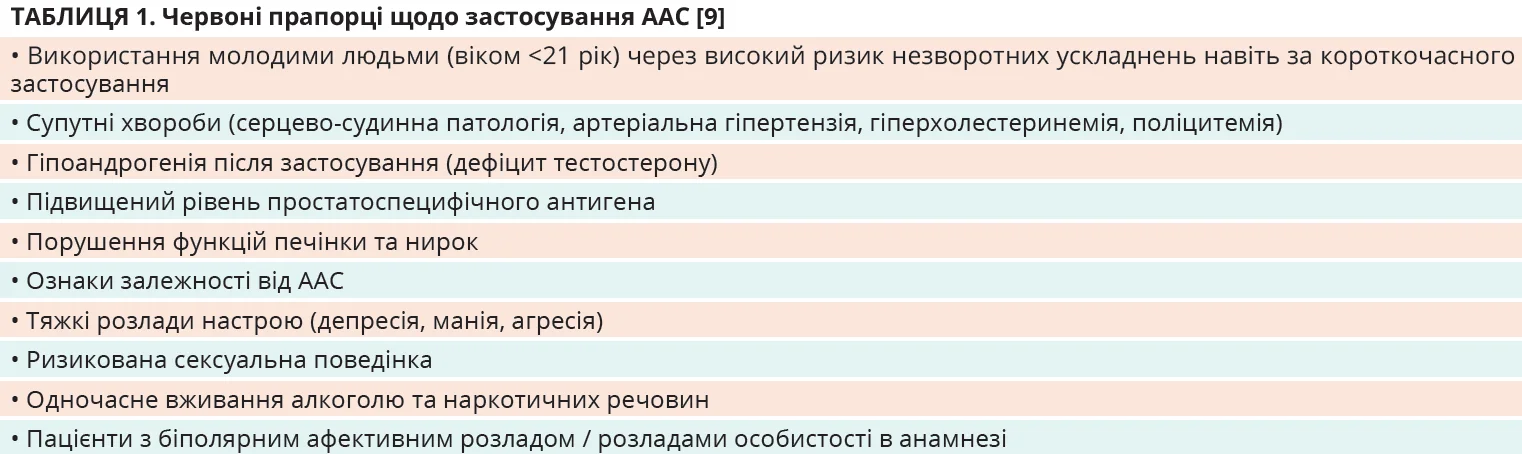
Зважаючи на ймовірні побічні ефекти, Австралійська робоча група рекомендує відмовитися від застосування ААС в осіб, у яких виявлено «червоні прапорці» (табл. 1).
Сучасні підходи до діагностики та лікування ААС-індукованого гіпогонадизму
Незважаючи на зростання кількості доказів негативного впливу зловживання ААС, потенційним стратегіям лікування ААС-індукованого гіпогонадизму (ААС-ІГГ) приділяється менше уваги [1]. Алгоритм лікування симптоматичної ААС-ІГГ, запропонований у 2014 р. (рис. 3), досі не оновлений; деякі лікарі продовжують його активно використовувати у своїй практичній діяльності після будь-якого курсу прийому ААС із метою збереження функції яєчок.
Нещодавно представлено протоколи для проведення скринінгових обстежень [22], стратегії зменшення шкоди [7] та фармакологічні втручання для відновлення фертильності після курсу ААС [16]. Австралійська робоча група рекомендує протягом 3 місяців після припинення прийому ААС виконати нейроендокринний аналіз крові (тестостерон, ЛГ, ФСГ, інсуліноподібний фактор росту-1, тиреотропний гормон, вільний Т4, простатоспецифічний антиген), ліпідограму, визначити рівні гемоглобіну, гематокриту, сечовини, електролітів, цистатину С, печінкових проб [22]. Спермограму слід оцінювати через 6 місяців після припинення прийому ААС, оскільки відновлення сперматогенезу потребує більше часу [22].
Стратегії зменшення шкоди засновані на роз’ясненні пацієнтам доцільності зменшення частоти прийому та дози ААС, мінімізації ускладнень у разі зловживання додаткових речовин, а також довготривалого моніторингу параметрів здоров’я [7].
Фармакологічний підхід до корекції ААС-ІГГ полягає в проведенні ТЗТ із застосуванням декількох груп препаратів: селективних модуляторів естрогенових рецепторів (SERM; кломіфен, тамоксифен), агоністів ЛГ-рецепторів (ЛХГ, рекомбінантний ЛГ), людського менопаузального гонадотропіну, рекомбінантного ФСГ, інгібіторів ароматази (анастрозол, летрозол) [2]. Зважаючи на різноманітні побічні дії, клініцисти намагаються застосовувати ААС із мінімальним андрогенним впливом і виразнішою анаболічною дією, щоб уберегти організм, особливо передміхурову залозу та серцево-судинну систему, від негативних наслідків. Із цією метою використовують анаболіко-андрогенний індекс, який характеризує силу анаболічного й андрогенного впливів. Залежно від анаболіко-андрогенного індексу ААС умовно поділяють на три групи: до першої входять ліки з тестостероноподібним ефектом, у яких співвідношення анаболічного ефекту до андрогенного дорівнює 1:1; другу групу становлять засоби з дигідротестостероноподібним впливом із вираженішою андрогенною дією (типовий представник – станозолол); третя група об’єднує препарати з нандролоноподібним ефектом, яким притаманна значна анаболічна та низька андрогенна активність (типові представники – нандролон, тренболон). Профілактика ААС-ІГГ передбачає кріоконсервацію яйцеклітин/сперматозоїдів для збереження фертильності в майбутньому [2].
За умови виникнення побічних ефектів на тлі ТЗТ рекомендується використовувати відповідну стратегію (табл. 2).
З огляду на основні та побічні дії тестостерону ТЗТ категорично протипоказана при місцево-поширеному/метастатичному раку простати, молочних залоз, грудей; ТЗТ не призначається чоловікам з активним бажанням мати дітей, високим гематокритом (>54%), неконтрольованою / погано контрольованою застійною серцевою недостатністю. Відносними протипоказаннями для ТЗТ є підвищений вихідний рівень гематокриту (48-50%), венозна тромбоемболія в сімейному анамнезі.
Висновки
АС являють собою родину гормонів, які використовують із медичною метою та поза медичними показаннями переважно спортсмени й люди, котрі ведуть активний спосіб життя, через здатність ААС збільшувати м’язову масу та силу. Наведений огляд літератури свідчить, що неоптимальне застосування/зловживання ААС провокує виникнення різноманітних несприятливих побічних ефектів, частина з яких може швидко регресувати після скасування ААС (дерматологічні зміни, еритроцитоз, гіпергемоглобінемія). Проте значна частина побічних дій ААС, яка пов’язана з негативним впливом на репродуктивну, гормональну, серцево-судинну, шлунково-кишкову та сечовивідну системи, здатна зберігатися протягом тривалого часу. Лабораторно-підтверджений ААС-ІГГ потребує призначення ТЗТ під ретельним медичним наглядом.
Література
- Anawalt B.D. Diagnosis and management of anabolic androgenic steroid use. J. Clin. Endocrinol. Metab. 2019; 104 (7): 2490-2500. doi: 10.1210/jc.2018-01882.
- Azevedo R.A., Gualano B., Teixeira T., et al. Abusive use of anabolic androgenic steroids, male sexual dysfunction and infertility: an updated review. Front. Toxicol. 2024; 6: 1379272. doi: 10.3389/ftox.2024.1379272.
- Bond P., Smit D., de Ronde W. Anabolic-androgenic steroids: how do they work and what are the risks? Front. Endocrinol. 2022; 13: 1059473. doi: 10.3389/fendo.2022.1059473.
- Davani-Davari D., Karimzadeh I., Khalili H. The potential effects of anabolic-androgenic steroids and growth hormone as commonly used sport supplements on the kidney: a systematic review. BMC Nephrol. 2019; 20 (1): 198. doi: 10.1186/s12882-019-1384-0.
- de Zeeuw T.I., Brunt T.M., van Amsterdam J., et al. Anabolic androgenic steroid use patterns and steroid use disorders in a sample of male gym visitors.Eur. Addict. Res. 2023; 29 (2): 99-108. doi: 10.1159/000528256.
- Esposito M., Salerno M., Calvano G., et al. Impact of anabolic androgenic steroids on male sexual and reproductive function: a systematic review. Panminerva Med. 2023; 65 (1): 43-50. doi: 10.23736/S0031-0808.22.04677-8.
- Eu B., Dawe J., Dunn M., et al. Impact of harm reduction practice on the use of non-prescribed performance and image-enhancing drugs: the PUSH! Audit. Aust. J. General Pract. 2023; 52 (4): 197-202. doi: 10.31128/AJGP-04-22-6402.
- Fadah K., Gopi G., Lingireddy A., et al. Anabolic androgenic steroids and cardiomyopathy: an update. Front. Cardiovasc. Med. 2023; 10: 1214374. doi: 10.3389/fcvm.2023.1214374.
- GP guide to harm minimisation for patients using non-prescribed anabolic-androgenic steroids (AAS) and other performance and image enhancing drugs (PIEDs). Available at: https://www.snhn.net/wp-content/uploads/2022/06/GP-Guide-to-Steroid-Harm-Minimisation-Print-Version-2022.pdf.
- Hoseini M., Yousefi B., Khazaei A. The prevalence of anabolic-androgenic steroids abuse, knowledge and attitude of their side effects, and attitude toward them among the female bodybuilding athletes in Kermanshah. J. Adv. Biomedical. Sci. 2020; 10 (3): 2439-2447.
- Hoseini R., Hoseini Z. Exploring the prevalence of anabolic steroid use among men and women resistance training practitioners after the COVID-19 pandemic. BMC Public Health. 2024; 24 (1): 798. doi: 10.1186/s12889-024-18292-5.
- Magnolini R., Falcato L., Cremonesi A., et al. Fake anabolic androgenic steroids on the black market – a systematic review and meta-analysis on qualitative and quantitative analytical results found within the literature. BMC Public Health. 2022; 22 (1): 1371. doi: 10.1186/s12889-022-13734-4.
- Mulawkar P.M., Maheshwari P.N., Gauhar V., et al. Use of anabolic-androgenic steroids and male fertility: a systematic review and meta-analysis. J. Hum. Reprod. Sci. 2023; 16 (4): 268-285. doi: 10.4103/jhrs.jhrs_90_23.
- Pope H.G. Jr, Kanayama G., Athey A., et al. The lifetime prevalence of anabolic-androgenic steroid use and dependence in Americans: current best estimates.Am. J. Addict. 2014; 23 (4): 371-377. doi: 10.1111/j.1521-0391.2013.12118.x.
- Rajmil O., Moreno-Sepulveda J. Recovery of spermatogenesis after androgenic anabolic steroids abuse in men. A systematic review of the literature. Actas Urol. Esp. (Engl. Ed.). 2024; 48 (2): 116-124. English, Spanish. doi: 10.1016/j.acuroe.2023.07.007.
- Rizzuti A., Alvarenga C., Stocker G., et al. Early pharmacologic approaches to avert anabolic steroid-induced male infertility: a narrative review. Clin. Ther. 2023; 45 (11): e234-e241. doi: 10.1016/j.clinthera.2023.09.003.
- Sagoe D., Molde H., Andreassen C., et al. The global epidemiology of anabolic-androgenic steroid use: a meta-analysis and meta-regression analysis. Ann.Epidemiol. 2014; 24 (5): 383-98. doi: 10.1016/j.annepidem.2014.01.009.
- Sessa F., Salerno M., Di Mizio G., et al. Anabolic androgenic steroids: searching new molecular biomarkers. Front. Pharmacol. 2018; 9: 1321. doi: 10.3389/fphar.2018.01321.
- Sharma A., Grant B., Islam H., et al. Common symptoms associated with usage and cessation of anabolic androgenic steroids in men. Best Pract. Res. Clin. Endocrinol. Metab. 2022; 36 (5): 101691. doi: 10.1016/j.beem.2022.101691.
- Torrisi M., Pennisi G., Russo I., et al. Sudden cardiac death in anabolic-androgenic steroid users: a literature review. Medicina (Kaunas). 2020; 56 (11): 587. doi: 10.3390/medicina56110587.
- van de Ven K., Malouff J., McVeigh J. The association between the nonmedical use of anabolic-androgenic steroids and interpersonal violence: a meta-analysis. Trauma Violence Abuse. 2024; 25 (2): 1484-1495. doi: 10.1177/15248380231186150.
- van de Ven K., Eu B., Jackson E., et al. GP guide to harm minimisation for patients using non-prescribed anabolic-androgenic steroids (AAS) and other performance and image enhancing drugs (PIEDs). 2020. Available at: https://www.snhn.net/steroid-harm-minimisation.
- Rahnema C., Lipshultz L., Crosnoe L., et al. Anabolic steroid-induced hypogonadism: diagnosis and treatment. Fertil. Steril. 2014; 101 (5): 1271-1279. doi: 10.1016/j.fertnstert.2014.02.002.