Всесвітній день стеатозу печінки – 2025: вітчизняний контекст
Підготувала канд. мед. наук Тетяна Можина
Червень став знаковим для міжнародної медичної спільноти, адже протягом місяця відбувалася громадська освітня кампанія, присвячена підвищенню обізнаності щодо захворювань печінки в різних країнах світу. Відома раніше як Міжнародний день неалкогольного стеатогепатиту – НАСГ (International NASH Day), цього року вона була проведена під новою назвою – Global Fatty Liver Day 2025. Зміна назви супроводжувалася розширенням концептуальних меж заходу. Якщо раніше фокус уваги переважно зосереджувався саме на НАСГ, то тепер акцент було зроблено на всьому клінічному спектрі метаболічно-асоційованої стеатотичної хвороби печінки (МАСХП), включно зі стеатозом, метаболічно-асоційованим стеатогепатитом (МАСГ), фіброзом печінки та гепатоцелюлярною карциномою. Така еволюція заходу відображає сучасні погляди на проблему стеатотичної хвороби печінки (СХП). Україна приєдналася до всесвітньої ініціативи: 26 червня 2025 р. за підтримки компанії Abbott у межах наукового заходу «Допомога лікарю та пацієнту: практичний досвід» відбувся міжнародний сателітний симпозіум, у якому взяли участь провідні закордонні та вітчизняні фахівці різноманітних спеціальностей.
Відкрив наукову програму симпозіуму професор David Jones (Велика Британія), котрий представив доповідь «Сучасні рекомендації з ведення MAСХП: сильні сторони, недоліки й «білі плями». У своєму виступі він зосередився на ретельному аналізі положень спільних рекомендацій EASL/EASD/EASO з діагностики та лікування МАСХП (2024). Доповідач запропонував розглянути цю настанову не лише як узагальнений документ, а як практичний матеріал, який має свої сильні та слабкі сторони. Саме тому професор умовно поділив свою доповідь на три частини: сильні сторони, недоліки та невисвітлені аспекти.
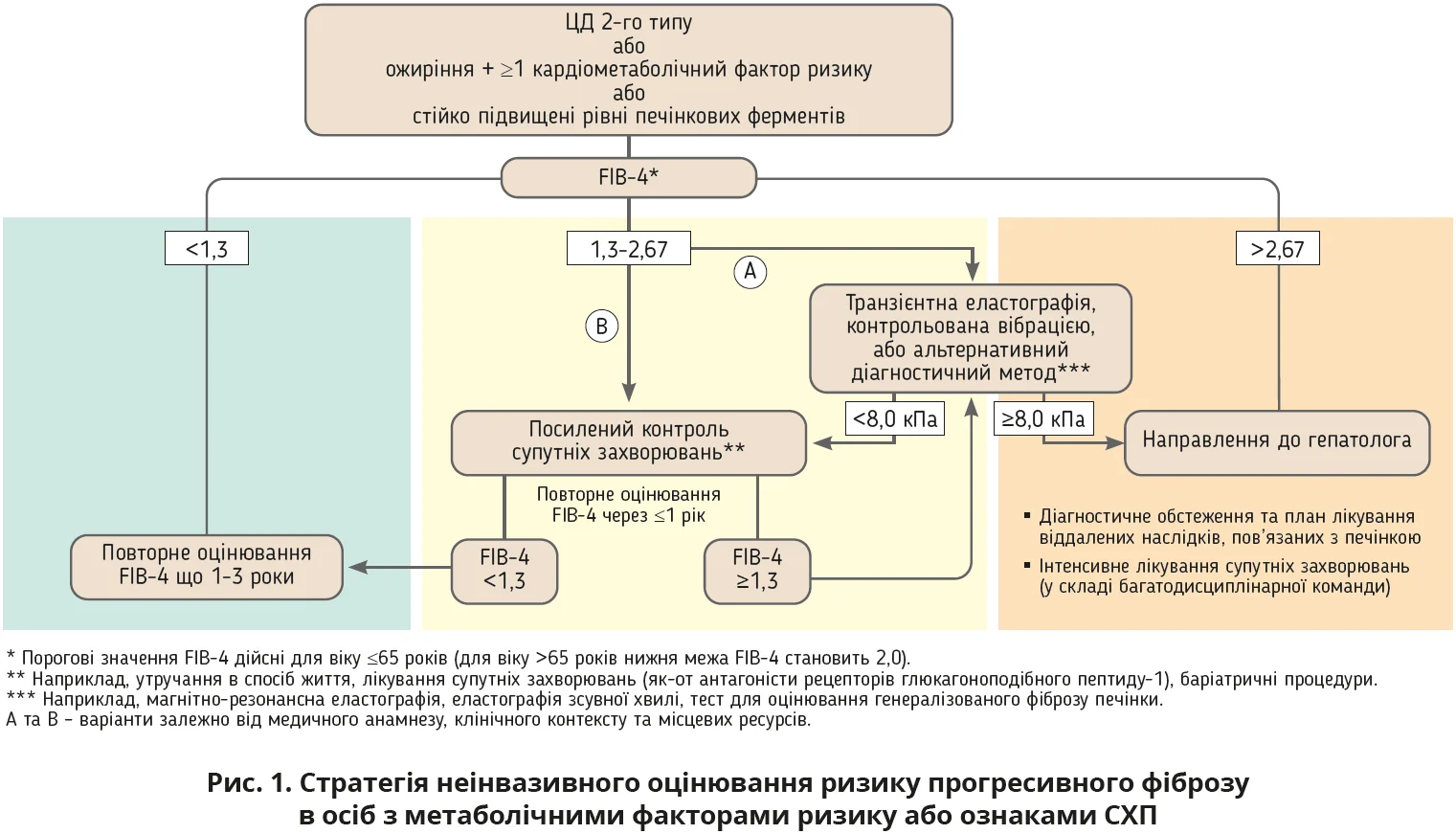
Сильними сторонами настанови можна вважати ґрунтовний і скрупульозний підхід до діагностики захворювання та стратифікації ризику. Нові рекомендації не тільки запроваджують нову чітку дефініцію та класифікацію СХП, але й наголошують на потребі послідовного й обов’язкового оцінювання прогресивного фіброзу. Стратифікація ризику з акцентом на прогресивному фіброзі як головному предикторі несприятливих наслідків проводиться на підставі розрахунку індексу FIB-4 (рис. 1).
Автори настанови підкреслюють, що випадкове виявлення стеатозу печінки має спонукати до оцінювання потенційної етіології СХП, а також до проведення тестів на наявність вираженого фіброзу. Водночас ізольований стеатоз не завжди є проявом патології, але якщо він супроводжується підвищеним рівнем печінкових ферментів або ознаками фіброзу, то необхідно проводити неінвазивне оцінювання фіброзу за допомогою еластографії печінки, визначення біомаркерів, FIB-4 та NAFLD Fibrosis Score тощо.
Рекомендації заслуговують на високу оцінку завдяки чіткому визначенню факторів ризику та коморбідних захворювань, які здатні провокувати чи прискорювати розвиток і прогресування МАСХП: цукровий діабет (ЦД) 2-го типу, артеріальна гіпертензія (АГ), атерогенна дисліпідемія, серцево-судинні (СС) хвороби, хронічна ниркова недостатність, ожиріння. Особлива увага приділена немедикаментозному веденню хворих на МАСХП і ролі модифікації способу життя в нормалізації стану пацієнтів. Настанова підкреслює необхідність стійкого зниження маси тіла й утримання досягнутої оптимальної ваги, адже зменшення ваги щонайменше на 7% дає змогу подолати запальний процес, а втрата ≥10% ваги є запорукою зниження інтенсивності фіброзу. Наголошується на доцільності дотримання середземноморської дієти, обмеженні вживання ультраобробленої їжі, солодких напоїв, продуктів з високим умістом цукру та насичених жирів.
Уперше в рекомендаціях зазначається ефективність ресметирому, селективного агоніста рецепторів гормонів щитоподібної залози, який імітує дію біологічно активних речовин, що відіграють важливу роль у метаболізмі ліпідів. У рандомізованому контрольованому дослідженні (РКД) ІІІ фази MAESTRO-NASH ресметиром довів свою здатність забезпечувати клінічно значущу регресію фіброзу та стеатогепатиту у хворих на НАСГ без цирозу. Це історичний момент, адже тепер існує затверджена цільова фармакотерапія нециротичної МАСХП.
Але деякі питання ще потребують подальшої роботи. До категорії «Недоліки» можна віднести формулювання рекомендацій у вигляді можливих варіантів дій, а не чітких клінічних алгоритмів. Наприклад, за наявності стеатозу печінки передбачаються різні сценарії дій: від очікувального нагляду до розширеного дообстеження. Такий підхід створює деяку невизначеність для спеціалістів-практиків. Неоднозначне ставлення до скринінгу СХП: загальний популяційний скринінг не рекомендований, але водночас передбачається поглиблене обстеження осіб з факторами ризику. Питання, коли саме починати скринінг, є дискутабельним і потребує чіткішого висвітлення.
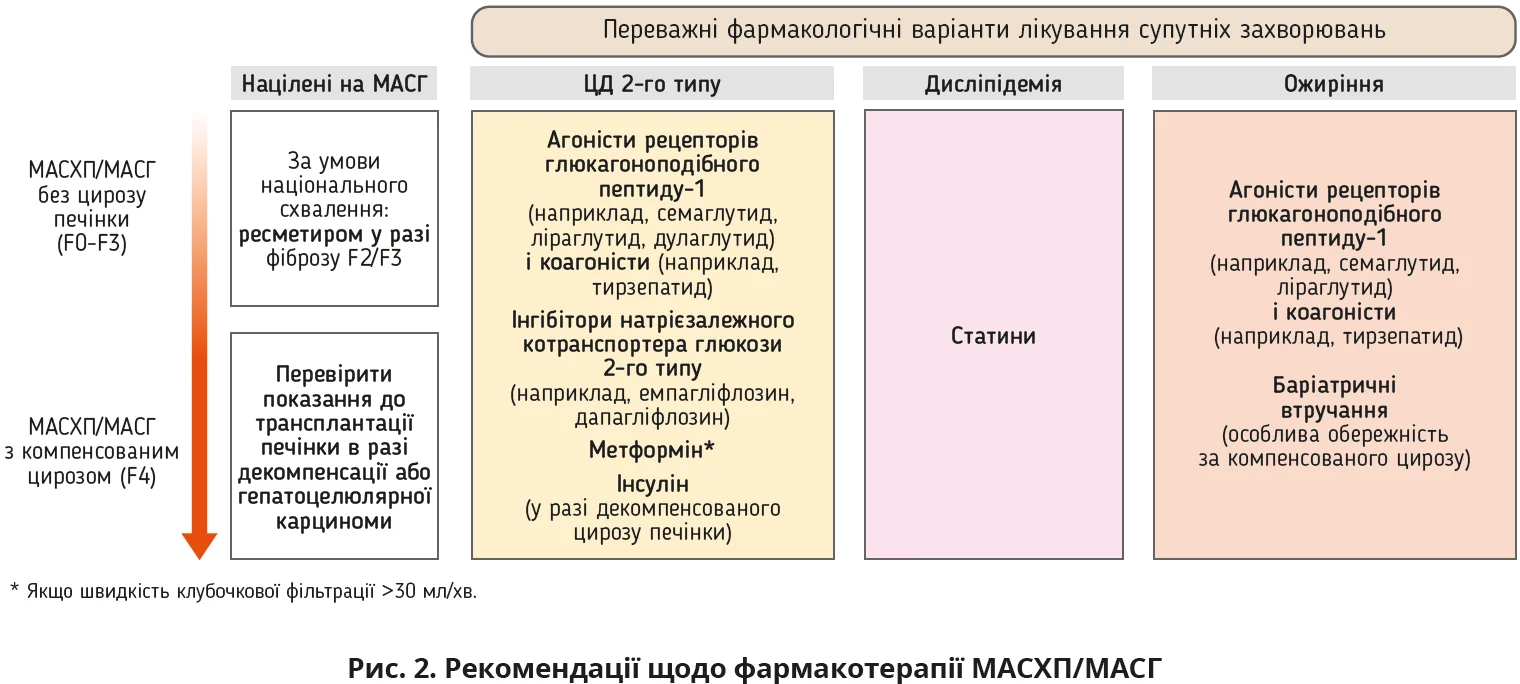
Велику дискусію також викликає питання фармакотерапії, адже ресметиром схвалено для лікування вузької категорії пацієнтів: його доцільно призначати тільки хворим з підтвердженим фіброзом F2-3 без цирозу, тоді як пацієнтам з ≤F1 і F4 цей препарат протипоказаний. Окрім цього, жоден інший препарат – вітамін Е, агоністи глюкагоноподібного пептиду, аналог глікопегільованого фактора росту фібробластів-21 тривалої дії або агоністи Pan-PPAR (препарати, які одночасно активують кілька підтипів рецепторів, що активуються пероксисомними проліфераторами – PPAR) – не рекомендований до використання через відсутність доведеної гістологічної ефективності. Це залишає величезну групу пацієнтів без фармакотерапевтичних опцій.
У рекомендаціях принципово бракує обговорення типових симптомів МАСХП. Категорію «Невисвітлені аспекти» очолює головний недолік – відсутність навіть згадування теми гепатогенної втоми, зниження життєвої енергії, тривожності, емоційного вигорання. І це парадоксально: за даними досліджень, хворі на МАСХП часто скаржаться на гепатогенну втому, яка суттєво знижує якість життя. Замовчується інше важливе питання – внутрішньопечінковий холестаз (ВПХ), який діагностують у 10-20% пацієнтів з MAСХП. Низка РКД свідчить, що значний ВПХ асоціюється з тяжчим перебігом і значнішою гепатогенною втомою; але в настанові не розглядаються клінічні наслідки такого поєднання. У рекомендаціях відсутній розділ, присвячений питанню комунікації з пацієнтами, психологічній підтримці або особливостям тривалого супроводу. Це також можна розглядати як значущий недолік, оскільки MAСХП є хронічним захворюванням, успіх лікування котрого залежить від мотивації та настрою пацієнта.
Отже, нові рекомендації EASL/EASD/EASO з діагностики та лікування СХП (2024) є значним кроком уперед, адже дають чіткі орієнтири щодо стратифікації ризику та пропонують чіткий алгоритм дій щодо неінвазивного оцінювання фіброзу, підтримують зміни способу життя як основу немедикаментозної терапії та вперше затверджують ресметиром як схвалений засіб фармакотерапії. Водночас вони ігнорують клінічно значущі симптоми, залишають хворих із цирозом печінки без альтернативної медикаментозної підтримки, не дають чітких відповідей на деякі запитання. Зазначені недоліки потребують скорішого вирішення.
Продовжив наукову програму заходу президент Української гастроентерологічної асоціації, доктор медичних наук, професор Ігор Скрипник. Його доповідь «МАСГ у світлі клінічних рекомендацій 2024-2025 років: виклики сучасності й український контекст» стала логічним продовженням симпозіуму.
МАСГ стрімко перетворюється на глобальний клінічний і соціальний виклик, який набуває рис неінфекційної пандемії. На відміну від простого стеатозу МАСГ є прогресивним варіантом МАСХП, який перебігає з поєднанням стеатозу, запалення, ушкодження гепатоцитів, формування фіброзу. Згідно з епідеміологічними даними майже 20-30% загальної популяції мають МАСХП, з них ≈25% страждає на МАСГ. Це означає, що понад 115 млн осіб у всьому світі живуть із цією патологією, в деяких випадках навіть без підтвердженого діагнозу. Невдовзі ситуація погіршиться, адже згідно з прогнозами у 2030 р. захворюваність на МАСХП сягне 357 млн осіб.
Рекомендації Американської асоціації з вивчення хвороб печінки (AASLD, 2023) та Європейської асоціації з вивчення печінки (EASL, 2024) чітко визначають фактори ризику й підходи до діагностики. Усім пацієнтам з ознаками стеатозу чи підозрою на МАСГ за наявності ожиріння або інших метаболічних факторів ризику доцільно проводити оцінювання прогресивного фіброзу за допомогою FIB-4 (рис. 1). Хворим з високим ризиком (ЦД 2-го типу, ожиріння, цироз у родинному анамнезі, вживання алкоголю) рекомендується виконати неінвазивні (еластографія, ультразвукове дослідження (УЗД), біомаркери) дослідження; повторювати зазначену стратифікацію ризику доцільно що 1-2 роки, використовуючи FIB-4 (рис. 2). Така рекомендація може бути легко застосована у вітчизняній амбулаторній практиці. Біопсія печінки не вважається прийнятним рутинним способом моніторингу перебігу хвороби; натомість динаміка АЛТ, маси тіла, результатів візуалізаційних методів досліджень (УЗД, еластографія) можуть бути використані як сурогатні показники, за якими можна оцінювати ефективність терапії: зниження АЛТ на ≥17 Од/л асоційовано з позитивною динамікою активності МАСГ.
Підходи до ведення хворих на МАСГ ґрунтуються на зміні способу життя. Оптимальною дієтичною стратегією визнано середземноморський раціон зі збільшенням частки ненасичених жирів, обмеженням цукрів, уживанням клітковини. Фізична активність рекомендована всім категоріям пацієнтів незалежно від маси тіла.
У певних когортах передбачається застосування різних лікарських засобів: у хворих на ожиріння або ЦД 2-го типу перевага віддається семаглутиду, в пацієнтів з компенсованим цирозом і збереженою функцією нирок – метформіну, за наявності високого СС-ризику підтримується призначення статинів. Водночас застосування вітаміну Е дещо обмежується через потенційне зростання СС-ризиків і збільшення ймовірності розвитку раку простати.
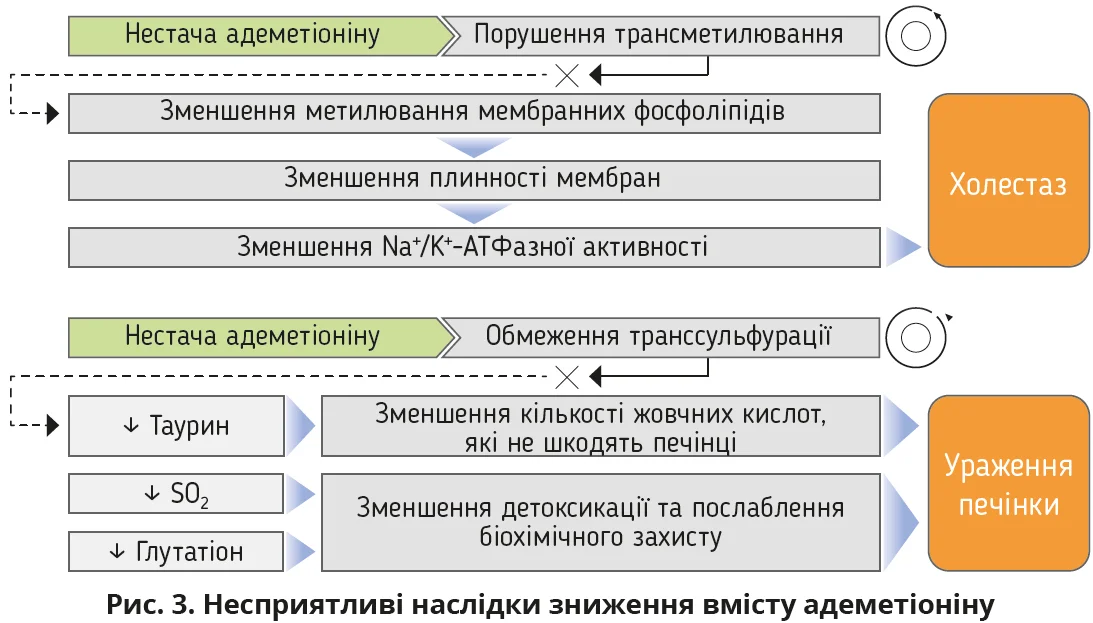
На особливу увагу заслуговує зниження рівня адеметіоніну, ендогенної сполуки та похідної амінокислоти метіоніну. Це створює умови для ураження печінки, зростання активності запальних процесів, виникнення незворотних структурних і дистрофічних змін у печінці (рис. 3). Відновлення його рівня добре впливає на ключові патогенетичні ланки МАСГ: підвищується вміст глутатіону, змінюється метилювання ДНК, знижується експресія прозапальних цитокінів (фактор некрозу пухлин-α), інгібується синтез колагену 1-го типу.
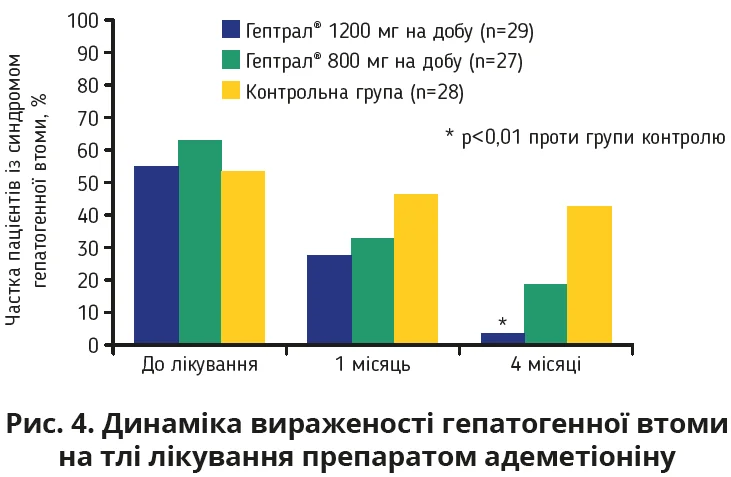
Адеметіонін запобігає прогресуванню ВПХ при МАСХП, активує синтез ендогенного антиоксиданту глутатіону, стимулює синтез ліпопротеїнів дуже низької щільності, які беруть участь у виведенні тригліцеридів (ТГ) з печінки, що сприяє зниженню ступеня стеатозу та покращує гістологічну структуру печінки за даними УЗД. Адеметіонін зменшує такий типовий, хоч і неспецифічний, симптом ВПХ, як гепатогенна втома, котра суттєво впливає на різноманітні аспекти життєдіяльності пацієнтів, включно з фізичною активністю (73%), сімейним життям (57%) і продуктивністю праці (30%). Згідно з даними РКД призначення оригінального препарату адеметіоніну хворим із вторинним ВПХ сприяє нівелюванню ознак ВПХ та 2-разовому зменшенню вираженості гепатогенної втоми (рис. 4). Призначення адеметіоніну дає змогу не лише покращити морфофункціональні маркери ураження печінки, а й поліпшити якість життя пацієнтів.
Отже, в контексті актуальних клінічних рекомендацій МАСГ має розглядатися як пандемічна хвороба, яка потребує системного та міждисциплінарного підходу, призначення патогенетично спрямованої терапії із застосуванням адеметіоніну.
Злагоджене тріо провідних спеціалісток – гастроентеролога Олени Баки, кардіолога Лариси Міщенко й ендокринолога Любові Соколової – презентувало клінічний випадок «Case challenge. Роль мультидисциплінарної команди у веденні пацієнта з МАСГ».
Олена Бака представила дані пацієнта К., 46 років, який звернувся по медичну допомогу з приводу неконтрольованої АГ: середні цифри «робочого» артеріального тиску (АТ) становили 150/100 мм рт. ст., епізодично вони підіймалися до 180/110 мм рт. ст. Серед скарг домінували загальна втома й головний біль; в анамнезі життя звернули увагу на 25-річний стаж паління та щоденне вживання алкоголю (0,5-1 л пива; 1-2 рази на тиждень – міцні напої), низький рівень фізичної активності (3-5 тис. кроків на добу). АГ діагностовано близько року тому, відтоді пацієнт приймає фіксовану комбінацію периндоприл/індапамід (4/1,25 мг) 1 раз на добу. Під час об’єктивного обстеження діагностували ожиріння 2-го ступеня (маса тіла – 118 кг, зріст – 178 см, індекс маси тіла (ІМТ) – 37,2 кг/м²), але ознак органної недостатності не виявили. Під час ехокардіографії констатували концентричну гіпертрофію міокарда лівого шлуночка (ЛШ), діастолічну дисфункцію 1-го типу, збережену фракцію викиду ЛШ; УЗД органів черевної порожнини виявило стеатоз печінки. За результатами лабораторних досліджень відзначили помірний цитолітичний (АЛТ – 56 Од/л) синдром, ознаки ВПХ, комбіновану дисліпідемію (загальний холестерин – 7,21 ммоль/л, ліпопротеїни низької щільності – 3,46 ммоль/л, ліпопротеїни високої щільності – 1,0 ммоль/л, ТГ – 5,6 ммоль/л) за збереженого рівня глікемії натще та приграничного рівня HbA1c (6,2%).
Отже, пацієнт має всі основні компоненти кардіометаболічного ризику: ожиріння, АГ, дисліпідемію, переддіабет і МАСГ. Роль алкоголю в розвитку стеатогепатиту потребує уточнення з огляду на щоденне вживання, проте загальні клінічні та лабораторні маркери свідчать на користь МАСГ.
Докторка медичних наук, професорка Лариса Міщенко підкреслила, що згідно із сучасним розумінням патогенезу СХП МАСГ виникає на тлі системного метаболічного розладу, який охоплює декілька органів-мішеней (печінка, серце, нирки, підшлункова залоза), спричиняє підвищення захворюваності та смертності як від серцево-судинних, так і несерцево-судинних причин. Цей розлад має гетерогенну етіологію з різноманітними, хоча й схожими за наслідками, патогенетичними механізмами. Хронічне персистування гіперглікемії, інсулінорезистентності, дисліпідемії, а також субклінічне запалення й оксидативний стрес спричиняють формування МАСГ і подальший розвиток фіброзу. Особливе значення має поєднання метаболічних і поведінкових чинників ризику: куріння, гіподинамія, надлишкове споживання солі й алкоголю, відсутність належного контролю глікемії та ліпідів. У пацієнта К. відзначено прогностично значущі зміни: його ІМТ перевищує 35 кг/м², ТГ >5 ммоль/л, HbA1c перебуває в діапазоні 5,7-6,4%, АТ >140/90 мм рт. ст., стеатоз печінки, постійне алкогольне навантаження. Він також має високий СС-ризик згідно з показником SCORE2 (22%). Зважаючи на перелічені фактори, встановлено попередній діагноз: гіпертонічна хвороба ІІ стадії, 2-го ступеня, концентрична гіпертрофія ЛШ, ризик дуже високий (SCORE2 – 22%), серцева недостатність стадії В, хронічна серцева недостатність 0. Ожиріння 2-го ступеня. Комбінована дисліпідемія. Метаболічна алкогольна хвороба печінки, МАСГ. Переддіабет.
Докторка медичних наук, професорка Любов Соколова розглянула способи немедикаментозного лікування пацієнта. Терапевтична стратегія ґрунтується на комплексному підході з акцентом на модифікацію способу життя: пацієнту слід дотримуватися середземноморської дієти й обмежити калораж (до 1200 ккал на добу), підвищити рівень фізичної активності (щоденна ходьба, плавання, збільшення кроків).
Олена Бака додала, що з огляду на наявність стеатозу та підвищення АЛТ доцільно провести дообстеження й визначити показник FIB-4, рівні AСT, загального білірубіну та його фракцій, γ-глутамілтранспептидази, лужної фосфатази, альбуміну, коагулограму, виконати еластографію печінки та/або фібротест. У фармакотерапії доцільно відстежувати два напрями: гепатопротекцію й оптимізацію СС-профілю. З одного боку, згідно із сучасними рекомендаціями EASL (рис. 2) пацієнту з МАСГ може бути призначено ресметиром, якщо під час еластографії буде діагностовано фіброз печінки стадії F2-3. З іншого боку, цей препарат поки не зареєстровано в Україні, а його приймання супроводжується різноманітними побічними діями, найпоширенішими з яких є діарея (до 33%), нудота (до 22%), свербіж (до 11%) і блювання (до 11%).
Розглядаючи можливі варіанти гепатопротекції, слід узяти до уваги ймовірне порушення адеметіонінозалежного метаболізму. Адеметіонін відіграє ключову роль у таких метаболічних процесах, як амінопропілювання (забезпечує стабільність ДНК і РНК, ріст і диференціювання клітин, зниження кількості прозапальних цитокінів), трансметилювання (залог синтезу фосфатидилхоліну, стабілізації клітинних мембран, вироблення нейротрансмітерів) і транссульфурація (необхідна для вироблення глутатіону та процесів детоксикації). При дефіциті адеметіоніну знижується метилювання мембран, порушується функціонування транспорту жовчі, розвивається холестаз, зростає оксидативний стрес (рис. 3). Фармакологічний вплив на ці процеси за допомогою адеметіоніну може сприяти зменшенню вираженості запалення та фіброзу печінки. Результати клінічних досліджень доводять ефективність адеметіоніну в нівелюванні цитолітичного та холестатичного синдромів, зменшення інтенсивності жовтяниці, шкірного свербежу, втомлюваності (рис. 5).
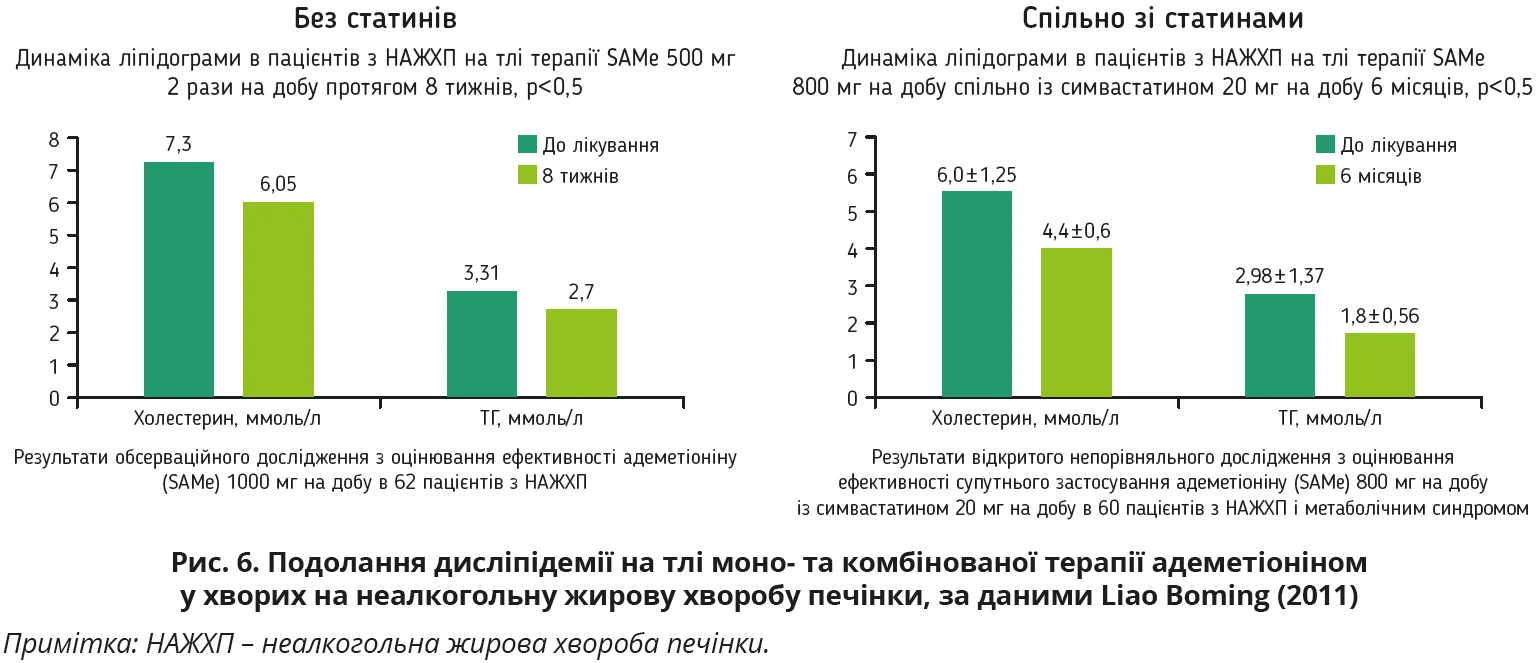
Як монотерапія адеметіоніном, так і комбінація статинів з адеметіоніном чинять сприятливий вплив на ліпідний обмін, забезпечуючи вірогідне зниження рівнів загального холестерину, ТГ (рис. 6), а також зменшення економічного тягаря хвороби: скорочення тривалості перебування на лікарняному та зменшення кількості відвідувань лікаря.
Враховуючи наведені дані, а також скарги на підвищену втому, помірний цитолітичний синдром, пацієнту призначено оригінальний препарат адеметіоніну: внутрішньовенне ведення в дозі 1000 мг на добу протягом 2 тижнів з подальшим переходом на пероральне приймання по 500 мг 2 рази на добу протягом 3 місяців.
Лариса Міщенко наголосила, що поточну гіпотензивну терапію, яку отримував хворий (периндоприл/індапамід 4/1,25 мг), можна вважати недостатньою. З огляду на гіпертрофію ЛШ та діастолічну дисфункцію доцільно підвищити дозування цієї комбінації до 8/2,5 мг і додати моксонідин 0,4 мг; для корекції змішаної дисліпідемії – фенофібрат.
Подальше спостереження за пацієнтом дасть змогу оцінити ефективність призначеної терапії; на подальших зустрічах спікерки планують доповісти результати дообстеження пацієнта К. та розглянути корекцію призначень.
СХП, МАСХП залишаються актуальною глобальною проблемою. Стрімке поширення МАСГ надає захворюванню рис неінфекційної пандемії. МАСГ слід розглядати як прояв системного метаболічного розладу, для подолання котрого потрібна злагоджена робота багатодисциплінарної команди із залученням гастроентеролога, кардіолога, ендокринолога, дієтолога. Призначення препарату адеметіоніну дає змогу покращити функціональні маркери ураження печінки, зменшити вираженість ВПХ, нівелювати гепатогенну втому та поліпшити якість життя пацієнтів.