Вплив мікробіоти кишківника на перебіг автоімунного тиреоїдиту та зв’язок із результатами вагітності
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Автоімунний тиреоїдит (АІТ) являє собою опосередковану Т-лімфоцитами органоспецифічну автоімунну хворобу, що переважно проявляється як тиреоїдит Хашімото та хвороба Ґрейвса. Частота АІТ становить близько 5%; ця патологія є поширенішою серед жінок дітородного віку. АІТ супроводжують лімфоцитарна інфільтрація щитоподібної залози (ЩЗ), підвищений титр антитиреоїдних антитіл, зокрема до тиреопероксидази (АТПО) та тиреоглобуліну, а також гіпотиреоз різного ступеня. Лімфоцити, які інфільтрують ЩЗ, чинять безпосередню цитотоксичну дію на фолікулярні клітини й опосередковано погіршують функцію останніх, провокуючи каскади цитокінових реакцій. У результаті цих процесів розмір ЩЗ збільшується, розвивається фіброз, рівні тиреоїдних гормонів знижуються. Водночас погіршуються скоротливість серця, моторика кишківника, підвищується ризик розвитку ішемічної хвороби серця, гіперліпідемії, неплідності, нейросенсорних і м’язово-скелетних розладів.
Етіологія АІТ дотепер невідома. Вважається, що ця хвороба є наслідком як генетичних чинників, так і факторів довкілля, від взаємодії яких залежать фенотип і тяжкість АІТ.
Факторами довкілля, що спричиняють розвиток АІТ, є надлишкове вживання йоду, дефіцит селену, заліза, цинку та вітаміну D, споживання глютену й алкоголю, надмірні стреси, вагітність, уживання інтерферону й імуномодуляторів (іпримумабу, алензумабу). Нові дослідження показують, що мікробіота кишківника теж може відігравати важливу роль у розвитку АІТ.
Зв’язок між АІТ і мікробіотою кишківника
Мікробіота кишківника – це узагальнювальний термін для комплексу мікроорганізмів, які населяють кишківник людини. До цих мікроорганізмів належать бактерії, грибки, віруси й археї, всього близько 2000 видів. Основними типами бактерій кишківника є Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria та Verrucomycetes, причому на частку Firmicutes і Bacteroidetes припадає >90% усієї мікробіоти. Тип Firmicutes включає понад 200 родів бактерій, у тому числі Lactobacillus, Mycoplasma, Bacillus і Clostridium.
На склад і стан мікробіоти впливають генетика, харчування та вплив довкілля, котрі можуть провокувати ріст патогенних бактерій. Дисфункція мікробіоти кишківника спричиняє не лише низку шлунково-кишкових захворювань (діарея, закреп, ентерит), а й розвиток ожиріння, серцево-судинних хвороб, цукрового діабету, метаболічного синдрому. Кишкова флора та її метаболіти також регулюють імунну відповідь і розвиток автоімунних хвороб.
У пацієнтів з АІТ було виявлено низку різнопланових кількісних і якісних дисбалансів екології бактерій кишківника. Це свідчить про те, що надмірний ріст певних бактерій і їхній вплив на вісь «кишківник – ЩЗ» можуть брати участь у розвитку та прогресуванні АІТ. Зокрема, за даними кількох авторських колективів, у фекаліях пацієнтів із тиреоїдитом Хашімото було виявлено збільшення кількості Firmicutes і Actinobacteria на тлі зниження кількості Bacteroides і Proteobacteria. Метааналіз виявив, що видове різноманіття біфідобактерій, лактобацил і представників типу Firmicutes у осіб з АІТ було нижчим, аніж у відносно здорових представників групи порівняння. Цікаво, що зміни кількості певних бактерій асоціювалися з наявністю АТПО чи антитіл до тиреоглобуліну.
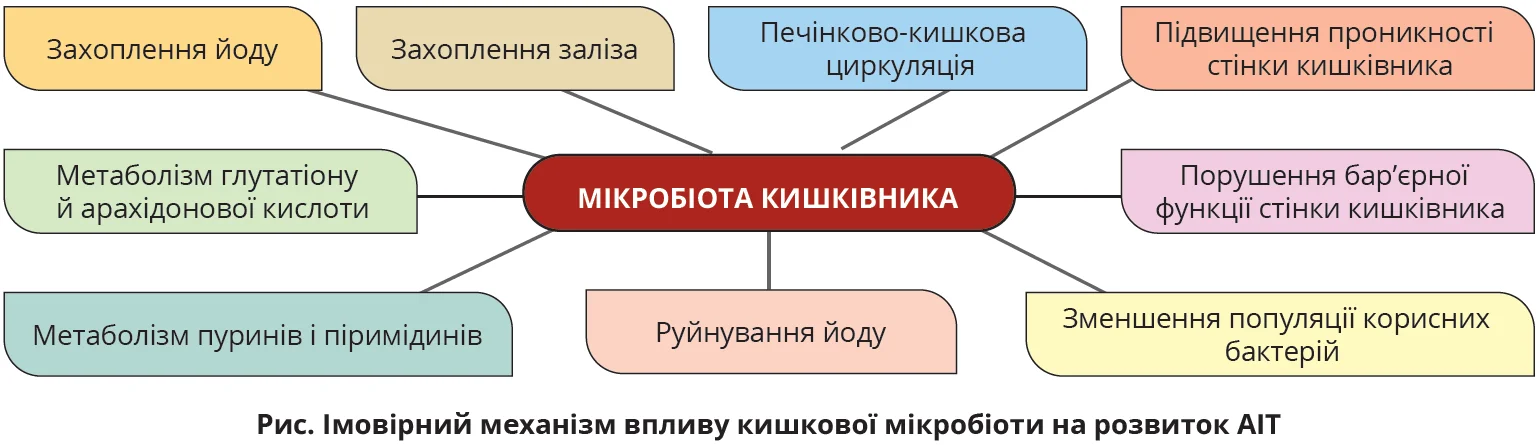
Механізм впливу мікробіоти кишківника на розвиток і перебіг АІТ досі вивчається. Імовірно, взаємодія між мікробами й організмом-господарем опосередкована такими мінералами, як селен, залізо, цинк, які впливають на рівні тиреоїдних гормонів. Окрім того, кишкова мікробіота продукує власні антигени, що можуть зумовлювати порушення цілісності міжклітинних контактів, надходити в системний кровообіг і, відповідно, призводити до формування прозапального тла й розвитку автоімунних процесів, зокрема в ЩЗ.
Водночас зменшення популяції корисних бактерій (Lactobacillus, Bifidobacterium) асоціюється зі зменшенням виділення протизапальних речовин, які протидіють ефектам патогенів. Вважається, що певні штами бактерій беруть участь у розвитку тиреоїдиту Хашімото через вплив на метаболізм глутатіону, арахідонової кислоти, пуринів і піримідинів (рис.).
Вплив АІТ на перебіг вагітності
Численні дослідження продемонстрували, що АІТ підвищує ризик несприятливих наслідків вагітності. У цей період метаболічні потреби жінки змінюються: існує потреба в більшій кількості тиреоїдних гормонів, що забезпечує ріст і розвиток плода та передусім його мозку. У зв’язку із цим під час вагітності нерідко виявляють хвороби ЩЗ, найчастіше клінічно виражений і субклінічний гіпотиреоз. Поширеність клінічно явного гіпотиреозу становить приблизно 0,3-1,0%, субклінічного – 4,0-17,8%.
Основною причиною гіпотиреозу у вагітних виступає АІТ, середня поширеність якого дорівнює 7,8%.
АІТ і неплідність
Поширеність неплідності в жінок з АІТ є дуже високою й за наявності хвороби Ґрейвса становить 52,3%, а за наявності тиреоїдиту Хашімото – 47,0%. Також неплідність часто асоціюється з наявністю АТПО.
АІТ і викидні
АІТ асоціюється з постійними викиднями. Вважається, що автоімунні процеси індукують порушення імплантації ембріона в ендометрій, окрім того, гіпотиреоз на ранніх етапах вагітності є відомою причиною невиношування. Важливим показником функції ЩЗ у вагітних є рівень тиреотропного гормону (ТТГ). Верхня межа норми ТТГ на початку вагітності має становити 4,0 мОд/л, а показник 2,5-4,0 мОд/л вважається високим нормальним значенням. Жінки з гіпотиреозом (високим і високим нормальним ТТГ) та наявними антитиреоїдними антитілами або в разі необхідності допоміжних репродуктивних технологій потребують призначення левотироксину, який навіть у низьких дозах здатен до певної міри запобігати викидням і збільшувати частку живонароджених немовлят, хоча деякі дослідження не змогли довести такого сприятливого ефекту.
Слід зауважити, що застосування левотироксину не впливає на ризик викиднів, передчасних пологів, прееклампсії, відшарування плаценти та частоту госпіталізації новонароджених у еутиреоїдних жінок з АІТ й АТПО, хоча відзначається певна тенденція до зменшення кількості передчасних пологів і викиднів. Аналогічно додаткове застосування глюкокортикоїдів та аспірину в еутиреоїдних жінок з АІТ, яким проводиться запліднення in vitro з перенесенням ембріона, також не підвищує частку успішних вагітностей чи живонароджених плодів.
АІТ й інші несприятливі наслідки вагітності
У жінок із наявними АТПО ризик передчасних пологів є вищим, аніж за їх відсутності. Імовірно, зв’язок між наявністю АТПО та передчасними пологами опосередкований концентрацією ТТГ: за показника ТТГ >4,0 мОд/л ризик є вищим, аніж у разі нижчих чисел.
Підвищення вмісту АТПО й антитіл до тиреоглобуліну на ранніх етапах і посередині вагітності також підвищує ризик розвитку гестаційного діабету.
Мікробіота кишківника та вагітність
Протягом останніх років з’явилися численні докази того, що статеві гормони впливають на структуру та метаболізм мікробіоти кишківника. Вагітність є особливим періодом життя жінки, під час якого відбуваються значні зміни гормонального тла, здатні впливати й на склад кишкової мікробіоти. Наприклад, у міру прогресування вагітності збільшується вміст у кишківнику таких родів бактерій, як Neisseria, Brautia, Collins і Bifidobacterium. Збільшення кількості біфідобактерій, імовірно, зумовлено прогестероном. Зміни мікробіоти матері, своєю чергою, викликають зміни мікробіоти дитини.
Низка досліджень продемонструвала, що стан кишкової мікробіоти вагітних асоціюється з багатьма хворобами. Наприклад, у жінок із прееклампсією спостерігається достовірно менша кількість таких мікроорганізмів, як Prevotella, Porphyromonas, Varibaculum і Lactobacillus, порівняно з вагітними без цього ускладнення. Прееклампсія асоціюється також зі збільшенням загальної кількості патогенних бактерій (Clostridium perfringens, Bulleidia moorei) та зменшенням кількості пробіотичних штамів (наприклад, Coprococcus catus).
Поширеним акушерським ускладненням є синдром затримки розвитку плода. Виявлено, що в жінок, у плодів яких відзначалося це ускладнення, спостерігається більший уміст родів Bacteroides, Faecalibacterium і Lachnospira порівняно з групою контролю.
Гестаційний діабет теж пов’язаний із дисбалансом мікробіоти, зокрема підвищенням кількості представників типу Firmicutes і зниженням – типу Bacteroides. Такий дисбаланс асоціюється з хронічним запаленням низької інтенсивності, інсулінорезистентністю, ожирінням. І навпаки, вища кількість біфідобактерій і нижча – стафілококів мають захисний вплив щодо надмірного набору ваги.
Висновки
АІТ підвищує ризик неплідності, викиднів й інших несприятливих для матері та плода результатів вагітності. У пацієнток із нормальним високим рівнем ТТГ зменшити кількість таких наслідків можна за допомогою левотироксину, однак у еутиреоїдних жінок з АІТ, яким проводиться запліднення in vitro, цей препарат не покращує результатів вагітності.
Деякі дослідники виявили відмінності у складі мікробіоти пацієнтів з АІТ порівняно із загальною популяцією. Надмірний ріст певних видів бактерій здатен впливати на вісь «кишківник – ЩЗ» та зумовлювати вироблення антитиреоїдних антитіл, але дотепер не встановлено, яким саме чином зміни кишкової мікробіоти спричиняють несприятливі наслідки вагітності в жінок з АТПО. Питання покращення результатів вагітності в жінок з АІТ за допомогою впливу на склад мікробіоти також потребує подальшого вивчення.
Література
Song Y., Bai Y., Liu C., Zhai X., Zhang L. The impact of gut microbiota on autoimmune thyroiditis and relationship with pregnancy outcomes: a review. Front. Cell Infect. Microbiol. 2024; 14: 1361660.