Вплив діабету на когнітивні порушення: огляд сучасних доказів і перспективи майбутніх досліджень
Переклала й адаптувала канд. мед. наук Тетяна Можина
Останніми роками цукровий діабет (ЦД) перетворився з медичної проблеми, пов’язаної з порушенням обміну речовин, на складне захворювання з потенційними наслідками, які виходять далеко за межі глікемічного контролю [1]. Оскільки поширеність ЦД продовжує зростати в усьому світі, дедалі більше досліджень висвітлюють його потенційний вплив на когнітивні функції (КФ) [2]. ЦД, що характеризується нездатністю організму ефективно регулювати рівень глюкози в крові, добре відомий асоційованими з ним ускладненнями, включаючи серцево-судинні захворювання, нейропатію та ретинопатію [3]. Проте його потенційний вплив на когнітивні здібності менш досліджений. Порушення КФ, яке охоплює дефіцит пам’яті, уваги, мови та виконавчих функцій, являє собою значну проблему для хворих, їхніх родин і медичних працівників [4].
Взаємозв’язок між ЦД та порушенням КФ є багатогранним і складним [5]. Хоча точні механізми ще не визначені, з’явилося кілька потенційних теорій. Судинні чинники, окислювальний стрес, запалення й інсулінорезистентність (ІР) вважають одними з ключових «гравців», які опосередковують вплив ЦД на КФ [6]. Розуміння цих механізмів є надзвичайно важливим, оскільки це може сприяти розробленню цілеспрямованих втручань задля збереження когнітивного здоров’я в осіб із ЦД. Цей огляд представляє сучасні знання про взаємозв’язок між ЦД і когнітивними порушеннями (КП).
Методологія та відбір досліджень
У цьому огляді використано пошук літератури для виявлення відповідних досліджень, що вивчають вплив ЦД на КП. Із цією метою використали чотири авторитетні бази даних: PubMed, MEDLINE, Embase та PsycINFO, в яких було проведено ретельний пошук за відповідними ключовими словами та в каталозі медичних предметних рубрик. Пошук обмежений дослідженнями, опублікованими протягом 10 років до серпня 2023 р.
Когнітивні сфери, на які впливає ЦД
Пам’ять
Пам’ять, яку часто вважають однією з найважливіших когнітивних сфер, ретельно вивчали в контексті ЦД. Пам’ять можна поділити на короткочасну, довготривалу й оперативну. Велика кількість досліджень підтверджує підвищений ризик дефіциту пам’яті у хворих на ЦД, особливо в тих, яким важко підтримувати адекватний контроль рівня глікемії [9-11]. Цей дефіцит може проявлятися у вигляді труднощів із пригадуванням нещодавніх подій, імен або осіб, що глибоко впливає на повсякденне функціонування та якість життя. Точні механізми, які стоять за цими порушеннями пам’яті, недостатньо вивчені. Проте вони можуть бути пов’язані з пагубним впливом хронічної гіперглікемії на структури мозку та нейронні мережі, які мають вирішальне значення для процесів пам’яті [12].
Увага та концентрація
Серед КФ увага та концентрація є стовпами розумових здібностей, що дають людям змогу зосереджуватися на конкретних завданнях, відфільтровувати відволікальні чинники та підтримувати розумові зусилля впродовж тривалого часу [13]. ЦД-асоційовані КП (ЦД-аКП) у цих сферах часто проявляються у вигляді підвищеного відволікання, зниження здатності до багатозадачності та труднощів із підтриманням стійкої уваги [14]. Ці недоліки можуть мати практичні наслідки в повсякденній діяльності, впливаючи на індивідуальну здатність виконувати завдання, що потребують тривалого зосередження: керування автомобілем, продуктивність на робочому місці.
Чинники, що зумовлюють розвиток ЦД-аКП
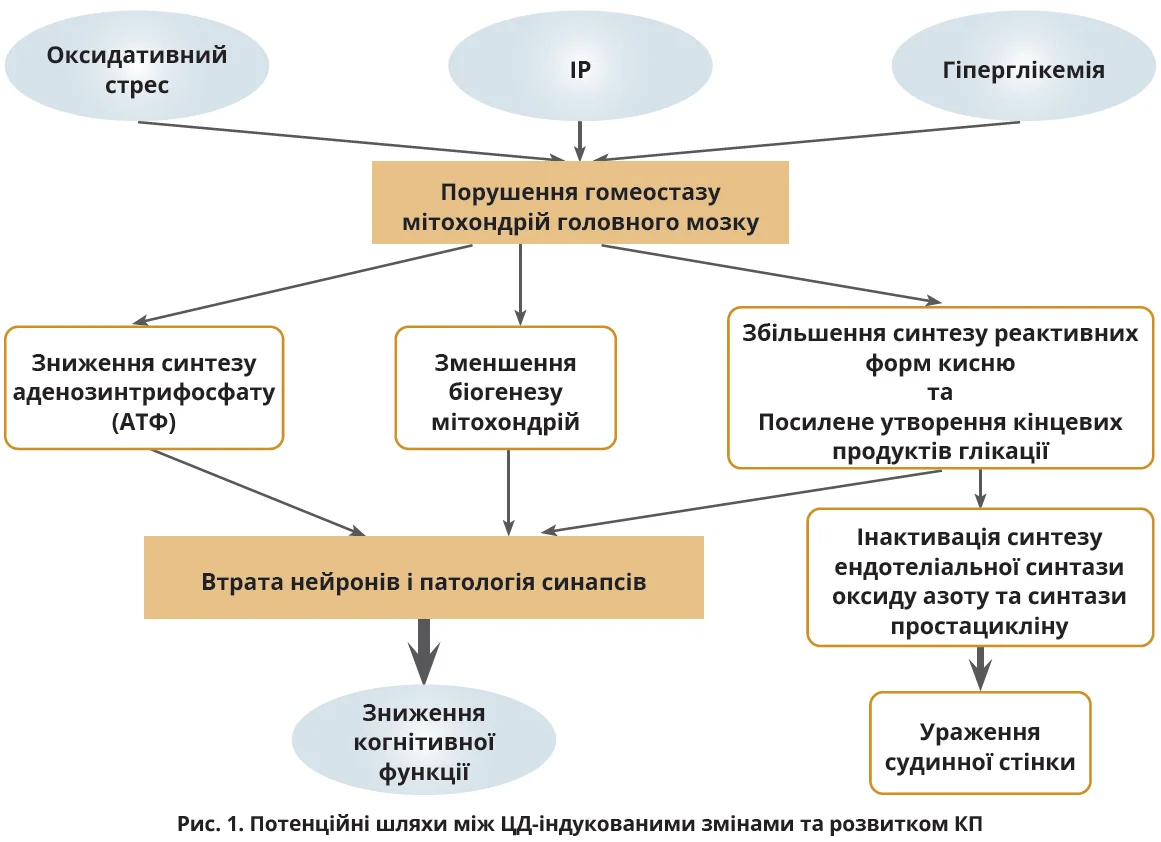
Різноманітні супутні чинники зумовлюють розвиток ЦД-аКП, кожен з яких по-своєму формує когнітивний ландшафт у хворих на ЦД (рис. 1).
Хронічна гіперглікемія та варіабельність глікемії
Підвищений рівень глікемії, характерна ознака ЦД, являє собою першочерговий чинник КП [21]. Тривала гіперглікемія запускає каскад шкідливих процесів, включаючи підвищене утворення активних форм кисню, особливо супероксиду [22].
Ці активні форми кисню ініціюють такі несприятливі ефекти, як підвищена активація поліолового шляху, посилене утворення кінцевих продуктів глікації, активація протеїнкінази С й інтенсивне шунтування глюкози в гексозаміновому шляху [22].
Ці процеси в підсумку призводять до оксидативного пошкодження та судинних ускладнень. Хронічна гіперглікемія тісно пов’язана з ендотеліальною дисфункцією, насамперед через активацію поліолового шляху [23]. Цей процес виснажує нікотинамідаденіндинуклеотидфосфат (НАДФ), зменшуючи активність ендотеліальної синтази оксиду азоту та знижуючи вироблення оксиду азоту. На цьому тлі розвиваються атеросклероз, тромбоутворення, інфаркт мозку, що спричиняє КП [24].
ІР і порушення регуляції
ЦД-аКП тісно пов’язані з ІР і дисрегуляцією [25]. Відділи головного мозку, в яких розташовані інсулінові рецептори, включаючи гіпокамп і лобову кору головного мозку, потрібні для реалізації когнітивних ефектів інсуліну [26]. Інсулінові рецептори розподілені по всьому мозку, даючи інсуліну й інсуліноподібному фактору росту-1 змогу здійснювати свій біологічний вплив [27]. ІР і гіперінсулінемія, характерні для ЦД, негативно впливають на перероблення та накопичення амілоїду [27], що призводить до збільшення інтранейронального відкладення β-амілоїду, гіперфосфорилювання та зниження кліренсу β-амілоїду. Одночасно ІР порушує гематоенцефалічний бар’єр (ГЕБ), впливаючи на цереброваскулярну функцію та когнітивні процеси [27]. Крім того, ІР часто супроводжується хронічним запаленням низького ступеня, відомим як «метазапалення» [26]. Цей запальний стан може поширюватися на мозок і спричиняти нейрозапалення [26]. Хронічне нейрозапалення асоційоване з різними КП [27].
Судинні ускладнення та мікросудинна дисфункція
До формування ЦД-аКП значною мірою призводить негативний вплив ЦД на мікро- та макросудинну системи [28]. Гіперглікемія лежить в основі мікросудинних ускладнень, які спричиняють діабетичну нефропатію, нейропатію й ретинопатію. Макросудинні ускладнення охоплюють серцево-судинні та цереброваскулярні захворювання [29]. При ЦД порушується цілісність нервово-судинних утворень, відповідальних за регулювання мозкового кровотоку. Структурні зміни в мікросудинах, у тому числі зменшення капілярів й артеріовенозних скорочень, обмежують доставку поживних речовин до нервової тканини. Це робить мозок чутливішим до нестачі кисню, що потенційно може призвести до КП [30].
Механізми, що лежать в основі взаємозв’язку між ЦД та КП
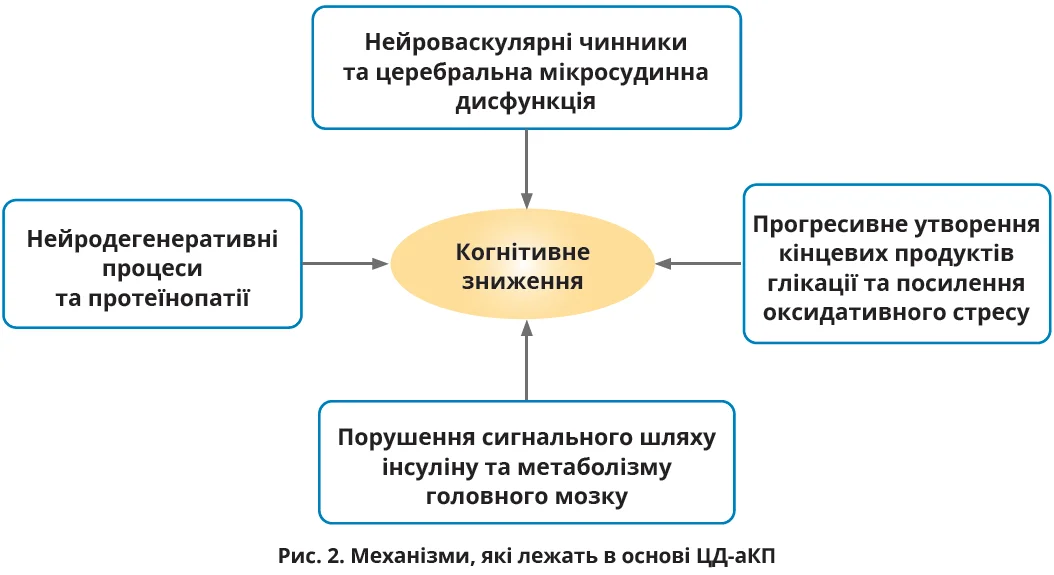
Етіологія ЦД-аКП є складною темою, яка продовжує досліджуватися [3]. Сучасні доказові дані свідчать, що зміна функції ГЕБ особливо пов’язана з церебральною мікросудинною дисфункцією, яка відіграє ключову роль [35] (рис. 2).
Нейросудинні чинники та церебральна мікросудинна дисфункція
ГЕБ, що складається з ендотелію судин мікросудин головного мозку та прилеглих відростків астроцитів, регулює транспорт речовин до/з паренхіми мозку [36]. Щільні ендотеліальні з’єднання, мінімальна фенестрація та низький піноцитарний трафік підтримують мікрооточення мозку [36]. Астроцити, потрібні для регуляції ГЕБ, вивільняють сигнали, як-от трансформувальний фактор росту-β і фактор росту ендотелію судин, що впливають на проникність ГЕБ і нейросудинні зв’язки [37, 38]. Експериментальні дані, хоча і є предметом дискусій, свідчать про те, що ЦД порушує цілісність ГЕБ, підвищуючи його проникність [36]. Тривала гіперглікемія також погіршує зв’язок між астроцитарними щілинами, потенційно порушуючи нейросудинні зв’язки, зумовлюючи виникнення КП [39]. Зниження доступності оксиду азоту, часто внаслідок окислювального стресу, спричиненого кінцевими продуктами посиленого глікозилювання, ще більше погіршує нейросудинні зв’язки при ЦД, імовірно, призводячи до розвитку КП [40].
Клінічні прояви та наслідки ЦД-аКП
Зростає кількість доказів, які вказують на патологічний взаємозв’язок між метаболічною дисфункцією, як-от ЦД, та схильністю до КП, що викликає значне клінічне занепокоєння [68]. Попередні дослідження підтвердили зв’язок між ЦД і прогресивним зниженням КФ, починаючи від легких когнітивних порушень з/без амнезії до деменції, включаючи судинну деменцію та хворобу Альцгеймера [69].
Втручання та стратегії управління
На тлі розроблення ефективних втручань для контролю гіперглікемії та пом’якшення ЦД-аКП зростає потреба в нових і результативніших методах лікування для зменшення й пом’якшення когнітивного дефіциту у хворих на ЦД [89]. Одна з ключових стратегій передбачає пригнічення нейрозапалення, спричиненого гіперглікемією, надмірним виробленням активних форм кисню та запальних цитокінів [90]. Нещодавні протидіабетичні засоби, як-от агоністи рецепторів глюкагоноподібного пептиду-1 (арГПП-1), продемонстрували багатообіцяльні результати в контролі гіперглікемії й усуненні ознак когнітивної дисфункції.
Модифікація способу життя для збереження КФ
Підвищений рівень острівкового амілоїдного поліпептиду у хворих на ЦД асоційований з ІР і зниженням КФ [91]. Зміни способу життя можуть відігравати ключову роль у збереженні КФ. Доведено, що фізичні вправи покращують КФ і корегують наявну дисфункцію. Наприклад, 6-місячна програма аеробних вправ покращила виконавчу функцію у хворих на ЦД 2-го типу, сприяла зниженню рівня глюкози натщесерце та порушеної толерантності до глюкози [92]. Модифікація дієти, наприклад перехід на середземноморську дієту, пов’язана з кращим контролем глікемії та збереженням КФ [93]. Дослідження підтверджують, що дотримання цієї дієти пов’язане з покращенням КФ і низьким ризиком КП [94].
Фармакологічні втручання, спрямовані на КП
Численні фармакотерапевтичні засоби використовуються для лікування ЦД, зниження ризику КП, у тому числі деменції. Ці засоби належать до різних класів пероральних цукрознижувальних засобів: бігуаніди, похідні сульфонілсечовини, тіазолідиндіони, інгібітори дипептидилпептидази-4 (ДПП-4) й арГПП-1 [95]. Останні дослідження підтвердили захисні ефекти інгібіторів ДПП-4, особливо в комбінації з метформіном, у зниженні ризику розвитку деменції [96, 97]. Аналогічно інгібітори натрійзалежного котранспортера глюкози 2-го типу значно зменшують КП [98]. Інші фармакологічні засоби, включаючи фенібут й іпідакрин, досліджувались як додаткові методи лікування хворих на ЦД [99].
Оптимізація глікемічного контролю та його вплив на когнітивну здатність
Контроль глікемії має ключове значення в зниженні ЦД-аКП. Кілька досліджень указують на прямий зв’язок між поганим глікемічним контролем і погіршенням КФ, включаючи розвиток деменції [56, 57]. Контроль рівня цукру в крові має вирішальне значення для запобігання погіршенню КФ. Наприклад, високі концентрації глікозильованого гемоглобіну асоційовані з прогресивним зниженням КФ, зокрема пам’яті та виконавчих функцій [100]. Однак варто зазначити, що інсулін, хоча і є ефективним засобом контролю глікемії, пов’язаний із ЦД-індукованим нейрокогнітивним зниженням [101]. Інтраназальна інсулінотерапія демонструє багатообіцяльні результати в покращенні пам’яті [101]. Хоча інтенсивний контроль глікемії пов’язаний зі зменшенням атрофії мозку, немає переконливих доказів, які підтверджують його перевагу над стандартним контролем глікемії [102].
Висновки
Вплив ЦД на КФ складний і багатогранний, він потребує всебічного розуміння та цілеспрямованого втручання. У ході аналізу різних когнітивних сфер, на які впливає ЦД, чинників ризику й основних механізмів виникнення стає очевидним, що КП є серйозною проблемою для хворих на ЦД. Дефіцит пам’яті, проблеми з увагою й концентрацією, труднощі з мовленням, порушення виконавчих функції та візуально-просторових навичок – усе це є довготривалими наслідками ЦД. Провокувальні чинники, як-от хронічна гіперглікемія, ІР, судинні ускладнення, запалення та генетичний вплив, додають складності цьому взаємозв’язку. Розуміння зазначених чинників необхідне для розроблення ефективних стратегій профілактики та лікування.
Значні клінічні наслідки впливають на повсякденне функціонування, контроль глікемії, загальну якість життя. Сучасна терапія охоплює модифікацію способу життя, фармакотерапію й оптимізацію глікемічного контролю. Перспективними є нові методи лікування, спрямовані на інгібування нейрозапалення та нейродегенеративних процесів. Персоналізовані підходи, адаптовані втручання являють собою шлях уперед, визнаючи індивідуальну варіабельність ЦД-аКП.
Література
Aderinto N., et al. The impact of diabetes in cognitive impairment: a review of current evidence and prospects for future investigations. 2023. doi: 10.1097/MD.0000000000035557.