Вітамін D та репродуктивна ендокринологія: від класичних до нових поглядів
Переклала й адаптувала канд. мед. наук Тетяна Можина
Перелік вітамінів, відкритих у ХХ столітті та віднесених до життєво необхідних, упевнено очолює вітамін D. Історія його вивчення почалася зі встановлення здатності посилювати всмоктування кальцію в кишківнику, підтримувати сироваткові рівні кальцію та фосфору у вузьких фізіологічних межах, впливати на процеси росту й реорганізації кістки, змінюючи активність остеобластів/остеокластів. Протягом останніх 30 років з’явилися доказові дані щодо наявності у вітаміну D нових, позакісткових ефектів, які дістали назву «нових», або «некласичних»: участь в імунологічній регуляції, процесах росту та диференціювання клітин, гемопоезу [7], детоксикації ксенобіотиків, антиоксидантних реакціях, кардіоваскулярному захисті та нейропротекції, протизапальних і протипухлинних реакціях [4]. Після відкриття такого широкого спектра дії ставлення медичного товариства до цієї біологічно активної речовини суттєво змінилося: тепер вітамін D не просто вважають «справжнім» вітаміном, його розглядають як прогормон, а активний метаболіт вітаміну D називають «D-гормоном».
Вітамін D: класичні та репродуктивні властивості
Термін «вітамін D», який використовується нині лише за історичною традицією та для зручності спілкування, є збірним поняттям; він об’єднує групу подібних за хімічною будовою речовин: вітаміни D1, D2 та D3. У цій трійці панує вітамін D3, або холекальциферол, який утворюється в шкірі тварин і людини під дією сонячного світла із 7-дегідрохолестеролу. Саме йому притаманна значна фізіологічна активність і саме його називають «істинним» вітаміном D. Вітамін D2, або ергокальциферол, є найпоширенішою формою вітаміну D, яка також утворюється під дією сонячного світла, проте з іншого джерела (ергостеролу) та в інших живих організмах (рослини, гриби). Вітамін D1 зазвичай згадують лише в історичному аспекті, підкреслюючи сам факт відкриття вітаміну D, хоча за своєю хімічною структурою вітамін D1 є сполукою ергокальциферолу та люмістеролу (стереоізоформи ергостеролу) [4]. Зважаючи на наведені особливості, вітаміни D1 і D2 називають модифікованими похідними вітаміну D [5].
Від особливостей синтезу до репродуктивної ендокринології
Класичне ставлення щодо надходження вітаміну D в організм людини прекрасне відоме: майже 80% вітаміну D в організмі утворюється внаслідок ендогенного синтезу в шкірі та лише 20% має екзогенне походження із жовтків яєць і жирної риби (екзогенний вітамін D3), вершкового масла та сухих сніданків, штучно збагачених вітаміном D2, та вітамінних добавок (рис. 1).

Зазнали значних змін уявлення щодо його метаболізму: доведено, що після всмоктування в кишківнику або утворення в шкірі вітамін D зв’язується з багатофункціональним білком переносником (вітамін-D-зв’язувальний білок – ВDЗБ), який транспортує його в печінку, де під час гідроксилювання останній трансформується у 25-гідроксивітамін D3 (25-(OH)D3) – основну форму, що використовується організмом для циркуляції та зберігання вітаміну D. Під час наступного етапу метаболізму, який відбувається в нирках, 25-(OH)D3 перетворюється на 1,25-(OH)2D3 (кальцитріол). Свій гормоноподібний вплив на організм ця біологічно активна форма чинить шляхом зв’язування зі спеціальними рецепторами, розташованими на поверхні клітин – вітамін-D-зв’язувальними рецепторами (VDR) [7]. Проводячи експериментальні дослідження, вчені сподівалися виявити VDR у «класичному» місці (в ентероцитах і, можливо, колоноцитах), але знайшли їх у дуже «нетрадиційних» локаціях: кератиноцитах, промієлоцитах, моноцитах, лімфоцитах, острівках підшлункової залози та навіть в ооцитах і сперматозоїдах, яєчниках і яєчках, ендометрії, плаценті та трофобласті [7]. Нині переконливо доведено, що недостатність вітаміну D у чоловіків призводить до гіпогонадизму та зниження фертильності, у жінок – спричиняє розвиток синдрому полікістозних яєчників (СПКЯ), ендометріозу, лейоміозу, впливає на перебіг вагітності, утруднює природне запліднення та підвищує ймовірність екстракорпорального запліднення (ЕКЗ) [18].
Після отримання доказів впливу вітаміну D на рівень статевих гормонів (тестостерон, естрадіол, α1-гідроксилаза, антимюллерів гормон (АМГ) та ін.) вчені почали активно досліджувати зв’язок між VDR і віссю «гіпоталамус – гіпофіз – яєчники» [4, 5]. Унаслідок цього з’явилося поняття «репродуктивна ендокринологія вітаміну D», яка вивчає його вплив на статеве дозрівання, репродуктивну функцію, а також виникнення та перебіг ендокринної статевої патології [14].
Вітамін D і репродуктивне здоров’я: активність наукових досліджень
Згідно з нещодавно представленим оглядом кількість публікацій, у яких аналізується вплив вітаміну D на стан репродуктивної системи, прогресивно зростає з 2012 р. та досягла свого піку протягом останніх років (рис. 2).

Найактивніше досліджують вплив вітаміну D на репродуктивне здоров’я американські (25,06%), китайські (15,48%), англійські (10,23%), австралійські (8,04%) та канадські (7,60%) дослідники [15]. На перший погляд, протягом останніх декількох років обсяг інформації у вітчизняній медичній пресі щодо позакісткового впливу вітаміну D значно зріс, але порівняно з іншими країнами він залишається просто мізерним: наприклад, якщо протягом року в США та Канаді публікується, відповідно, >300 і 100-300 статей щодо репродуктивних властивостей вітаміну D, то в Україні навіть до початку повномасштабної війни цей показник становив лише 10-30 публікацій [15].
Бібліометричний аналіз літературних джерел свідчить, що найчастіше наукові публікації досліджують роль вітаміну D у дієтичному харчуванні (21,50%), виникненні акушерсько-гінекологічної патології (21,01%) та ендокринних метаболічних порушень (18,44%) [15]. Топ-10 найдосліджуваніших сфер позакісткового впливу вітаміну D замикають репродуктивна біологія (7,77%), педіатрія (6,51%), біохімія та молекулярна біологія (6,02%), загальна внутрішня медицина (5,74%), гігієна праці (5,31%), імунологія (5,25%) та міждисциплінарні науки (5,14%) [15]. Отже, нині провідні інститути й науковці світового рівня відводять велике значення розкриттю репродуктивного потенціалу вітаміну D та забезпеченню його широкого профілактичного застосування.
Вітамін D, фертильність та ЕКЗ
Сезонний сплеск народжуваності, який постійно фіксується в північних країнах, пов’язують зі зростанням імовірності природного зачаття в літні місяці з високою освітленістю [13]. Одним із можливих пояснень цього факту є збільшення вмісту вітаміну D з наступними активацією синтезу оваріальних стероїдних гормонів (прогестерону, естрадіолу, естрону) [13], посиленням ооцитогенезу, виживаності трофобласта та прискоренням швидкості імплантації плідного яйця [4, 11]. У клінічних дослідженнях ЕКЗ зафіксовано взаємозв’язок між підвищенням рівня естрадіолу на тлі гонадотропін-індукованої стимуляції яєчників і зростанням сироваткового рівня 1,25(ОН)2D3 (r=0,787; p<0,001) [28]. Констатовано збільшення ймовірності вагітності та швидкості імплантації плідного яйця в жінок із більшим умістом 25(OH)D3 у фолікулярній рідині; вчені запропонували вважати цей показник незалежним предиктором вдалої процедури ЕКЗ: кожне підвищення вмісту вітаміну D на 1 нмоль/л дає змогу збільшити ймовірність клінічної вагітності на 2,4% [13].
Уміст АМГ, доброго показника оваріального резерву, також корелює із сироватковою концентрацією вітаміну D та змінами пори року: вміст АМГ знижується на 18% під час зими порівняно з літом; коливання рівня АМГ асоційовані із середніми змінами вмісту вітаміну D [13]. Зазначені зміни АМГ і вітаміну D впливають на ймовірність вагітності [15]. Достатній рівень вітаміну D підвищує виживаність преантральних фолікулів, підтримує синтез АМГ і прискорює зростання антральних фолікулів [27]. Він також впливає на довжину теломер, активність ферменту теломерази, даючи змогу знизити ймовірність анеуплодії (різновиду хромосомної патології) та підвищити ефективність ЕКЗ [2].
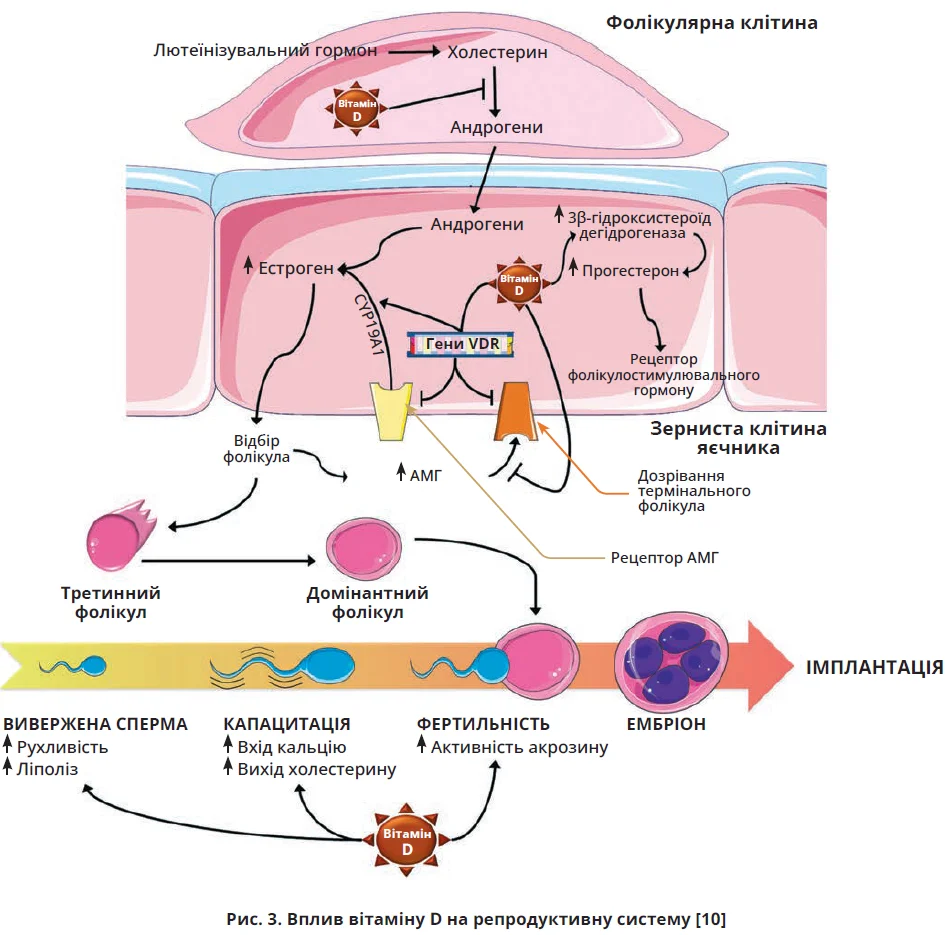
Низький рівень вітаміну D впливає не тільки на жіноче репродуктивне здоров’я, а й на чоловічу фертильність: чоловіки з достатнім умістом вітаміну D у сироватці крові мають кращі показники спермограми, ніж чоловіки з дефіцитом вітамін D (<20 нг/мл), причому вища фертильність асоційована з більшим рівнем вітаміну D [1]. Існує вікова залежність між умістом вітаміну D та концентрацією тестостерону: в дорослих і літніх чоловіків зафіксовано прямий зв’язок між рівнем тестостерону та вмістом вітаміну D, водночас у підлітків така залежність відсутня [14]. Вітамін D відсутній у спермі, але міститься у фолікулярній рідині; достатній уміст вітаміну D у фолікулярній рідині допомагає сперматозоїдам подолати процеси проникнення, гіперактивації й акросомальну реакцію під час запліднення (рис. 3) [18]. Гіповітаміноз D асоційований із розвитком еректильної дисфункції в чоловіків [6].
Синдром полікістозних яєчників
СПКЯ вважають найпоширенішою ендокринною патологією: частота розладу в жінок репродуктивного віку становить 5-20% [2]. СПКЯ пов’язаний із дисфункцією яєчників, гіперандрогенемією, порушеннями менструального циклу у вигляді оліго-/аменореї, полікістозними змінами яєчників, безпліддям, ожирінням, інсулінорезистентністю та компенсаторною гіперінсулінемією [24]. Основні причини виникнення СПКЯ ще продовжують вивчатися, але нині домінує гіпотеза щодо мультифакторної етіології цього стану, надаючи велике значення генетичній схильності, чинникам зовнішнього середовища, інсулінорезистентності та гіповітамінозу D. Установлено, що вміст вітаміну D при СПКЯ асоційований із репродуктивною функцією, метаболічними змінами та ментальним здоров’ям [17].
Нормалізація рівня вітаміну D сприяє зниженню вмісту андрогенів і АМГ, зменшенню товщини ендометрія в пацієнток із СПКЯ [12], а також відновленню менструального циклу та фолікулогенезу [17]. Імовірність овуляції корелює з концентрацією вітаміну D: при вмісті вітаміну D близько 20 нг/мл імовірність овуляції становить 68%, у разі зростання концентрації до 20-30 нг/мл вона перевищує 78% [19]. Метааналіз 25 досліджень довів, що додатковий прийом вітаміну D сприяє вірогідному зниженню рівнів тригліцеридів (сумарний ефект (СЕ) -0,15; 95% довірчий інтервал (ДІ) від -0,23 до -0,08; р≤0,001), загального холестерину (СЕ -0,17; 95% ДІ від -0,23 до -0,11; р≤0,001) і підвищенню вмісту ліпопротеїнів високої щільності (СЕ 0,08; 95% ДІ 0,01-0,15; р=0,025) [23], що також допомагає поліпшити стан хворих на СПКЯ.
СПКЯ асоційований із патологічними змінами ендометрія, котрі унеможливлюють імплантацію плідного яйця. Існують докази того, що додавання вітаміну D полегшує імплантацію та покращує чутливість ендометрія: в жінок із високим рівнем експресії VDR в ендометрії, особливо під час імплантації ембріона, вагітність настає вірогідно рідше порівняно з пацієнтками з меншою експресією VDR [9]. Терапія вітаміном D також дає змогу покращити сприйнятливість ендометрія в пацієнток із СПКЯ [16]. Доведено, що імплантація й імовірність настання клінічної вагітності при ЕКЗ є значно вищими в пацієнток із СПКЯ та нормальним умістом вітаміну D порівняно із жінками, рівень вітаміну D в яких був украй низьким (<20 нг/мл) [28]. Автори цієї роботи також довели прямий зв’язок між умістом вітаміну D й імовірністю імплантації та клінічної вагітності (р<0,01) [28]. Вітамін D покращує якість ембріонів: кількість ембріонів високої якості, отриманих у жінок із СПКЯ на тлі лікування вітаміном D, дорівнює такому в жінок із нормальною концентрацію вітаміну D [28].
Вагітність
Дефіцит вітаміну D супроводжує велику кількість ускладнень вагітності. Встановлено, що низький рівень вітаміну D у першому триместрі (10,1 проти 15,7 нг/мл) асоційований із розвитком гестаційного цукрового діабету (ГЦД), який діагностують на 24-26-му тижні вагітності, незалежно від традиційних чинників ризику (обтяжений анамнез щодо ГЦД, ожиріння). У вагітних із дефіцитом вітаміну D частіше розвивається ГЦД порівно із жінками, в яких уміст цього вітаміну перевищує 75 нмоль/л (87,1 проти 68,7% відповідно) [11, 26].
Фіксують сезонні коливання розвитку прееклампсії з підвищенням захворюваності взимку порівняно з літом [8, 11], що корелює із сезонними змінами вітаміну D. Доведено, що вищі рівні вітаміну D під час вагітності мають протективний вплив і асоційовані зі зниженням ризику прееклампсії [11, 26]. Вітамін D посилює домінування Th2 та знижує експресію певних генів плацентарних судин (розчинна Fms-подібна тирозинкіназа-1, судинний ендотеліальний фактор росту), зростання рівня котрих пов’язано з прееклампсією. Ці чинники можуть відігравати певну роль у захисному ефекті вітаміну D [11, 26]. Крім того, дефіцит вітаміну D пов’язаний зі звичними абортами [8, 11], він типовий для жінок, які страждають на безпліддя порівняно зі звичайною популяцією [11, 26].
Вітамін D пригнічує функцію запальних цитокінів (інтерлейкін-2, інтерферон-γ, фактор некрозу пухлини-α) [26].
Достатня кількість вітаміну D у матері дає змогу не тільки підтримувати фертильність, уникати розвитку ускладнень вагітності, але й запобігати виникненню ускладнень із боку ембріона й утворює основи оптимального здоров’я дитини протягом усього життя. Дефіцит вітаміну D в ембріона може бути частково врівноважений фізіологічними змінами рівня вітаміну D, які відбуваються під час вагітності: кількість активного вітаміну D збільшується в декілька разів незалежно від рівнів кальцію, фосфату або паратгормону [4, 11].
Водночас підтверджено: що значніше зниження рівня вітаміну D у матері, то ймовірніше виникнення ускладнень у ембріона, оскільки підвищується ризик спонтанних передчасних пологів, хоріоамніоніту [26]. Прийом вітаміну D і зростання його сироваткової концентрації >40 нг/мл асоційовані зі зменшенням ризику передчасних пологів на 60% [26]. Окрім ускладнення перебігу ембріогенезу, внутрішньоутробний дефіцит вітаміну D може серйозно вплинути на подальше життя малечі, провокуючи розвиток ювенільної астми, шизофренії, розсіяного склерозу, ЦД 1 типу, інсулінорезистентності [11] та навіть аутизму [26].
Лікування гіповітамінозу D
Відповідно до сучасних американських настанов не рекомендується проводити скринінг дефіциту вітаміну D у невагітних дорослих, які проживають не в будинках для людей похилого віку та не мають симптомів гіповітамінозу D або захворювань, за яких рекомендовано прийом вітаміну D [25].
В усіх інших випадках доцільно вимірювати та контролювати вміст 25(OH)D у сироватці крові [11]. Результати визначення вітаміну D трактуються таким чином: за рівня 25(OH)D <20 нг/мл діагностують дефіцит вітаміну D, вміст 20-30 нг/мл відповідає субоптимальному стану, тоді як оптимальною концентрацією вважається рівень <50 нмоль/л [22]. Нині рекомендується утримувати вміст 25(OH)D у сироватці крові в межах 30-50 нг/мл, що дає змогу досягти оптимальних фізіологічних переваг за підтримання рівня вітаміну D у сироватці крові >30 нг/мл [3].
Препаратом першої лінії лікування гіповітамінозу D у дорослих визнано пероральний холекальциферол (вітамін D3) [20, 21]. Застосування кальцифедіолу замість вітаміну D3 передбачається за деяких станів, включаючи ожиріння або порушення всмоктування; у хворих із тяжкою мальабсорбцією можливе парентеральне введення вітаміну D [20, 21]. Експерти, підкреслюючи роль дефіциту вітаміну D у розвитку еклампсії, рекомендують зменшувати ризик виникнення цього ускладнення за допомогою корекції нутритивного статусу та прийому вітаміну D як «найкращої добавки для зниження захворюваності на еклампсію» [11].
Згідно з консенсусними положеннями експертів Центральної та Східної Європи корекцію дефіциту вітаміну D варто розпочинати при концентрації 25(OH)D <20 нг/мл, а при значеннях <30 нг/мл доцільно розглянути можливість лікування [21]. Причому лікування варто розпочинати з вищих добових початкових доз, які в пацієнтів без додаткових чинників ризику становлять 4000-6000 МО [20, 21]. За наявності супутніх станів/захворювань, за яких порушується всмоктування (муковісцидоз, запальні захворювання кишківника, баріатрична хірургія, радіаційний ентерит), тривалого прийому ліків, здатних впливати на метаболізм вітаміну D (протисудомні препарати, глюкокортикоїди, ліки від СНІДу, протигрибкові засоби, холестирамін), ожиріння початкову добову дозу рекомендується підвищити до 10 000 МО та вживати її протягом 4-12 тижнів залежно від ступеня тяжкості гіповітамінозу [21]. При досягненні сироваткової концентрації 25(OH)D 30-50 нг/мл (75-125 нмоль/л) рекомендується перейти на підтримувальну дозу 800-2000 МО/добу, котру також можна використовувати як стартову терапію, якщо немає потреби у швидкій корекції дефіциту вітаміну D [21].
Призначення високих доз вітаміну D, які перевищують рекомендовані для загальної популяції, вважається доцільним та ефективним за потреби нівелювання явищ гіповітамінозу в пацієнтів із групи ризику. Терапію високими дозами в таких випадках можна проводити без рутинного скринінгу вмісту вітаміну D [22]. Польські експерти наполягають на обов’язковому покращенні вітамінного статусу населення загалом, лікуванні пацієнтів із груп ризику та підкреслюють, що такі заходи слід оголосити політикою охорони здоров’я для зниження ризику виникнення цілого спектра захворювань [22].
Призначаючи пацієнтам вітамін D, можна рекомендувати лінійку препаратів вітчизняного виробництва Відеїн® (виробник – АТ «Київський вітамінний завод»), серед переваг якого слід зазначити:
- препарат вітаміну D від відомого виробника вітамінів в Україні;
- виготовляється згідно з вимогами Належної виробничої практики (GMP);
- має дозування 4000 МО для зручнішої профілактики й лікування дефіциту вітаміну D3 (менша кількість таблеток);
- капсульна форма випуску містить мінімальну кількість допоміжних речовин у своєму складі (на відміну від таблеток);
- лінійка для всієї родини (500, 1000, 2000, 4000, 20 000 МО);
- зручна форма випуску та дозування для кожної вікової категорії (м’які желатинові капсули для дітей, підлітків і дорослих);
- розпад і всмоктування речовин із капсули відбуваються швидше, ніж із таблетки, що є важливим під час прийому вітамінів;
- доступна ціна.
Протягом останніх років з’явилася велика кількість доказових даних, які підтверджують «позакісткову» активність вітаміну D, у тому числі його здатність впливати на репродуктивну функцію як у жінок, так і в чоловіків. Достатній рівень вітаміну D – запорука високої фертильності, вдалого запліднення, швидкої імплантації плідного яйця, пролонгування вагітності, народження доношеної дитини, подальшого здорового життя. Достатній рівень вітаміну D захищає від розвитку СПКЯ, ендометріозу. Консенсус експертів Центральної та Східної Європи з лікування гіповітамінозу D (2022) рекомендує як терапію 1-ї лінії обирати пероральний холекальциферол і починати лікування з призначення високих стартових доз із наступним переходом на підтримувальну терапію з меншими дозами.
Література
- Akhavizadegan H., Karbakhsh M. Comparison of serum vitamin D between fertile and infertile men in a vitamin D deficient endemic area: a case-control study. Urologia. 2017; 84 (4): 218-220. doi: 10.5301/uj.5000248.
- Azziz R. Polycystic ovary syndrome. Obstet. Gynecol. 2018; 132 (2): 321-336. doi: 10.1097/AOG.0000000000002698.
- Bantwal G. A review on vitamin D deficiency and related disorders: what is the right serum vitamin D level? J. Assoc. Physicians India. 2023; 71 (5): 11-12. doi: 10.5005/japi-11001-0240.
- Calcaterra V., Magenes V.C., Tagi V.M., et al. Association between vitamin D levels, puberty timing, and age at menarche. Children (Basel). 2023; 10 (7): 1243. doi: 10.3390/children10071243.
- Ciarambino T., Crispino P., Minervini G., et al. Vitamin D: can gender medicine have a role? Biomedicines. 2023; 11 (6): 1762. doi: 10.3390/biomedicines11061762.
- Crafa A., Cannarella R., Barbagallo F., et al. Mechanisms suggesting a relationship between vitamin D and erectile dysfunction: an overview. Biomolecules. 2023; 13 (6): 930. doi: 10.3390/biom13060930.
- Gil Á., Plaza-Diaz J., Mesa M. Vitamin D: classic and novel actions. Ann. Nutr. Metab. 2018; 72 (2): 87-95. doi: 10.1159/000486536.
- Grundmann M., von Versen-Höynck F. Vitamin D – roles in women’s reproductive health? Reprod. Biol. Endocrinol. 2011; 9: 146. doi: 10.1186/1477-7827-9-146.
- Guo J., Liu S., Wang P., et al. Characterization of VDR and CYP27B1 expression in the endometrium during the menstrual cycle before embryo transfer: implications for endometrial receptivity. Reprod. Biol. Endocrinol. 2020; 18 (1): 24. doi: 10.1186/s12958-020-00579-y.
- Keane K.N., Cruzat V.F., Calton E., et al. Molecular actions of vitamin D in reproductive cell biology. Reproduction. 2017; 153 (1): R29-R42. doi: 10.1530/REP-16-0386.
- Kinshella M.W., Pickerill K., Bone J., et al. An evidence review and nutritional conceptual framework for pre-eclampsia prevention. Br. J. Nutr. 2023; 130 (6): 1065-1076. doi: 10.1017/S0007114522003889.
- Kuyucu Y., Çelik L.S., Kendirlinan Ö., et al. Investigation of the uterine structural changes in the experimental model with polycystic ovary syndrome and effects of vitamin D treatment: an ultrastructural and immunohistochemical study. Reprod. Biol. 2018; 18 (1): 53-59. doi: 10.1016/j.repbio.2018.01.002.
- Lerchbaum E., Obermayer-Pietsch B. Vitamin D and fertility: a systematic review. Eur. J. Endocrinol. 2012; 166 (5): 765-78. doi: 10.1530/EJE-11-0984.
- Lorenzen M., Boisen I.M., Mortensen L., et al. Reproductive endocrinology of vitamin D. Mol. Cell. Endocrinol. 2017; 453: 103-112. doi: 10.1016/j.mce.2017.03.023.
- Lu Y., Zhang X., Wu S., et al. A bibliometric analysis of global research on vitamin D and reproductive health between 2012 and 2021: learning from the past, planning for the future. Front. Nutr. 2022; 9: 973332. doi: 10.3389/fnut.2022.973332.
- Menichini D., Forte G., Orrù B., et al. The role of vitamin D in metabolic and reproductive disturbances of polycystic ovary syndrome: a narrative mini-review. Int. J. Vitam. Nutr. Res. 2022; 92 (2): 126-133. doi: 10.1024/0300-9831/a000691.
- Mu Y., Cheng D., Yin T., et al. Vitamin D and polycystic ovary syndrome: a narrative review. Reprod. Sci. 2021; 28 (8): 2110-2117. doi: 10.1007/s43032-020-00369-2.
- Nandi A., Sinha N., Ong E., et al. Is there a role for vitamin D in human reproduction? Horm. Mol. Biol. Clin. Investig. 2016; 25 (1): 15-28. doi: 10.1515/hmbci-2015-0051.
- Pal L., Zhang H., Williams J., et al. Vitamin D status relates to reproductive outcome in women with polycystic ovary syndrome: secondary analysis of a multicenter randomized controlled trial. J. Clin. Endocrinol. Metab. 2016; 101 (8): 3027-35. doi: 10.1210/jc.2015-4352.
- Płudowski P., Kos-Kudła B., Walczak M., et al. Guidelines for preventing and treating vitamin D deficiency: a 2023 update in Poland. Nutrients. 2023; 15 (3): 695. doi: 10.3390/nu15030695.
- Pludowski P., Takacs I., Boyanov M., et al. Clinical practice in the prevention, diagnosis and treatment of vitamin D deficiency: a Central and Eastern European expert consensus statement. Nutrients. 2022; 14 (7): 1483. doi: 10.3390/nu14071483.
- Pludowski P. Supplementing vitamin D in different patient groups to reduce deficiency. Nutrients. 2023; 15 (17): 3725. doi: 10.3390/nu15173725.
- Radkhah N., Zarezadeh M., Jamilian P., et al. The effect of vitamin D supplementation on lipid profiles: an umbrella review of meta-analyses. Adv. Nutr. 2023: S2161-8313(23)01362-5. doi: 10.1016/j.advnut.2023.08.012.
- Tannus S., Tan J., Son W., et al. Prevalence, clinical characteristics, and reproductive outcomes of polycystic ovary syndrome in older women referred for tertiary fertility care. Arch. Gynecol. Obstet. 2018; 297 (4): 1037-1042. doi: 10.1007/s00404-017-4642-z.
- US Preventive Services Task Force; Krist A.H., Davidson K.W., et al. Screening for vitamin D deficiency in adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2021; 325 (14): 1436-1442. doi: 10.1001/jama.2021.3069.
- Várbíró S., Takács I., Tűű L., et al. Effects of vitamin D on fertility, pregnancy and polycystic ovary syndrome – a review. Nutrients. 2022; 14 (8): 1649. doi: 10.3390/nu14081649.
- Xu J., Hennebold J.D., Seifer D. Direct vitamin D3 actions on rhesus macaque follicles in three-dimensional culture: assessment of follicle survival, growth, steroid, and antimüllerian hormone production. Fertil. Steril. 2016; 106 (7): 1815-1820.e1. doi: 10.1016/j.fertnstert.2016.08.037.
- Zhao J., Liu S., Wang Y., et al. Vitamin D improves in-vitro fertilization outcomes in infertile women with polycystic ovary syndrome and insulin resistance. Minerva Med. 2019; 110 (3): 199-208. doi: 10.23736/S0026-4806.18.05946-3.
