Вітамін D покращує біологію жирової тканини: вплив на кардіометаболічні хвороби, пов’язані з ожирінням
Підготувала канд. мед. наук Ольга Королюк
Через невисокий уміст вітаміну D в обмеженій кількості харчових продуктів і вплив безлічі чинників на його синтез у шкірі недостатність вітаміну D поширена навіть у розвинених країнах. Активна форма вітаміну D – секостероїдний гормон 1a,25-дигідроксивітамін D (1a,25(OH)2D) – утворюється шляхом двохетапного гідроксилювання в печінці й нирках і зв’язується з рецептором вітаміну D (VDR), регулюючи безліч біологічних процесів, насамперед гомеостаз кальцію та здоров’я опорно-рухового апарату. Локальна активація вітаміну D можлива в інших органах, зокрема в жировій тканині.
Численні обсерваційні дослідження виявили низький рівень вітаміну D в осіб з ожирінням і асоційованими хворобами. Проте, чи спричиняє недостатність вітаміну D появу ожиріння та кардіометаболічних захворювань (КМЗ) і чи знижує насиченість вітаміном D ризик указаних станів, чітко не доведено. Цей огляд висвітлює сучасні погляди на метаболізм вітаміну D і його роль у регуляції біології жирової тканини на молекулярному та клітинному рівнях, щоб пояснити зворотний зв’язок між статусом вітаміну D, ожирінням і КМЗ, а також результати рандомізованих досліджень, які оцінювали вплив вітаміну D на КМЗ.
Статус ожиріння
За останні 40 років захворюваність на ожиріння в більшості країн світу подвоїлася; очікується, що до 2035 року понад 50% населення планети матиме надлишкову масу тіла чи ожиріння. Ожиріння підвищує ризик таких кардіометаболічних розладів, як резистентність до інсуліну, дисфункція β-клітин, цукровий діабет (ЦД) 2-го типу, асоційована з метаболічною дисфункцією стеатотична хвороба печінки й атеросклеротичні серцево-судинні захворювання (ССЗ), які збільшують смертність від усіх причин. Окрім того, ожиріння істотно збільшує витрати на охорону здоров’я. Отже, розроблення ефективних терапевтичних підходів до ожиріння й асоційованих захворювань є дуже важливим.
Неоднорідність жирової тканини
Ожиріння – це стан надлишку жирової маси. В організмі людини жирова тканина розташована в багатьох місцях; неоднорідність її походження, розвитку, функцій і впливу на КМЗ добре задокументована. Розрізняють бурі та білі жирові депо. Бурий жир підтримує терморегуляцію. Білий жир охоплює внутрішньочеревні та підшкірні депо; підшкірний жир, своєю чергою, класифікують на жир у верхній і нижній частинах тіла. Вісцеральне ожиріння підвищує ризик КМЗ, натомість підшкірний жир у нижній частині тіла відіграє захисну роль. У жирових депо присутні різні типи адипоцитів із пластичним фенотипом: білі адипоцити можуть перетворюватися на бурі, й навпаки. Порівняно з білими бурі та буроподібні адипоцити мають вищу щільність мітохондрій; їм притаманна експресія роз’єднувального білка-1 (UCP1), здатного розсіювати енергію у вигляді тепла. У людей з ожирінням і КМЗ кількість й активність бурих і буроподібних адипоцитів знижуються.
Дисфункції жирової тканини при ожирінні
Жирова тканина – це метаболічний, ендокринний та імунний орган, який відіграє вирішальну роль у підтриманні системного метаболічного здоров’я. Адипоцити є основним місцем зберігання надлишку енергії у вигляді тріацилгліцерину (ТАГ), що депонується в ліпідних краплях. Збільшення потреби в енергії призводить до гідролізу ТАГ з утворенням жирних кислот (ЖК) та гліцерину, котрі вивільняються з адипоцитів. Окрім того, жирова тканина функціонує як ендокринний та імунний орган, виділяючи багато гормонів і цитокінів, як-от лептин, адипонектин, оментин, інтерлейкін-6 (IЛ-6), фактор некрозу пухлини-α (ФНП-α). Ожиріння призводить до дисфункції жирової тканини. Високі рівні ЖК, гліцерину та прозапальних цитокінів на тлі зниженого вивільнення адипонектину й оментину вважаються основними чинниками ризику КМЗ в осіб з ожирінням. Як наслідок, порушуються сигнальні шляхи інсуліну, посилюються системне запалення й ектопічне відкладання жиру, відбуваються системні порушення метаболічного здоров’я.
Дисфункцію жирової тканини при ожирінні зумовлюють декілька чинників: окислювальний та ендоплазматичний стрес, запалення, фіброз. Хронічний позитивний енергетичний баланс спричиняє гіпертрофію й загибель адипоцитів, призводячи до активації імунних клітин і посилення запалення в жировій тканині. Дослідження на тваринах показали, що при спричиненому дієтою ожирінні загибель адипоцитів збігається з порушеннями системного метаболізму, що чітко вказує на важливість підтримання функціональної жирової тканини для системного здоров’я. Не цілком зрозуміло, що саме зумовлює загибель адипоцитів; за однією з гіпотез, важливе значення має розмір адипоцитів, який визначається оборотом ТАГ. Чинники, що сприяють катаболізму ліпідів, можуть зменшити механічне навантаження на адипоцити та спричинити їх загибель. Натомість заміна гіпертрофічних дисфункціональних адипоцитів шляхом рекрутингу та диференціювання стовбурових клітин жирової тканини зменшує стрес на адипоцити, сприяючи підтриманню загального здоров’я.
Метаболізм вітаміну D
Вітаміни D3 (холекальциферол) і D2 (ергокальциферол) містяться в продуктах тваринного та рослинного походження відповідно. Найкращими природними джерелами вітаміну D є жирна риба та риб’ячий жир; вітамін також міститься в субпродуктах, яєчному жовтку, твердих сирах, грибах. Біодоступність вітаміну D у різних харчових продуктах вивчена недостатньо, але є вищою в D3.
Після надходження до травного тракту вітамін D включається в міцели, а потім поглинається ентероцитами, де упаковується в хіломікрони та секретується в лімфу. Стани мальабсорбції жиру або баріатрична хірургія порушують засвоєння вітаміну D, спричиняючи його дефіцит. Після доставлення жиророзчинних поживних речовин до непечінкових тканин залишки хіломікронів поглинаються печінкою (рис. 1).
Синтез вітаміну D3 у шкірі відбувається внаслідок фотолізу 7-дегідрохолестерину, опосередкованого ультрафіолетовими променями В; утворений превітамін активується шляхом ізомеризації (рис. 1). Вважається, що доросла людина може отримати достатню кількість вітаміну D, перебуваючи на сонці до 30 хвилин щодня або принаймні двічі на тиждень з відкритими обличчям, руками та ногами. Проте на синтез вітаміну D впливає багато чинників, як-от пігментація шкіри, використання сонцезахисних кремів, одяг, пора року та вік, що ускладнює визначення оптимальної тривалості перебування на сонці. Крім того, вплив сонця спричиняє фотостаріння та підвищує ризик виникнення раку шкіри. Утворений у шкірі вітамін D3 зв’язується з відповідним зв’язувальним білком або з альбуміном і транспортується кров’ю (рис. 1).
Утворення 1α,25(OH)2D відбувається шляхом двохетапного гідроксилювання: 25-гідроксилаза (CYP2R1, CYP27A1, CYP3A4, CYP2J2) переважно експресується в печінці; 1α-гідроксилаза (CYP27B1) – у нирках. Однак експресія обох гідролаз можлива і в інших органах, включно із жировою тканиною, де локально активований 1α,25(OH)2D регулює певні функції. 24-гідроксилаза (CYP24A1) перетворює 25(OH)D та 1α,25(OH)2D на 24,25(OH)2D та 1α,24,25(OH)3D відповідно, які далі метаболізуються й виводяться у складі жовчі. Паратиреоїдний гормон підвищує експресію 1α-гідроксилази, а фактор росту фібробластів-23 знижує її експресію. 1α,25(OH)2D підвищує 24-гідроксилазу, одночасно пригнічуючи 1α-гідроксилазу (рис. 1). Указані механізми жорстко регулюють рівні 1α,25(OH)2D.
Недостатність вітаміну D
Статус вітаміну D найточніше відображає рівень 25(OH)D у крові. Хоча немає єдиного консенсусу щодо референтних значень, більшість настанов вважають оптимальними сироваткові рівні 25(OH)D у межах 100-200 нмоль/л (40-80 нг/мл), значення <50 нмоль/л (<20 нг/мл) – недостатніми, а показники <30 нмоль/л (<12 нг/мл) – дефіцитом вітаміну D. Рівні >125 нмоль/л (>50 нг/мл) можуть асоціюватися з побічними явищами, пов’язаними з гіперкальціємією, а безпечна верхня межа споживання встановлена на рівні 4000 МО/добу. Надмірне перебування на сонці зазвичай не спричиняє токсичності вітаміну D через обмежену термічну активацію, але часте відвідування солярію може підвищити рівень 25(OH)D до 150-200 нг/мл.
Підтримувати достатній рівень вітаміну D виключно завдяки дієті доволі складно. Для здорових дорослих людей установлено рекомендовану добову норму вітаміну D 15 мкг (600 МО) з урахуванням того, що люди мінімально перебувають на сонці. Настанови Ендокринного товариства (2024) пропонують додавати вітамін D вище вказаних добових норм для таких груп: діти від 1 до 18 років, особи віком >75 років, люди з високим ризиком переддіабету. Крім того, робоча група пропонує щоденні добавки вітаміну D замість періодичного використання великих доз (Demay M.B. et al., 2024).
Недостатність вітаміну D вважається показником загального стану здоров’я. Систематичний огляд, проведений J. Hilger і співавт. (2014), показав, що в 37,3% населення планети середні сироваткові рівні 25(OH)D становлять <50 нмоль/л. Пізніші дослідження вказують на недостатність вітаміну D у 47,9% учасників (Cui A. et al., 2023).
Ризик недостатності вітаміну D вищий у певних групах. Грудне молоко забезпечує 25-78 МО/л 25(OH)D, тому Американська академія педіатрії рекомендує добавку 10 мкг (400 МО) на добу немовлятам на грудному вигодовуванні до моменту відлучення від грудей. У людей похилого віку знижується синтез вітаміну D у шкірі, вони рідше перебувають на свіжому повітрі. До груп високого ризику відносять також людей з темним кольором шкіри або обмеженим перебуванням на сонці, порушенням засвоєння жиру та пацієнтів із хворобами нирок.
Численні обсерваційні дослідження повідомляють про низький рівень вітаміну D при ожирінні та КМЗ. Вивільнення вітаміну D із жирової тканини відбувається повільно, але збільшується під час схуднення внаслідок розщеплення ліпідів. Уміст 25(OH)D у підшкірному жирі позитивно корелює з рівнями 25(OH)D у сироватці крові. Це свідчить про те, що більша кількість жирової тканини при ожирінні секвеструє або буферизує вітамін D, спричиняючи його недостатність або дефіцит.
В осіб з ожирінням синтез вітаміну D у шкірі не порушується, але його біодоступність знижується. Крім того, до нестачі вітаміну D у людей з ожирінням призводять нерегульований метаболізм вітаміну D, низьке споживання й обмежене перебування на сонці.
Посередництво VDR у впливах вітаміну D
Вітамін D реалізує свою дію через VDR, присутні в клітинах скелетних м’язів, а також клітинах, не задіяних у регуляції кальцію, – імунних клітинах, стовбурових, адипоцитах. Локально активований або системно доставлений 1α,25(OH)2D дифундує через плазматичну мембрану, зв’язується з лігандозв’язувальним доменом VDR та утворює гетеродимерний комплекс із ретиноїдним X-рецептором. Гетеродимер переміщується в ядро, де асоціюється з елементами відповіді на вітамін D (VDRE) на цільових генах, регулюючи їх транскрипцію. Крім того, VDR регулює експресію генів через взаємодію з іншими ядерними рецепторами, зокрема ядерним фактором κB. На сьогодні відомо понад 200 генів з VDRE. Завдяки геномній дії вітамін D регулює багато біологічних функцій: гомеостаз кальцію, ріст, диференціацію та смерть клітин, метаболізм, запалення. Частина VDR присутня в плазматичній мембрані, збагаченій кавеолами; після зв’язування з лігандами вони активують численні сигнальні каскади, зокрема шляхи мітогенактивованих протеїнкіназ, Ca2+-кальмодулінкінази II, протеїнкіназ А та С. Через мітохондріальні VDR 1α,25(OH)2D3 регулює дихальну функцію мітохондрій у тромбоцитах і кератиноцитах (рис. 2).
Метаболізм вітаміну D у жировій тканині
У жировій тканині можлива експресія 25-гідроксилази, 1α-гідроксилази та VDR. Жирова тканина здатна перетворити 25(OH)D на 1α,25(OH)2D, але не здатна перетворити активний вітамін D на 25(OH)D. В осіб з ожирінням рівні експресії мРНК 25-гідроксилази (CYP2J2) та 1α-гідроксилази (CYP27B1) у жировій тканині знижені; натомість рівні мРНК VDR у жировій тканині, навпаки, підвищені й позитивно корелюють з маркерами запалення. Отже, в осіб з ожирінням порушуються метаболізм вітаміну D та його дія в жировій тканині, що, принаймні частково, пояснює зниження біодоступності й суперечливі ефекти від приймання добавок вітаміну D у людей з ожирінням.
Роль вітаміну D у проліферації та диференціації стовбурових клітин жирової тканини
У кількох клітинних моделях установлено, що 1α,25(OH)2D3 пригнічує проліферацію преадипоцитів. Проте дані щодо впливу вітаміну D на адипогенез суперечливі. Два дослідження показали, що 1α,25(OH)2D3 пригнічує диференціювання клітин 3T3-L1; однак інше дослідження виявило індукцію диференціювання, коли вітамін додавали за відсутності адипогенного індукційного коктейлю. У мишачих і людських стовбурових клітинах жирової тканини, а також мезенхімальних стовбурових клітинах мишей і свиней 1α,25(OH)2D3 посилював адипогенез. Відомо також, що VDR бере участь як у про-, так і в антиадипогенній дії вітаміну D. Суперечливість результатів частково можна пояснити відмінностями в адипогенних програмах різних типів клітин або різним дизайном експериментів. Щоб узгодити суперечливість, потрібні подальші дослідження.
Роль вітаміну D у метаболізмі жирової тканини
Результати двох досліджень продемонстрували здатність 1α,25(OH)2D3 посилювати сигнальний шлях інсуліну та стимульоване інсуліном поглинання глюкози адипоцитами 3T3-L1. Окрім того, вітамін D індукував експресію глюкозного транспортера GLUT4 та стимульоване інсуліном поглинання глюкози через VDR-залежні механізми в жировій тканині мишей. Отже, вітамін D може зменшити непереносимість глюкози й інсулінорезистентність шляхом посилення інсулінозалежного поглинання глюкози в адипоцитах.
Інформація щодо регуляції вітаміном D синтезу та розпаду ліпідів в адипоцитах обмежена. 1α,25(OH)2D3 зменшував ліпогенез de novo й розміри ліпідних крапель з одночасним посиленням базального та стимульованого ліполізу в адипоцитах 3T3-L1; посилював експресію генів, залучених до окислення ЖК (PPARα, PGC1α та CPT1α), збільшував швидкість окислення ЖК, підвищував UCP1 в адипоцитах 3T3-L1 й індукував «бурі» фенотипи в підшкірних попередниках жирових клітин людини. Центральна крапля ліпідів містить нейтральні ліпіди та займає більшу частину об’єму білих адипоцитів; вітамін D може зменшити розміри адипоцитів шляхом посилення катаболізму ліпідів і зниження синтезу ліпідів, що знижує стрес у гіпертрофованих адипоцитах при ожирінні, зменшуючи їх дисфункцію та загибель.
Унаслідок видалення VDR або 1α-гідроксилази (CYP27B1) миші демонстрували худорлявий фенотип з індукцією експресії UCP1 та окислення ЖК у білій і бурій жировій тканині. Отже, непрямі катаболічні впливи вітаміну D та VDR на системний енергетичний метаболізм можуть сприяти фенотипу худорлявості. Зокрема, миші з нокаутом 1α-гідроксилази та VDR демонструють посилене потемніння білого жиру, на що вказують індукція експресії UCP1 і поява багатолокулярних клітинних кластерів. І навпаки, трансгенні миші з надмірною експресією VDR в адипоцитах демонстрували нижчі рівні окислення ЖК, нижчі рівні UCP1 та енергетичного метаболізму, що спричиняло гіпертрофію адипоцитів і збільшення маси тіла. Проте в самок мишей з нокаутом VDR в адипоцитах також спостерігалося збільшення маси епідидимального жиру та накопичення жиру в печінці. Причини таких суперечливих результатів не цілком зрозумілі; частково їх можна пояснити залежними від статі відмінностями у фенотипах мишей з нокаутом VDR у жировій тканині й особливостями дієти. Зважаючи на дослідження, котрі повідомляли про зниження диференціації 1α,25(OH)2D3 й експресії UCP1 у бурих адипоцитах, потрібні подальші випробування для розуміння впливу вітаміну D та VDR на системний енергетичний метаболізм.
Вплив вітаміну D на запалення й ендокринні функції жирової тканини
У моделях преадипоцитів і адипоцитів 1,25(OH)2D3 через VDR знижував експресію прозапальних адипокінів/цитокінів (лептину, ІЛ-6, ІЛ-1β, ІЛ-8, білка-1 хемоатракції макрофагів), водночас індукуючи протизапальний адипокін і сенситайзер інсуліну адипонектин. Тваринні моделі продемонстрували, що система вітамін D – VDR зменшує міграцію макрофагів у жирову тканину. Отже, впливаючи на різні типи клітин, вітамін D знижує запалення жирової тканини, що може полегшити її дисфункцію при ожирінні.
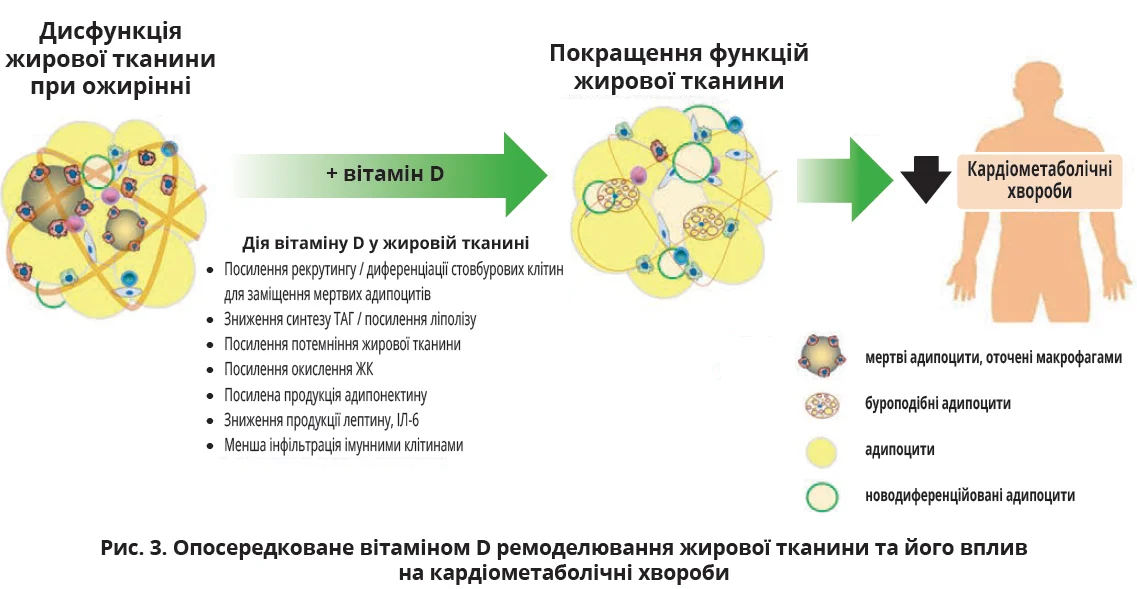
Крім того, 1,25(OH)2D3 пригнічує прозапальні сигнальні шляхи в адипоцитах 3T3-L1 та імунних клітинах, зменшує запалення жирової тканини, впливаючи на імунні клітини, які експресують VDR. Вітамін D оновлює жирову тканину, прискорюючи утворення адипоцитів шляхом рекрутингу та диференціації стовбурових клітин, що сприяє заміні мертвих адипоцитів і посиленню здатності адипоцитів накопичувати ліпіди. Комплекс вітамін D – VDR покращує функції жирової тканини: посилює окислювальний метаболізм; зумовлює потемніння; зменшує запалення; посилює ендокринні властивості жирової тканини. Завдяки здоровому ремоделюванню жирової тканини вітамін D може знизити ризик КМЗ (рис. 3).
Вплив добавок вітаміну D на ожиріння
Незважаючи на значну поширеність недостатності вітаміну D у людей з ожирінням, у багатьох дослідженнях добавки вітаміну D суттєво не впливали на такі маркери ожиріння, як індекс маси тіла (ІМТ), окружність талії (ОТ) та масу жиру. У дослідженні The Women’s Health Initiative Calcium / Vitamin D Supplemental Trial добавки вітаміну D та кальцію продемонстрували невелике, але значуще зниження маси тіла за відсутності впливу на ІМТ або масу жиру. Проте нещодавній огляд 14 метааналізів виявив невеликий значущий вплив на ІМТ й ОТ, але не на масу жиру (Musazadeh V. et al., 2022). Встановлено також, що в жінок і в утручаннях ≥6 місяців добавки вітаміну D значно зменшували ІМТ й ОТ (Duan L. et al., 2020).
Вплив добавок вітаміну D на адипокіни та цитокіни
Вплив добавок вітаміну D на рівні адипокінів/цитокінів у людей залишається суперечливим. Два метааналізи не показали істотного впливу вітаміну D на сироваткові рівні адипонектину й лептину; інше дослідження виявило підвищення сироваткових рівнів лептину в пацієнтів із ЦД 2-го типу. Систематичний огляд і метааналіз показали, що вітамін D не впливав на рівні адипонектину в об’єднаних даних, але значно підвищував рівні адипонектину в підгрупі пацієнтів з діабетом (Nikooyeh B., Neyestani T.R., 2021). Окрім того, вітамін D сприятливо впливав на адипонектин за щоденного прийому або одночасного приймання добавок з кальцієм, але ефект послаблювався в разі збільшення ІМТ.
Низка досліджень указує на відсутність істотного впливу добавок вітаміну D на сироваткові рівні С-реактивного білка (СРБ), IЛ-6 і ФНП-α.
Проте метааналіз, проведений E.K. Calton і співавт. (2017), показав, що в дозах ≥1000 МО/день вітамін D сприятливо впливав на CРБ залежно від віку та статі. Встановлено, що добавки вітаміну D значно знижували рівні СРБ та ФНП-α в дослідженнях за участю пацієнтів із ЦД 2-го типу. Для точніших висновків треба провести подальші дослідження з урахуванням впливу доз вітаміну D, тривалості дослідження та досліджуваних популяцій (вік, стать, ступінь ожиріння, супутні хвороби).
Вплив добавок вітаміну D на толерантність до глюкози та ЦД 2-го типу
Більш ранні систематичні огляди та метааналізи не виявили суттєвого впливу добавок вітаміну D на рівні глікемії й інсуліну натще, глікованого гемоглобіну (HbA1c) та індекс інсулінорезистентності, оцінений за моделлю гомеостазу (HOMA-IR). Проте в осіб з переддіабетом і ЦД 2-го типу додавання вітаміну D значно знижувало всі вказані показники. Аналіз підгруп показав кращі ефекти в пацієнтів без ожиріння порівняно з пацієнтами з ожирінням; в осіб, які отримували дози >2000 МО/день; осіб з дефіцитом вітаміну D; пацієнтів із тривалістю діабету <10 років або віком <60 років. Окрім того, вітамін D знижував ризик розвитку ЦД 2-го типу та підвищував імовірність нормалізації толерантності до глюкози в осіб з переддіабетом. Добавки вітаміну D та кальцію сприятливо впливали на рівні глікемії натще й HbA1c в осіб із ЦД 2-го типу. Загалом результати вказують на сприятливий вплив добавок вітаміну D на метаболізм глюкози й інсуліну в цій когорті.
Підтримання сироваткових рівнів 25(OH)D ≥125 нмоль/л знижувало ризик розвитку ЦД 2-го типу порівняно з показниками 50-74 нмоль/л за відсутності відмінностей у частоті таких побічних явищ, як нефролітіаз, гіперкальціємія та гіперкальціурія. За даними аналізу підгруп, вплив добавок вітаміну D на контроль діабету в осіб із ЦД 2-го типу залежав від збільшення маси тіла, ІМТ та тривалості діабету. Помітніший ефект спостерігався за умови призначення великих доз вітаміну D протягом короткого періоду часу, а також у пацієнтів, які мали оптимальний глікемічний контроль, не мали ожиріння або дефіциту вітаміну D.
Хоча недостатність вітаміну D асоціювалася з вищим ризиком смертності від усіх причин і від ССЗ у пацієнтів з переддіабетом або ЦД 2-го типу, низка рандомізованих досліджень виявила мінімальний вплив добавок вітаміну D на ризики та наслідки ССЗ. Систематичний огляд когортних і рандомізованих досліджень, проведений M.A. Rasouli та співавт. (2023), показав, що в когортних дослідженнях вищі рівні 25(OH)D підвищували частоту ССЗ на 31%, смертність – на 37%. Огляд, проведений S.U. Khan і співавт. (2019), виявив, що вітамін D з кальцієм підвищують ризик інсульту, здебільшого через добавки кальцію.
Утім, інші дослідження виявили покращення профілю ліпідів крові з вираженішим ефектом в осіб з дефіцитом вітаміну D або в дослідженнях тривалістю >8 тижнів, або за умови застосування високодозових добавок щотижня. Нещодавні метааналізи також показали сприятливий вплив вітаміну D на рівень холестерину в крові та ТАГ у пацієнтів з переддіабетом і діабетом з дефіцитом вітаміну D або нижчими показниками ІМТ (Afraie M. et al., 2024; Qorbani M. et al., 2022; Yang Y. et al., 2023; Lu Q. et al., 2024). Крім того, вітамін D у дозуванні >800 МО/день упродовж <6 місяців знижував артеріальний тиск в осіб віком ≥50 років, у здорових суб’єктів і пацієнтів з гіпертензією, без жодного впливу на осіб з надмірною масою тіла й ожирінням. Отже, корекція дефіциту вітаміну D у певних групах, зокрема за недостатності вітаміну D, переддіабету чи ЦД 2-го типу, може сприятливо вплинути на ССЗ.
Висновки
Система вітамін D – VDR регулює численні аспекти біології жирової тканини: рекрутинг стовбурових клітин та їх диференціацію в адипоцити, функції жирової тканини. У дослідженнях in vitro отримано суперечливі результати щодо здатності вітаміну D стимулювати та пригнічувати адипогенез, залежно від типів клітин і умов експерименту. Результати трансгенних моделей підтверджують, що вітамін D – VDR сприяє адипогенезу in vivo; проте фенотипи в цих моделях можна пояснити зміненим енергетичним метаболізмом. Окрім того, вітамін D може зменшити ожиріння шляхом ремоделювання жирової тканини, що передбачає посилення метаболічної активності бурої й білої жирової тканини та зменшення запалення. Завдяки здоровому ремоделюванню жирової тканини вітамін D може сприятливо впливати на пов’язані з ожирінням КМЗ.
Незважаючи на низькі рівні вітаміну D у багатьох пацієнтів з ожирінням і КМЗ, результати попередніх рандомізованих досліджень показали суперечливі ефекти. Останній метааналіз виявив, що вітамін D сприятливо впливає на рівні адипокінів, цитокінів, маркерів інсулінорезистентності та ліпідного профілю в пацієнтів з переддіабетом і ЦД 2-го типу. Аналіз підгруп демонструє, що добавки вітаміну D мають сприятливіший вплив на певні групи населення, зокрема на людей без ожиріння й осіб з дефіцитом вітаміну D. Знижена локальна активація та впливи вітаміну D, а також його секвестрація у великій масі жирової тканини зменшують ефективність добавок вітаміну D в осіб з ожирінням. У майбутніх дослідженнях слід ретельно вивчити тривалість і дозування вітаміну D у різних популяціях та особливості впливу в поєднанні з іншими добавками, зокрема з кальцієм.
Література
Lee M.J. Vitamin D enhancement of adipose biology: implications on obesity-associated cardiometabolic diseases. Nutrients. 2025 Feb 6; 17 (3): 586. doi: 10.3390/nu17030586.
На фармацевтичному ринку України доступні ефективні вітчизняні дієтичні добавки вітаміну D Відеїн (виробник – АТ «Київський вітамінний завод») з кількома дозами холекальциферолу: 25 мкг (1000 МО), 50 мкг (2000 МО), 100 мкг (4000 МО) та 500 мкг (20 000 МО), що полегшує дозування для різних станів і вікових груп.
Дієтичні добавки Відеїн мають оптимальне співвідношення вартість/кількість і показані для лікування клінічно підтвердженого дефіциту вітаміну D та профілактики дефіциту вітаміну D у пацієнтів з високим ризиком, що відкриває додаткові можливості досягнення кардіометаболічного здоров’я.