Синдром апное уві сні в практиці ендокринолога. Чому важливий мультидисциплінарний підхід?
Підготувала канд. мед. наук Ольга Королюк
За результатами проведеного в Європі дослідження SHIP-Trend, поширеність помірного-тяжкого синдрому обструктивного апное уві сні (СОАС) у загальній популяції становить 30% серед чоловіків і 13% серед жінок [1]. Інтермітивна гіпоксія, зумовлена СОАС, призводить до низки несприятливих змін, які підвищують ризик смерті, серцево-судинних подій, легеневих, нейрокогнітивних та інших ускладнень [2]. Ендокринні розлади асоціюються з високою частотою СОАС [3]. У цьому огляді обговорюються клінічна значущість СОАС, двобічні зв’язки між СОАС та ендокринними розладами, сучасні підходи до лікування з акцентом на мультидисциплінарний підхід.
ОАС: визначення, класифікація, механізми
Розрізняють чотири основні типи апное уві сні (табл. 1) [4]. Надалі розглядатиметься обструктивне апное уві сні (ОАС) – найпоширеніший у клінічній практиці тип, що часто асоціюється з ендокринною патологією. У таблиці 2 підсумовано термінологію, важливу для діагностики ОАС.
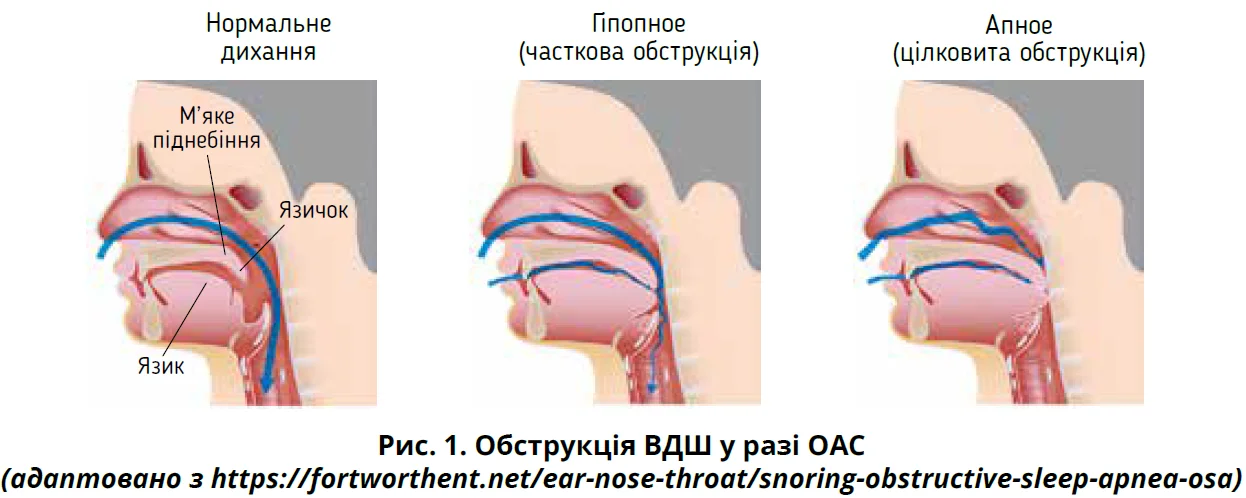
Безпосереднім механізмом ОАС є рецидивний колапс глоткового простору з частковою або повною обструкцією верхніх дихальних шляхів (ВДШ) під час сну (рис. 1) [6].
Інтермітивна гіпоксія, підвищений опір дихальних шляхів і гіперкапнія стимулюють прокидання, що забезпечує відкриття глотки та відновлює потік повітря [3]. Близько 75% респіраторних подій не супроводжуються прокиданням або прокидання виникає після респіраторної події. Це зумовлено різними механізмами ОАС, які визначають його фенотип [7].
Клінічна значущість ОАС: перебіг, асоційовані ускладнення
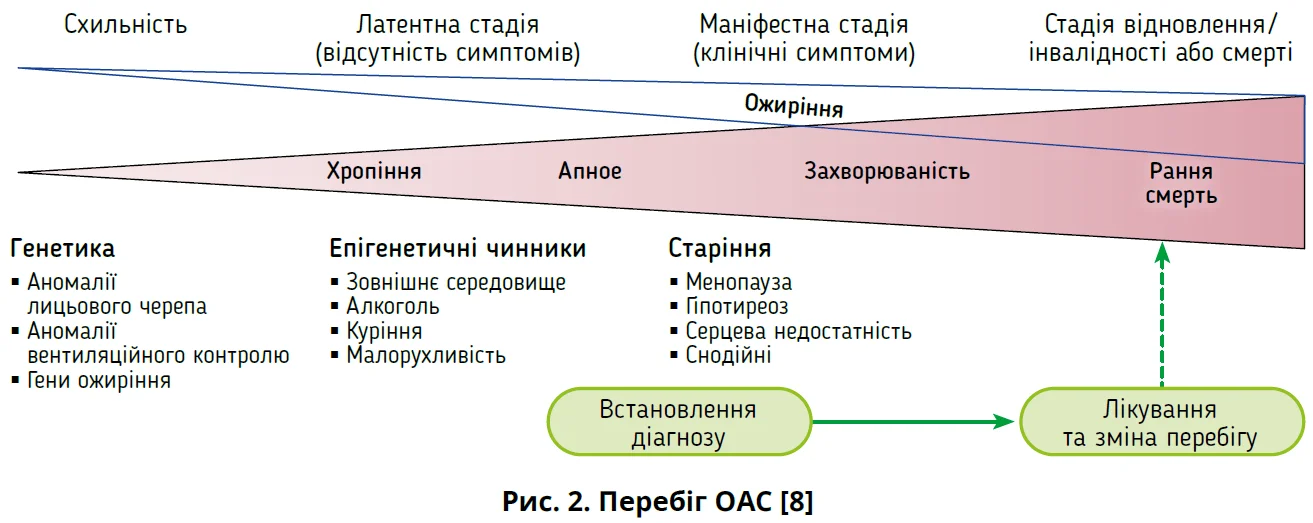
Клінічний перебіг ОАС є патофізіологічним континуумом, у якому ВДШ, здебільшого глотка, демонструють високий опір повітряним потокам (рис. 2).
Спочатку перебіг дисфункції безсимптомний або проявляється хропінням. Імовірно, існує генетична схильність до ОАС. Із віком і внаслідок збільшення маси тіла зовнішні й епігенетичні чинники посилюють колапс ВДШ. Під час «латентної стадії» хропіння зазвичай посилюється, з’являються нічні зупинки дихання, але людина ще не відчуває денних порушень унаслідок розладів сну. У людей з ОАС рівень свідомості вночі зазвичай знижений, тому діагноз часто встановлюється після свідчень інших осіб (партнерів або родичів), які спостерігають за пацієнтом під час сну [8]. Надалі хвороба переходить у «маніфестну стадію», що характеризується появою симптомів. Незалежно від тяжкості ОАС зумовлює надмірну денну сонливість, погіршуючи концентрацію під час роботи та повсякденного життя [9]. Відзначено істотний вплив ОАС на пам’ять, оскільки нефрагментований сон має важливе значення для формування й консолідації семантичної пам’яті [10]. За відсутності лікування СОАС призводить до депресії, порушень концентрації, підвищеного ризику автомобільних аварій і виробничих травм [11]. Отже, люди, робота яких пов’язана з керуванням транспортними засобами, механізмами або обладнанням, особливо ризикують через відсутність вчасної діагностики СОАС [6].
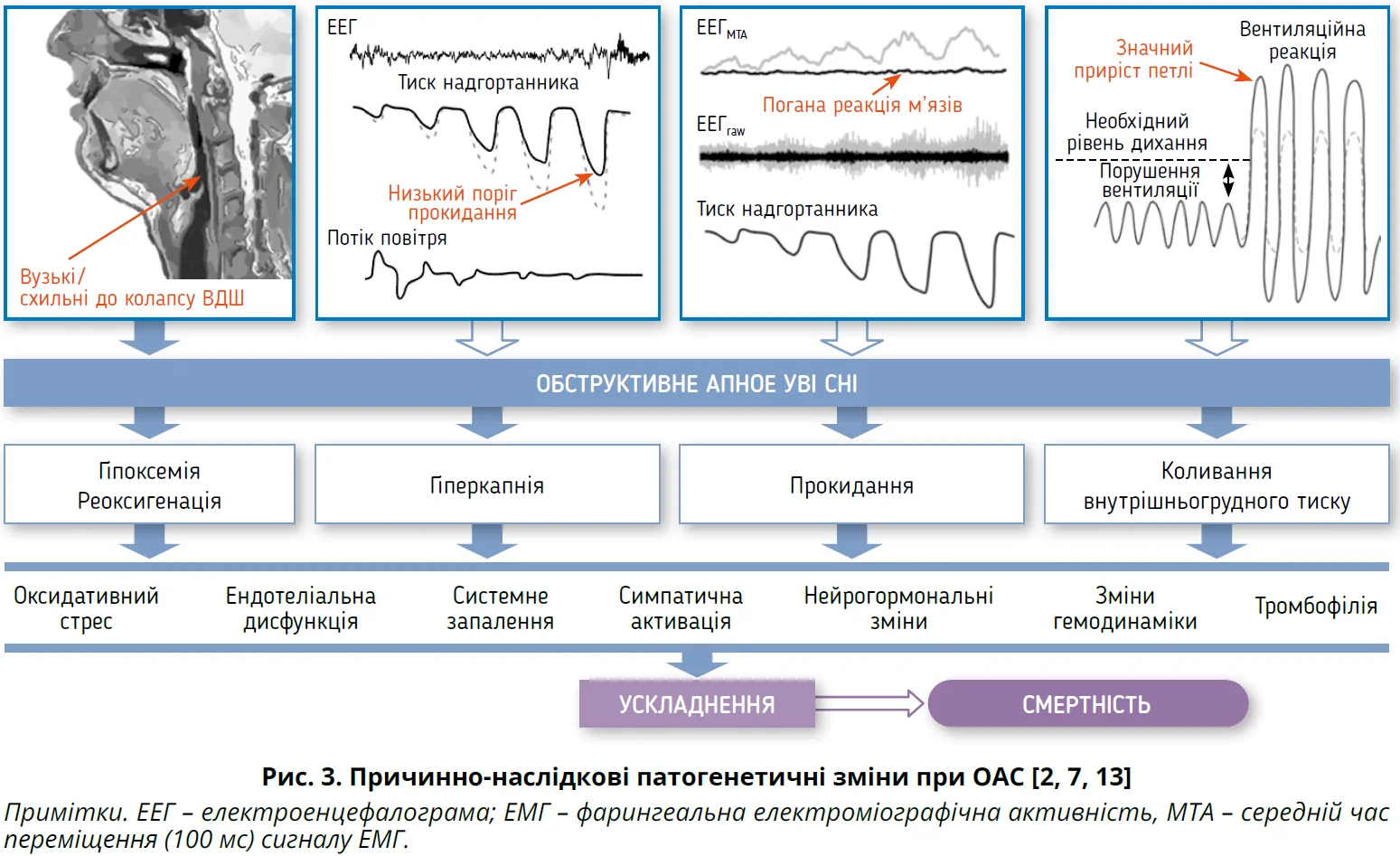
Важливою умовою для виникнення ОАС є певний ступінь порушення анатомії ВДШ, як-от вузькі / схильні до колапсу ВДШ. До неанатомічних механізмів ОАС відносять низький поріг прокидання, погану реактивність м’язів глотки та значний приріст петлі (рис. 3), які можуть бути терапевтичними цілями [7, 12].
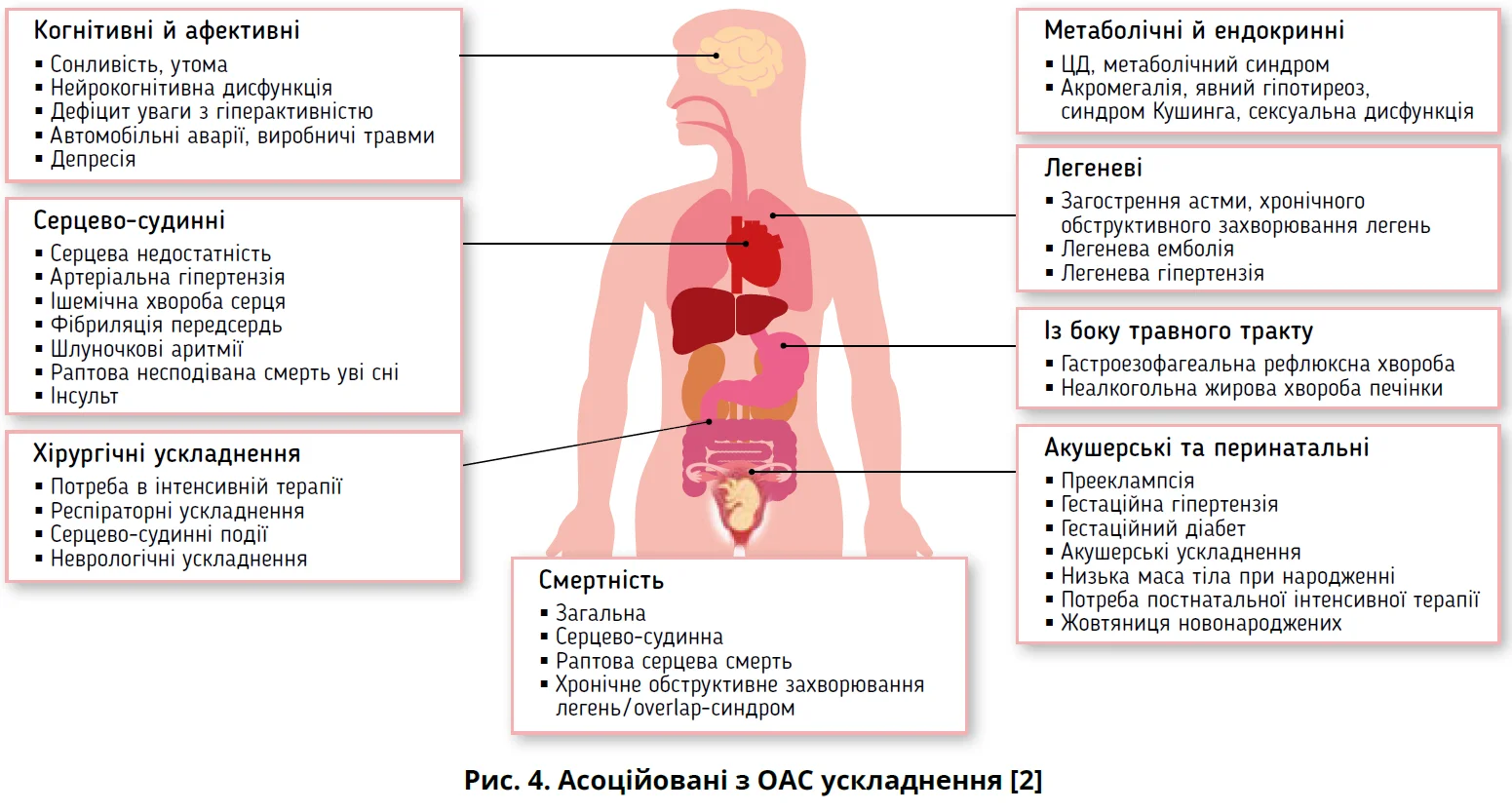
Повторювана обструкція ВДШ із циклічним обмеженням повітряного потоку асоціюється з десатурацією й реоксигенацією, коливаннями внутрішньогрудного тиску, що порушують гемодинаміку та спричиняють збудження через активацію симпатичної нервової системи. Разом із супутніми чинниками ризику (ожиріння й метаболічний синдром) нічна респіраторна дисфункція (гіпоксемія, реоксигенація та гіперкапнія), погана якість сну (прокидання, фрагментація сну зі вкороченням фаз N3 та REM) і коливання внутрішньогрудного тиску спричиняють або потенціюють оксидативний стрес, запалення, ендотеліальну дисфункцію, нейрогормональні зміни, тромбофілію та порушення гемодинаміки (рис. 3). Указані патофізіологічні порушення лежать в основі багатьох несприятливих системних наслідків СОАС (рис. 4) [2, 14].
За відсутності лікування ОАС призводить до інвалідності та передчасної смерті, найчастіше через серцево-судинні події [8]. Інтермітивна гіпоксія, зумовлена повторними епізодами гіпопное/апное, посилює симпатичний тонус і серцевий викид, що підвищує артеріальний тиск, збільшує частоту серцевих скорочень і посилює серцевий стрес. Установлено значущий зв’язок між тяжкістю ОАС за індексом AHI або часом десатурації (SpO2 <90%) та поширеністю серцево-судинних захворювань, навіть після поправки на такі чинники ризику, як вік, стать, індекс маси тіла (ІМТ), артеріальна гіпертензія та холестерин ліпопротеїнів високої щільності [15]. Негативні впливи на серцево-судинну систему пояснюють високу смертність унаслідок серцево-судинних подій у цій когорті – 42% порівняно з 26% в осіб без ОАС [16].
Чинники ризику ОАС
Чинники ризику ОАС умовно поділяють на анатомічні (структурні) та неанатомічні (табл. 3) [17]. Серед неструктурних змін (табл. 3) найбільше значення мають вік, чоловіча стать, сімейний анамнез та ендокринно-метаболічні порушення, що докладно розглядатимуться нижче [6].
Ендокринні чинники ризику ОАС
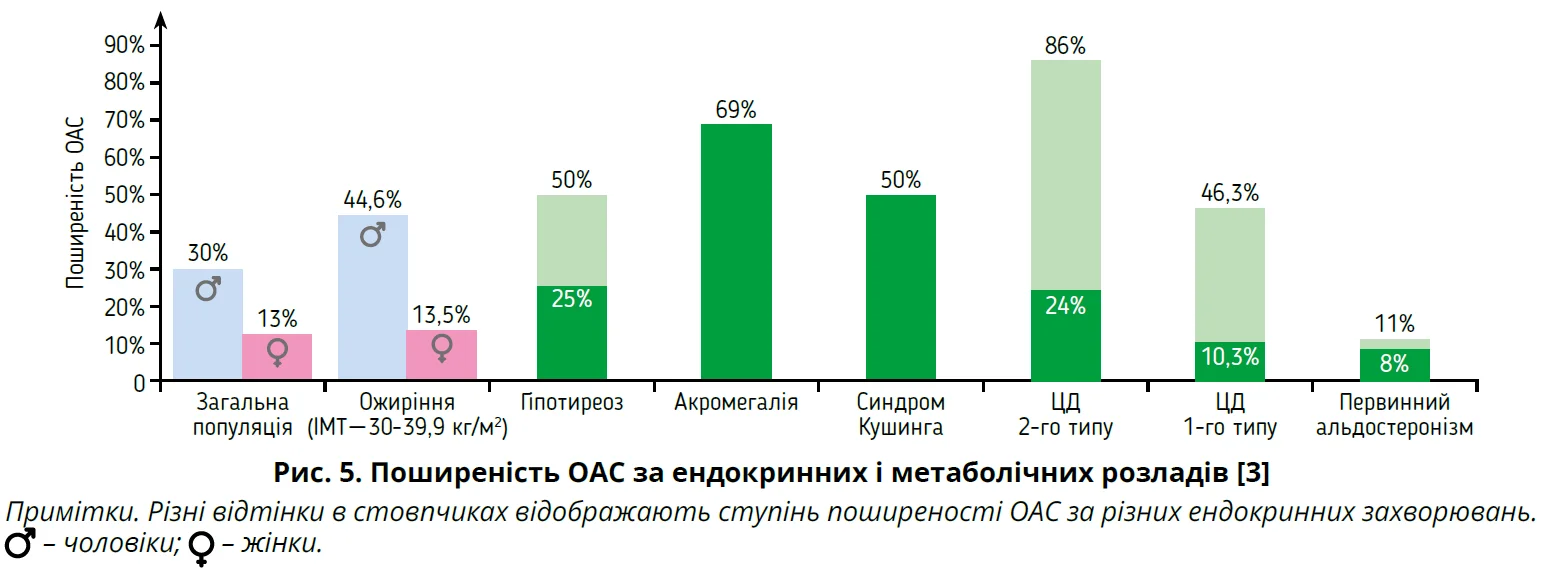
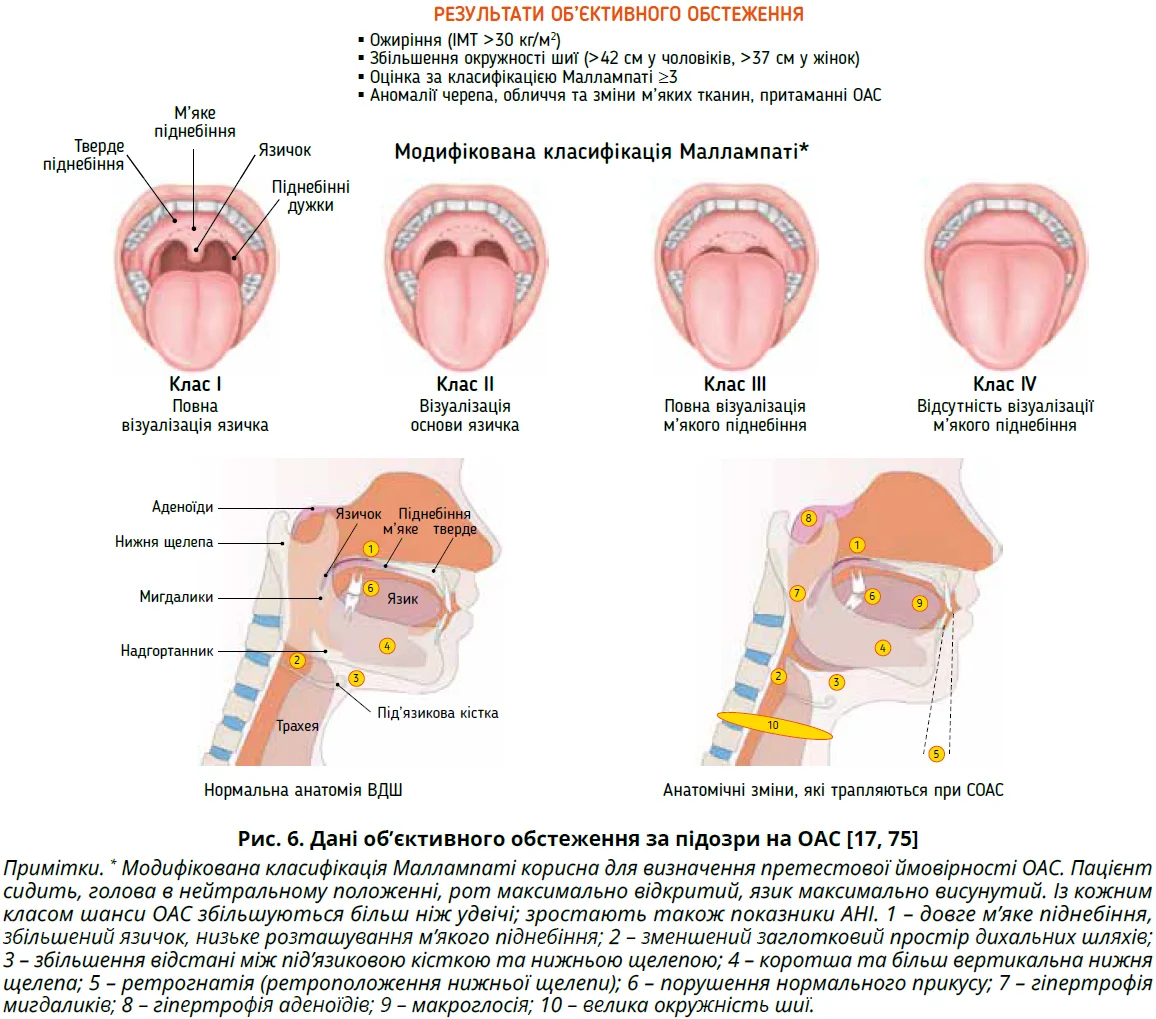
Поширеність ОАС за ендокринних розладів ілюструє рисунок 5.
Ожиріння
Ожиріння – один із найпотужніших чинників ризику ОАС. Відношення шансів ОАС у людей з ожиріння становить 4-10 порівняно з людьми з нормальною масою тіла [19]. За даними епідеміологічних досліджень, поширеність ОАС серед осіб віком 30-49 років з ІМТ <25 кг/м² становить 1,4-7,0%, сягаючи 13,5% у жінок та 44,6% у чоловіків з ІМТ 30-39,9 кг/м² [20]. Звуження ВДШ у цій когорті зумовлено відкладенням жиру в парафарингеальних жирових подушках і м’язах глотки [19]. Ожиріння асоціюється з помітним зниженням нервово-м’язових реакцій ВДШ, що пояснюється впливами греліну, адипонектину й лептину [21]. Крім того, ОАС може спричинити збільшення маси тіла та хвороби, пов’язані з ожирінням. Ожиріння й ОАС збільшують ризик серцево-судинних подій, раку та смертності [22]. Отже, зв’язок між ОАС і ожирінням двобічний, що створює хибне коло.
Варто вказати, що ОАС більше пов’язане з центральним розподілом жиру, тому ІМТ не є надійним предиктором ОАС. Окружність талії, співвідношення окружностей талії та стегон і окружність шиї краще корелюють з ОАС. Зокрема, збільшення окружності шиї асоціюється з ОАС і метаболічним синдромом незалежно від окружності талії [23]. Тісний зв’язок ОАС із центральним ожирінням пояснює вищу поширеність ОАС у чоловіків порівняно з жінками, котрі до менопаузи схильні до периферичного відкладання жиру. Гормональні зміни, що асоціюються з ожирінням, також впливають на поширеність ОАС, особливо в жінок. Наприклад, у жінок з ожирінням і синдромом полікістозних яєчників важливу роль у патогенезі ОАС і його тяжкості відіграє андрогенемія [21]; рівень вільного тестостерону >1,07 нг/дл вважається предиктором ОАС [24].
Ожиріння часто спричиняє резитентну артеріальну гіпертензію. У пацієнтів з ожирінням підтверджено надмірне утворення альдостерону з одночасним зниженням рівнів гормону росту й інсуліноподібного фактора росту-1 (IGF-1). Низькі рівні IGF-1 корелюють із вищими показниками AHI [25]. Інсулінорезистентність зазвичай асоціюється з абдомінальним ожирінням і характеризується зниженням біологічної дії інсуліну, що спричиняє діабет – інший установлений чинник ризику ОАС. Сучасна епідемія ожиріння дає змогу прогнозувати зростання поширеності ОАС у найближчій перспективі [3].
Цукровий діабет 2-го типу
Серед пацієнтів із цукровим діабетом (ЦД) 2-го типу поширеність ОАС коливається від 24 до 86%, що суттєво вище, ніж у загальній популяції. Велике ретроспективне дослідження «випадок – контроль» показало, що відносний ризик ОАС у пацієнтів із ЦД 2-го типу становить 1,76 порівняно з особами без діабету; зв’язок залишався значущим після корегування таких чинників, як вік, стать та ІМТ [26].
Патофізіологічні зв’язки між ЦД 2-го типу й ОАС складні. На стабільність ВДШ впливають інсулінорезистентність і дисфункція вегетативної нервової системи. Хронічна гіперглікемія змінює чутливість каротидних тілець. Дисфункція та дегенеративні зміни каротидних тілець знижують реактивність у відповідь на гіпоксемію [27]. Підвищення глікованого гемоглобіну (HbA1c) корелює з тяжкістю ОАС [28]. Іншим потенційним механізмом ОАС є вегетативна нейропатія. Вплив на центральні та периферичні хеморецептори, язикоглотковий, блукальний і пропріоцептивний нерви порушує хімічний контроль дихання, що спричиняє або посилює ОАС [29]. Пацієнти з периферичною діабетичною нейропатією значно частіше страждають на ОАС; існує позитивна кореляція між тяжкістю ОАС і тяжкістю нейропатії [30]. Тяжкість ОАС корелює з усіма мікросудинними ускладненнями діабету [31]. Через високу поширеність ОАС Міжнародна федерація діабету підкреслює важливість скринінгу ОАС у всіх пацієнтів із ЦД 2-го типу [32].
Цукровий діабет 1-го типу
Значна поширеність ОАС у разі ЦД 1-го типу підтверджує потенційну патогенетичну роль гіперглікемії, мікро- та макросудинних ускладнень діабету [33]. Поширеність помірного-тяжкого ОАС становить 10,3% через 9,3±7,3 року хвороби, сягаючи 46,3% за тривалості діабету 29±14 років [34].
Гестаційний діабет
За даними систематичного огляду та когортного дослідження, ймовірність виникнення гестаційного діабету у вагітних із СОАС на 52-78% вища [35, 36]. У дослідженні, яке вивчало взаємодії між вагітністю, ОАС і гестаційним діабетом, установлено, що індекс прокидання й індекс кисневої десатурації є незалежними предикторами гіперглікемії [37]. Передбачувані патогенетичні механізми гестаційного діабету в жінок з ОАС включають порушення сну, періодичну гіпоксемію, оксидативний стрес, запалення, катехоламінергічну активацію, периферичну вазоконстрикцію й ендотеліальну дисфункцію. Ступінь тяжкості ОАС впливає на ступінь порушення толерантності до глюкози. У 23 учасниць дослідження з гестаційним діабетом виявлено позитивну кореляцію між AHI та сироватковими рівнями фактора некрозу пухлин-α й інтерлейкіну-6 і -8 [38]. Ступінь десатурації у вагітних із гестаційним діабетом корелює з глікемією натще, резистентністю до інсуліну та функцією β-клітин [39].
Гіпотиреоз
За даними систематичного огляду, поширеність СОАС у пацієнтів з явним гіпотиреозом становить 25-50% [40]. Існує багато механізмів, які пояснюють зв’язок між гіпотиреозом і СОАС, але найвагомішу роль відіграють зміни фізіології дихання, зокрема порушення регуляторного контролю м’язів – розширювачів глотки через нейропатію та пригнічення дихального центру [41]. При тяжкій мікседемі обструкція ВДШ може бути спричинена макроглосією та відкладанням мукопротеїнів [3]. Великий зоб також зумовлює механічне стиснення ВДШ внаслідок набряку, пов’язаного зі зменшенням венозного повернення від голови та шиї [42]. Крім того, зниження функції щитоподібної залози має опосередкований вплив на ОАС через метаболічний синдром [43].
Хоча субклінічний гіпотиреоз асоціюється з інсулінорезистентністю, дисліпідемією та більшою поширеністю атеросклерозу, його зв’язок з ОАС значно слабший через відсутність серйозного впливу на фізіологію дихання. Пацієнти із субклінічним гіпотиреозом можуть мати знижену силу м’язів діафрагми та менший об’єм легень, але це не спричиняє ОАС [40].
Акромегалія
У 69% пацієнтів з акромегалією виявляють ОАС. Акромегалія спричиняє деформацію кісток обличчя, особливо нижньої щелепи, потовщення глотки/язика внаслідок відкладення глікозаміногліканів і посиленого утворення колагену. Крім того, виникає набряк тканин, зумовлений підвищеною реабсорбцією натрію в нирках унаслідок стимуляції епітеліальних натрієвих каналів гормоном росту й IGF-1. Пацієнтам з акромегалією притаманний надмір маси тіла, що також посилює ризик СОАС [44]. Поширеність акромегалії в пацієнтів із СОАС становить 0,14-0,71%, що значно вище, ніж у загальній популяції [45]. У пацієнтів із вищими рівнями гормону росту й IGF-1 зрідка спостерігається центральне апное уві сні, пов’язане з посиленням вентиляційної відповіді на вуглекислий газ [3].
Синдром Кушинга
Синдром Кушинга асоціюється з ожирінням, діабетом та 2,82-разовим підвищенням ризику ОАС [46]. У дослідженні «випадок – контроль» поширеність ОАС у пацієнтів із синдромом Кушинга була вдвічі вищою, ніж у групі контролю, зіставною за статтю, віком та ІМТ. Самостійну роль в обструкції ВДШ та сприйнятливості до ОАС у цій когорті можуть відігравати накопичення жирової тканини в підшкірній клітковині шиї та м’язова слабкість [47].
Первинний альдостеронізм
Ожиріння – це спільний чинник ризику для ОАС і первинного альдостеронізму. Надлишок жирової тканини загострює ОАС, а продукти секреції адипоцитів зумовлюють надмірну секрецію альдостерону в осіб з ожирінням [48]. Первинний альдостеронізм призводить до перевантаження рідиною та метаболічних аномалій, які спричиняють ОАС. Переміщення рідини з нижніх кінцівок у шию призводить до набряку м’яких тканин і резистентності ВДШ з обструкцією повітряного потоку. Нічний ростральний зсув рідини є одним із механізмів, пов’язаних із виникненням ОАС за серцевої недостатності [49]. Поширеність ОАС у пацієнтів із первинним альдостеронізмом коливається від 8 до 11%, але незначно відрізняється від поширеності в загальній популяції. У нещодавньому перехресному дослідженні HYPNOS виявлено значущий зв’язок між рівнем альдостерону в плазмі крові та помірним-тяжким ОАС [50]. Настанови Ендокринного товариства рекомендують скринінг на первинний альдостеронізм у пацієнтів з ОАС і гіпертензією [51].
Ендокринні порушення, спричинені ОАС
Важливо, що СОАС – це стан із потенціалом негативного зворотного зв’язку. Інакше кажучи, СОАС погіршує певні супутні хвороби, що, своєю чергою, погіршує СОАС. У цьому розділі обговорюватиметься зв’язок СОАС ® ендокринні розлади ® загострення СОАС [3].
Патофізіологічні механізми зв’язку ОАС та ендокринних розладів
Патофізіологія ОАС складна, зумовлена різними механізмами, зокрема колапсом ВДШ, реактивністю м’язів (здатність до розширення в разі звуження), пробудження під час сну для відновлення дихання та посилення вентиляційної петлі (рис. 3). Різні механізми зумовлюють гетерогенну реакцію ВДШ на гіпопное/апное, які можна індивідуально оцінити шляхом визначення пасивного критичного тиску закриття ВДШ, порогу прокидання, посилення петлі та шкали м’язової чутливості, що дає можливість установити фенотип ОАС [52]. Частковий або повний колапс ВДШ спричиняє повторювані падіння сатурації, серцево-судинні порушення (тахікардію, брадикардію, підвищення артеріального тиску) та фрагментацію сну внаслідок прокидання. Крім того, ОАС впливає на ендокринну систему через переривчасту гіпоксію, активацію симпатичної нервової системи, прокидання та системне запалення [3].
Гормональні зміни внаслідок ОАС
Початок сну та повільний сон асоціюються зі зниженням рівня кортизолу з подальшим збільшенням його секреції під час прокидання [3].
У систематичному огляді досліджень, які порівнювали рівень кортизолу в плазмі крові в осіб з ОАС та ожирінням або нормальною масою тіла, не було доказів активації гіпоталамо-гіпофізарно-надниркової (ГГН) осі в 6 із 7 досліджень [53]. Лише у 2 дослідженнях оцінювали 24-годинний профіль кортизолу, але їхні результати виявилися суперечливими. Можливо, вплив ОАС на вісь ГГН не пов’язаний із базальним або 24-годинним профілем кортизолу, а полягає в динамічних відповідях на пригнічення або стимуляцію ГГН [3].
В одному дослідженні встановлено: незважаючи на відсутність різниці в показниках базального кортизолу в слині в пацієнтів з ОАС і групою контролю з ожирінням, пригнічення кортизолу в слині після пригнічувального тесту з дексаметазоном було значно менш вираженим у пацієнтів з ОАС [54].
У нещодавньому метааналізі не спостерігалося істотного зв’язку між ОАС і активністю/концентрацією реніну в плазмі, але рівні ангіотензину II були значно вищими в пацієнтів з ОАС порівняно з групою контролю [55]. Встановлено також, що ОАС асоціюється з пригніченням базальних і стимульованих рівнів гормону росту
й IGF-1 [56].
У пацієнтів з ОАС і гіпертензією спостерігалися рідкісні випадки псевдофеохромоцитоми – клініко-біохімічні ознаки феохромоцитоми за відсутності пухлини, що секретує катехоламіни. Після схуднення або застосування CPAP клініко-біохімічні ознаки зазвичай зникають [57].
Метаболізм глюкози
На метаболізм глюкози впливає інтермітивна гіпоксія, індукуючи симпатичну активацію, системне запалення з виділенням прозапальних цитокінів, контрінсулярних гормонів і жирних кислот, що посилює інсулінорезистентність і дисфункцію β-клітин і корелює з тяжкістю ОАС [58]. Фрагментація сну також посилює симпатичну активність і змінює вісь ГГН, спричиняючи інсулінорезистентність. Структура сну, насамперед притаманна ОАС депривація фази повільного сну, особливо пов’язана з інсулінорезистентністю [34]. Більша резистентність до інсуліну виникає при тяжчих ОАС незалежно від ожиріння та жирової маси [59].
Гіперглікемія натще пов’язана із СОАС і його тяжкістю. Іншим механізмом посилення симпатичної активності, підвищення артеріального тиску, дисрегуляції периферичної чутливості до інсуліну та гомеостазу глюкози є підвищення хемочутливості каротидних тілець унаслідок СОАС [60]. Предіабет і ЦД 2-го типу підвищують чутливість каротидних тілець, замикаючи негативне метаболічне хибне коло [61]. Часткова депривація сну спричиняє дисфункцію осі ГГН, симпатичну активацію та порушує гомеостаз глюкози [3].
За даними метааналізу, СОАС є незалежним чинником ризику ЦД 2-го типу після корекції таких чинників, як вік, стать та ІМТ [62]. Порушення метаболізму глюкози при ОАС залишаються нерозпізнаними у 28% пацієнтів із помірним-тяжким ОАС [63].
Функція щитоподібної залози
Нещодавній метааналіз, який включав 17 досліджень, показав підвищену поширеність явного гіпотиреозу при ОАС – 8% проти 0,5-5,2% у загальній популяції Європи. Виникнення явного гіпотиреозу асоціювалося з тяжкістю ОАС. Підвищеної поширеності субклінічного гіпотиреозу не виявлено. Основним спотворювальним чинником у цій популяції було ожиріння [64].
Відомо, що поширеність автоімунних розладів і дисфункції щитоподібної залози вища в людей з ожирінням [42]. У дослідженні, де критерієм автоімунного тиреоїдиту був позитивний результат на анти-ТПО та/або анти-ТГ у пацієнта з неоднорідністю паренхіми та зниженою ехогенністю щитоподібної залози під час ультразвукового дослідження, діагноз установлено в 47% осіб з ОАС і 32% учасників групи контролю. Автори дійшли висновку, що поширеність хвороби Хашимото вища при ОАС і корелює з тяжкістю ОАС, особливо в жінок [65]. Вища поширеність автоімунного тиреоїдиту в пацієнтів з ОАС може пояснюватися системним запаленням низького ступеня, спричиненим інтермітивною гіпоксією, що, своєю чергою, може зумовлювати клітинне пошкодження та дисрегуляцію імунної відповіді [66].
Існує декілька механізмів, які можуть призвести до підвищення рівня тиреотропного гормону (ТТГ) при ожирінні. Жирова тканина виробляє цитокіни й інші фактори запалення, а лептин підвищує рівень тиреотропін-рилізинг-гормону через прямий вплив на відповідні нейрони. Крім того, при ожирінні спостерігається підвищена активність дейодинази, що посилює перетворення Т4-Т3 [67]. Нарешті, ожиріння асоціюється з більшою поширеністю антитіл до тиреопероксидази [68].
Гіпогонадизм
Дисфункція гіпоталамо-гіпофізарно-гонадної осі у відповідь на високий рівень кортизолу може підвищувати рівень тестостерону. Проте рівень тестостерону може бути нормальним або зниженим, оскільки на нього впливає гіпоксія, спричинена ОАС [69]. У нещодавньому дослідженні «випадок – контроль» у чоловіків з ОАС рівні тестостерону були нижчими [70]. У жінок AHI >10 асоціювався з нижчими рівнями 17-OH-прогестерону, прогестерону й естрадіолу в сироватці крові, що свідчить про можливість дисфункції яєчників при ОАС [71].
Гіперальдостеронізм
Виявлено потенційний двобічний зв’язок між ОАС і гіперальдостеронізмом, оскільки гіперальдостеронізм може спричиняти ОАС, а ОАС здатне індукувати активацію ренін-ангіотензин- альдостеронової системи через інтермітивну гіпоксію [72].
Діагностика ОАС
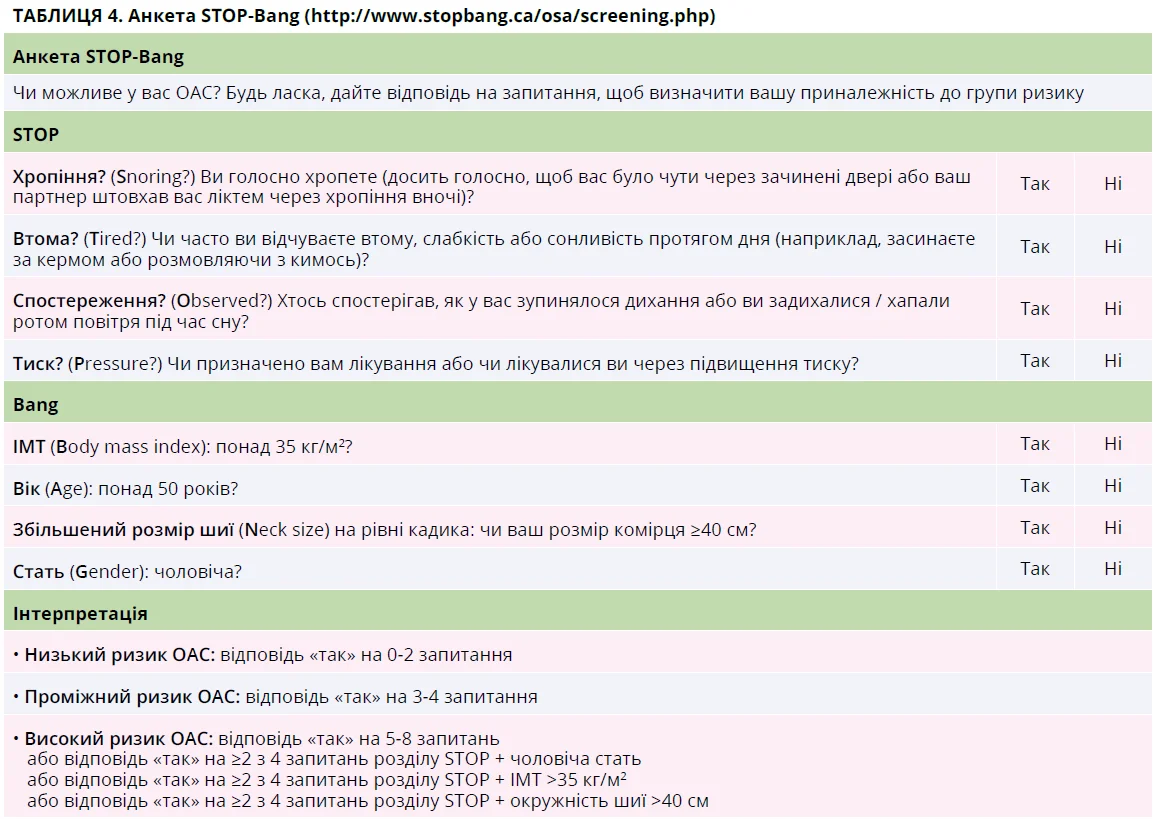
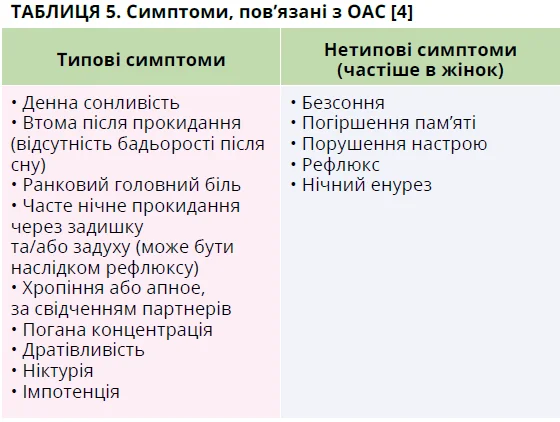
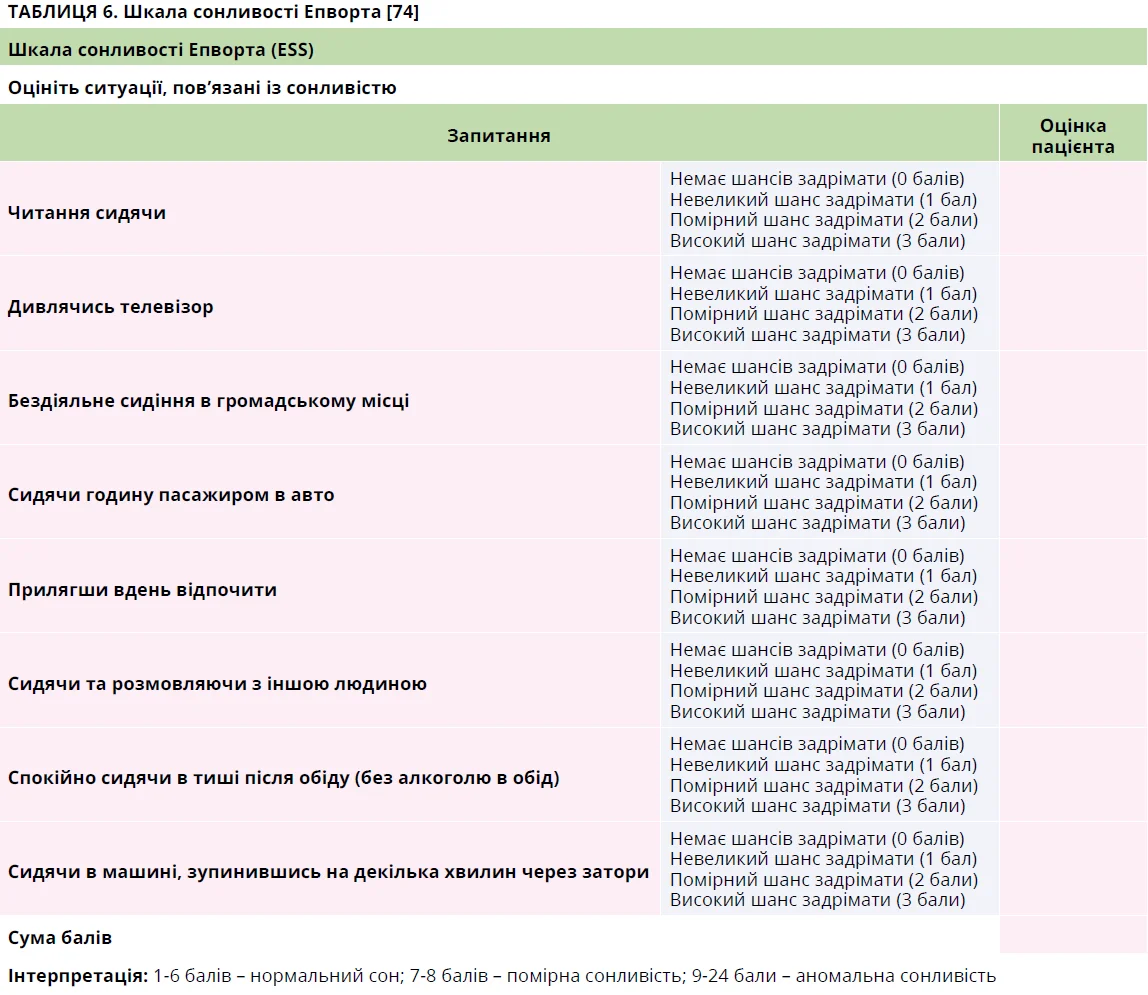
У пацієнта з підозрою на ОАС слід зібрати докладний анамнез, включно з опитуванням партнера чи близьких родичів пацієнта. Ризик помірного-тяжкого ОАС можна оцінити за анкетою STOP-Bang (табл. 4) [73]. Хоча найпоширенішим симптомом ОАС є надмірна денна сонливість, клінічні прояви можуть бути різноманітними, іноді атиповими (табл. 5). Рекомендується, щоб пацієнт заповнив шкалу сонливості Епворта (табл. 6) [73].
Окрім ретельного об’єктивного обстеження всіх систем, первинний огляд пацієнта з підозрою на ОАС має включати вимірювання зросту, маси тіла, окружностей талії та шиї, оцінку за класифікацією Маллампаті й виявлення аномалій черепа, обличчя та ВДШ, притаманних ОАС (рис. 6) [4].
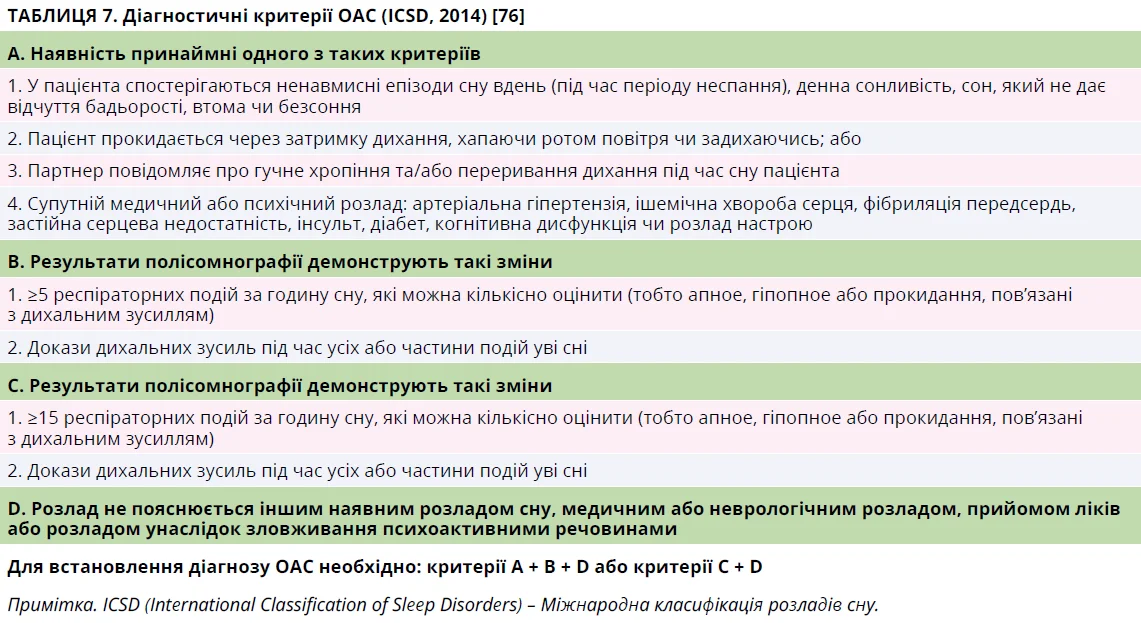
Потреба проведення подальших досліджень визначається ризиком середнього-тяжкого ОАС (табл. 7). Якщо ризик високий, показане проведення тесту на апное уві сні вдома (HSAT). Проведення HSAT недоцільне за наявності будь-якого з таких критеріїв виключення: 1) ймовірність нереспіраторного розладу сну (хронічне безсоння, ходьба/розмова уві сні); 2) ризик гіповентиляції (нервово-м’язове захворювання, ІМТ ≥40 кг/м2); 3) тривале вживання опіатів; 4) серйозне серцево-легеневе захворювання (інсульт в анамнезі, серцева недостатність, захворювання легень середнього-тяжкого ступеня); 5) попередній негативний або сумнівний результат HSAT; 6) вік <16 років; 7) нездатність виконати потрібні кроки для самостійного проведення HSAT (когнітивні, фізичні чи інші бар’єри). Якщо HSAT неможливо провести, пацієнта варто скерувати до сомнолога для визначення потреби в проведенні полісомнографії [4].
Принципи лікування ОАС
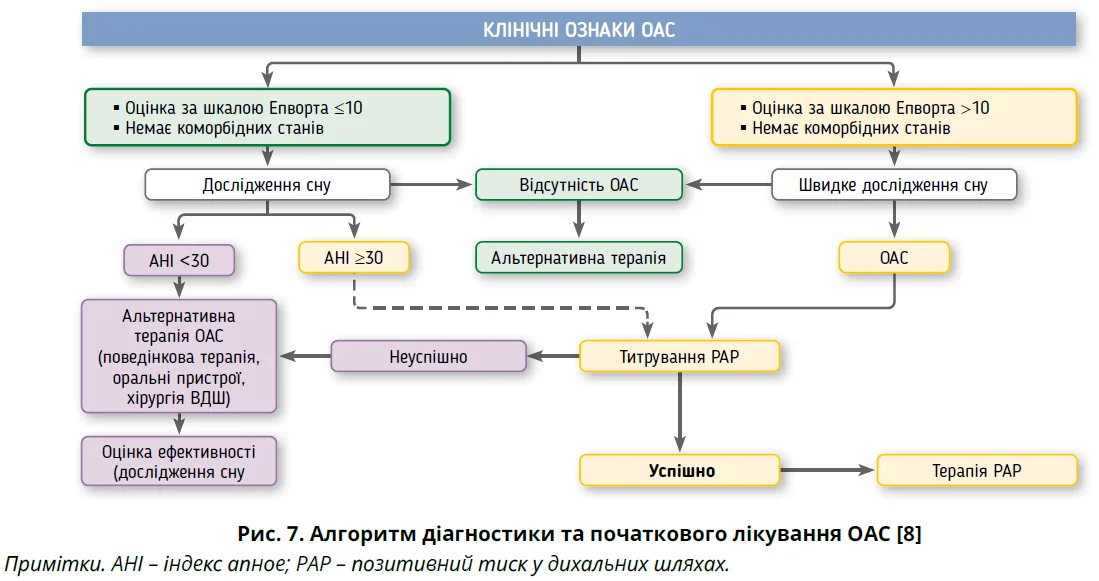
Потреба в лікуванні визначається тяжкістю симптомів, наявністю та тяжкістю будь-якого супутнього захворювання або професійних ризиків, пов’язаних з ОАС, а також ступенем тяжкості порушень, виявлених під час моніторингу сну. За відсутності лікування пацієнти з ОАС і денною сонливістю та/або десатурацією уві сні мають вищий ризик ускладнень. Лікування показане більшості пацієнтів із СОАС і супутніми захворюваннями або ризиком виробничої травми. Лікування доцільно розглянути в пацієнтів із втомою та/або сонливістю навіть за незначного підвищення AHI. Оскільки пацієнти з ОАС схильні до сонливості під час керування транспортом, доцільно також оцінити медичну придатність водія [4].
Здорова поведінка (здоровий спосіб життя, фізичні вправи, дієта) рекомендована всім, особливо пацієнтам з артеріальною гіпертензією та метаболічними чинниками ризику (підвищення ІМТ, порушення регуляції обміну глюкози, дисліпідемія) [4].
Позиційна терапія: уникати сну в положенні горілиць, якщо моніторинг сну вказує на виникнення ОАС у такому положенні. Існують також електронні пристрої, які можуть контролювати та фіксувати положення під час сну [4].
Постійний позитивний тиск у дихальних шляхах (CPAP) залишається стандартним і найефективнішим методом лікування помірного-тяжкого СОАС. Пристрої CPAP створюють безперервний тиск повітря, щоб підтримувати ВДШ відкритими, що забезпечує адекватне дихання вночі. Використання CPAP покращує якість сну, зменшує кількість прокидань, асоціюється зі зниженням AHI та періодів десатурації. Крім того, СРАР покращує якість життя та виживання, а також зменшує ризик серцево-судинних подій [77].
Оральні пристрої можуть бути ефективними в певної частки пацієнтів із легким-помірним ОАС або в разі непереносимості / небажання використовувати CPAP [4].
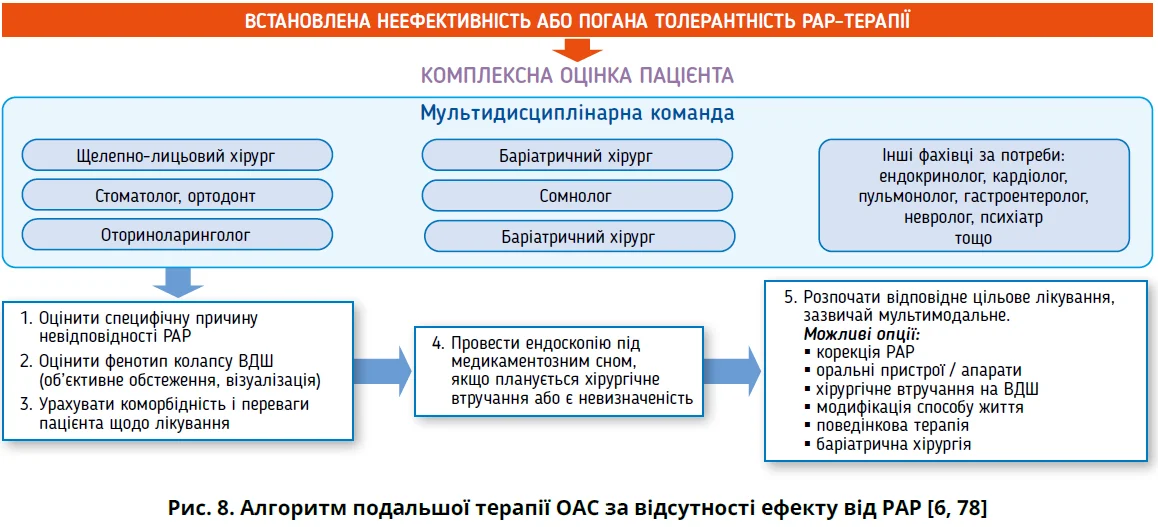
Різні варіанти хірургічного лікування насамперед показані пацієнтам із гіпертрофією мигдаликів або черепно-лицьовими аномаліями. Вирішення потреби хірургічного втручання потребує консультації сомнолога, візуалізації та консультації відповідних фахівців – стоматолога, ортодонта, отоларинголога, щелепно-лицьового хірурга тощо [4].
Загалом сучасна стратегія лікування ОАС акцентує на важливості комплексного персоніфікованого підходу до кожного пацієнта за участю мультидисциплінарної команди [6, 8, 78]. Алгоритми початкового та подальшого лікування ОАС підсумовано на рисунках 7 і 8.
Вплив лікування ендокринної патології на перебіг і тяжкість ОАС
Лікування ожиріння
Встановлено, що втрата 10-15% початкової маси тіла сприяє зменшенню AHI приблизно на 50% у чоловіків із помірним ожирінням. Імовірно, цей ефект зумовлений зменшенням стиснення ВДШ уві сні, зниженням механічного навантаження та покращенням нервово-м’язового контролю глотки [21].
Дієту, фізичні вправи та сон часто називають трьома стовпами здоров’я. Якщо нехтувати принаймні одним зі складників, два інші будуть під загрозою [79]. Отож оптимальний ефект досягається комплексним впливом на всі компоненти [80]. На жаль, у реальному житті часто нехтують важливістю здорового сну, незважаючи на значний потенціал у лікуванні ОАС, ожиріння та ЦД 2-го типу [81].
Аеробні вправи покращують загальне здоров’я. М’язи, що скорочуються, поглинають глюкозу незалежно від секреції інсуліну та посилюють метаболічну дію інсуліну, що сприяє зниженню гіперглікемії [82]. Фізичні вправи також здатні зменшити денну сонливість і тяжкість ОАС, навіть у разі мінімальних змін маси тіла [83]. Отже, фізичні вправи та реабілітація завжди корисні як допоміжна терапія ОАС. Окрім того, аеробні вправи вважаються важливим компонентом контролю маси тіла з додатковими перевагами за умови проведення інтенсивних інтервальних тренувань, особливо в комплексному втручанні, яке також включає корекцію дієти та сну [84-86].
Препарати для лікування ожиріння. Фармакотерапія фентерміном/топіраматом, бупропіоном/налтрексоном та орлістатом сприяє зниженню маси тіла, проте використання цих препаратів часто обмежується побічними ефектами [87]. Перспективним класом стають агоністи рецепторів глюкагоноподібного пептиду-1 (арГПП-1), які забезпечують ефективний контроль маси тіла та глікемії. Серед представників цього класу вже використовуються щоденні ін’єкції ліраглутиду й щотижневі ін’єкції семаглутиду, схвалені Управлінням із контролю продовольства та медикаментів США (FDA) для лікування ЦД 2-го типу й ожиріння. Новим препаратом, який поєднує властивості глюкозозалежного рецептора інсулінотропного поліпептиду (GIP) й арГПП-1, є тирзепатид, схвалений для лікування ЦД 2-го типу. Результати його застосування свідчать про значну втрату маси тіла в пацієнтів із ЦД 2-го типу, проте поки що препарат очікує схвалення для лікування ожиріння [82]. Одним із досліджень, які вивчали вплив арГПП-1 на ОАС, було SCALE Sleep Apnea, що оцінювало ефекти ліраглутиду в дозі 3,0 мг на день у пацієнтів з ОАС без діабету, які не перебували на CPAP-терапії. Виявлено статистично значуще зниження AHI порівняно з плацебо (-12,2 проти -6,1 події, P=0,015), імовірно, через втрату маси тіла (-5,7% порівняно з -1,6% у групі плацебо, P<0,0001) [88]. Лікування ОАС і ЦД 2-го типу препаратами для зниження маси тіла сприяє зниженню кардіометаболічного ризику [89-91].
Баріатрична хірургія дедалі частіше використовується для досягнення значного та тривалого схуднення. Найбільшу ефективність забезпечують рукавна гастректомія та процедури шунтування Roux-en-Y. На сьогодні в клінічній практиці використовуються мінімально інвазивні методики баріатричної хірургії. Аналіз впливу різних методів баріатричної хірургії на ОАС у 13 900 пацієнтів продемонстрував покращення або зникнення ОАС у 78-90% випадків [92]. Декілька досліджень підтверджують тривалу втрату маси тіла після баріатричної хірургії, а також значне покращення або навіть вилікування ЦД 2-го типу й ОАС. У деяких дослідженнях показано ймовірність рецидиву ОАС після баріатричної хірургії, переважно внаслідок повторного збільшення маси тіла, старіння та перерозподілу жиру в організмі [93-95]. До чинників, які прогнозують стійке помірне-тяжке ОАС після операції, відносять: вік ≥50 років, передопераційний AHI ≥30, втрату маси тіла <60% і гіпертензію [96]. Отже, для оптимізації кардіометаболічного ризику після баріатричної хірургії рекомендується тривале спостереження за пацієнтами [95].
Лікування ЦД 2-го типу
Нещодавнє інтервенційне дослідження, проведене в Іспанії, вивчало вплив покращення контролю глікемії на параметри дихання під час сну в 35 пацієнтів із ЦД 2-го типу та СОАС. Пацієнтам проводили полісомнографію на початку дослідження й після 4 місяців інтенсифікації протидіабетичної терапії (метформін у режимі монотерапії [11,4%] або з іншими пероральними препаратами [22,9%], базальний інсулін як монотерапія або в базально-болюсному режимі [25,7%], арГПП-1 + пероральні препарати [5,7%], базальний інсулін із ГПП-1 [8,6%]). Для мінімізації впливу втрати маси тіла на результати пацієнтів зі зменшенням ІМТ >2,0 кг/м2 виключено з дослідження. Помірне покращення показників AHI та нічної гіпоксемії спостерігалося у 24 осіб, які досягли зниження HbA1c ≥0,5%; кращі результати отримано в пацієнтів, які лікувалися інсуліном [97].
Лікування акромегалії
Лікування акромегалії може допомогти вирішити або покращити ОАС у багатьох пацієнтів, але близько 40% демонструють стійкість ОАС, незважаючи на добрий контроль хвороби. Тому слід ретельно контролювати ОАС після початку лікування акромегалії [98]. Надлишок гормону росту при акромегалії безпосередньо впливає на звуження ВДШ, спричиняючи надмірний ріст кісток нижньої та верхньої щелеп, набряк м’яких тканин глотки й макроглосію. Лікування забезпечує частковий регрес указаних змін, але не в усіх пацієнтів [99]. До стійкості ОАС можуть призводити пов’язані з акромегалією явний гіпотиреоз і надмір маси тіла [100].
Лікування гіпотиреозу
У пацієнтів з явним гіпотиреозом замісна гормональна терапія зазвичай сприяє нормалізації функції щитоподібної залози, зменшенню ІМТ, товщини шкірної складки, рівнів глікемії та ліпідів крові й певному покращенню ОАС. Проте сприятливий результат зі значним скороченням періодів апное, хропіння та задухи спостерігався лише в кількох давно проведених дослідженнях з обмеженою кількістю пацієнтів; зникнення ОАС спостерігалося в 66% випадків [101-103]. Зважаючи на значну кількість чинників ризику ОАС (вік, чоловіча стать, менопаузальний статус у жінок, ожиріння), замісної гормональної терапії часто недостатньо для цілковитого вирішення проблеми ОАС [3].
Лікування первинного альдостеронізму та синдрому Кушинга
Невеликі обсерваційні та рандомізовані контрольовані дослідження показали, що в пацієнтів із резистентною гіпертензією й ОАС антагоністи альдостерону сприяють значущому зниженню AHI [48]. Ймовірно, вплив на ОАС є результатом зниження окружності шиї [104]. Спеціальної літератури щодо впливу лікування синдрому Кушинга на ОАС поки що немає [3].
Чи покращує CPAP ендокринні наслідки ОАС?
Назальний CPAP покращує денні симптоми ОАС, повсякденне функціонування й артеріальний тиск [105, 106]. Останні дані свідчать про те, що прихильності до CPAP можна досягнути в більшості пацієнтів за умови використання сучасних пристроїв, навчання й усунення несправності інтерфейсу маски [107]. Проте відомо також, що для оптимізації лікування ОАС часто потрібні альтернативні методи лікування на додаток до CPAP [108]. Різні фенотипи ОАС потребують індивідуалізованого підходу до лікування, що забезпечує значно кращі результати, ніж стандартний підхід «один розмір для всіх» [109]. Незважаючи на переконливі дані спостережень, немає даних рандомізованих досліджень, які показали б, що CPAP сприяє зниженню частоти інсульту чи інфаркту міокарда [110].
Ожиріння
У деяких дослідженнях CPAP-терапія асоціювалася зі збільшенням маси тіла. Дослідження з вимірюванням об’єму позаклітинної рідини вказує, що CPAP може спричиняти затримку рідини [111]. Інші дослідники припускають, що CPAP зменшує витрату калорій через зменшення дихальних зусиль [112]. Іншим поясненням збільшення маси тіла в пацієнтів на CPAP-терапії є нормалізація якості життя та відновлення звичної активності, що призводить до нехтування правилами здорової поведінки (частіший прийом їжі, пиво з друзями). Запропоновано також гормональні теорії збільшення маси тіла внаслідок CPAP-терапії, хоча точні механізми цього ефекту мало зрозумілі [113].
ЦД 2-го типу
Чи має CPAP сприятливий вплив на метаболізм глюкози, не зрозуміло. Дані літератури повідомляють суперечливі результати. У когорті 888 пацієнтів з ОАС і стабільним серцево-судинним захворюванням упродовж 4 років спостереження не виявлено переваг CPAP щодо контролю глікемії порівняно зі звичайним лікуванням в осіб із ЦД 2-го типу, предіабетом або ризиком діабету [114]. Нещодавній метааналіз, який включав 443 учасники, продемонстрував, що лікування CPAP (тривалість втручання – понад 2 тижні) значно покращило показник HOMA-IR, але не рівень глікемії натще [115]. Єдине рандомізоване дослідження за участю пацієнтів із ЦД 2-го типу й ОАС, які протягом 3 місяців отримували CPAP або фіктивний CPAP, не продемонструвало позитивного впливу CPAP на HbA1c або інсулінорезистентність [116].
Гіпотиреоз
У дослідженні за участю пацієнтів із помірним-тяжким ОАС поширеність субклінічного гіпотиреозу та синдрому нетиреоїдного захворювання (СНТЗ), яке характеризується нормальним рівнем ТТГ і низьким рівнем трийодтироніну, становила 8 та 10,4% відповідно. У пацієнтів із СНТЗ нічна гіпоксемія виявилася гіршою, ніж в інших пацієнтів з ОАС. Лікування ОАС сприяло покращенню рівня гормонів у пацієнтів із СНТЗ та субклінічним гіпотиреозом. Під час терапії CPAP у 100% пацієнтів із СНТЗ нормалізувався рівень T3, у 75% пацієнтів із субклінічним гіпотиреозом знизився рівень ТТГ [117].
Сидром Кушинга
Вплив CPAP на артеріальний тиск і рівень кортизолу є дискусійним через суперечливі висновки різних досліджень, зумовлені різним дизайном і малим розміром вибірки. Очевидно, CPAP зменшує стрес, спричинений ОАС. Як наслідок, знижується секреція стресових гормонів (кортизолу, катехоламінів), а отже, й артеріальний тиск [118].
Чи потрібний скринінг ОАС пацієнтам з ендокринними хворобами?
У звіті Робочої групи з профілактичних послуг США (2017) зазначено, що немає достатніх доказів для скринінгу ОАС за відсутності чітких симптомів [119]. Натомість скринінг ОАС і синдрому гіповентиляції показаний усім пацієнтам, яким планується баріатрична хірургія, для зниження ризику періопераційних ускладнень [120]. Підозра на ОАС значно збільшується в чоловіків з окружністю шиї >42,3 см (точність прогнозування помірного-тяжкого ОАС становить 78%) [121].
Систематичну оцінку ризику ОАС можна рекомендувати пацієнтам із ЦД 2-го типу, оскільки лікування ОАС покращує контроль діабету та серцево-судинних чинників ризику. У 2008 р. робоча група Міжнародної федерації діабету рекомендувала цілеспрямований підхід до скринінгу ОАС у пацієнтів із ЦД 2-го типу й ожирінням через значну поширеність ОАС у цій когорті. Крім того, запропоновано скринінг пацієнтів із ЦД 2-го типу за наявності класичних симптомів ОАС. На жаль, ця рекомендація нечасто виконується в повсякденній клінічній практиці [122].
Скринінг ОАС доцільно проводити пацієнтам з акромегалією та явним гіпотиреозом через значну поширеність і невизначений перебіг СОАС після корекції ендокринних розладів. Натомість у пацієнтів із первинним альдостеронізмом поширеність ОАС така сама, як у загальній популяції, що не виправдовує скринінгу [3].
Чи потрібний скринінг ендокринних розладів пацієнтам з ОАС?
Рекомендацій щодо скринінгу діабету при ОАС поки що немає. Проте Американська діабетологічна асоціація рекомендує скринінг на діабет в осіб із надмірною масою тіла / ожирінням за наявності принаймні одного з таких чинників ризику: діабет у родича першого ступеня спорідненості, етнічна приналежність до груп високого ризику, анамнез серцево-судинних захворювань, артеріальна гіпертензія, метаболічна дисліпідемія, синдром полікістозних яєчників, недостатня фізична активність та інші клінічні стани, пов’язані з інсулінорезистентністю [123]. Багато пацієнтів з ОАС демонструють принаймні одну з указаних характеристик, що зумовлює потребу скринінгу на порушення метаболізму глюкози.
Пацієнти із субклінічним гіпотиреозом зазвичай не мають симптомів; діагностика включає визначення ТТГ та вільного тироксину. Скринінг функції щитоподібної залози вважається економічно ефективним під час вагітності [124]. Проте для інших категорій дорослих без симптомів даних щодо балансу користь/витрати від скринінгу недостатньо [125]. Дискусія щодо цього питання надалі відкрита.
Скринінг на акромегалію доцільний у пацієнтів із СОАС, оскільки поширеність акромегалії в цій когорті у 8-30 разів вища, ніж у загальній популяції [44]. За рекомендаціями Ендокринного товариства, всім пацієнтам із типовими проявами акромегалії пропонується визначення IGF-1 [45]. Визначення IGF-1 у пацієнтів з ОАС доцільно проводити лише за наявності інших супутніх захворювань, як-от діабет або артеріальна гіпертензія [126]. Зважаючи на високу вартість визначення IGF-1, одним із варіантів скринінгу акромегалії може бути розпізнавання легких дисморфічних рис на фотографіях обличчя за допомогою комп’ютерного програмного забезпечення [127].
Висновки
- Між ожирінням, ОАС і ЦД 2-го типу існує багато взаємодій, які посилюють кардіометаболічний ризик.
- Значна поширеність ОАС при ожирінні, ЦД 2-го типу, акромегалії, синдромі Кушинга та явному гіпотиреозі зумовлює потребу активного виявлення ОАС у вказаних когортах.
- У пацієнтів з ОАС можливе виникнення низки ендокринних розладів, які також потребують скринінгу. Скринінг на акромегалію поки що не рекомендований, але ознаки акромегалії мають детально оцінюватися сомнологом під час обстеження пацієнта з нещодавно діагностованим ОАС, щоб уникнути неправильного діагнозу та небажаних наслідків від відсутності лікування. Потреба скринінгу розладів щитоподібної залози дискутується, але скринінг цілком виправданий у групах ризику або за наявності симптомів. Виявлення пов’язаних з ОАС ендокринних розладів є важливим, оскільки відповідне лікування покращує ОАС.
- У пацієнтів з ендокринними розладами ОАС недостатньо діагностується та лікується через брак обізнаності фахівців і відсутність систематичного скринінгу.
- Найкращий результат лікування ОАС забезпечує комплексний персоніфікований підхід за участю мультидисциплінарної команди, до складу якої доцільно включити ендокринолога.
Література
- Fietze I., Laharnar N., Obst A., et al. Prevalence and association analysis of obstructive sleep apnoea with gender and age differences – results of SHIP-Trend. J. Sleep Res. 2019; 28 (5): e12770.
- Espiritu J.R.D. Health consequences of obstructive sleep apnea. J. Sleep Disord. Ther. 2019; 8: 307. doi: 10.35248/2167-0277.19.8.307.
- Akset M., Poppe K.G., Kleynen P., et al. Endocrine disorders in obstructive sleep apnoea syndrome: a bidirectional relationship. Clin. Endocrinol. (Oxf.). 2023 Jan; 98 (1): 3-13. doi: 10.1111/cen.14685.
- BC Guidelines. Obstructive sleep apnea: assessment and management in adults. 2021. Available at: https://www2.gov.bc.ca/gov/content/health/practitioner-professional-resources/bc-guidelines/sleep-apnea.
- Parati G., Lombardi C., Hedner J., et al.; EU COST Action B26 members. Recommendations for the management of patients with obstructive sleep apnoea and hypertension. Eur. Respir. J. 2013; 41 (3): 523-38. doi: 10.1183/09031936.00226711.
- Arachchige M.A., Steier J. Beyond usual care: a multidisciplinary approach towards the treatment of obstructive sleep apnoea. Front. Cardiovasc. Med. 2022 Jan 5; 8: 747495. doi: 10.3389/fcvm.2021.747495.
- Lai V., Carberry J.C., Eckert D.J. Sleep apnea phenotyping: implications for dental sleep medicine. J. Dent. Sleep Med. 2019; 6 (2).
- Marin-Oto M., Vicente E.E., Marin J.M. Long term management of obstructive sleep apnea and its comorbidities. Multidiscip. Respir. Med. 2019; 14: 21. doi: 10.1186/s40248-019-0186-3.
- What Happens During OSA. Sleep Apnea. healthysleep.med.harvard.edu. Available at: http://healthysleep.med.harvard.edu/sleep-apnea/what-is-osa/what-happens#:~:text=When%20we%20sleep%2C%20there%20is.
- Sleep apnea creates gaps in life memories: people with sleep apnea struggle to remember details of memories from their own lives putting them at risk of depression. ScienceDaily. 2019. Available at: https://www.sciencedaily.com/releases/2019/01/190131101103.htm.
- Personal & Societal Consequences | Sleep Apnea. Harvard.edu. 2010. Available at: http://healthysleep.med.harvard.edu/sleep-apnea/living-with-osa/persona-societal.
- Bosi M., De Vito A., Eckert D., et al. Qualitative phenotyping of obstructive sleep apnea and its clinical usefulness for the sleep specialist. Int. J. Environ. Res. Public Health. 2020; 17 (6): 2058. doi: 10.3390/ijerph17062058.
- Carberry J.C., Amatoury J., Eckert D.J. Personalized management approach for OSA. Chest. 2018; 153 (3): 744-755.
- Shamsuzzaman A.S., Gersh B.J., Somers V.K. Obstructive sleep apnea: implications for cardiac and vascular disease. JAMA. 2003; 290 (14): 1906-1914.
- Shahar E., Whitney C.W., Redline S., et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. American Journal of Respiratory and Critical Care Medicine. 2001; 163 (1): 19-25.
- Toolkit For Commissioning and Planning Local NHS Services in the UK Obstructive Sleep Apnoea (OSA). Available at: https://www.blf.org.uk/sites/default/files/OSA_Toolkit_2015_BLF_0.pdf.
- Lévy P., Kohler M., McNicholas W.T., et al. Obstructive sleep apnoea syndrome. Nat. Rev. Dis. Primers. 2015; 1: 15015. doi: 10.1038/nrdp.2015.15.
- Zreaqat M., Hassan R., Samsudin A.R., et al. Tonsil size and Mallampati score as clinical predictive factors for obstructive sleep apnea severity in children. J. Contemp. Dent. Pract. 2021 Jul 1; 22 (7): 850-853.
- Gottlieb D.J., Punjabi N.M. Diagnosis and management of obstructive sleep apnea: a review. JAMA. 2020; 323 (14): 1389-1400. doi: 10.1001/jama.2020.3514.
- Peppard P.E., Young T., Barnet J.H., et al. Increased prevalence of sleep-disordered breathing in adults. Am. J. Epidemiol. 2013; 177 (9): 1006-14. doi: 10.1093/aje/kws342.
- Schwartz A.R., Patil S.P., Laffan A.M., et al. Obesity and obstructive sleep apnea: pathogenic mechanisms and therapeutic approaches. Proc. Am. Thorac. Soc. 2008; 5 (2): 185-92. doi: 10.1513/pats.200708-137MG.
- Hruby A., Manson J.E., Qi L., et al. Determinants and consequences of obesity. Am. J. Public Health. 2016; 106 (9): 1656-62. doi: 10.2105/AJPH.2016.303326.
- Carneiro G., Zanella M.T. Obesity metabolic and hormonal disorders associated with obstructive sleep apnea and their impact on the risk of cardiovascular events. Metabolism. 2018; 84: 76-84. doi: 10.1016/j.metabol.2018.03.008.
- Tock L., Carneiro G., Togeiro S.M., et al. Obstructive sleep apnea predisposes to nonalcoholic fatty liver disease in patients with polycystic ovary syndrome. Endocr. Pract. 2014; 20 (3): 244-51. doi: 10.4158/EP12366.OR.
- Izumi S., Ribeiro-Filho F.F., Carneiro G., et al. IGF-1 levels are inversely associated with metabolic syndrome in obstructive sleep apnea. J. Clin. Sleep Med. 2016; 12 (4): 487-93. doi: 10.5664/jcsm.5672.
- Subramanian A., Adderley N.J., Tracy A., et al. Risk of incident obstructive sleep apnea among patients with type 2 diabetes. Diabetes Care. 2019; 42 (5): 954-963. doi: 10.2337/dc18-2004.
- Balkau B., Vol S., Loko S., et al.; Epidemiologic Study on the Insulin Resistance Syndrome Study Group. High baseline insulin levels associated with 6-year incident observed sleep apnea. Diabetes Care. 2010; 33 (5): 1044-9. doi: 10.2337/dc09-1901.
- Pillai A., Warren G., Gunathilake W., Idris I. Effects of sleep apnea severity on glycemic control in patients with type 2 diabetes prior to continuous positive airway pressure treatment. Diabetes Technol. Ther. 2011; 13 (9): 945-9. doi: 10.1089/dia.2011.0005.
- Bottini P., Redolfi S., Dottorini M.L., Tantucci C. Autonomic neuropathy increases
the risk of obstructive sleep apnea in obese diabetics. Respiration. 2008; 75 (3): 265-71. doi: 10.1159/000100556.
- Bahnasy W.S., El-Heneedy Y.A.E., El-Seidy E.A.S., et al. Sleep disturbances in diabetic peripheral neuropathy patients: a clinical and polysomnographic study. Egypt J. Neurol. Psychiatr. Neurosurg. 2018; 54 (1): 23. doi: 10.1186/s41983-018-0024-0.
- Xue P., Covassin N., Ran X., et al. Association of parameters of nocturnal hypoxemia with diabetic microvascular complications: a cross-sectional study. Diabetes Res. Clin. Pract. 2020; 170: 108484. doi: 10.1016/j.diabres.2020.108484.
- The IDF Consensus Statement on Sleep Apnoea and Type 2 Diabetes. International Diabetes Federation; 2008.
- Manin G., Pons A., Baltzinger P., et al. Obstructive sleep apnoea in people with type 1 diabetes: prevalence and association with micro- and macrovascular complications. Diabet. Med. 2015; 32 (1): 90-6. doi: 10.1111/dme.12582.
- Song S.O., He K., Narla R.R., et al. Metabolic consequences of obstructive sleep apnea especially pertaining to diabetes mellitus and insulin sensitivity. Diabetes Metab. J. 2019; 43 (2): 144-155. doi: 10.4093/dmj.2018.0256.
- Ding X.X., Wu Y.L., Xu S.J., et al. A systematic review and quantitative assessment
of sleep-disordered breathing during pregnancy and perinatal outcomes. Sleep Breath. 2014; 18 (4): 703-713. - Bourjeily G., Danilack V.A., Bublitz M.H., et al. Obstructive sleep apnea in pregnancy is associated with adverse maternal outcomes: a national cohort. Sleep Medicine. 2017; 38: 50-57.
- Reutrakul S., Zaidi N., Wroblewski K., et al. Interactions between pregnancy, obstructive sleep apnea, and gestational diabetes mellitus. The Journal of Clinical Endocrinology
and Metabolism. 2013; 98 (10): 4195-4202. - Bublitz M.H., Carpenter M., Amin S., et al. The role of inflammation in the association between gestational diabetes and obstructive sleep apnea: a pilot study. Obstetric Medicine. 2018; 11 (4): 186-191.
- Wanitcharoenkul E., Chirakalwasan N., Amnakkittikul S., et al. Obstructive sleep apnea and diet-controlled gestational diabetes. Sleep Medicine. 2017; 39: 101-107.
- Sorensen J.R., Winther K.H., Bonnema S.J., et al. Respiratory manifestations of hypothyroidism: a systematic review. Thyroid. 2016; 26 (11): 1519-1527. doi: 10.1089/thy.2015.0642.
- Bruyneel M., Veltri F., Poppe K. Prevalence of newly established thyroid disorders in patients with moderate-to-severe obstructive sleep apnea syndrome. Sleep Breath. 2019; 23 (2): 567-573. doi: 10.1007/s11325-018-1746-z.
- Attal P., Chanson P. Endocrine aspects of obstructive sleep apnea. J. Clin. Endocrinol. Metab. 2010; 95 (2): 483-95. doi: 10.1210/jc.2009-1912.
- Chaker L., Bianco A.C., Jonklaas J., Peeters R.P. Hypothyroidism. Lancet. 2017; 390 (10101): 1550-1562. doi: 10.1016/S0140-6736(17)30703-1.
- Attal P., Chanson P. Screening of acromegaly in adults with obstructive sleep apnea: is it worthwhile? Endocrine. 2018; 61 (1): 4-6. doi: 10.1007/s12020-018-1618-0.
- Bruyneel M., Veltri F., Sitoris G., et al. Prevalence of acromegaly in moderate-to-severe obstructive sleep apnoea. Clin. Endocrinol. (Oxf.). 2022; 96 (6): 918-921. doi: 10.1111/cen.14463.
- Wang L.U., Wang T.Y., Bai Y.M., et al. Risk of obstructive sleep apnea among patients with Cushing’s syndrome: a nationwide longitudinal study. Sleep Med. 2017; 36: 44-47. doi: 10.1016/j.sleep.2017.04.016.
- Gokosmanoğlu F., Güzel A., Kan E.K., Atmaca H. Increased prevalence of obstructive sleep apnea in patients with Cushing’s syndrome compared with weight- and age-matched controls. Eur. J. Endocrinol. 2017; 176 (3): 267-272. doi: 10.1530/EJE-16-0815.
- Pecori A., Buffolo F., Pieroni J., et al. Primary aldosteronism and obstructive sleep apnea: casual association or pathophysiological link? Horm. Metab. Res. 2020; 52 (6): 366-372. doi: 10.1055/a-1133-7255.
- White L.H., Bradley T.D. Role of nocturnal rostral fluid shift in the pathogenesis of obstructive and central sleep apnoea. J. Physiol. 2013; 591 (5): 1179-93. doi: 10.1113/jphysiol. 2012.245159.
- Buffolo F., Li Q., Monticone S., et al. Primary aldosteronism and obstructive sleep apnea: a cross-sectional multi-ethnic study. Hypertension. 2019; 74 (6): 1532-1540. doi: 10.1161/HYPERTENSIONAHA.119.13833.
- Funder J.W., Carey R.M., Mantero F., et al. The management of primary aldosteronism: case detection, diagnosis, and treatment: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2016; 101 (5): 1889-916. doi: 10.1210/jc.2015-4061.
- Bonsignore M.R., Suarez Giron M.C., Marrone O., et al. Personalised medicine in sleep respiratory disorders: focus on obstructive sleep apnoea diagnosis and treatment. Eur. Respir. Rev. 2017; 26 (146): 170069. doi: 10.1183/16000617.0069-2017.
- Tomfohr L.M., Edwards K.M., Dimsdale J.E. Is obstructive sleep apnea associated with cortisol levels? A systematic review of the research evidence. Sleep Med. Rev. 2012; 16 (3): 243-9. doi: 10.1016/j.smrv.2011.05.003.
- Carneiro G., Togeiro S.M., Hayashi L.F., et al. Effect of continuous positive airway pressure therapy on hypothalamic-pituitary-adrenal axis function and 24-h blood pressure profile in obese men with obstructive sleep apnea syndrome. Am. J. Physiol. Endocrinol. Metab. 2008; 295 (2): E380-4. doi: 10.1152/ajpendo.00780.2007.
- Zhang W.D., Zhang J.W., Wu K.F., et al. Effect of aldosterone antagonists on obstructive sleep apnea in patients with resistant hypertension: a systematic review and meta-analysis. J. Hum. Hypertens. 2017; 31 (12): 855-856. doi: 10.1038/jhh.2017.70.
- Lanfranco F., Motta G., Minetto M.A., et al. Growth hormone/insulin-like growth factor-I axis in obstructive sleep apnea syndrome: an update. J. Endocrinol. Invest. 2010; 33 (3): 192-6. doi: 10.1007/BF03346580.
- Gilardini L., Lombardi C., Redaelli G., et al. Effect of continuous positive airway pressure in hypertensive patients with obstructive sleep apnea and high urinary metanephrines. J. Hypertens. 2018; 36 (1): 199-204. doi: 10.1097/HJH.0000000000001507.
- Punjabi N.M., Beamer B.A. Alterations in glucose disposal in sleep-disordered breathing. Am. J. Respir. Crit. Care Med. 2009; 179 (3): 235-40. doi: 10.1164/rccm.200809-1392OC.
- Ip M.S., Lam B., Ng M.M., et al. Obstructive sleep apnea is independently associated with insulin resistance. Am. J. Respir. Crit. Care Med. 2002; 165 (5): 670-6. doi: 10.1164/ajrccm.165.5.2103001.
- Almendros I., Basoglu Ö.K., Conde S.V., et al. Metabolic dysfunction in OSA: is there something new under the sun? J. Sleep Res. 2022; 31 (1): e13418. doi: 10.1111/jsr.13418.
- Sacramento J.F., Andrzejewski K., Melo B.F., et al. Exploring the mediators that promote carotid body dysfunction in type 2 diabetes and obesity related syndromes. Int. J. Mol. Sci. 2020; 21 (15): 5545. doi: 10.3390/ijms21155545.
- Anothaisintawee T., Reutrakul S., Van Cauter E., Thakkinstian A. Sleep disturbances compared to traditional risk factors for diabetes development: systematic review and meta-analysis. Sleep Med. Rev. 2016; 30: 11-24. doi: 10.1016/j.smrv.2015.10.002.
- Bruyneel M., Kleynen P., Poppe K. Prevalence of undiagnosed glucose intolerance and type 2 diabetes in patients with moderate-to-severe obstructive sleep apnea syndrome. Sleep Breath. 2020; 24 (4): 1389-1395. doi: 10.1007/s11325-019-01989-y.
- Zhang M., Zhang W., Tan J., et al. Role of hypothyroidism in obstructive sleep apnea: a meta-analysis. Curr. Med. Res. Opin. 2016; 32 (6): 1059-64. doi: 10.1185/03007995.2016.1157461.
- Bozkurt N.C., Karbek B., Cakal E., et al. The association between severity of obstructive sleep apnea and prevalence of Hashimoto’s thyroiditis. Endocr. J. 2012; 59 (11): 981-8. doi: 10.1507/endocrj.ej12-0106.
- Drager L.F., Jun J.C., Polotsky V.Y. Metabolic consequences of intermittent hypoxia: relevance to obstructive sleep apnea. Best Pract. Res. Clin. Endocrinol. Metab. 2010; 24 (5): 843-51. doi: 10.1016/j.beem.2010.08.011.
- Duntas L.H., Biondi B. The interconnections between obesity, thyroid function, and autoimmunity: the multifold role of leptin. Thyroid. 2013; 23 (6): 646-53. doi: 10.1089/thy.2011.0499.
- Marzullo P., Minocci A., Tagliaferri M.A., et al. Investigations of thyroid hormones and antibodies in obesity: leptin levels are associated with thyroid autoimmunity independent of bioanthropometric, hormonal, and weight-related determinants. J. Clin. Endocrinol. Metab. 2010; 95 (8): 3965-72. doi: 10.1210/jc.2009-2798.
- Mohammadi H., Rezaei M., Sharafkhaneh A., et al. Serum testosterone/cortisol ratio in people with obstructive sleep apnea. J. Clin. Lab. Anal. 2020; 34 (1): e23011. doi: 10.1002/jcla.23011.
- Mostafa R.M., Kamel N.M., Elsayed E.M., Saad H.M. Assessment of sexual functions in male patients with obstructive sleep apnea. Am. J. Otolaryngol. 2021; 42 (2): 102899. doi: 10.1016/j.amjoto.2020.102899.
- Netzer N.C., Eliasson A.H., Strohl K.P. Women with sleep apnea have lower levels of sex hormones. Sleep Breath. 2003; 7 (1): 25-9. doi: 10.1007/s11325-003-0025-8.
- Ahmad M., Makati D., Akbar S. Review of and updates on hypertension in obstructive sleep apnea. Int. J. Hypertens. 2017; 2017: 1848375. doi: 10.1155/2017/1848375.
- Kapur V.K., Auckley D.H., Chowdhuri S., et al. Clinical practice guideline for diagnostic testing for adult obstructive sleep apnea: an American Academy of Sleep Medicine clinical practice guideline. Journal of Clinical Sleep Medicine. 2017; 13 (03): 479-504.
- Johns M.W. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991; 14: 540-5.
- Nuckton T.J., Glidden D.V., Browner W.S., Claman D.M. Physical examination: Mallampati score as an independent predictor of obstructive sleep apnea. Sleep. 2006; 29 (7): 903-938.
- Sateia M.J. International classification of sleep disorders-third edition: highlights and modifications. Chest. 2014; 146 (5): 1387-1394. doi: 10.1378/chest.14-0970.
- Khan S.U., Duran C.A., Rahman H., et al. A meta-analysis of continuous positive airway pressure therapy in prevention of cardiovascular events in patients with obstructive sleep apnoea. Eur. Heart J. 2018; 39 (24): 2291-2297. doi: 10.1093/eurheartj/ehx597.
- Weber M., Carter J., White E.K., Weidenbecher M. A comprehensive and multidisciplinary approach to obstructive sleep apnea: case examples. J. of Clin. Otorh. 2021; 3 (1). doi: 10.31579/2692-9562/020.
- Mukherjee S., Patel S.R., Kales S.N., et al.; American Thoracic Society ad hoc Committee on Healthy Sleep. An official American Thoracic Society statement: the importance of healthy sleep. Recommendations and future priorities. Am. J. Respir. Crit. Care Med. 2015; 191 (12): 1450-8. doi: 10.1164/rccm.201504-0767ST.
- Vallat R., Berry S.E., Tsereteli N., et al. How people wake up is associated with previous night’s sleep together with physical activity and food intake. Nat. Commun. 2022; 13 (1): 7116. doi: 10.1038/s41467-022-34503-2.
- Singh P., Beyl R.A., Stephens J.M., et al. Effect of sleep restriction on insulin sensitivity and energy metabolism in postmenopausal women: a randomized crossover trial. Obesity (Silver Spring). 2023; 1: 1. doi: 10.1002/oby.23739.
- Kurnool S., McCowen K.C., Bernstein N.A., et al. Sleep apnea, obesity, and diabetes – an intertwined trio. Curr. Diab. Rep. 2023; 23: 165-171. doi: 10.1007/s11892-023-01510-6.
- Awad K.M., Malhotra A., Barnet J.H., et al. Exercise is associated with a reduced incidence of sleep-disordered breathing. Am. J. Med. 2012; 125 (5): 485-90. doi: 10.1016/ j.amjmed.2011.11.025.
- Iftikhar I.H., Bittencourt L., Youngstedt S.D., et al. Comparative efficacy of CPAP, MADs, exercise-training, and dietary weight loss for sleep apnea: a network meta-analysis. Sleep Med. 2017; 30: 7-14. doi: 10.1016/j.sleep.2016.06.001
- Berge J., Hjelmesaeth J., Hertel J.K., et al. Effect of aerobic exercise intensity on energy expenditure and weight loss in severe obesity – a randomized controlled trial. Obesity (Silver Spring). 2021; 29 (2): 359-369. doi: 10.1002/oby.23078.
- Park I., Díaz J., Matsumoto S., et al. Exercise improves the quality of slow-wave sleep by increasing slow-wave stability. Sci. Rep. 2021; 11 (1): 4410. doi: 10.1038/s41598-021-83817-6.
- Schauer P.R., Kashyap S.R., Wolski K., et al. Bariatric surgery versus intensive medical therapy in obese patients with diabetes. N. Engl. J. Med. 2012; 366 (17): 1567-76. doi: 10.1056/NEJMoa1200225.
- Blackman A., Foster G.D., Zammit G., et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int. J. Obes. (Lond.). 2016; 40 (8): 1310-9. doi: 10.1038/ijo.2016.52.
- Aaseth J., Ellefsen S., Alehagen U., et al. Diets and drugs for weight loss and health in obesity – an update. Biomed. Pharmacother. 2021; 140: 111789. doi: 10.1016/j.biopha.2021.111789.
- Jastreboff A.M., Aronne L.J., Ahmad N.N., et al.; SURMOUNT-1 Investigators. Tirzepatide once weekly for the treatment of obesity. N. Engl. J. Med. 2022; 387 (3): 205-216. doi: 10.1056/NEJMoa2206038.
- Frías J.P., Fernández Landó L., Brown K. Tirzepatide versus semaglutide once weekly in type 2 diabetes. Reply. N. Engl. J. Med. 2022; 386 (7): e17. doi: 10.1056/NEJMc2114590.
- Sarkhosh K., Switzer N.J., El-Hadi M., et al. The impact of bariatric surgery on obstructive sleep apnea: a systematic review. Obes. Surg. 2013; 23 (3): 414-23. doi: 10.1007/s11695-012-0862-2.
- Eisenberg D., Shikora S.A., Aarts E., et al. 2022 American Society of Metabolic and Bariatric Surgery (ASMBS) and International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) indications for metabolic and bariatric surgery. Obes. Surg. 2023; 33 (1): 3-14. doi: 10.1007/s11695-022-06332-1.
- Raphelson J.R., Schmickl C.N., Sonners C., et al. Obesity hypoventilation syndrome and postsurgical outcomes in a bariatric surgery cohort. Obes. Surg. 2022 Jul; 32 (7): 1-7. doi: 10.1007/s11695-022-06073-1.
- Kreitinger K.Y., Lui M.M.S., Owens R.L., et al. Screening for obstructive sleep apnea in a diverse bariatric surgery population. Obesity (Silver Spring). 2020; 28 (11): 2028-2034. doi: 10.1002/oby.23021.
- de Raaff C.A., Coblijn U.K., Ravesloot M.J., et al. Persistent moderate or severe obstructive sleep apnea after laparoscopic Roux-en-Y gastric bypass: which patients? Surg. Obes. Relat. Dis. 2016; 12 (10): 1866-1872. doi: 10.1016/j.soard.2016.03.014.
- Gutiérrez-Carrasquilla L., López-Cano C., Sánchez E., et al. Effect of glucose improvement on nocturnal sleep breathing parameters in patients with type 2 diabetes: the Candy Dreams Study. J. Clin. Med. 2020; 9 (4): 1022. doi: 10.3390/jcm9041022.
- Chemla D., Attal P., Maione L., et al. Impact of successful treatment of acromegaly on overnight heart rate variability and sleep apnea. J. Clin. Endocrinol. Metab. 2014; 99 (8): 2925-31. doi: 10.1210/jc.2013-4288.
- Parolin M., Dassie F., Alessio L., et al. Obstructive sleep apnea in acromegaly and the effect of treatment: a systematic review and meta-analysis. J. Clin. Endocrinol. Metab. 2020; 105 (3): dgz116. doi: 10.1210/clinem/dgz116.
- Bruyneel M., Haumont S., Devuyst F. Les apnées du sommeil disparaissent-elles une fois l’acromégalie traitée ? [Does sleep apnea disappear once acromegaly is adequately treated?]. Rev. Mal. Respir. 2016; 33 (5): 405-8. French. doi: 10.1016/j.rmr.2015.07.002.
- Lin C.C., Tsan K.W., Chen P.J. The relationship between sleep apnea syndrome and hypothyroidism. Chest. 1992; 102 (6): 1663-7. doi: 10.1378/chest.102.6.1663.
- Hira H.S., Sibal L. Sleep apnea syndrome among patients with hypothyroidism. J. Assoc. Physicians India. 1999; 47 (6): 615-8.
- Jha A., Sharma S.K., Tandon N., et al. Thyroxine replacement therapy reverses sleep-disordered breathing in patients with primary hypothyroidism. Sleep Med. 2006; 7 (1): 55-61. doi: 10.1016/j.sleep.2005.05.003.
- Wolley M.J., Pimenta E., Calhoun D., et al. Treatment of primary aldosteronism is associated with a reduction in the severity of obstructive sleep apnoea. J. Hum. Hypertens. 2017;31 (9): 561-567. doi: 10.1038/jhh.2017.28.
- Jenkinson C., Davies R.J., Mullins R., Stradling J.R. Comparison of therapeutic and suбtherapeutic nasal continuous positive airway pressure for obstructive sleep apnoea: a randomised prospective parallel trial. Lancet. 1999; 353 (9170): 2100-5. doi: 10.1016/S0140-6736(98)10532-9.
- Pepperell J.C., Ramdassingh-Dow S., Crosthwaite N., et al. Ambulatory blood pressure after therapeutic and subtherapeutic nasal continuous positive airway pressure for obstructive sleep apnoea: a randomised parallel trial. Lancet. 2002; 359 (9302):204-10. doi: 10.1016/S0140-6736(02)07445-7.
- Malhotra A., Crocker M.E., Willes L., et al. Patient engagement using new technology to improve adherence to positive airway pressure therapy: a retrospective analysis. Chest. 2018; 153 (4): 843-850. doi: 10.1016/j.chest.2017.11.005.
- Jen R., Grandner M.A., Malhotra A. Future of sleep-disordered breathing therapy using a mechanistic approach. Can. J. Cardiol. 2015; 31 (7): 880-8. doi: 10.1016/j.cjca.2015.02.007.
- Malhotra A., Mesarwi O., Pepin J.L., Owens R.L. Endotypes and phenotypes in obstructive sleep apnea. Curr. Opin. Pulm. Med. 2020; 26 (6): 609-614. doi: 10.1097/MCP.0000000000000724.
- Marin J.M., Carrizo S.J., Vicente E., Agusti A.G. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet. 2005; 365 (9464): 1046-53. doi: 10.1016/S0140-6736(05)71141-7.
- Herculano S., Grad G.F., Drager L.F., et al. Weight gain induced by continuous positive airway pressure in patients with obstructive sleep apnea is mediated by fluid accumulation: a randomized crossover controlled trial. Am. J. Respir. Crit. Care Med. 2021; 203 (1): 134-136. doi: 10.1164/rccm.202005-1853LE.
- Stenlöf K., Grunstein R., Hedner J., Sjöström L. Energy expenditure in obstructive sleep apnea: effects of treatment with continuous positive airway pressure. Am. J. Physiol. 1996; 271 (6 Pt. 1): E1036-43. doi: 10.1152/ajpendo.1996.271.6.E1036.
- O’Donnell C.P. Metabolic consequences of intermittent hypoxia. Adv. Exp. Med. Biol. 2007; 618: 41-9. doi: 10.1007/978-0-387-75434-5_4.
- Loffler K.A., Heeley E., Freed R., et al.; SAVE Substudy Investigators. Continuous positive airway pressure treatment, glycemia, and diabetes risk in obstructive sleep apnea and comorbid cardiovascular disease. Diabetes Care. 2020; 43 (8): 1859-1867. doi: 10.2337/dc19-2006.
- Abud R., Salgueiro M., Drake L., et al. Efficacy of continuous positive airway pressure (CPAP) preventing type 2 diabetes mellitus in patients with obstructive sleep apnea hypopnea syndrome (OSAHS) and insulin resistance: a systematic review and meta-analysis. Sleep Med. 2019; 62: 14-21. doi: 10.1016/j.sleep.2018.12.017.
- West S.D., Nicoll D.J., Wallace T.M., et al. Effect of CPAP on insulin resistance and HbA1c in men with obstructive sleep apnoea and type 2 diabetes. Thorax. 2007; 62 (11): 969-74. doi: 10.1136/thx.2006.074351.
- Petrone A., Mormile F., Bruni G., et al. Abnormal thyroid hormones and non-thyroidal illness syndrome in obstructive sleep apnea, and effects of CPAP treatment. Sleep Med. 2016; 23: 21-25. doi: 10.1016/j.sleep.2016.07.002.
- Ken-Dror G., Fry C.H., Murray P., et al. Changes in cortisol levels by continuous positive airway pressure in patients with obstructive sleep apnoea: meta-analysis of 637 individuals. Clin. Endocrinol. (Oxf.). 2021; 95 (6): 909-917. doi: 10.1111/cen.14573.
- US Preventive Services Task Force; Bibbins-Domingo K., Grossman D.C., Curry S.J., et al. Screening for obstructive sleep apnea in adults: US Preventive Services Task Force recommendation statement. JAMA. 2017; 317 (4): 407-414. doi: 10.1001/jama.2016.20325.
- de Raaff C.A.L., de Vries N., van Wagensveld B.A. Obstructive sleep apnea and bariatric surgical guidelines: summary and update. Curr. Opin. Anaesthesiol. 2018; 31 (1): 104-109. doi: 10.1097/ACO.0000000000000542.
- Polesel D.N., Nozoe K.T., Tufik S.B., et al. Gender differences in the application of anthropometric measures for evaluation of obstructive sleep apnea. Sleep Sci. 2019; 12 (1): 2-9. doi: 10.5935/1984-0063.20190048.
- Seetho I.W., O’Brien S.V., Hardy K.J., Wilding J.P.H. Obstructive sleep apnoea in diabetes – assessment and awareness. Br. J. Diabetes Vasc. Dis. 2014; 14: 105-108.
- American Diabetes Association. 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2019. Diabetes Care. 2019; 42 (Suppl. 1): S13-S28. doi: 10.2337dc19-S002.
- Dosiou C., Barnes J., Schwartz A., et al. Cost-effectiveness of universal and risk-based screening for autoimmune thyroid disease in pregnant women. J. Clin. Endocrinol. Metab. 2012; 97 (5): 1536-46. doi: 10.1210/jc.2011-2884.
- LeFevre M.L.; U.S. Preventive Services Task Force. Screening for thyroid dysfunction: U.S. Preventive Services Task Force recommendation statement. Ann. Intern. Med. 2015; 162 (9): 641-50. doi: 10.7326/M15-0483.
- Katznelson L., Laws E.R. Jr., Melmed S., et al.; Endocrine Society. Acromegaly: an endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2014; 99 (11): 3933-51. doi: 10.1210/jc.2014-2700.
- Kong X., Gong S., Su L., et al. Automatic detection of acromegaly from facial photographs using machine learning methods. EBioMedicine. 2018; 27: 94-102. doi: 10.1016/j.ebiom. 2017.12.015.