Сучасні погляди на проблему поєднання ожиріння та гіповітамінозу D
Підготувала канд. мед. наук Ольга Королюк
У статті розглянуто патофізіологічні взаємозв’язки між двома пандеміями сьогодення – ожирінням і гіповітамінозом D, проведено огляд сучасних доказів щодо статусу вітаміну D при ожирінні, потенційних наслідків такого поєднання, впливів схуднення та баріатричної хірургії на статус вітаміну D і засобів вітаміну D на гомеостаз маси тіла й метаболічні порушення.
Визначення понять і епідеміологія ожиріння та гіповітамінозу D
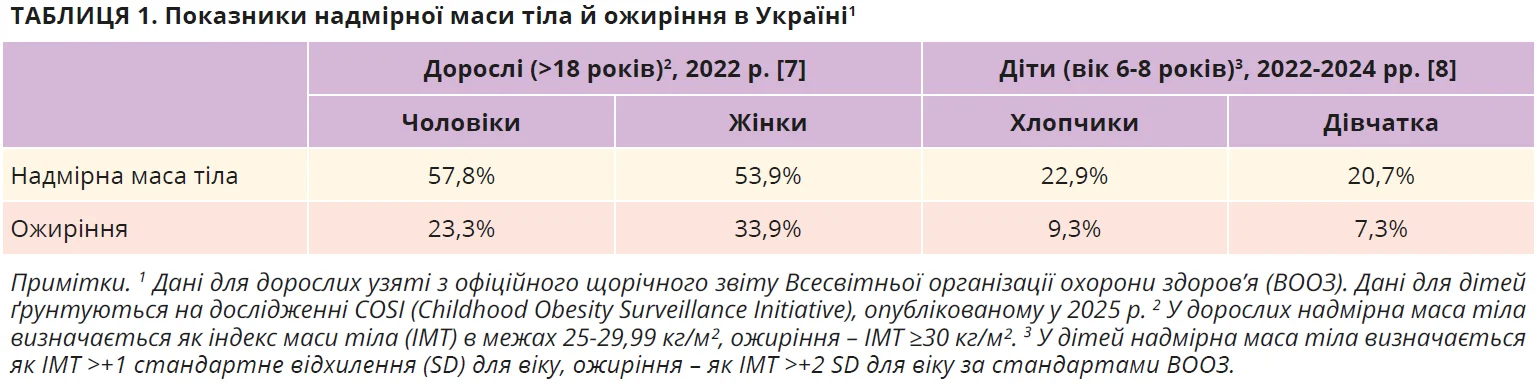
Ожиріння – це поліетіологічна хвороба, зумовлена позитивним енергетичним балансом з надмірним накопиченням жиру та/або патологічним розподілом жирової тканини, що асоціюється з виникненням багатьох коморбідних станів і вкороченням тривалості життя [1-3]. За останні 50 років поширеність ожиріння у світі подвоїлася [4]. Очікується, що до 2030 р. близько половини дорослого населення планети житимуть з надмірною масою тіла чи ожирінням [5]. Останнім часом відзначається також стрімке зростання поширеності ожиріння серед дітей і підлітків [6]. В Україні показники надмірної маси тіла й ожиріння не менш тривожні (табл. 1) [7, 8].
Найуживанішим інструментом для оцінювання надлишкової маси тіла в клінічній практиці є індекс маси тіла (ІМТ). Критерієм ожиріння є значення ІМТ ≥30 кг/м2. Тяжке ожиріння (ІМТ ≥40 кг/м2) або помірне ожиріння (ІМТ ≥35-39,99 кг/м2) за наявності коморбідних станів іноді називають «морбідним» через істотно вищі показники функціональних обмежень, захворюваності та смертності [9]. На ризик ускладнень впливає не лише збільшення жирової маси, а й патологічний розподіл жиру в тілі. Абдомінальне та вісцеральне ожиріння вважаються найнебезпечнішими фенотипами, що асоціюються з метаболічними розладами й високим ризиком серцево-судинних подій. Критеріями абдомінального ожиріння для європейців є збільшення окружності талії (ОТ) >80 см у жінок і >88 см у чоловіків та/або співвідношення окружності талії до стегон ≥0,85 у жінок і ≥0,95 у чоловіків, які відображають розподіл жирової тканини та найчастіше використовуються в повсякденній клінічній практиці [2].
Крім генетичної схильності, ризик ожиріння посилюють ендокринні розлади (гіпотиреоз, гіперкортицизм, інсулінорезистентність), недостатній сон, хронічний стрес. Певні впливи мають соціоекономічний статус і рівень освіти. Проте найважливішим чинником стрімкого збільшення поширеності ожиріння є сучасний спосіб життя з обмеженням фізичної активності та надмірним споживанням енергетично щільної їжі [1, 2, 6].
Ожиріння є визнаним чинником ризику гіповітамінозу D. До інших чинників ризику відносять: ранній або похилий вік, жіночу стать, темний фототип шкіри, зимову пору року, недоїдання, низький соціально-економічний статус, закритий стиль одягу, тривале перебування в закритих приміщеннях або обмежену мобільність, хронічні хвороби та застосування ліків, які прискорюють катаболізм вітаміну D [10].
Для оцінювання статусу вітаміну D використовується загальна концентрація 25-гідроксивітаміну D (25(OH)D) у сироватці крові, яка включає обидві форми (ергокальциферол – D2 та холекальциферол – D3).
Рівень 25(OH)D відображає внесок дієти й ендогенного синтезу вітаміну D. Хоча активною формою вітаміну D є 1,25-дигідроксивітамін D (1,25(OH)2D), його визначення не рекомендується для оцінювання статусу вітаміну D, оскільки жорстка фізіологічна регуляція зумовлює стабільну концентрацію 1,25(OH)2D в крові зі зниженням лише в умовах тяжкого дефіциту вітаміну D (ДВD). На концентрацію 1,25(OH)2D впливають різні гормони (естрадіол, тестостерон, пролактин, простагландини) та ліки (кортикостероїди, кетоконазол, бісфосфонати, гепарин і тіазидні діуретики). Крім того, період напіввиведення 1,25(OH)2D з плазми крові значно коротший (~4 години), ніж у 25(OH)D (~3 тижні).
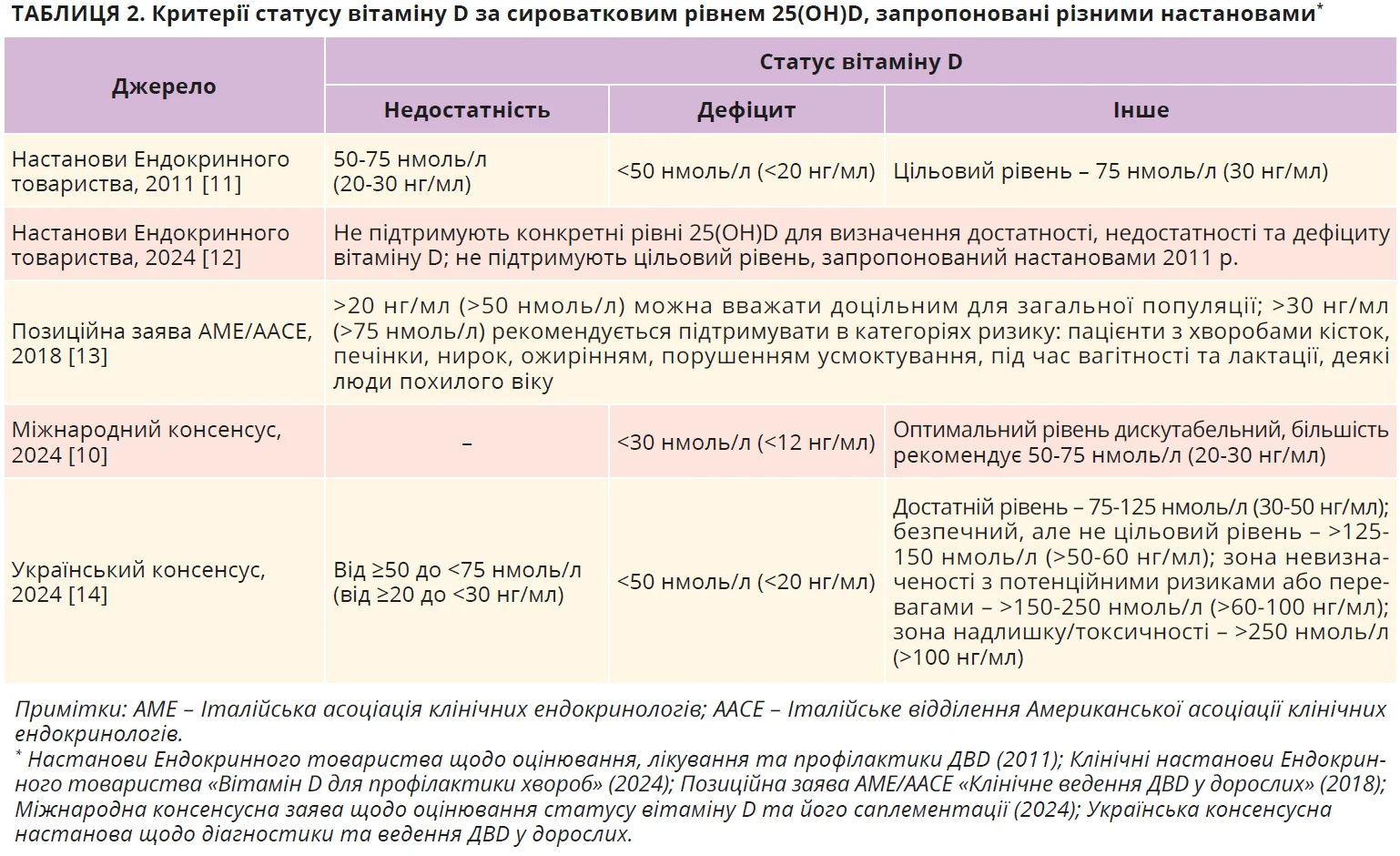
На сьогодні немає єдиного консенсусу щодо порогових значень 25(OH)D для визначення гіповітамінозу D – дефіциту чи недостатності. Різні організації пропонують різні порогові рівні або взагалі відмовляються від конкретизації, вважаючи оптимальними рівні, які не призведуть до остеомаляції в жодного пацієнта чи в 97,5% популяції (табл. 2).
Поширеність гіповітамінозу D у світі доволі висока. Нещодавній аналіз 308 досліджень за участю 7,9 млн осіб виявив такі показники поширеності: 15,7; 47,9 та 76,6% для сироваткових рівнів 25(OH)D <30, <50 і <75 нмоль/л відповідно [15]. Що стосується показників в Україні, то перше національне дослідження, проведене у 2011 р. за участю 1575 осіб віком 20-89 років, виявило ДВD у 81,8% учасників, недостатність вітаміну D – у 13,6%. Епідеміологічне дослідження, проведене у 2016-2022 рр. за участю 8426 дорослих віком 20-99 років, виявило ДВD у 20%, недостатність – у 27% [14].
Причини, механізми й потенційні клінічні наслідки поєднання ожиріння та дефіциту вітаміну D
Дані масштабних обсерваційних досліджень, зокрема Фремінгемського, свідчать, що ожиріння асоціюється з підвищеним ризиком гіповітамінозу D [16]. Метааналіз даних 23 обсерваційних досліджень вивчав поширеність ДВD (25(OH)D <50 нмоль/л) у групах учасників з ожирінням, надлишком маси тіла (ІМТ – 25-29,99 кг/м2) і нормальною масою тіла (ІМТ – 18,5-24,99 кг/м2). Максимальну поширеність ДВD виявлено в групі осіб з ожирінням – на 35 і 24% вищу, ніж у групах з нормальним і надлишковим діапазонами ІМТ відповідно. Асоціація ДВD з ожирінням не залежала від віку, порогових значень для визначення ДВD, географічної широти та країни, де проводилося дослідження [17].
Незважаючи на надмірне споживання енергетично щільної їжі, в людей з ожирінням часто виявляють гіповітаміноз D. Одним з пояснень такого парадоксу є те, що вітамін D природно міститься в небагатьох харчових продуктах (жирна риба, риб’ячий жир, висушені на сонці гриби), а збагачені продукти (молоко, соки, пластівці, маргарин, кулінарна олія) не завжди доступні через відмінності в політиці охорони здоров’я щодо фортифікації харчових продуктів вітаміном D у різних країнах світу та рекомендаціях щодо використання засобів вітаміну D [3]. Проте внесок дієти доволі незначний, адже понад 80% ендогенного вітаміну D синтезується в шкірі під дією ультрафіолетових сонячних променів довжиною хвилі 290-315 нм (УФ-В). Старіння значно знижує здатність шкіри виробляти превітамін D після впливу сонячного світла. Кількість УФ-В сильно залежить від географічної широти, висоти над рівнем моря, пори року, часу доби та якості повітря. Забруднення атмосфери блокує корисний спектр УФ-В, спричиняючи ДВD у мешканців міст і промислових регіонів. Існують також сезонні коливання з вищими рівнями вітаміну D влітку та восени, але нижчими – взимку й на початку весни [10]. Попри значну інсоляцію, високі показники поширеності гіповітамінозу D реєструються в Африці, Австралії, Азії, Південній Америці та на Близькому Сході [15]. Одним з можливих пояснень є слабший вплив сонячного світла на синтез вітаміну D в осіб з темнішою шкірою. Одяг, що закриває значну площу поверхні тіла, та використання сонцезахисних кремів також обмежують вплив УФ-B. Нарешті, культурні й релігійні особливості, соціально-економічний статус і рівень освіченості визначають харчові звички, стиль одягу, поведінку та спосіб життя, впливаючи на ризик виникнення як ожиріння, так і гіповітамінозу D [3, 10].
У літературі описано декілька механізмів ДВD при ожирінні. Насамперед люди з ожирінням зазвичай ведуть малоактивний спосіб життя, рідше перебувають на свіжому повітрі та частіше носять закритий одяг [3]. На існування інших механізмів указують результати дослідження, котре порівнювало утворення вітаміну D3 після опромінення УФ-В всього тіла в групах людей з ожирінням і нормальною масою тіла. Через 24 години після опромінення в групі з ожирінням виявлено на 57% нижчий рівень підвищення 25(OH)D в крові, хоча рівні 7-дегідрохолестерину (попередника вітаміну D) у шкірі істотно не відрізнялися між групами [18]. Отже, біодоступність вітаміну D при ожирінні знижена. Оскільки вітамін D жиророзчинний, після синтезу в шкірі він активно накопичується в адипоцитах, що зменшує його надходження в кров. Жирова тканина діє як резервуар, але вивільнення з неї обмежене, особливо при інсулінорезистентності та хронічному запаленні. Цей механізм називається секвестрацією, внаслідок чого вітамін D стає недоступним для метаболізму. Крім того, низькі концентрації 25(OH)D в крові можуть бути наслідком об’ємного розведенням вітаміну D у тканинах (жирі, м’язах, печінці, крові), об’єм яких вищий при ожирінні. Підтвердженням цієї гіпотези є відсутність різниці в циркулювальних рівнях 25(OH)D в осіб з нормальною та підвищеною масою тіла після корегування на розмір тіла [19]. Іншою можливою причиною ДВD у людей з ожирінням є метаболічна активність жирової тканини. Нещодавні клінічні й експериментальні дослідження продемонстрували, що ожиріння асоціюється зі зниженням експресії специфічних генів, які кодують синтез двох ферментів – 25-гідроксилази й 1α-гідроксилази, котрі регулюють метаболізм вітаміну D. Знижений синтез ферментів пояснює низький рівень 25(OH)D у сироватці крові [20]. Нарешті, існує негативний зворотний зв’язок між активним метаболітом 1,25(OH)2D та печінковим синтезом його попередника 25(OH)D. Окремі дослідження виявили підвищений рівень 1,25(OH)2D у людей з ожирінням порівняно з худорлявими людьми [3].
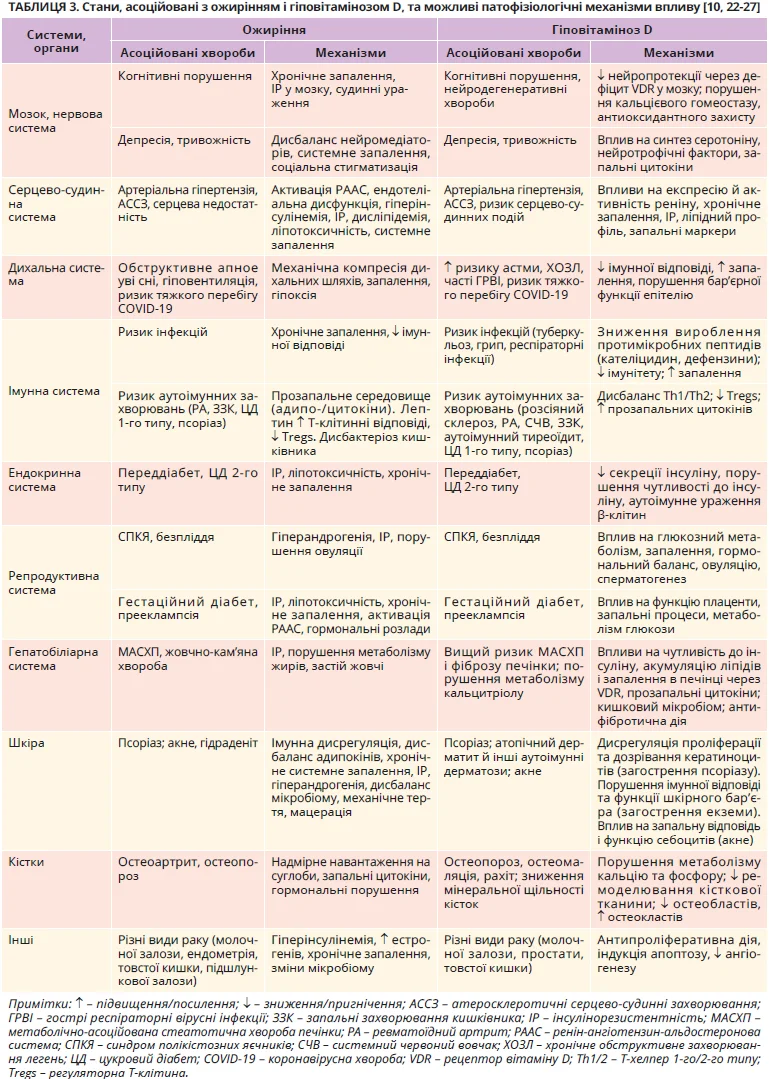
Фізіологічна роль вітаміну D не обмежується гомеостазом кальцію та здоров’ям кісток. Завдяки плейотропним впливам на метаболізм, імунітет, клітинну проліферацію й диференціацію реалізуються протизапальний, антиатерогенний, кардіо- та нейрозахисний ефекти вітаміну D. Окрім ожиріння, гіповітаміноз D тісно пов’язаний з компонентами метаболічного синдрому – артеріальною гіпертензією, дисліпідемією, інсулінорезистентністю та порушеннями обміну глюкози [21]. З іншого боку, ожиріння асоціюється з низкою коморбідних станів, дуже схожих на стани, пов’язані з ДВD [22]. Систематизація патології, що асоціюється з ожирінням і ДВD, та розгляд їхніх патофізіологічних механізмів (табл. 3) демонструють синергічний негативний вплив поєднання ожиріння з ДВD на більшість коморбідних станів.
Синергічний ефект стає очевидним, якщо розглянути плейотропні ефекти вітаміну D на молекулярному рівні. Біологічна дія вітаміну D реалізується через відповідні рецептори (VDR). Експресія VDR виявлена практично в усіх тканинах і клітинах. Після зв’язування 1,25(OH)2D з ядерним рецептором VDR у цитоплазмі різних клітин утворюється гетеродимер з ретиноїдним X-рецептором (RXR). Надалі цей комплекс зв’язується з VDRE (Vitamin D Response Elements) – відповідними регуляторними елементами в промоторних ділянках генів (рис. 1). Таким чином вітамін D здатний регулювати транскрипцію понад 200 генів [27].
Жирова тканина є прямою мішенню для дії вітаміну D, на що вказує експресія генів VDR і 25-ОН-D й 1α-гідроксилази в адипоцитах. Адипоцити можуть бути залучені до локального синтезу активного 1,25(OH)2D, який зв’язуючись з VDR, чинить ендокринну, автокринну або паракринну дію на жирову тканину. Вітамін D регулює експресію генів у кількох сигнальних шляхах, відповідальних за пригнічення диференціації преадипоцитів та індукцію їх апоптозу, пригнічення синтезу жирних кислот і накопичення ліпідів у вакуолях [3, 27]. За даними експериментальних досліджень, надмірна експресія VDR може пригнічувати диференціацію преадипоцитів навіть без зв’язування 1,25(OH)2D [3].
Інший механізм впливу пов’язаний з паратиреоїдним гормоном (ПТГ), рівень якого підвищується при ДВD. ПТГ підвищує вироблення 1,25(OH)2D, паралельно посилюючи ліпогенез через збільшення припливу кальцію до адипоцитів, що призводить до надлишку жиру та збільшення маси тіла. Крім того, вітамін D є ключовим регулятором метаболізму кальцію, задіяного у внутрішньоклітинних процесах. Збільшення споживання кальцію з їжею модулює ріст жирової тканини, знижуючи ліпогенез через пригнічення експресії синтази жирних кислот адипоцитів і стимулюючи ліполіз [3].
Пряма дія вітаміну D на експресію генів відповідає за модуляцію секреції адипокінів, зокрема лептину, що відіграє вагому роль у патогенезі ожиріння [22]. Експериментальні дослідження на тваринах продемонстрували, що 1,25(OH)2D посилює вироблення лептину [28]. Лептин може відігравати певну роль у підвищенні рівня ПТГ внаслідок гіповітамінозу D [29]. Отже, можливими механізмами зв’язку гіповітамінозу D з ожирінням є прямий вплив на регуляцію генів або опосередковані впливи через модуляцію ПТГ, кальцію та лептину.
Механізми покращення чутливості до інсуліну охоплюють: 1) посилення експресії IRS1 і GLUT4, що покращує транспорт глюкози та її поглинання клітинами; 2) активацію сигнального шляху PI3K/Akt, що нормалізує внутрішньоклітинну сигналізацію інсуліну, порушену за умов інсулінорезистентності; 3) зниження рівня ПТГ, що зменшує інсулінорезистентність через зниження кальцію в цитозолі [3].
Імунна регуляція реалізується шляхом: 1) зменшення активації ядерного фактора κB, що знижує транскрипцію прозапальних цитокінів; 2) посилення вироблення протизапальних цитокінів – інтерейкіну-10, фактора трансформації росту-β; 3) зсуву балансу Th1/Th17 у бік Th2/Treg – це зменшує автоімунне та хронічне системне запалення, що є вагомим патогенетичним механізмом ожиріння, діабету й атеросклерозу. Епігенетичні ефекти вітаміну D реалізуються впливами VDR на архітектуру хроматину через рекрутинг гістонових ацетилтрансфераз і деацетилаз, а також здатністю змінювати метилювання промоторів генів, пов’язаних з метаболізмом, запаленням і проліферацією [3, 27].
Отже, через VDR вітамін D діє як мультисистемний регулятор, впливаючи на адипогенез і ліпогенез, інсулінову чутливість, імунну відповідь та епігенетичну регуляцію генів [27]. Ці механізми пояснюють, чому ДВD при ожирінні поглиблює метаболічні порушення, а його корекція може мати терапевтичний потенціал.
Причинно-наслідкові зв’язки
Зворотний зв’язок між ожирінням і вітаміном D встановлено в численних обсерваційних дослідженнях і метааналізах. Дискусійним залишається напрямок зв’язку: чи є ожиріння причиною низького рівня вітаміну D, чи низький рівень вітаміну D спричиняє ожиріння? У метааналізі із застосуванням двобічної менделівської рандомізації (MR) з’ясовували це питання, аналізуючи дані понад 42 тис. учасників із 6 країн Європи та Північної Америки. Як генетичні маркери використовували однонуклеотидні поліморфізми (SNP) – 12 SNP, пов’язаних з ІМТ, і 2 SNP, пов’язані з рівнем 25(OH)D. Варіанти, пов’язані з ІМТ, демонстрували зв’язки як з ІМТ, так і з гіповітамінозом D. Натомість SNP, пов’язані з 25(OH)D, демонстрували зв’язки лише зі статусом вітаміну D. Збільшення ІМТ на кожен 1 кг/м2 асоціювалося зі зниженням 25(OH)D на 1,15% після корегування на вік, стать та інші фактори, що впливають на результат [30]. Масштабніше MR-дослідження з аналізом 138 SNP, пов’язаних з рівнем циркулювального 25(OH)D, у понад 440 тис. європейців також не виявило достовірного причинного зв’язку між рівнем 25(OH)D й антропометричними показниками ожиріння [31]. Загалом ці результати підтверджують гіпотезу про те, що ожиріння може призвести до низького рівня вітаміну D, тоді як зворотний ефект малоймовірний.
Вплив схуднення та баріатричних утручань на рівень вітаміну D
Вплив схуднення після дієтичних та/або фізичних утручань на збільшення сироваткового рівня 25(OH)D вивчали два метааналізи. Перший метааналіз (15 досліджень, але тільки 4 рандомізовані контрольовані дослідження – РКД) продемонстрував невелике, але значуще підвищення рівня 25(OH)D після схуднення, хоча ефект не був дозозалежним [32]. Інший метааналіз (23 дослідження) виявив, що втрата маси тіла та жирової маси асоціювалася з незначним підвищенням рівня 25(OH)D [33]. Отже, схуднення має незначний корисний вплив на статус вітаміну D. Зважаючи на невелику кількість і неоднорідність проаналізованих досліджень, а також різні методологічні проблеми, для з’ясування цього питання потрібні додаткові дослідження.
Найефективнішим методом лікування ожиріння вважається баріатрична хірургія. Проте довгостроковим ускладненням після баріатричних утручань є дефіцит нутрієнтів. Рестриктивні процедури (шунтування шлунка, рукавна гастректомія, гастропластика, бандажування шлунка) обмежують споживання їжі через раннє насичення. Мальабсорбційні процедури (єюноілеальне шунтування) порушують усмоктування, змінюючи потік їжі та її контакт із жовчними кислотами й ферментами підшлункової залози. На сьогодні найчастіше проводиться шунтування шлунка за Ру, яке має рестриктивний і мальабсорбційний ефекти. Крім макронутрієнтів, після баріатричної хірургії спостерігається значна мальабсорбція мікронутрієнтів – вітамінів групи В, жиророзчинних вітамінів (A, D, K) та мінералів (кальцію, заліза, цинку, міді) [3]. Тому після операції завжди рекомендується додавання препаратів вітаміну D та кальцію відповідно до консенсусних рекомендацій [10].
Вплив засобів вітаміну D на його статус після операції та здоров’я кісток вивчали декілька метааналізів. Метааналіз 13 досліджень, які порівнювали впливи шунтування шлунка та рукавної гастректомії на здоров’я кісток і асоційовані ускладнення, показав значно нижчі рівні 25(OH)D та кальцію в крові після шунтування шлунка, однак подібні показники ІМТ і мінеральної щільності кісток після обох процедур [34]. Метааналіз 10 проспективних обсерваційних досліджень за участю 344 пацієнтів з тяжким ожирінням після шунтування шлунка за Ру показав, що після операції рівень 25(OH)D істотно не змінився, але знизився рівень кальцію та підвищився рівень ПТГ. Попри те що всі учасники приймали добавки кальцію й вітаміну D після операції (дози та тривалість спостереження значно коливалися), спостерігалося значне зниження мінеральної щільності кісток, що свідчить про втрату кісткової маси [35]. Як відомо, 25(OH)D обернено корелює з ПТГ. Через 1 рік після операції поріг 25(OH)D для пригнічення ПТГ був нижчим у пацієнтів з ІМТ ≥30 кг/м2 порівняно з пацієнтами з ІМТ <30 кг/м2 (5 проти 10 нг/мл). Отже, дуже низькі рівні 25(OH)D активують вісь ПТГ, що призводить до вторинного гіперпаратиреозу та втрати кісткової маси [36]. Метааналіз 12 досліджень (6 РКД) за участю 1285 пацієнтів з ожирінням, які отримували добавки вітаміну D після баріатричної хірургії, виявив значуще збільшення рівня 25(OH)D через 1 рік після втручання незалежно від дизайну дослідження, початкового рівня 25(OH)D, відсотка втрати маси тіла та дозування вітаміну D. До операції ДВD підтверджено в 54% пацієнтів, через 1 рік – у 31%; різниця в поширеності ДВD була значущою лише в РКД і за умови дозування засобів вітаміну D >800 МО/добу [34].
Загалом ці дані не дають переконливого уявлення про статус вітаміну D після баріатричної хірургії через високу гетерогенність, невелику кількість включених досліджень і варіабельність стратегій застосування добавок. Імовірно, додавання вітаміну D у вищих добових дозах може запобігти післяопераційному ДВD.
Вплив препаратів вітаміну D на показники ожиріння та супутні метаболічні розлади
Результати нещодавно проведеного узагальненого метааналізу (включено 14 метааналізів високої якості) свідчать, що додаткова терапія вітаміном D має незначний, але статистично достовірний вплив на зниження ІМТ (-0,11 кг/м2) та ОТ (-0,79 см) у дорослих з ожирінням порівняно з контрольною групою. Хоча зміни маси тіла та жирової маси не досягли статистичної значущості, антропометричні покращення можуть мати клінічне значення, особливо в пацієнтів з метаболічними порушеннями. Ефективність втручання залежала від дози, тривалості, віку пацієнтів і супутніх захворювань. Найвираженіший ефект спостерігався при дозах >5000 МО/день та тривалості до 16 тижнів, особливо в пацієнтів з метаболічно-асоційованою стеатотичною хворобою печінки, цукровим діабетом 2-го типу та метаболічним синдромом. У пацієнток із синдромом полікістозних яєчників (СПКЯ) ефект був менш вираженим, що може бути пов’язано з недостатньою кількістю досліджень у цій групі. Можливі механізми дії охоплюють модуляцію запальної відповіді, регуляцію експресії VDR, вплив на гормональну регуляцію (лептин, грелін, інсулін) і апоптоз адипоцитів, а також опосередкований вплив на ліпогенез через кальцієвий обмін і зменшення секреції прозапальних цитокінів. У разі цукрового діабету 2-го типу й інсулінорезистентності вітамін D модулює експресію рецепторів інсуліну й адипонектину, що покращує глікемічний контроль; у пацієнтів з метаболічним синдромом – знижує рівні прозапальних цитокінів, зменшує ОТ і покращує чутливість до інсуліну; в жінок з СПКЯ – впливає на гормональний баланс, знижує рівень андрогенів і може покращувати репродуктивну функцію. Загалом вітамін D може розглядатися як допоміжний засіб у лікуванні ожиріння, особливо в пацієнтів з метаболічними порушеннями. Проте для підтвердження ефективності потрібні високоякісні РКД з уніфікованими методами оцінювання, чітким контролем супутніх факторів і стратифікацією за рівнем 25(OH)D [38].
Рекомендації настанов і консенсусів щодо саплементації вітаміну D в людей з ожирінням
Опублікована у 2024 р. консенсусна заява міжнародної групи експертів щодо оцінювання статусу вітаміну D та його саплементації рекомендує визначення рівня 25(OH)D в осіб з підвищеним ризиком ДВD, зокрема в людей з ожирінням. Експерти визнають, що ожиріння зменшує ефект від саплементації вітаміну D. Найприроднішим методом саплементації вважається щоденне пероральне приймання холекальциферолу, що демонструє високу ефективність, безпеку, позаскелетні переваги та зручність через відсутність потреби суворого моніторингу. Парентеральне введення можна розглядати після баріатричних утручань і в осіб з тяжкими синдромами мальабсорбції. Ергокальциферол вважається менш ефективним щодо підвищення рівня 25(OH)D у сироватці крові, але може застосовуватися в певних клінічних ситуаціях. Кальцифедіол може бути рекомендований пацієнтам з ожирінням, синдромами мальабсорбції, дисфункцією CYP2R1 або за потреби швидкого підвищення 25(OH)D [10].
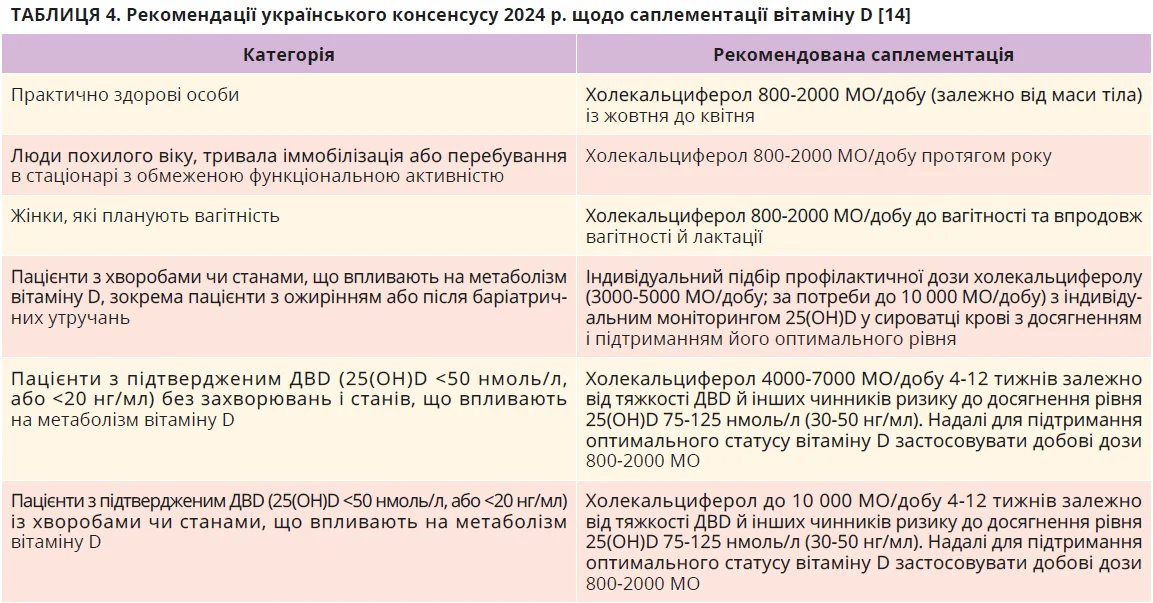
Оприлюднений у 2024 р. Український консенсус щодо діагностики та лікування ДВD у дорослих також відносить осіб з ожирінням до груп ризику ДВD, яким рекомендовано скринінг 25(OH)D. Для профілактики та лікування ДВD рекомендується віддавати перевагу пероральному застосуванню холекальциферолу щоденно або щотижнево; бажане дозування для різних категорій вказано в таблиці 4 [14].
Висновки
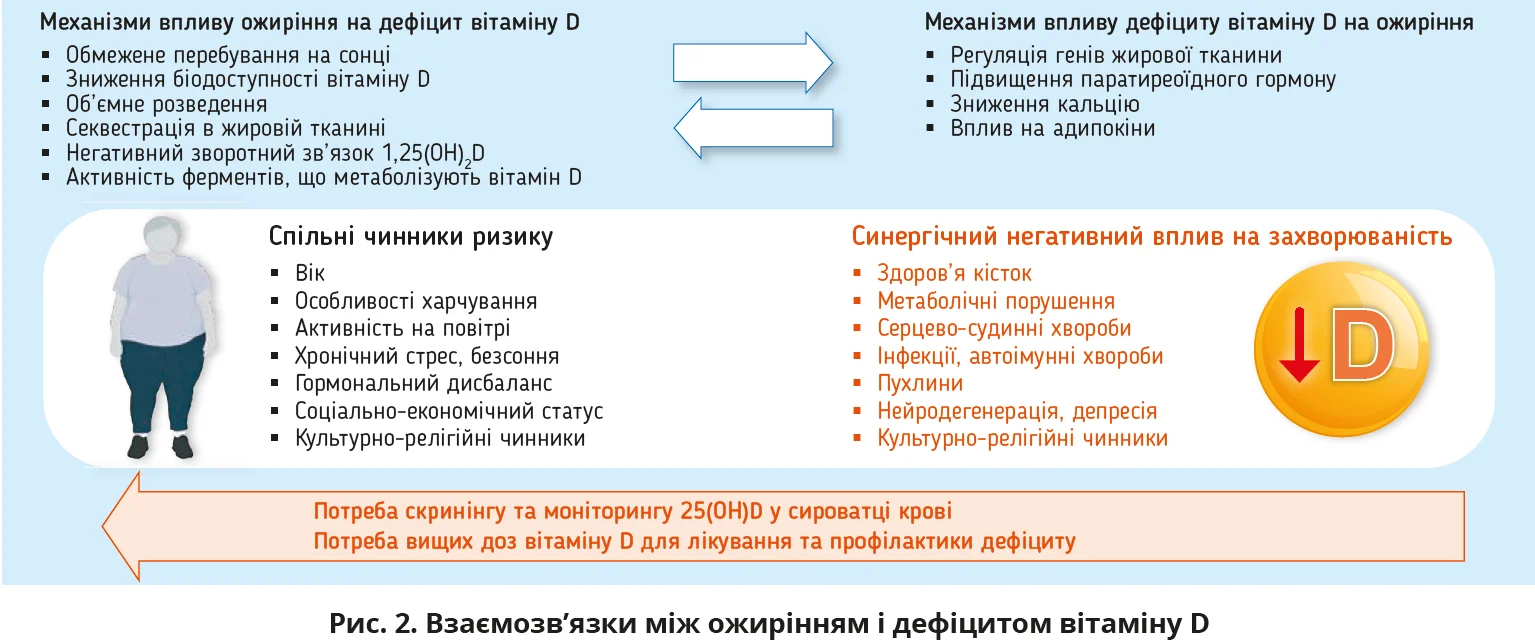
- Поширеність ожиріння й гіповітамінозу D у світі неухильно зростає. Ці стани часто поєднуються через низку спільних чинників ризику та взаємних впливів (рис. 2).
- Ожиріння й гіповітаміноз D підвищують ризик багатьох захворювань; у разі їх поєднання спостерігається синергічний негативний вплив зі збільшенням захворюваності та смертності.
- Скринінг і подальший моніторинг рівня 25(OH)D у сироватці крові показані пацієнтам з ожирінням, а також після баріатричних утручань.
- Вітамін D може розглядатися як допоміжний засіб у лікуванні ожиріння, особливо в пацієнтів з метаболічними розладами, але дози саплементації мають бути вищими. Пацієнти, які перенесли баріатричні втручання, потребують індивідуального підходу до саплементації.
На фармацевтичному ринку України доступні ефективні вітчизняні лікарські засоби вітаміну D Відеїн (виробник – АТ «Київський вітамінний завод») з кількома дозами холекальциферолу: 25 мкг (1000 МО), 50 мкг (2000 МО), 100 мкг (4000 МО) та 500 мкг (20 000 МО), що полегшує дозування для різних станів і вікових груп. Препарат Відеїн має оптимальне співвідношення вартість/кількість і показаний для лікування клінічно підтвердженого ДВD та профілактики ДВD у пацієнтів з високим ризиком, що відкриває додаткові можливості досягнення метаболічного здоров’я.
Список літератури – в редакції.