Стратегія комбінованого лікування фіксованою комбінацією базального інсуліну й арГПП-1: роздуми щодо прийняття рішення
Автори: Олеся Вадимівна ЗІНИЧ, доктор медичних наук, керівниця відділу вікової ендокринології та клінічної фармакології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Наталія Миколаївна КУШНАРЬОВА, кандидат медичних наук, відділ вікової ендокринології та клінічної фармакології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України»
У світлі зростання поширеності цукрового діабету (ЦД) наукове співтовариство зосереджує свою увагу на розвитку інтегрованих моделей управління захворюванням, які враховують широкий спектр впливу екологічних, генетичних, епігенетичних, біохімічних і соціально-економічних факторів (Davies, 2018). Сучасні рекомендації щодо лікування ЦД вже не спираються на колишню традиційну глюкозоцентричну модель на користь багатофакторного підходу, що, своєю чергою, відкриває ширші можливості для індивідуалізації лікування, спрямованого, зокрема, на мінімізацію виникнення гіпоглікемії, контроль серцево-судинних факторів ризику та маси тіла (Gaede, 2008; Hunt, 2017). Отже, стратегія застосування комбінованої терапії ЦД 2-го типу не лише чинитиме вплив на безпосередні патогенетичні ланки розвитку та прогресування захворювання, але й виявлятиме додаткові плейотропні ефекти (Perry, 2020; Doyle-Delgado, 2020).
Останніми роками в настановах Американської діабетичної асоціації та Європейської асоціації з вивчення діабету (ADA/EASD) особлива увага приділяється важливості вчасного й ефективного застосування ін’єкційної терапії препаратами групи антагоністів рецепторів глюкагоноподібного пептиду-1 (арГПП-1) та/або базальним інсуліном у пацієнтів, які недостатньо контрольовані одним або декількома пероральними цукрознижуваль- ними засобами – ПЦЗ (Perry, 2020; ADA, 2022). Проте інформації щодо чіткого алгоритму застосування фіксованих комбінацій цих препаратів як засобів першої лінії ін’єкційної терапії в настановах не міститься. Деякі дослідники зазначають, що в пацієнтів із рівнем глікованого гемоглобіну (HbA1с) >9% або на 2% вище їхнього індивідуального цільового рівня чи в разі різниці між рівнем глікемії натще та постпрандіальною >3,0 ммоль/л доцільно як засіб першої лінії після пероральної терапії розглянути призначення фіксованої комбінації, на противагу застосуванню базального інсуліну (Suastika, 2022).
Доведено, що базальні інсуліни забезпечують переважно контроль рівня глюкози натще, однак мають обмежену здатність щодо контролю постпрандіальних коливань глікемії. Водночас арГПП-1 стимулюють глюкозозалежну секрецію інсуліну, пригнічують секрецію глюкагону, затримують спорожнення шлунка та знижують апетит, тим самим допомагають підтримувати на належному рівні постпрандіальні показники глікемії. Отже, переваги поєднання базального інсуліну й арГПП-1 зумовлені тим, що в одній ін’єкції одночасно вводяться два засоби з взаємодоповнюючими механізмами дії без збільшення ризику серйозних гіпоглікемічних подій.
Систематичний огляд і метааналіз, проведені для оцінки ефективності та безпеки комбінованого засобу з фіксованим співвідношенням інсуліну ультратривалої дії деглюдек і арГПП-1 ліраглутиду (IDegLira) у хворих на ЦД 2-го типу, включили 13 досліджень, у яких брали участь 7773 пацієнти. Продемонстровано, що порівняно з контрольними групами досліджуваний препарат забезпечував оптимальний ефект щодо зміни HbA1c, частки пацієнтів, які досягли HbA1c <7% і <6,5% без збільшення ваги та без важких/підтверджених гіпоглікемій. Зафіксовано позитивні зміни рівня глюкози в плазмі натще, систолічного тиску та зниження загальної добової дози інсуліну. Не виявлено жодної різниці між досліджуваною та контрольною групами щодо зміни маси тіла, діастолічного тиску, важкої чи підтвердженої симптоматичної гіпоглікемії (вдень або вночі), серйозних побічних подій.
У підсумку застосування фіксованої комбінації покращило глікемічний контроль у пацієнтів із ЦД 2-го типу, одночасно збалансувавши ризик гіпоглікемії та диспептичних явищ (Liu, 2023).
Широкомасштабна комплексна програма клінічних досліджень DUAL включала дев’ять рандомізованих досліджень, у яких комбінації інсуліну деглюдек і ліраглутиду (IDegLira) продемонстрували кращу ефективність, аніж низка препаратів порівняння, в різних популяціях хворих на ЦД 2-го типу.
У програмі DUAL початкова доза IDegLira становила 10 одиниць інсуліну деглюдек / 0,36 мг ліраглутиду або 16 одиниць інсуліну деглюдек / 0,58 мг ліраглутиду залежно від того, чи отримували пацієнти раніше базальний інсулін або арГПП-1. Дози IDegLira коригувалися двічі на тиждень, щоб досягти цільового рівня глікемії натще 4,0-5,0 ммоль/л. Первинною кінцевою точкою для більшості цих досліджень була зміна HbA1c порівняно з вихідним рівнем. DUAL I та DUAL VIII включали популяції пацієнтів із незадовільним глікемічним контролем на тлі пероральної протидіабетичної терапії; DUAL III – популяцію після терапії арГПП-1; DUAL V і VII – популяцію після базального інсуліну; DUAL IX – популяцію пацієнтів, що отримували інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2).
Усі дослідження мали або включали 26-тижневий період лікування (Tibaldi, 2020).
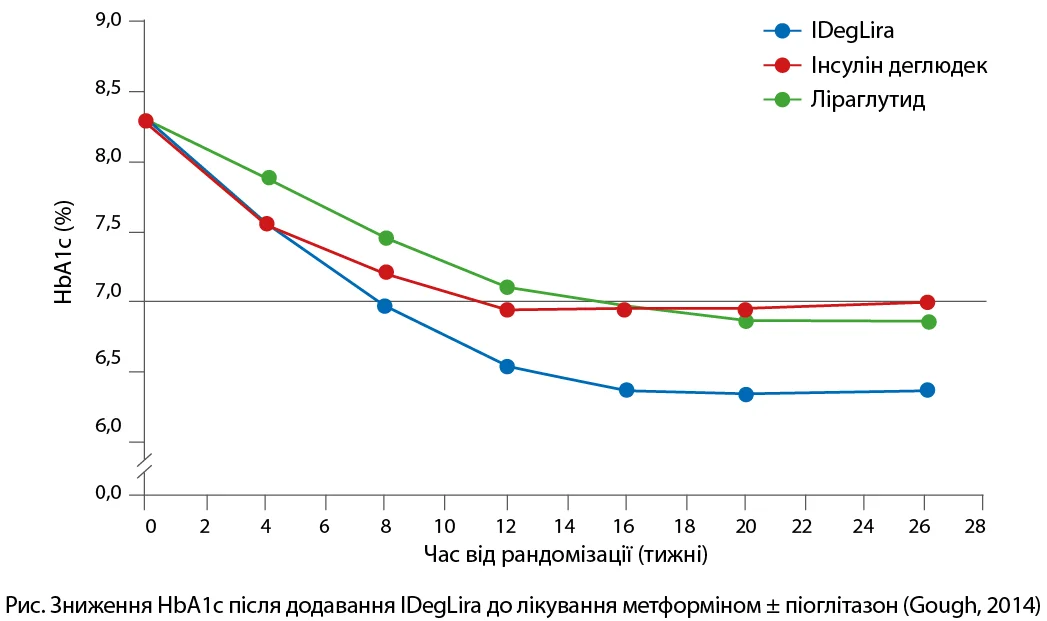
DUAL І було найпершим дослідженням, результати якого довели доцільність і безпечність застосування фіксованої комбінації порівняно з окремим уведенням ін’єкцій інсуліну деглюдек і ліраглутиду в разі неефективності ПЦЗ. Дослідження проводилося в 19 країнах світу за участі 1663 пацієнтів із незадовільним контролем вуглеводного обміну на тлі прийому метформіну з/без піоглітазону. У дослідженні фіксовану комбінацію IDegLira порівнювали з додаванням однієї з двох його активних речовин – інсуліну деглюдек або ліраглутиду. Середній рівень HbA1c, який становив 8,3% на початку, знизився до 6,4% після 26 тижнів лікування IDegLira порівняно з 6,9% і 7,0% відповідно при застосуванні інсуліну деглюдек або ліраглутиду (рис.).
При цьому доза інсуліну в пацієнтів, які застосовували IDegLira на 12-му тижні, становила 38 к.д. і надалі не зростала, на противагу групі осіб, що перебувавала на терапії інсуліном деглюдек: зафіксовано зростання до 53 к.д. Середня зміна ваги становила -0,5 кг при застосуванні IDegLira, +1,6 кг на інсуліні деглюдек, -3,0 кг – на ліраглутиді.
Аналогічних результатів було досягнуто в дослідженні DUAL VIII, у якому брали участь 1012 пацієнтів із ЦД 2-го типу, що не контролювався прийомом ПЦЗ (метформін, сульфонілсечовина, глініди, піоглітазон або інгібітори дипептидилпептидази-4). Пацієнти були рандомізовані 1:1 для відкритого лікування фіксованою комбінацією інсуліну деглюдек / ліраглутиду або інсуліном гларгін 100 Од/мл (IGlar U100). Отримані результати засвідчили високодостовірне зниження рівня HbA1c у групі лікування IDegLira на 2% порівняно з 1,5% при застосуванні IGlar U100 (P<0,0001). При цьому частота гіпоглікемій була на 44% нижчою при застосуванні фіксованої комбінації, а зниження маси тіла становило 0,5 кг для IDegLira та 2,1 кг для IGlar U100 (P<0,0001) (Aroda, 2019).
Відомо, що в пацієнтів із ЦД надзвичайно розповсюдженими є кардіоваскулярні ускладнення на тлі серцевої недостатності (СН) із нормальною чи зниженою систолічною функцією, причому, за оцінками різних дослідників, поширеність СН зі збереженою фракцією викиду становить до 47%. У зв’язку із цим особливо цікавими є результати дослідження DUAL IX. Пацієнтів (n=210) рандомізували для прийому IGlar U100 (без максимальної дози) або фіксованої комбінації IDegLira як доповнення до терапії іНЗКТГ-2 ± інші ПЦЗ (метформін, інгібітори дипептидилпептидази-4 та/або піоглітазон). Перевага IDegLira порівняно з IGlar U100 щодо зміни HbA1c була підтверджена розрахунковою різницею лікування (РРЛ) – -3,90 ммоль/моль (95% довірчий інтервал [ДІ] від -5,45 до -2,35; P<0,0001; -0,36%-бали, 95% ДІ від -0,50 до -0,21; P<0,0001). Частка учасників, у яких було зафіксовано гіпоглікемію, становила 12,9% для IDegLira (0,37 епізоду / учасник – рік впливу) та 19,5% для IGlar U100 (0,90 епізоду / учасник – рік впливу). Крім того, наприкінці дослідження учасники групи IDegLira отримували значно нижчу середню добову дозу інсуліну, ніж учасники, які отримували IGlar U100 (36,2 (13,4) та 53,5 (26,1) к.д. відповідно; РРЛ -15,37 Од; 95% ДІ від -19,60 до -11,13; P<0,0001), а також мали менший приріст маси тіла (Philis-Tsimikas, 2019).
Цікавими виявилися також результати ретроспективного аналізу (post hoc) серцево-судинних ефектів IDegLira за даними, отриманими в межах програми DUAL, у якому пацієнти різних когорт були згруповані за статтю, віком (<65 років, ≥65 років) і тривалістю діабету (<10 років, ≥10 років). Продемонстровано переваги лікування фіксованою комбінацією деглюдек і ліраглутид у багатьох підгрупах щодо змін порівняно з початковим рівнем глікованого гемоглобіну (DUAL II, DUAL V), маси тіла (DUAL II, V, VІІ), систолічного артеріального тиску (всі три дослідження), холестерину ліпопротеїнів високої щільності (DUAL VII) і холестерину ліпопротеїнів низької щільності (DUAL II, DUAL V). Ці дані свідчать, що 26-тижневе застосування IDegLira асоціюється із покращенням маркерів серцево-судинного ризику порівняно з базальним інсуліном або базально-болюсною терапією (Vilsbøll, 2019).
Загалом програма клінічних досліджень DUAL I-IX продемонструвала, що незалежно від попередньої терапії (із застосуванням інсуліну, ПЦЗ, арГПП-1, іНЗКТГ-2) доповнення комбінованим препаратом IDegLira, який поєднує в собі клінічні переваги обох монокомпонентів, забезпечує зниження рівнів глюкози в крові як натще, так і після прийому їжі та, крім того, пом’якшує основні побічні ефекти, пов’язані з дією інсуліну й арГПП-1.
Слід також зазначити, що спрощення ін’єкційної терапії через зменшення кількості ін’єкцій до 1 разу на день може стати ключовим чинником для підвищення ефективності та комплаєнтності до лікування пацієнтів похилого віку (Hayashi, 2021).
Отже, враховуючи те, що в клінічній практиці призначення лікування інсуліном часто відтерміновується через побоювання щодо таких розповсюджених ускладнень, як гіпоглікемія та збільшення маси тіла, є доцільним запропонувати пацієнтові застосування одразу фіксованої комбінації базального інсуліну / арГПП-1, що дає можливість уникнути перелічених небажаних явищ, інтенсифікувати цукрознижувальну терапію, забезпечити захист серцево-судинної системи, зменшити необхідну загальну дозу інсуліну та досягти глікемічної компенсації за допомогою однієї ін’єкції на добу (Evans, 2020; Harris, 2020).
В останніх рекомендаціях АDA 2023 р. зазначено: «Якщо базальний інсулін титрували до прийнятного рівня глюкози в крові натще (або якщо доза становить >0,5 Од/кг/день з ознаками необхідності іншої терапії), а HbA1c залишається вище цільового значення, розгляньте можливість переходу до комбінованої ін’єкційної терапії. Цей підхід може використовувати арГПП-1…, доданий до базального інсуліну або кількох доз інсуліну. Комбінація базального інсуліну й арГПП-1 має потужну цукрознижувальну дію та менший приріст ваги і гіпоглікемії порівняно з режимами інтенсифікованого інсуліну» (Perry, 2023).
Прогресивніший алгоритм, на нашу думку, представлений у рекомендаціях Американської асоціації клінічної ендокринології (ААСЕ) 2023 р., в якому препарати групи арГПП-1 мають переваги перед ініціацією інсулінотерапії, проте за недостатньої ефективності цього виду лікування необхідно розглянути додавання базального інсуліну або фіксованої комбінації. І лише в разі гіперглікемії з вираженими симптомами, яка характеризується значним підвищенням рівня НbА1c >10,0% і рівнем глікемії >16,7 ммоль, варто розпочинати з базально-болюсної інсулінотерапії (Samson, 2023).
Крім того, беручи до уваги переваги фіксованої комбінації базального інсуліну й арГПП-1 порівняно з базально-болюсним режимом інсулінотерапії щодо досягнення компенсації вуглеводного обміну, кардіопротекторної дії та запобігання побічним ефектам, можна допустити, що в разі неефективності попередньої терапії для безпечнішої інтенсифікації глікемічного контролю логічним буде при ініціації інсулінотерапії використати саме фіксовану комбінацію інсуліну ультратривалої дії з арГПП-1 у вигляді ін’єкції 1 раз на добу, безпечність та ефективність якої незалежно від раніше застосованих цукрознижувальних засобів наразі доведено низкою клінічних досліджень. Зокрема, результати європейського багатоцентрового ретроспективного дослідження EXTRA продемонстрували ефективність фіксованої комбінації IDegLira в реальній клінічній практиці у хворих із ЦД 2-го типу (n=611) на різних видах початкової терапії (неін’єкційні препарати – 19%, базальний інсулін – 19%, арГПП-1 – 10%, нефіксована комбінована терапія інсулін/арГПП-1 – 24% та багаторазові щоденні ін’єкції інсуліну – 28%, усі ± пероральні протидіабетичні препарати).
Через 6 місяців спостерігалося значне зниження HbA1c (0,9%, P<0,0001) і середньої маси тіла (-0,7 кг, P<0,05) загалом. Частота гіпоглікемії знизилася на 82% порівняно з початковим періодом. Середня доза IDegLira становила 22, 30 і 32 кроки дози на початку та через 6 і 12 місяців відповідно (Price, 2018).
Клінічний випадок, наведений нижче, допоможе краще зрозуміти місце фіксованих комбінацій базального інсуліну й арГПП-1 у терапії ЦД та визначити категорію пацієнтів, які насамперед потребують призначення цієї групи препаратів.
Підсумовуючи, наводимо ключові переваги та місце тактики призначення фіксованої комбінації базального інсуліну й арГПП-1 у разі неефективності контролю глікемії за допомогою ПЦЗ, що були визначені з досвіду роботи відділення вікової ендокринології та клінічної фармакології:
- фіксована комбінація базального інсуліну й арГПП-1 сприяє поліпшенню компенсації ЦД 2-го типу за рахунок впливу на різні механізми розвитку та прогресування захворювання, виявляючи, з одного боку, синергічний вплив, а з іншого – нівелюючи низку побічних ефектів кожного компонента окремо;
- застосування фіксованої комбінації дає можливість не лише запобігти збільшенню маси тіла, що разом із гіпоглікемією є основними небажаними явищами інсулінотерапії, а й зменшити частоту виникнення останньої;
- терапію фіксованою комбінацією варто рекомендувати як першу ін’єкційну терапію пацієнтам із НbА1с >9,0%, оскільки застосування лише базального інсуліну в такому випадку, найімовірніше, буде недостатнім, особливо щодо контролю постпрандіальної глікемії;
- перед початком ін’єкційної терапії слід визначити у хворого наявність ускладнень і супутньої патології та в разі, якщо пацієнт належить до групи високого кардіоваскулярного ризику, має в анамнезі перенесені інфаркт міокарда чи ішемічний інсульт, атеросклеротичні ураження коронарних або каротидних артерій, найбільш доцільно розглядати призначення фіксованої комбінації саме інсуліну деглюдек / ліраглутид, оскільки доведені позитивні кардіо- та цереброваскулярні ефекти останнього допоможуть запобігти прогресуванню наявних ускладнень або попередити виникнення нових атеросклеротичних захворювань;
- при застосуванні фіксованої комбінації доза інсуліну не матиме швидкого темпу зростання, що сприятиме уникненню надмірної інсулінізації, що особливо важливо для пацієнтів із надмірною вагою;
- спрощення схеми терапії сприятиме зростанню прихильності до лікування, особливо для пацієнтів похилого віку.
Пацієнт М., 56 років, надійшов зі скаргами на підвищення рівня глікемії протягом доби (від 10 до 15,9 ммоль/л), ніктурію, поліурію, підвищену спрагу, коливання рівня артеріального тиску, головний біль, запаморочення, слабкість, сонливість, швидку стомлюваність, зниження працездатності, оніміння ніг, відчуття повзання мурашок, судоми в ногах.
Анамнез захворювання. Хворіє на ЦД 5 років, отримував лікування метформіном, рівень глікованого гемоглобіну не контролював, рівень глікемії, зі слів пацієнта, – до 10,0 ммоль/л. У листопаді 2022 р. консультований у Національному інституті серцево-судинної хірургії ім. М.М. Амосова з приводу болю в серці, що виникає періодично, особливо при інтервальному фізичному навантаженні. На тлі нестабільної стенокардії проведено коронаровентрикулографію 28.11.2022, діагностовано стенозуючий коронаросклероз: передня міжшлуночкова гілка (медіальна частина) – 70-90%, діагональна гілка – 90%, передня міжшлуночкова гілка (дистальна частина) – 70%; і в той же день проведено стентування передньої міжшлуночкової та діагональної гілок лівої коронарної артерії. Через виявлену гіперглікемію 14,8 ммоль/л пацієнт був скерований до ендокринолога. Після обстеження діагностовано хронічну хворобу нирок ІІ ст. (швидкість клубочкової фільтрації – 61 мл/хв/1,73 м2) та СН ІІА зі збереженою систолічною функцією лівого шлуночка (фракція викиду – 55%), що обумовило призначення фіксованої комбінації дапагліфлозин/метформін 10/1000 мг зранку та ліраглутид 0,6 мг із подальшою титрацією дози. Через 3 тижні після призначення ліраглутиду пацієнт припинив прийом препарату, оскільки погано переносив дозу 1,2 мг, незважаючи на сповільнену титрацію (1 раз на 14 днів замість 1 раз на 7 днів). Через недостатнє зниження глікемії додатково був призначений гліклазид МР 60 мг на добу.
В анамнезі також хронічне обструктивне захворювання легень (бронхіт курця), ожиріння ІІ ст. (індекс маси тіла – 36 кг/м2), дисліпідемія. Постійно приймає аторвастатин 40 мг, езетиміб 10 мг, кислоту ацетилсаліцилову 100 мг, клопідогрелю гідросульфат 75 мг, пантопразол 20 мг, периндоприлу аргінін / амлодипін 10/10 мг.
У січні 2023 р. проведено біфуркаційне стентування огинаючої та проміжної гілок лівої коронарної артерії.
Пацієнт звернувся на консультацію в ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» через відсутність компенсації вуглеводного обміну: рівень глікемії, незважаючи на отримувану терапію (гліклазид МР 60 мг, дапагліфлозин/метформін 10/1000 мг і метформін 1000 мг), залишався в межах 12-15 ммоль/л, рівень НbА1с – 9,2%. Після обстеження першим варіантом щодо тактики ведення пацієнта було додати базальний аналог інсуліну до пероральної терапії, але з огляду на наявність тяжкого атеросклеротичного ураження прийнято рішення призначити фіксовану комбінацію базального інсуліну й арГПП-1. Зважаючи на неуспішну спробу прийому ліраглутиду у 2022 р. та відсутність інсулінотерапії в анамнезі, прийом Ксалтофай® розпочато з 10 к.д., прийом гліклазиду МР відмінено. Пацієнт був проінструктований щодо збільшення дози Ксалтофай® кожні 3 доби на 2 к.д. до досягнення цільового рівня глікемії, який для нього визначений як 6,0-6,5 ммоль/л натще. За місяць пацієнт досягнув компенсації вуглеводного обміну при використанні дози Ксалтофай® 28 к.д. Враховуючи повільний темп титрації, переносимість препарату була кращою, ніж у випадку монотерапії ліраглутидом, незважаючи на те що загальна доза ліраглутиду в складі фіксованої комбінації становила 1,0 мг, що співставно з дозою, яка була призначена пацієнту раніше. Через 3 місяці застосування фіксованої комбінації в дозі 28 к.д. рівень НbА1с знизився до 7,1%, рівень глікемії натще становив 6,2-6,7 ммоль/л, вага пацієнта знизилася на 4 кг.
Література
- American Diabetes Association Professional Practice Committee. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes – 2022. Diabetes Care. 2022 Jan 1;45 (Suppl. 1): S17-S38.
- Aroda V.R., González-Galvez G., Grøn R., et al. Durability of insulin degludec plus liraglutide versus insulin glargine U100 as initial injectable therapy in type 2 diabetes (DUAL VIII): a multicentre, open-label, phase 3b, randomised controlled trial. Lancet Diabetes Endocrinol. 2019; 7: 596-605.
- Davies M.J., D’Alessio D.A., Fradkin J., Kernan W.N., Mathieu C., Mingrone G., Rossing P., Tsapas A., Wexler D.J., Buse J.B. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018 Dec; 41 (12): 2669-2701.
- Doyle-Delgado K., Chamberlain J.J., Shubrook J.H., Skolnik N., Trujillo J. Pharmacologic approaches to glycemic treatment of type 2 diabetes: synopsis of the 2020 American Diabetes Association’s Standards of Medical Care in Diabetes Clinical Guideline. Ann. Intern. Med. 2020 Nov 17; 173 (10): 813-821. doi: 10.7326/M20-2470.
- Evans M., Lehmann R., Liebl A., Linjawi S., Holt R.I.G., Hosszúfalusi N., Rutten G., Vilsbøll T. Clinical considerations when initiating and titrating insulin degludec / liraglutide (IDegLira) in people with type 2 diabetes. Drugs. 2020 Feb; 80 (2): 147-165. doi: 10.1007/s40265-019-01245-3.
- Gaede P., Lund-Andersen H., Parving H.H., Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N. Engl. J. Med. 2008; 358 (6): 580-591. doi: 10.1056/NEJMoa0706245.
- Gough S.C., Bode B., Woo V., et al.; NN9068-3697 (DUAL-I) Trial Investigators. Efficacy and safety of a fixed-ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open-label, randomised, 26-week, treat-to-target trial in insulin-naive patients with type 2 diabetes. Lancet Diabetes Endocrinol. 2014; 2: 885-893.
- Harris S., Abrahamson M.J., Ceriello A., Charpentier G., Evans M., Lehmann R., Liebl A., Linjawi S., Holt R.I.G., Hosszúfalusi N., Rutten G., Vilsbøll T. Clinical considerations when initiating and titrating insulin degludec / liraglutide (IDegLira) in people with type 2 diabetes. Drugs. 2020 Feb; 80 (2): 147-165. doi: 10.1007/s40265-019-01245-3.
- Hunt B., Mocarski M., Valentine W.J., Langer J. Evaluation of the short-term cost-effectiveness of IDegLira versus continued up-titration of insulin glargine U100 in patients with type 2 diabetes in the USA. Adv. Ther. 2017 Apr; 34 (4): 954-965. doi: 10.1007/s12325-017-0502-2.
- Liu Y., Li X., Zheng Y., Wang X., Wang X. IDegLira for type 2 diabetes: a systematic review and meta-analysis. Endocrine. 2023 Sep 28. doi: 10.1007/s12020-023-03543-z.
- Perry M.L., Prahalad P., Pratley R.E., Seley J.J., Stanton R.C., Gabbay R.A., on behalf of the American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Care in Diabetes – 2023. Diabetes Care. 2023 Jan 1; 46 (Suppl. 1): S140-S157. doi: 10.2337/dc23-S009.
- Philis-Tsimikas A., Billings L.K., Busch R., et al. Superior efficacy of insulin degludec / liraglutide versus insulin glargine U100 as add-on to sodium-glucose co-transporter-2 inhibitor therapy: a randomized clinical trial in people with uncontrolled type 2 diabetes. Diabetes Obes. Metab. 2019; 21: 1399-1408.
- Samson S.L., Vellanki P., Blonde L., Christofides E.A., Galindo R.J., Hirsch I.B., et al. American Association of Clinical Endocrinology Consensus Statement: comprehensive type 2 diabetes management algorithm – 2023 update. Endocr. Pract. 2023 May; 29 (5): 305-340. doi: 10.1016/j.eprac.2023.02.001.
- Suastika K., Eliana F., Kshanti I.A.M., Mardianto M., Mudjarnako S.W., Natalia N., Hs H.N., Sibarani R.P., Soewondo P., Soelistijo S.A., Tarigan T.J.E., Zufry H. Expert opinion on diabetes management challenges and role of basal insulin / GLP-1 RA fixed-ratio combination in people with type 2 diabetes from Indonesia. Diabetes Metab. Syndr. Obes. 2022 Sep 27; 15: 2977-2990.doi: 10.2147/DMSO.S367153.
- Vilsbøll T., Blevins T.C., Jodar E., Poulter N., Tentolouris N., Ross Agner B.F., Lehmann L., Leiter L.A. Fixed-ratio combination of insulin degludec and liraglutide (IDegLira) improves cardiovascular risk markers in patients with type 2 diabetes uncontrolled on basal insulin. Diabetes Obes. Metab. 2019 Jun; 21 (6): 1506-1512. doi: 10.1111/dom.13675.
- Tibaldi J., Mercado M.E., Strong J. How effective is the fixed-ratio combination of insulin degludec and liraglutide (IDegLira) in different patient populations, and when should it be used
in clinical practice? Clin. Diabetes. 2020 Oct; 38 (4): 339-347. doi: 10.2337/cd20-0014.