Стеатозна хвороба печінки, асоційована з метаболічною дисфункцією: лікування коморбідних пацієнтів в ендокринології
Підготувала д-р мед. наук Лариса Стрільчук
Печінка – динамічний ендокринний орган – активно взаємодіє з іншими органами й системами та включається в низку метаболічних, ендокринних і гормональних сигнальних шляхів (Nobili V. et al., 2013). Печінка є найбільшою травною залозою людини та провідним центром метаболізму, який підтримує життєдіяльність людини, регулюючи обмін білків, жирів, вуглеводів, вітамінів і гормонів, а також секретуючи/екскретуючи жовч і розщеплюючи токсини. Однак у зв’язку з несприятливими змінами довкілля та способу життя населення планети кількість хвороб печінки продовжує зростати рік у рік. Чинниками, які спричиняють гепатологічні захворювання, є вплив хімікатів і ліків, вірусні інфекції, зловживання алкоголем, неправильне харчування, порушення кислотно-лужного балансу травного тракту тощо. Станом на сьогодні хвороби печінки вірусного, медикаментозного, метаболічного й алкогольного ґенезу є однією з найпоширеніших груп захворювань у всьому світі (Wang C. et al., 2021).
У практиці сімейних лікарів, терапевтів, гастроентерологів та ендокринологів надзвичайно часто трапляється стеатозна хвороба печінки, асоційована з метаболічною дисфункцією (СХПМД).
Цю назву, яка замінила термін «неалкогольна жирова хвороба печінки» (НАХЖП), було офіційно затверджено у 2023 р. Оскільки дані досліджень продемонстрували високу конкордантність структурних ознак СХПМД і НАЖХП, які включають стеатоз, балонну дистрофію, лобулярне запалення та, на пізніх стадіях, фіброзно-циротичні зміни (Pan Q. et al., 2023), у цьому огляді вживатиметься лише новий термін – СХПМД, хоча деякі з авторів цитованих джерел послуговувалися поняттям НАЖХП.
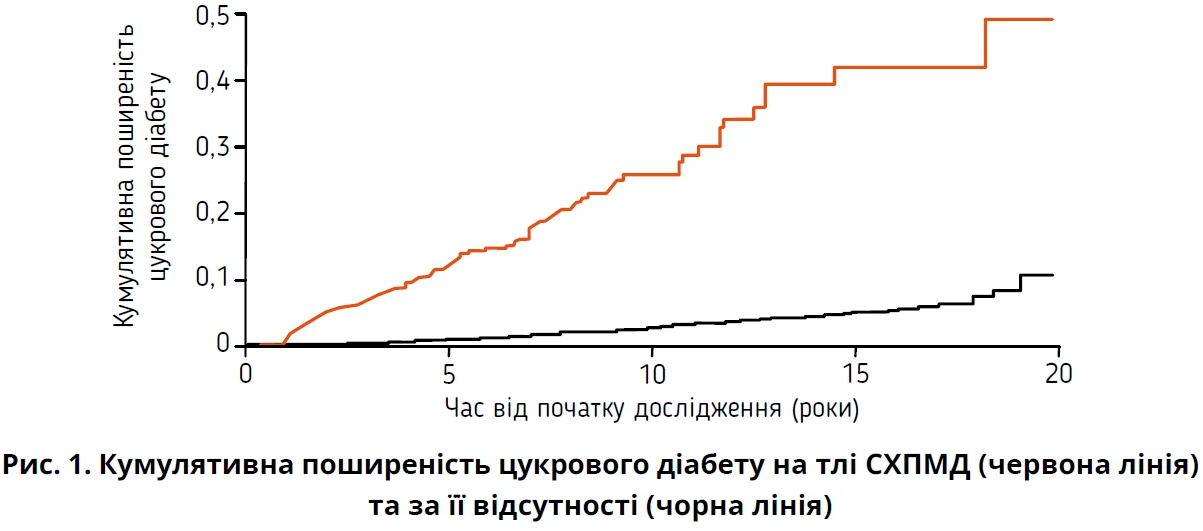
СХПМД включає цілий спектр нозологій від стеатозу до стеатогепатиту, цирозу та гепатоцелюлярної карциноми (Chalasani N. et al., 2012). Очікується, що до 2030 р. СХПАМД уразить майже 1/3 загальної популяції світу (Estes C. et al., 2018). Патогенез СХПМД у наш час розглядається крізь призму теорії «множинних ударів» (multiple hit theory), яка ґрунтується на синергетичній ролі генетичних та епігенетичних чинників, включаючи інсулінорезистентність, окисний стрес, дисбіоз кишківника тощо (Marchisello S. et al., 2019). Стан печінки й наявність СХПМД вважають своєрідним «барометром метаболічного здоров’я», що підкреслює важливість контролю за станом печінки, метаболічними розладами й асоційованою з ними ендокринною дисфункцією (Tutunchi H. et al., 2020; Nobili V. et al., 2013). Зв’язок СХПМД з різними ендокринними хворобами ретельно вивчався та продовжує вивчатися, і станом на сьогодні відомо, що ендокринопатії є чинниками ризику виникнення, прогресування й тяжкого перебігу СХПМД (Hazlehurst J.M., Tomlinson J.W., 2013). Експериментальні та клінічні дослідження однозначно підтвердили зв’язок СХПМД із синдромом полікістозних яєчників, гіпопітуїтаризмом, дефіцитом гормону росту, гіпогонадизмом та іншими ендокринними патологіями (Arefhosseini S. et al., 2022). СХПМД також тісно асоціюється з розвитком цукрового діабету 2-го типу (рис. 1) (Park S.H. et al., 2023).
Вагомою причиною стеатозу печінки, тісно пов’язаною з інсулінорезистентністю, є ожиріння. Проте дедалі більше досліджень демонструють, що жирова тканина має низку фізіологічних функцій, тому не варто припускати, що підвищена маса тіла й надмірне накопичення жиру свідчать про незадовільний стан здоров’я. Запропоновано виділяти фенотипи метаболічно здорових і метаболічно нездорових осіб з ожирінням (Gambarin-Gelwan M. et al., 2007; Vassilatou E. et al., 2014). Точніше оцінити роль жирової тканини в патофізіологічних процесах і ризик розвитку метаболічних захворювань дає змогу ступінь вісцерального ожиріння. Для оцінки останнього запропоновано використовувати індекс вісцерального ожиріння – ІВО (Lonardo A. et al., 2019), який розраховується на основі обводу талії, індексу маси тіла, вмісту тригліцеридів і ліпопротеїнів високої щільності. ІВО тісно пов’язаний із поширеністю та перебігом метаболічно-асоційованих хвороб. Зокрема, 4-річне проспективне когорт не дослідження виявило, що ІВО є незалежним чинником ризику розвитку СХПМД (Shengir M. et al., 2021). Іще одним цікавим індексом є добуток ліпідного накопичення (ДЛН), для розрахунку якого потрібно знати лише обвід талії та вміст тригліцеридів (Targher G. et al., 2016). Показано, що ДЛН тісно пов’язаний із поширеністю й тяжкістю СХПМД (Kelley C.E.
et al., 2014). Відомим сурогатним маркером для оцінки інсулінорезистентності – чи не найважливішого чинника патогенезу метаболічно-асоційованих хвороб – є тригліцеридно-глюкозний індекс (ТГІ), який асоціюється з кардіоваскулярними хворобами, цукровим діабетом і діабетичною нефропатією (Brown A.J. et al., 2005; Ramezani-Binabaj M. et al., 2014; Rocha A. et al., 2017). ТГІ дає змогу визначати осіб із високим ризиком СХПМД й оцінювати прогресування фіброзу печінки (Jones H. et al., 2012; Wu J. et al., 2018).
Для покращення стану пацієнтів із СХПМД, яка часто є коморбідним станом ендокринологічних і кардіологічних захворювань, доцільно застосовувати препарати метаболічного та гепатопротекторного спрямування, здатні зменшувати вираженість запалення, підвищувати чутливість до інсуліну, включатися в каскади біохімічних реакцій. Добре вивченими молекулами цього класу є аргінін, бетаїн та L-карнітин.
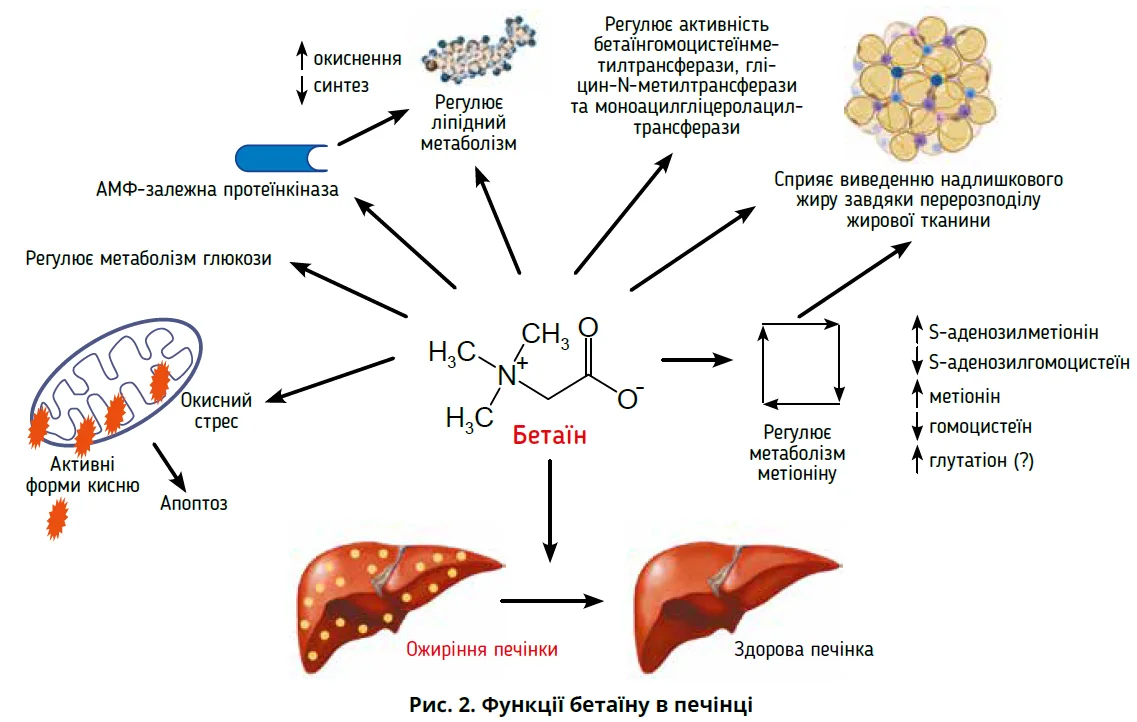
Зокрема, показано, що бетаїн покращує перебіг СХПМД і зменшує асоційовану з нею печінкову інсулінорезистентність, забезпечуючи гепатопротекцію. Бетаїн є сполукою природного походження, що трапляється в продуктах харчування та синтезується in vivo з холіну. В умовах живого організму бетаїн виступає донором метильних груп у процесі перетворення гомоцистеїну на метіонін, а також діє як осмоліт (Kathirvel E. et al., 2010). Функції бетаїну в печінці є надзвичайно багатогранними (рис. 2) (Arumugam M.K. et al., 2021).
У рандомізованому подвійному сліпому дослідженні за участю осіб із надлишковою масою тіла й ожирінням застосування дієтичної добавки бетаїну забезпечувало достовірне зниження вмісту інсуліну та тенденцію до зниження рівня глюкози натще. Водночас було зафіксовано зниження рівня загального холестерину (Grizales A.M. et al., 2018). У дослідженні M. Abdelmalek і співавт. (2009) було встановлено, що застосування добавок бетаїну протягом 12 місяців знижує вираженість стеатозу печінки (підтверджено даними біопсії). Експериментальне дослідження, проведене Е. Kathirvel і співавт. (2010), продемонструвало, що високожирова дієта сприяє зниженню концентрації бетаїну в тканинах печінки на 50% і водночас наростанню вмісту токсичного гомоцистеїну. Введення в раціон експериментальних тварин добавок бетаїну сприяло нормалізації рівнів гомоцистеїну й аланінамінотрансферази, зменшенню накопичення жиру в печінці, зниженню загального холестерину, тригліцеридіві глюкози натще. Автори дійшли висновку, що бетаїн забезпечує регрес стеатозу печінки та печінкової інсулінорезистентності, індукованих високожировою дієтою. Результати було підтверджено й за допомогою аналізів in vitro: інкубація з бетаїном зменшувала інтенсивність ліпогенезу de novo.
Своєю чергою, L-аргінін являє собою умовно незамінну амінокислоту, яка бере участь у низці метаболічних процесів. У біологічних тканинах L-аргінін виступає джерелом оксиду азоту (NO), протидіє окисному стресу (Gupta V. et al., 2005), регулює окисно-відновний стан клітин (Ranjbar K. et al., 2015), підсилює імунітет і запобігає гіперхолестеринемії (рис. 3) (Szlas A. et al., 2022; Liang M.
et al., 2018). Терапевтичні властивості L-аргініну були підтверджені за цілого спектра гострих і хронічних хвороб, включаючи криз серпоподібноклітинної анемії, легеневу гіпертензію, ішемічну хворобу серця тощо (Sharma V. et al., 2019). Продовжує зростати доказова база здатності L-аргініну нормалізувати метаболізм при ожирінні, регулювати артеріальний тиск і зменшувати вираженість симптомів цукрового діабету 2-го типу (Szlas A. et al., 2022).
L-аргінін бере участь у детоксикації печінки та може застосовуватися за різноманітних уражень цього органа. Показано, що при токсичному гепатиті застосування L-аргініну зменшувало ступінь некрозу та запалення в печінці, знижувало інтенсивність перекисного окиснення ліпідів і відновлювало антиоксидантний статус печінки (Saad E.A., 2012). Експериментальне дослідження A.A. Sedik і співавт. (2023) виявило, що застосування L-аргініну в щурів з індукованою тіоацетамідом печінковою енцефалопатією сприяло нормалізації рівня аміаку в сироватці крові та тканинах мозку, відновленню фізіологічних рівнів аланін- і аспартатамінотрансферази, лужної фосфатази, загального білірубіну, а також нормалізації локомоторної активності, відновленню попередніх рухових здатностей та усуненню порушень пам’яті, що виникли на тлі енцефалопатії. За даними гістопатологічного дослідження, застосування L-аргініну сприяло ослабленню реактивності ядерного фактора еритроїд-асоційованого фактора-2 (Nrf2), таким чином протидіючи апоптозу. Подібні результати отримали й S. Al-Dalaen і співавт. (2016), які дійшли висновку, що в разі ушкодження печінки гепатотоксичними речовинами L-аргінін має не лише протекторний, а й лікувальний ефект. Слід зауважити, що покращення на тлі застосування L-аргініну мають не лише біохімічний, а й структурний характер: усувають дегенеративні зміни та нормалізують архітектуру тканин печінки (Sharma V. et al., 2019).
L-карнітин є водорозчинною амінокислотою, яка виконує в організмі людини низку важливих функцій, зокрема зменшує окисний стрес, покращує роботу мітохондрій, протидіє інсулінорезистентності (Li N., Zhao H. et al., 2021). L-карнітин синтезується в печінці та нирках, а також надходить в організм із харчовими продуктами й біодобавками.
Ця речовина бере участь у транспорті довголанцюгових жирних кислот через внутрішню мембрану мітохондрій, а також виступає кофактором β-окиснення жирних кислот. У зв’язку з останнім ефектом L-карнітин доцільно застосовувати при СХПМД (Liu A. et al., 2023). L-карнітин сприяє зменшенню внутрішньоклітинної концентрації вільних жирних кислот і тригліцеридів у гепатоцитах, запобігаючи ліпотоксичності. Ці ефекти можуть забезпечувати покращення не лише при СХПМД і стеатогепатиті, а й за фіброзу печінки та гепатоцелюлярної карциноми (Li N., Zhao H. et al., 2021). Метааналіз M. Abolfathi та співавт. (2020) продемонстрував, що застосування L-карнітину пацієнтами із СХПМД забезпечує зниження рівнів тригліцеридів, аланін- і аспартатамінотрансферази, а також індексу інсулінорезистентності HOMA.
L-Бетаргін (ТОВ «Ворвартс Фарма») являє собою дієтичну добавку до основного раціону харчування, котра виступає додатковим джерелом аргініну бетаїну та карнітину. 10 мл розчину L-Бетаргіну (1 стік) містить 1 г аргініну цитрату, 1 г бетаїну та 300 мг L-карнітину.
L-Бетаргін сприяє нормалізації функціонального стану гепатобіліарної системи, поліпшенню функції серцево-судинної системи, виведенню токсичних речовин з організму й підтримці нормального кровообігу та процесів мікроциркуляції в печінці, зменшенню гіпоксії печінки, усуненню проявів токсикозу вагітних, покращує репродуктивні функції чоловіків і жінок під час планування вагітності, нормалізує рівень гомоцистеїну. Застосування цієї діабетичної добавки потенційно здатне покращити обмін речовин у печінці, таким чином запобігаючи розвитку чи прогресуванню СХПМД.