Роль вітаміну D за ендокринної патології: значення високих доз
Підготувала канд. мед. наук Ольга Королюк
На сьогодні з’являється дедалі більше повідомлень про нескелетні ефекти вітаміну D, адже його рецептори є в більшості клітин організму (рис. 1), зокрема й у ендокринній системі [1, 2]. Обговорюється роль вітаміну D у патофізіології автоімунної патології щитоподібної залози (ЩЗ), гіперпаратиреозу, патології надниркових залоз, цукрового діабету (ЦД) 1 та 2 типів, ожиріння, що відкриває нові можливості терапевтичного впливу на вказані стани [3-9].

Фізіологічні впливи вітаміну D
У природі вітамін D переважно трапляється у двох ізоформах: ергокальциферол (вітамін D2) фотохімічно синтезується в рослинах; холекальциферол (вітамін D3) синтезується в шкірі з 7-дегідрохолестерину під впливом ультрафіолетових променів типу B довжиною хвилі 280-320 нм (рис. 2) [10]. Білок, що зв’язує вітамін D, транспортує ізоформи вітаміну D до печінки, де під впливом ферменту 25-гідроксилази утворюється кальцидіол, або 25-гідроксивітамін D (25(OH)D) [4, 11]. У людини переважає ізоформа 25(OH)D3, яка у фізіологічних концентраціях є неактивною. У нирках під впливом 1α-гідроксилази (CYP27B1) утворюється активна форма – 1,25-дигідроксивітамін D3 (1,25(OH)2D3), або кальцитріол. Активність 1α-гідроксилази регулюється паратиреоїдним гормоном (ПТГ). Натомість високі рівні 1,25(OH)2D3 мають негативний зворотний зв’язок із фактором росту фібробластів-23. Експресію 1α-гідроксилази виявлено також у кістках, шкірі, товстій кишці, мозку й імунних клітинах, де її регуляція не залежить від ПТГ. Катаболізм вітаміну D відбувається під впливом 24-гідроксилази (CYP24A1), що перетворює кальцитріол на 1,24,25(OH)3D, який надалі перетворюється на продукт виділення – кальцитроєву кислоту [12]. Отже, система вітаміну D включає стероїдні прогормони, їхні метаболіти, носії та ферменти, які беруть участь у метаболізмі вітаміну D [13].

Діючи на рівні кісток скелета, кишківника та нирок, вітамін D регулює фосфорно-кальцієвий гомеостаз, забезпечуючи здоров’я кісток. Проте нині активно дискутується його роль як маркера загального здоров’я, оскільки низькі рівні вітаміну D пов’язані з інфекційними хворобами, автоімунною патологією, метаболічними розладами, нервово-м’язовими захворюваннями та раком [13].
Вітаміну D притаманні геномна й негеномна дії. Геномна дія опосередковується рецептором вітаміну D (VDR). Це ядерний рецептор, присутній у понад 30 тканинах. Він діє як ліганд-активований фактор транскрипції, регулюючи близько 700 генів, тобто 3% геному людини [14]. Зв’язана з VDR активна форма вітаміну D утворює гетеродимерну молекулу, взаємодіючи з ретиноїдним рецептором. Надалі цей комплекс переміщується до ядра та зв’язується з елементами, що реагують на вітамін D (VDRE) в промоторній ділянці відповідних генів. Ремоделюванню хроматину сприяють корегуляторні елементи, які зумовлюють зміни епігенетичних гістонів і рекрутинг локальної РНК-полімерази II.
Як наслідок, відбувається експресія генів, зокрема тих, що відповідають за проліферацію й диференціювання клітин, імуномодулювальну відповідь і ангіогенез [15, 16]. Негеномна дія реалізується через активацію різних сигнальних молекул, як-от фосфатидилінозитол-3-кіназа, протеїнкінази A та C, фосфоліпаза С, Ca2+-кальмодулінкіназа II, мітоген-активована протеїнкіназа (MAPK). Усі вони націлені на фактори транскрипції, які зрештою залучають VDRE до активації відповідних генів [17].
Імуномодулювальний ефект вітаміну D (рис. 3) полягає у впливі на дозрівання макрофагів, диференціацію моноцитів, посилення фагоцитозу й хемотаксису та протипухлинні впливи мононуклеарних макрофагів.
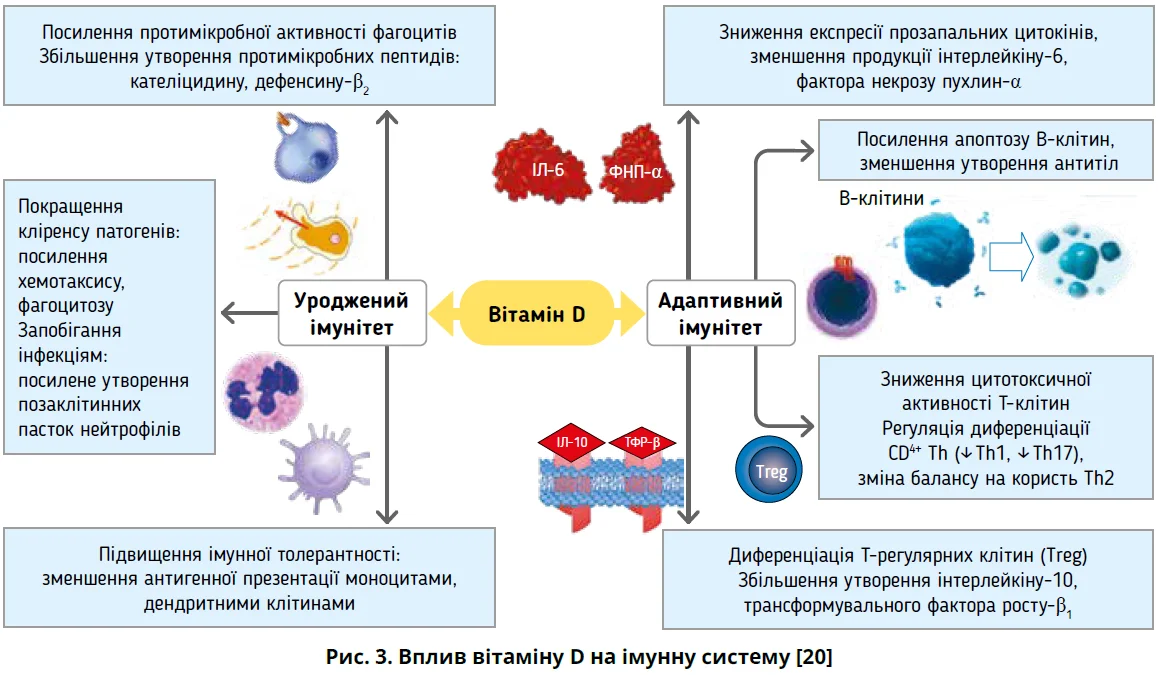
Вітамін D пригнічує експресію Toll-подібних рецепторів (TLR2, TLR4) на поверхні моноцитів, що порушує ідентифікацію молекулярних структур, пов’язаних із патогеном, а отже, знижує імунну реакцію й утворення запальних цитокінів, унеможливлюючи надмірну імунну відповідь і запалення [18]. Встановлено декілька механізмів впливу 1,25(OH)2D3 на дендритні клітини: 1) пригнічення сигнальних шляхів p38 MAPK та ядерного фактора каппа B (NF-kB), що впливає на синтез інтерлейкінів (ІЛ) у дендритних клітинах; 2) збільшення утворення протизапальних цитокінів, зокрема ІЛ-10, та інгібіторних молекул Т-клітин, які відповідають за апоптоз і порушення диференціації Тh унаслідок зниження синтезу прозапальних цитокінів – IЛ-12, IЛ-23, фактора некрозу пухлин-α (ФНП-α) й інтерферону-γ [19].
Лабораторне визначення вітаміну D, критерії недостатності й дефіциту
Контроль рівня вітаміну D здійснюється шляхом визначення концентрації циркулювального метаболіту 25(OH)D3, який відображає надходження вітаміну D із продуктами харчування й утворення шкірою. Завдяки тривалому періоду напіввиведення (10-19 днів) показник вважається надійним і рекомендується як діагностичний тест різними настановами, зокрема Інституту медицини й Американського товариства ендокринології [21]. Можна визначити й сироваткову концентрацію 1,25(OH)2D3, але цей показник менш надійний.
За вторинного гіперпаратиреозу внаслідок дефіциту вітаміну D його значення можуть бути в нормі або навіть підвищені [22].
Практичні настанови Ендокринного товариства (2011) вважають дефіцитом концентрацію 25(OH)D3 у сироватці крові <50 нмоль/л (20 нг/мл), тоді як рівні в межах 50-75 нмоль/л (20-30 нг/мл) – недостатністю вітаміну D [23]. Консенсусна заява Другої міжнародної конференції вказує, що рівні 25(OH)D3 у межах 50-125 нмоль/л (20-50 нг/мл) є безпечними щодо здоров’я опорно-рухового апарату; дефіцитом вважаються значення <30 нмоль/л (12 нг/мл), недостатністю – значення в межах 30-50 нмоль/л (12-20 нг/мл) [24].
Роль вітаміну D при автоімунній патології ЩЗ
До найчастіших автоімунних захворювань ЩЗ відносять тиреоїдит Хашимото (ТХ) та хворобу Грейвса (ХГ). Зв’язок вітаміну D із цією патологією насамперед зумовлений імуномодулювальним впливом (рис. 4).

У дослідженні, в якому порівнювали 50 пацієнтів з автоімунними хворобами ЩЗ, 42 пацієнтів із неавтоімунними хворобами ЩЗ та 98 здорових людей, було встановлено, що дефіцит вітаміну D (25(OH)D3 <10 нг/мл) істотно переважав у пацієнтів з автоімунними хворобами порівняно з групою контролю (72 проти 30,6%; p<0,001) та в пацієнтів з автоімунним тиреоїдитом порівняно з групою неавтоімунної патології (79 проти 52%; p<0,05). Виявлено зв’язки між низькими рівнями вітаміну D й антитиреоїдними антитілами (p=0,01), а також аномальними маркерами функції ЩЗ (p=0,059), що може вказувати на патогенетичну роль вітаміну D та підкреслює важливість корекції дефіциту вітаміну D за цих станів [26]. Нещодавній метааналіз указує на кореляцію нижчих рівнів вітаміну D з автоімунними станами ЩЗ (p=0,013), ТХ (p<0,001) та гіпотиреозом (p=0,03). Для ХГ зв’язок не був статистично значущим (р=0,06), але набував значущості в осіб віком понад 40 років [27].
Тиреоїдит Хашимото
ТХ – автоімунна хвороба невідомої етіології, зумовлена дисбалансом Т-хелперних клітин (Th) 1 та 2 типів, що характеризується зобом, наявністю циркулювальних антитіл проти тиреоїдної пероксидази (ATPO) та/або антитіл проти тиреоглобуліну (TgAb), що призводить до гіпофункції залози різного ступеня [20]. Під впливом цитокінів, які утворюють Th1, тиреоцити експресують поверхневі антигени головного комплексу гістосумісності II класу HLA-DR, що робить їх схильними до імунологічної атаки. Згодом активовані Т-клітинами В-лімфоцити виробляють автоантитіла до антигенів ЩЗ. Гістологічно ТХ проявляється хронічним лімфоцитарним тиреоїдитом [6, 25, 28].
Захворюваність на ТХ останнім часом зростає, але перебіг хвороби часто безсимптомний, а дисфункція ЩЗ здебільшого виникає лише на пізніх стадіях. Можлива інша супутня патологія, зокрема злоякісні пухлини. Наприклад, у кількох клінічних дослідженнях ТХ асоціювався з ризиком розвитку папілярної карциноми ЩЗ [25].
Імунна відповідь у разі ТХ може пригнічуватися вітаміном D, який діє як імуносупресант, впливаючи на різні стадії автоімунного процесу [29]. Зокрема, пригнічує опосередковану дендроцитами активацію Т-лімфоцитів, зменшує проліферацію Th1-клітин та їхню здатність до секреції інтерферону-γ; пригнічує утворення цитокінів і блокує поверхневу експресію HLA-DR MHCII на клітинах ЩЗ; зменшує проліферацію В-клітин і прискорює їх апоптоз, що знижує утворення автоантитіл та їхній згубний вплив на ЩЗ [5, 28]. Ризик ТХ підвищений в осіб із низьким рівнем вітаміну D та за порушення функціональності вітаміну D внаслідок аномалій вітамін-D-зв’язувального білка чи певних генних поліморфізмів VDR [30]. Установлено, що понад 60% пацієнтів із ТХ мають гіповітаміноз D. Проте хвороба тісніше пов’язана з дефіцитом вітаміну D (<20 нг/мл), аніж із недостатністю (21-29 нг/мл) [31-33]. Низка клінічних досліджень указує, що поширеність ТХ у пацієнтів із гіповітамінозом D значно вища, ніж в осіб із достатнім рівнем вітаміну D, особливо серед дітей, людей похилого віку та жінок у пременопаузі [8, 34, 35]. Сильний негативний зв’язок між концентрацією вітаміну D у сироватці крові та рівнями тиреотропного гормона (ТТГ) може вказувати, що дефіцит вітаміну D у пацієнтів із ТХ асоціюється з прогресуванням до гіпотиреозу [31].
Декілька груп дослідників оцінювали вплив добавок вітаміну D на ТХ. У проспективному дослідженні 82 пацієнтів із ТХ рандомізували на дві групи. Пацієнти першої групи (n=46) отримували холекальциферол у дозі 1000 МО на день упродовж 1 місяця, пацієнти другої групи не отримувала вітаміну D. У першій групі спостерігалося суттєве зниження рівнів ATPO та TgAb [36]. В іншому дослідженні порівнювали 75 пацієнтів із ТХ з групою контролю, яка включала 43 здорових осіб. Пацієнти з дефіцитом вітаміну D (25(OH)D3 <20 нг/мл) отримували щотижневі добавки 50 000 МО протягом 8 тижнів із повторним визначенням усіх показників через 2 місяці. Порівняно з групою контролю в пацієнтів із ТХ виявлено значно нижчі середні рівні вітаміну D (9,37±0,69 проти 11,95±1,01 нг/мл; p<0,05) та вільного тироксину (0,89±0,02 проти 1,07±0,03 нг/дл; p<0,001), але більший середній об’єм ЩЗ (7,71±0,44 проти 5,46±0,63 мл; p<0,01). Після прийому замісної терапії вітаміном D спостерігалися значуще зниження титрів антитиреоїдних антитіл і покращення рівня холестерину ліпопротеїнів високої щільності в пацієнтів з еутиреоїдним ТХ. Автори дійшли висновку, що дефіцит вітаміну D є поширеним явищем у цій когорті, а корекція дефіциту може запобігти виникненню гіпотиреозу та знизити ризик серцево-судинних захворювань [37]. Дослідження за участю 100 пацієнтів із нещодавно встановленим ТХ виявило найвищі рівні ATPO серед пацієнтів із рівнями 25(OH)D у найнижчому квартилі (p=0,084). Через 3 місяці після перорального застосування добавки вітаміну D3 у дозі 60 000 МО на тиждень протягом 8 тижнів рівень ATPO знизився на 46,73% порівняно з 16,6% серед пацієнтів, які не приймали вітаміну D (p=0,028). У групі замісної терапії частка пацієнтів, які досягли зниження рівнів ATPO на ≥25%, становила 68% проти 44% у групі порівняння (p=0,015) [38]. Ці результати підтверджено іншими проспективними й рандомізованими контрольованими дослідженнями (РКД), які продемонстрували зниження рівнів антитиреоїдних антитіл унаслідок додавання холекальциферолу в пацієнтів як із достатністю, так і з дефіцитом вітаміну D [29, 39]. Підвищення рівня вітаміну D на 5 нг/мл асоціювалося зі зниженням ризику ТХ на 20% [40]. Дослідження за участю 11 017 осіб оцінювало вплив вітамінних добавок на функцію ЩЗ та рівні антитиреоїдних автоантитіл. Установлено, що сироватковий рівень 25(OH)D3 ≥50 нг/мл зменшує ризик гіпотиреозу на 30%, ризик підвищення антитиреоїдних автоантитіл – на 32%. Автори дійшли висновку, що добавки вітаміну D позитивно впливають на функцію ЩЗ та забезпечують захист від нових проявів захворювання ЩЗ протягом 12 місяців спостереження [41]. У РКД за участю дорослих жінок із ТХ підтверджено значуще зниження ТТГ після щотижневого прийому 50 000 МО холекальциферолу [41].
Хвороба Грейвса
ХГ – найпоширеніша причина гіпертиреозу в розвинутих країнах із щорічною частотою 14 випадків на 100 тис. осіб [42]. Переважно хворіють жінки. Характерними ознаками хвороби є дифузний токсичний зоб, офтальмопатія та наявність автоантитіл до рецептора ТТГ (TRAb) [43]. Лімфоцитарна інфільтрація при ХГ зазвичай менша, ніж у разі ТХ, і залучає переважно CD4+ Th2-клітини [20].
Перехресне дослідження, котре включало 776 пацієнтів з автоімунними хворобами ЩЗ, показало, що поширеність недостатності вітаміну D у пацієнтів із ХГ вища, ніж у здорових осіб [44]. Попри більшу поширеність гіповітамінозу D серед пацієнтів із ХГ зв’язок між цими двома станами детально не вивчений [45]. Відомо, що вітамін D пригнічує проліферацію активованих Т-клітин і підтримує фагоцитарну здатність макрофагів [46]. Є дані про можливість зв’язку ХГ із VDR і поліморфізмом гена вітамін-D-зв’язувального білка [47]. Імовірно, вплив дефіциту вітаміну D на виникнення гіпертиреозу при ХГ реалізується через імунізацію рецептора тиреотропіну та пригнічення хемокіну Th1 CXCL10 у клітинах ЩЗ [48]. Окрім того, вітамін D пригнічує запальні реакції при ХГ [49].
Клінічні спостереження вказують, що в пацієнтів зі збільшеним об’ємом ЩЗ і раннім початком ХГ рівень вітаміну D часто знижений [50] а в осіб із ремісією рівень вітаміну D вищий, аніж у пацієнтів з активною фазою хвороби [51].
Ще два перехресні дослідження вказують на більшу поширеність гіповітамінозу в пацієнтів із ХГ, хоча зв’язку між сироватковими рівнями вітаміну D та TRAb не спостерігалося [52, 53]. Натомість у когорті, яка включала 70 пацієнтів із ХГ, виявлено зворотний зв’язок між концентрацією вітаміну D та TRAb [54]. Взаємозв’язок між сироватковими рівнями вітаміну D та ХГ ретельно оцінено в метааналізі, який включав 26 досліджень типу «випадок – контроль» або когортних досліджень. Результати підтвердили вищий ризик дефіциту вітаміну D у пацієнтів із ХГ порівняно з групою контролю (відношення шансів 2,24; 95% довірчий інтервал 1,31-3,81; p<0,001) [55].
Інтервенційне дослідження за участю 210 пацієнтів із ХГ та гіповітамінозом D оцінювало вплив щоденного лікування вітаміном D на рецидив ХГ. Перша група (n=60) отримувала холекальциферол у дозі 1000-2000 МО на добу, друга група (n=150) не отримувала вітаміну D. Частота рецидивів істотно не відрізнялася (38 проти 49%), але рецидив пізніше виникав у групі, яка отримувала холекальциферол (7 проти 5 місяців) [56]. В іншому дослідженні 60 пацієнтів віком 20-40 років із ХГ та гіповітамінозом (дефіцит вітаміну D у 73,9% чоловіків і 54,1% жінок, недостатність у 26,1% чоловіків і 45,9% жінок) рандомізовано на дві групи. У першій групі (n=20) проводили лікування метимазолом 30 мг щодня, у другій (n=40) – аналогічну дозу метимазолу поєднували зі внутрішньом’язовим уведенням вітаміну D у дозі 200 000 МО щомісяця протягом 3 місяців. Установлено тісний зв’язок між рівнем вітаміну D, об’ємом ЩЗ та ступенем екзофтальму. Після лікування в другій групі спостерігалося значно більше зниження об’єму ЩЗ та ступеня екзофтальму [57].
Рак щитоподібної залози
Рак ЩЗ – найпоширеніша ендокринна пухлина. Щороку реєструються 567 тис. нових випадків, частіше в жінок (10,2 проти 3,1 на 100 тис.) [58]. Переважає фолікулярний рак ЩЗ, який включає диференційований рак (DTC), низькодиференційований рак (PDTC) й анапластичний рак (ATC) [59]. До визнаних чинників ризику відносять попереднє опромінення шиї, наявність вузлів у ЩЗ та сімейний анамнез раку ЩЗ. Нещодавно встановлено вищий ризик раку при гіпо- та гіпертиреозі [60, 61].
Важливу роль у канцерогенезі приписують зовнішнім чинникам, які можуть впливати на гістопатологічний фенотип [62]. Зокрема, нещодавно ожиріння визнано екологічним і генетичним чинником ризику раку ЩЗ [63]. Гіпоксія, хронічне запалення й окисний стрес підвищують ризик DTC, що характеризується стійкістю до хіміотерапії та лікування 131I [64]. Є докази щодо вищого ризику папілярного раку ЩЗ у разі ТХ внаслідок збільшення продукції цитокінів [65, 66]. Декілька досліджень указують на роль хронічного запалення у виникненні DTC [67, 68]. Із цього огляду вітамін D може відігравати роль в онкогенезі, адже він модулює багато сигнальних шляхів, задіяних у процесах апоптозу, проліферації та диференціюванні клітин, ангіогенезу, інвазії та запальної відповіді [69] (рис. 5).

Установлено проапоптотичні, антипроліферативні та протизапальні властивості вітаміну D щодо мікрооточення пухлини [70]. Протипухлинна дія опосередковується VDR і взаємодією з іншими факторами транскрипції або клітинними сигнальними шляхами [71-73]. Експериментальні дані вказують на те, що статус вітаміну D впливає на прогресування раку ЩЗ, а 1,25(OH)2D3 може мати сприятливий лікувальний вплив. Незважаючи на докази протипухлинної дії 1,25(OH)2D3 у дослідженнях in vitro та на тваринних моделях раку, результати клінічних досліджень суперечливі. Декілька досліджень виявили, що нижчі рівні 25(OH)D3 значуще корелюють із вищим ризиком виникнення раку ЩЗ [74-76], тоді як інші вказують на протилежні результати [77-79]. Більшість досліджень спостерігали значно нижчі сироваткові концентрації 25(OH)D3 у пацієнтів із DTC порівняно з пацієнтами з доброякісними хворобами ЩЗ або здоровими людьми [74, 76, 80].
У нещодавньому метааналізі, який включав 14 досліджень типу «випадок – контроль», було показано, що передопераційні сироваткові рівні 25(OH)D3 нижчі в пацієнтів із раком ЩЗ порівняно з групою контролю, але ця різниця зникала після операції [69]. Подібні результати отримано в метааналізі, який включав 10 досліджень типу «випадок – контроль», демонструючи вищий ризик раку ЩЗ в осіб із гіповітамінозом D [81]. Установлено також, що низькі рівні 25(OH)D3 пов’язані з пізніми стадіями раку й агресивними клініко-патологічними ознаками [82, 83].
Іншим предметом дискусій є виявлення зниженого перетворення 25(OH)D3 на 1,25(OH)2D3 у пацієнтів із DTC, що може вказувати на потенційну роль поліморфізму гена CYP24A1 у канцерогенезі ЩЗ [75].
Декілька клінічних досліджень оцінювали роль добавок вітаміну D у запобіганні раку ЩЗ. Автори систематичного огляду 11 досліджень, що оцінював зв’язок між дієтичними добавками вітамінів і мінералів, включаючи вітамін D, і ризиком раку ЩЗ, дійшли висновку, що поточні докази, які підтверджують захисну роль вітаміну D у виникненні раку ЩЗ, є непереконливими [84]. Проспективне дослідження дієти та здоров’я Американської асоціації пенсіонерів Національного інституту здоров’я США (NIH-AARP) не продемонструвало чітких доказів позитивної чи негативної кореляції між дієтичним споживанням вітаміну D та ризиком раку ЩЗ [85]. Дослідження добавок 25(OH)D3 й 1,25(OH)2D3 за участю людей іще не проводилися [20].
Первинний гіперпаратиреоз
Регуляція рівня іонізованого кальцію в сироватці крові є наслідком взаємних впливів ПТГ, кальцитоніну й активного вітаміну D. Активний вітамін D й іонізований кальцій пригнічують впливи ПТГ. Неактивний 25(ОН)D має потужні регуляторні впливи на тканину паращитоподібних залоз. На відміну від інших тканин клітини паращитоподібних залоз легко поглинають вітамін-D-зв’язувальний білок, що забезпечує краще захоплення й утримання циркулювального 25(ОН)D. Уміст CYP27B1 у паращитоподібних залозах забезпечує утворення 1,25(ОН)2D для паракринної дії. Повноцінний доступ до циркулювальних 25(ОН)D, 1,25(ОН)2D і здатність утворення 1,25(ОН)2D забезпечують пригнічення секреції ПТГ і проліферацію паратиреоїдних клітин [86].
Значні аденоми паращитоподібних залоз мають слабкий зворотний зв’язок із кальцієм і активним вітаміном D, тому за первинного гіпертиреозу 1,25(ОН)2D позитивно корелює з 25(ОН)D [87]. Доки рівні циркулювальних вітамінів низькі, первинний гіпертиреоз залишається латентним – нормокальціємічним [88]. Підвищення рівнів 25(ОН)D і ПТГ активує нирковий CYP27B1, прискорюючи утворення 1,25(ОН)2D щодо 25(ОН)D, унаслідок чого виникає гіперкальціємія. Отже, система вітаміну D діє за принципом кінетичних реакцій першого порядку: вихід продукту (1,25-(ОН)2D) пропорційний до надходження субстрату (25(ОН)D), а відповідні ферменти функціонують залежно від надходження 25(ОН)D. У тяжких випадках гіперпаратиреозу ця адаптація порушується, що призводить до підвищення 1,25(ОН)2D і посилення всмоктування кальцію в кишківнику. Гіперкальціємія при аденомах паращитоподібних залоз є проявом гіперчутливості до високих доз вітаміну D [89].
Відомо, що в здорових людей підвищення рівня 25(ОН)D знижує концентрацію ПТГ у сироватці крові. Відповідно, рівень ПТГ може бути визначальним чинником адекватності рівня вітаміну D. У разі первинного гіперпаратиреозу цей зв’язок порушується, оскільки високі рівні ПТГ спричиняють нерегульоване надлишкове утворення 1,25(ОН)2D – потужного гіперкальціємічного гормона [1].
Хвороба Аддісона
Характеризується руйнуванням кори надниркових залоз, опосередкованим лімфоцитарною інфільтрацією CD8 і автоантитілами проти ферменту 21-гідроксилази. Може бути самостійним захворюванням або проявом поліендокринних синдромів [90]. Сучасні уявлення про етіологію хвороби вказують на сукупну роль зовнішніх і генетичних чинників. Генетична сприйнятливість визначається переважно в локусі HLA, можливо, також залучені гени VDR і CYP27B1 [91, 92]. Зважаючи на те що активний вітамін D знижує регуляцію CYP21A2 та посилює регуляцію CYP17A1 і CYP11A1, можна припустити, що він задіяний у стероїдогенезі й патогенезі хвороби Аддісона [1].
Цукровий діабет 1 типу
ЦД 1 типу – хронічна хвороба, зумовлена автоімунним руйнуванням β-клітин підшлункової залози, що призводить до інсулінопенії та стійкої гіперглікемії, переважно уражає дітей і людей молодого віку [93]. На момент установлення діагнозу ЦД 1 типу близько 50% β-клітин підшлункової залози можуть залишатися життєздатними. Залишкова функція β-клітин може зберігатися декілька місяців або навіть років [94-96]. Це називається фазою часткової клінічної ремісії або фазою «медового місяця» ЦД 1 типу, подовження котрої покращує глікемічний контроль і знижує ризик розвитку віддалених ускладнень діабету [97-99].
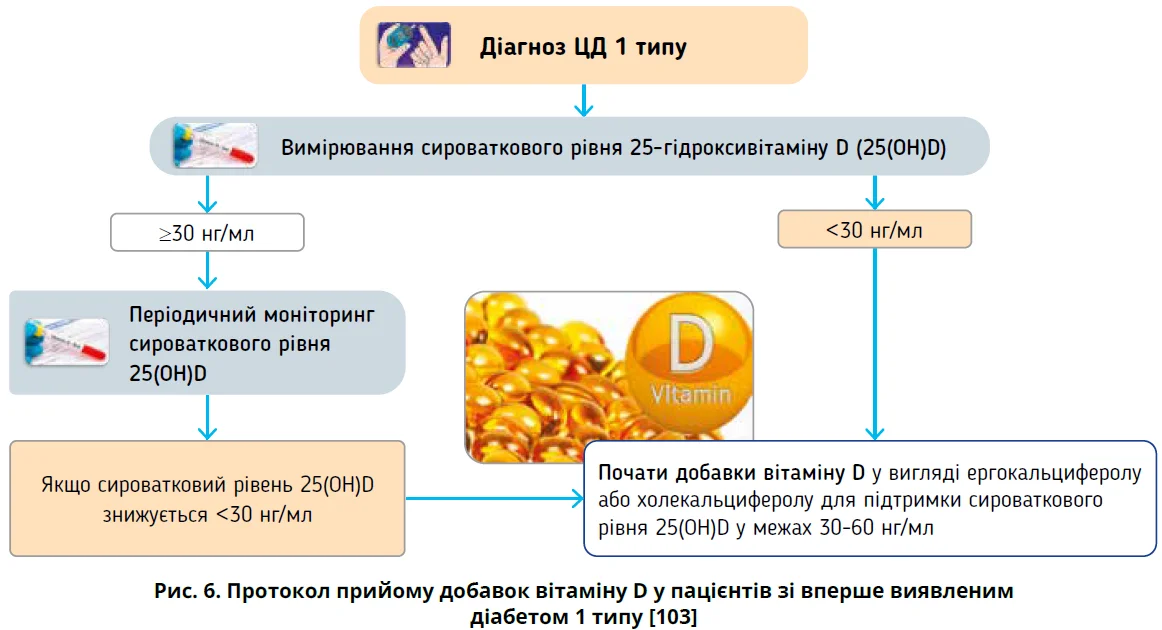
Дослідження, в яких використовували малі дози вітаміну D, повідомляли про незначущий вплив на часткову ремісію ЦД 1 типу [98, 100]. Дослідження на тваринах і клінічні випробування свідчать, що для реалізації позаскелетних ефектів вітаміну D потрібні високі дози [101, 102]. Нещодавно проведено РКД за участю 36 дітей і підлітків, яких рандомізували до прийому вітаміну D2 (ергокальциферол 50 000 МО на тиждень протягом 2 місяців, надалі через тиждень протягом 10 місяців) або плацебо. У групі застосування вітаміну D виявлено суттєве зменшення часового підвищення рівня глікованого гемоглобіну (НbA1c) із середньою швидкістю змін за 3 місяці 0,14% проти 0,46% у групі порівняння (p=0,044). HbA1c з поправкою на дозу інсуліну також був істотно меншим у групі застосування вітаміну D (середня швидкість змін за 3 місяці 0,30% проти 0,77% у групі порівняння; p=0,015). Дослідники рекомендують протокол застосування вітаміну D після встановлення діагнозу ЦД 1 типу та початкової оцінки концентрації 25(OH)D у сироватці крові (рис. 6) [103].
Захисний вплив вітаміну D, очевидно, зумовлений протизапальними й імуномодулювальними ефектами, які сприяють імунній відповіді Th2, що захищає β-клітини від подальшого руйнування [102]. Дослідження на тваринах продемонстрували, що вітамін D обмежує утворення запальних хемокінів β-клітинами та має прямий вплив на їхню функцію [104, 105]. Є також дані, що протизапальний вплив вітаміну D полягає в зменшенні концентрації ФНП-α в сироватці крові [106]. Отже, вітамін D зменшує явища острівцевого запалення – інсуліту та підтримує залишкову функцію β-клітин на ранніх стадіях ЦД 1 типу. Крім того, добавки вітаміну D уповільнюють збільшення потреби в інсуліні завдяки підвищенню чутливості до інсуліну [103]. Дослідження продемонстрували, що високі дози вітаміну D безпечні для дітей [107, 108].
Цукровий діабет 2 типу
На секрецію інсуліну значною мірою впливає 1,25(OH)2D, збільшуючи приплив іонів кальцію до β-клітин підшлункової залози в кінцевому етапі індукованої глюкозою секреції інсуліну [109].
Що стосується впливу вітаміну D на дію інсуліну в тканинах, то повідомляється як про прямий вплив через інсулінові рецептори, так і опосередкований через стимуляцію пероксисомних проліфератор-активованих рецепторів (PPAR), які відіграють важливу роль у контролі метаболізму жирних кислот в адипоцитах і міоцитах [110]. Резистентність до інсуліну може бути спричинена хронічним запаленням унаслідок порушень у мітохондріях.
Вітамін D знижує утворення прозапальних цитокінів і полегшує синтез протизапальних цитокінів. Дефіцит вітаміну D зазвичай пов’язаний із прозапальними станами [111, 112]. Епігенетичні зміни, які супроводжують ЦД 2 типу та резистентність до інсуліну, часто пов’язані з гіперметилюванням ДНК, що спричиняє інактивацію декількох генів. Вітамін D може протидіяти цим процесам, підвищуючи експресію ДНК-деметилази [113].
Вплив вітаміну D на посилення чутливості периферичних клітин до інсуліну реалізується кількома механізмами. Відомо, що 1,25(OH)2D3 підвищує чутливість до інсуліну шляхом стимуляції експресії інсулінового рецептора (IR) після зв’язування з VDRE в промоторі гена рецептора інсуліну людини або внаслідок активації PPARδ [114]. Інший непрямий механізм полягає в регуляції гомеостазу кальцію, адже кальцій модулює внутрішньоклітинні шляхи в інсулінозалежних тканинах і має дуже вузький діапазон для оптимальної функції. Отже, навіть невеликі зміни рівнів вітаміну D можуть погіршувати трансдукцію сигналів інсуліну, що знижує активність транспортера глюкози [115]. Транскрипційна активація гена IR відбувається завдяки 1,25(OH)2D3 на поверхні клітин, які реагують на інсулін, що збільшує кількість IR. Відповідно, правильна передача сигналів інсуліну забезпечується регуляцією гена IR [116]. Дефіцит вітаміну D спричиняє інсулінорезистентність через зниження експресії ІР. У тварин із стрептозоцин-індукованим діабетом добавки вітаміну D посилювали експресію IR у печінці [117].
Метааналіз 20 досліджень, які включали 2703 учасників, показав, що добавки вітаміну D значно покращили сироваткові рівні 25(OH)D та HOMA-IR [118]. Інший метааналіз включав 19 РКД (група втручання: n=747, група плацебо: n=627).
У групі короткочасного прийому вітаміну D виявлено покращення показників HbA1c, інсулінорезистентності й інсуліну порівняно з групою плацебо. Проте тривале спостереження після прийому добавок вітаміну D не асоціювалося із серйозними позитивними ефектами. Автори дійшли висновку, що вітамін D може бути додатковою терапевтичною мішенню при діабеті [119]. Аналіз 8 досліджень за участю 4896 осіб виявив значне зниження ризику, пов’язаного з діабетом 2 типу, завдяки прийому вітаміну D в осіб без ожиріння та відсутність аналогічного ефекту в осіб з ожирінням. Прийом харчових добавок вітаміну D асоціювався з поверненням нормоглікемії в осіб із предіабетом [120].
Ожиріння, вплив добавок на втрату маси тіла
Активна форма вітаміну D пригнічує адипогенез через VDR та інгібування диференціації преадипоцитів [121, 122]. Окрім того, 1,25(OH)2D3 може підтримуватися шлях WNT/β-катеніну, що пригнічує адипогенез [123].
Два дослідження довели, що низькі концентрації вітаміну D сприяють більшому приросту маси тіла, ніж у людей із вищими рівнями вітаміну D [124, 125]. У 34 крос-секційних дослідженнях установлено слабку, але статистично значущу обернену кореляцію між рівнем вітаміну D й індексом маси тіла (ІМТ) [126]. Причинно-наслідковий зв’язок між рівнем вітаміну D й ожирінням досліджував великий метааналіз, який включав 21 популяційне дослідження за участю 42 024 осіб [127]. Двосторонній менделівський аналіз великих когорт указує, що ожиріння може призвести до низького рівня вітаміну D, але не навпаки. Збільшення ІМТ на 1 кг/м2 асоціювалося зі зниженням 25(OH)D на 1,15% після врахування таких чинників, як вік і стать. У метааналізі, який включав 12 обсерваційних досліджень, виявлено зв’язок між ожирінням (ІМТ >30 кг/м2) та дефіцитом і недостатністю вітаміну D у всіх вікових групах [128]. Інший метааналіз, який включав 23 обсерваційні дослідження, також виявив, що дефіцит вітаміну D на 24% частіше виникає в людей із надмірною масою тіла та на 35% частіше в людей з ожирінням, аніж в осіб із нормальною масою тіла, проте пацієнти з морбідним ожирінням були виключені з аналізу [129]. Встановлено також, що низьке утворення вітаміну D пов’язане з ожирінням незалежно від географічної широти, віку, критеріїв дефіциту та рівня розвитку країни.
Значна кількість інтервенційних клінічних досліджень продемонструвала вплив добавок вітаміну D на ожиріння, за останні роки опубліковано 8 метааналізів на цю тему [25]. Метааналіз, який включав 12 РКД, досліджував вплив добавок на ожиріння за відсутності обмеження калорій [130]. Учасниками переважно були дорослі, два дослідження також включали дітей віком понад 10 років. Групи втручання застосовували різні дози кальцитріолу: 20-7000 МО щодня, 20 000-40 000 МО щотижня, 50 000 МО що 20 днів або 120 000 МО тричі що 2 тижні. Дослідження проводилися від 1 місяця до 3 років. Метааналіз не показав статистично значущого зменшення жодного показника ожиріння внаслідок прийому добавок. На масу тіла також не вплинула зміна концентрації вітаміну D порівняно з початковим рівнем або досягнення нормального статусу вітаміну D. Проте 8 РКД показали зниження ІМТ, яке не було статистично значущим і частіше спостерігалося в молодих людей і жінок [130]. Інший метааналіз (26 РКД, 42 430 дорослих, 12 місяців застосування вітаміну D3 у добових дозах 300-12 695 МО з або без кальцію) не показав значущих покращень щодо маси тіла, ІМТ або маси жиру [131]. У метааналізі, який включав 9 РКД та 1586 дорослих з ожирінням, було продемонстровано, що додавання вітаміну D не впливає ні на масу тіла, ні на ІМТ [132].
Отже, епідеміологічні дослідження, систематичні огляди та когортний аналіз указують, що знижений рівень вітаміну D є поширеним явищем у дорослих з ожирінням. Утім, точний механізм впливу вітаміну D на патогенез ожиріння та причинно-наслідкові зв’язки між недостатністю вітаміну D і надмірною масою тіла остаточно не встановлені. Можливо, механізми зв’язку низьких рівнів 25(OH)D з ожирінням будуть краще зрозумілі після отримання результатів молекулярних досліджень гена CYP2R1, VDR, адипогенезу й адиполізу [133].
Висновки
- На сьогодні з’являється дедалі більше доказів щодо патогенетичної ролі вітаміну D за багатьох ендокринних хвороб, зумовлених його протизапальними, муномодулювальними, протипухлинними та метаболічними властивостями (рис. 7).
- У пацієнтів з ендокринною патологією частіше, ніж у здорових осіб, спостерігається дефіцит або недостатність вітаміну D.
- Реалізація нескелетних ефектів вітаміну D потребує застосування високих доз.
- Терапевтичне застосування вітаміну D обґрунтоване за таких автоімунних станів, як ТХ, ХГ та ЦД 1 типу.
На фармацевтичному ринку України доступний ефективний вітчизняний препарат вітаміну D Відеїн 20 000 МО (виробник – АТ «Київський вітамінний завод»), що містить 500 мкг холекальциферолу та відкриває додаткові можливості ефективного лікування автоімунно-запальних ендокринних захворювань.

Література – в редакції.
