Роль фебуксостату при подагрі
Переклала й адаптувала канд. мед. наук Тетяна Можина
Схвалення у 2009 р. фебуксостату розширило вибір ліків, які лікарі можуть використовувати для корекції гіперурикемії при подагрі. Це також зменшило кількість пацієнтів, рефрактерних до наявних пероральних уратознижувальних препаратів (УЗП). Американська колегія ревматологів (ACR) радить алопуринол або фебуксостат як препарати першої лінії уратознижувальної терапії, а практичні настанови Європейської протиревматичної ліги (EULAR) рекомендують фебуксостат як терапію другої лінії для пацієнтів, які не переносять алопуринол [1, 2]. Нещодавні дослідження викликали занепокоєння щодо ризику серцево-судинних (СС) подій серед пацієнтів, які приймають фебуксостат; це призвело до переоцінки його місця серед пероральних УЗП, які використовуються для лікування подагри.
Порівняння алопуринолу та фебуксостату
Фармакологія
Фебуксостат зменшує утворення сечової кислоти (СК) шляхом потужного та селективного інгібування обох форм ферменту ксантиноксидази. Фебуксостат неконкурентно блокує активність двох форм ферменту шляхом зв’язування з їхнім активним центром [3], тоді як оксипуринол, активний метаболіт алопуринолу, діє як конкурентний інгібітор відновленої форми ксантиноксидази.
Фебуксостат є похідним 2-арилтіазолу, що не впливає на синтез пуринів, тоді як алопуринол структурно зв’язаний із пуринами та знижує їхній синтез у пацієнтів зі збереженою активністю гіпоксантингуанінфосфорибозилтрансферази. Пероральна абсорбція та період напіввиведення фебуксостату й алопуринолу дають змогу призначати ці препарати перорально 1 раз на добу [3, 4]. Близько 49% прийнятої дози фебуксостату виводиться із сечею, 45% – із калом [3]. Корекція дози фебуксостату у хворих похилого віку або пацієнтів із легким/помірним порушенням функції нирок (кліренс креатиніну – 30-89 мл/хв), легкою/помірною печінковою недостатністю (клас А/В за класифікацією Чайлда – П’ю) не потрібна. Пацієнтам із кліренсом креатиніну <30 мл/хв фебуксостат не рекомендований, хоча згідно з даними нещодавніх короткотривалих ретроспективних досліджень він може зберігати свою активність [5-7]. Близько 80% алопуринолу виводиться із сечею, здебільшого у вигляді оксипуринолу [4], який накопичується в пацієнтів із хронічною хворобою нирок (ХХН); це може спричиняти виникнення тяжких шкірних побічних реакцій (ШПР) і призвело до рекомендації обмеженого дозування алопуринолу у хворих на ХХН [8]. Нирковий транспортер уратів-1 (URAT1) бере участь у канальцевій реабсорбції оксипуринолу [9] й урикозуричних препаратів шляхом інгібування URAT1, збільшує ниркову екскрецію оксипуринолу [10]. Оскільки фебуксостат не є пурином, урикозуричні препарати не впливають на його концентрацію в плазмі крові, а комбінація фебуксостату з урикозуриком вважається особливо ефективною.
Ефективність
Фебуксостат є потужним УЗП, про що свідчать результати випробувань «Алопуринол- і плацебо-контрольоване дослідження ефективності фебуксостату» (APEX), «Дослідження фебуксостату проти алопуринолу» (FACT), а також дані рандомізованого контрольованого дослідження CONFIRM [11-13]. У дозах 80 і 120 мг/добу фебуксостат перевершує фіксовану дозу алопуринолу 300 мг/добу. Проте ці дослідження не продемонстрували перевагу фебуксостату над алопуринолом, оскільки дозу алопуринолу обмежували 300 мг/добу, а отже, отримані дані не відображали реальну клінічну практику, в якій дозування алопуринолу може бути збільшене до 800 мг у США та до 900 мг у Європі (www.micromedexsolutions.com). Незважаючи на те що дози >300 мг/добу застосовуються нечасто [14], кілька досліджень продемонстрували збільшення ймовірності досягнення цільового рівня урикемії, якщо алопуринол титрували вище 300 мг/добу [15-17].
Переносимість
Найчастішими клінічними побічними ефектами фебуксостату й алопуринолу є ШПР. Частота доброякісних шкірних реакцій на фебуксостат оцінена в 5,2% (95% довірчий інтервал (ДІ) 2,1-10,5%) у дослідженнях ІІІ фази реєстраційного досьє [18]. Шкірна непереносимість алопуринолу, що існувала раніше, здатна підвищити ризик розвитку ШПР [19]. У клінічній практиці, в якій побічні ефекти можуть бути недооцінені, частота легких ШПР на алопуринол зазвичай оцінюється у 2-8% [20]. У невеликому дослідженні, проведеному в HLA-B5801-негативних хворих на подагру, частота виникнення ШПР на фебуксостат (5,6%) й алопуринол (16,4%) вірогідно не відрізнялася (р=0,12) [21].
Занепокоєння щодо СС-безпеки фебуксостату виникли у зв’язку з дослідженнями APEX і FACT, у яких зафіксовано чисельно більшу частоту СС-подій, про яку повідомляли дослідники, при застосуванні фебуксостату порівняно з алопуринолом [11, 12]. Однак однозначного висновку зробити не вдалося, оскільки виявлені відмінності не мали статистичної вірогідності. Європейське агентство з лікарських засобів (EMA) схвалило прийом фебуксостату в дозах 80 і 120 мг/добу, але зазначило, що фебуксостат не рекомендується застосовувати в пацієнтів з ішемічною хворобою серця, застійною серцевою недостатністю та підкреслило необхідність проведення післяліцензійного порівняльного дослідження СС-безпеки фебуксостату й алопуринолу. Це випробування під назвою FAST («Фебуксостат проти алопуринолу: оптимізоване дослідження») досі триває [33]. Управління з контролю харчових продуктів і лікарських засобів США (FDA) провело додаткове 6-місячне рандомізоване контрольоване дослідження CONFIRM, у якому порівнювали фебуксостат (40 і 80 мг/добу) з алопуринолом у пацієнтів із подагрою (n=2269), більшість з яких мали супутні захворювання нирок або СС-захворювання (ССЗ): зафіксовані несприятливі СС-події не відрізнялися в 3 групах [13]. FDA схвалило прийом препарату в дозах 40 і 80 мг/добу, але рекомендувало моніторувати ознаки та симптоми інфаркту міокарда й інсульту, а також наполягала на проведенні післяліцензійного дослідження СС-безпеки. Нещодавно опубліковані результати дослідження «СС-безпека фебуксостату й алопуринолу в пацієнтів із подагрою та ССЗ» (CARES) [34] стали підставою для публікації FDA попередження про громадську та СС-безпеку фебуксостату [35].
CARES являє собою багатоцентрове подвійне сліпе неперехресне дослідження, в котрому взяли участь пацієнти з подагрою та значними ССЗ (n=6190), яких рандомізували для прийому алопуринолу або фебуксостату після стратифікації за функцією нирок. Обидва препарати титрували до досягнення сироваткового рівня СК <6 мг/дл, який було отримано однаковою мірою (69-75%) в обох групах протягом усього дослідження. Первинною кінцевою точкою були комбінована СС-смерть, нефатальний інфаркт міокарда, нефатальний інсульт або нестабільна стенокардія з невідкладною реваскуляризацією. Вторинні кінцеві точки містили окремі компоненти первинної кінцевої точки та додаткові показники безпеки, включаючи смерть від усіх причин.
Пацієнтів спостерігали протягом медіани в 32 місяці. Близько 56,6% пацієнтів припинили лікування передчасно, причому частота передчасного завершення терапії була зіставною в обох групах.
У попередньо проведеному аналізі небажаних подій, що відбулися під час прийому препарату або через 30 днів після припинення лікування, не виявлено жодної різниці в частоті досягнення первинної кінцевої точки (7,8 та 7,7% у групах фебуксостату й алопуринолу відповідно), але СС-смерть вірогідно частіше реєстрували в групі фебуксостату (4,3%) порівняно з групою алопуринолу (3,2%) (р=0,03), смертність від усіх причин також була вище в групі фебуксостату (7,8 проти 6,4%; р=0,04). Цікаво, що в ретроспективному аналізі показники смертності від СС-подій або від усіх причин серед пацієнтів, які продовжували приймати препарат на момент проведення аналізу, не мали статистичної відмінності між групами фебуксостату й алопуринолу. На додаток до високої вірогідності та, ймовірно, неминучого скасування терапії деякі невирішені питання обмежують трактування результатів досліджень: як можна пояснити невідповідність між первинною кінцевою точкою, що була однаковою в обох групах, і значним підвищенням смертності від ССЗ у групі фебуксостату? Чи може це бути простою випадковістю через багаторазове обстеження та відсутність стратифікації тяжкості СС-ризику? Чому велика частка смертей сталася після припинення прийму УЗП? Чи пояснюється це рецидивом гіперурикемії? Незважаючи на ці запитання, котрі поки що залишаються без відповіді, результати дослідження CARES підтримали вибір алопуринолу як інгібітора ксантиноксидази першої лінії для лікування подагри, як зазначено в нещодавній редакційній статті [36]. Інше проспективне когортне дослідження, проведене у хворих на подагру (n=99 744) похилого віку, які нещодавно почали приймати фебуксостат або алопуринол і мали однакову схильність до розвитку подагри, не виявило вірогідної різниці в ризику СС-подій або смертності від усіх причин між цими двома групами [37]. Проте спостерігали тенденцію до зростання ризику смертності від усіх причин у пацієнтів, які приймали фебуксостат понад 3 роки, порівняно з хворими, які застосовували алопуринол понад 3 роки. Із нетерпінням чекаємо на результати дослідження FAST, у якому рандомізацію між алопуринолом і фебуксостатом проводили відповідно до типів попередніх СС-подій [33].
Результати дослідження «Фебуксостат для профілактики церебральних і СС-подій» (FREED) [38] представлені на засіданні Європейського товариства кардіологів (ESC) у 2018 р. та доступні за посиланням www.clinicaltrialresults.org. Пацієнти, включені в дослідження, проведення котрого було ініційоване дослідниками, мали безсимптомну гіперурикемію (СК >7 і <9 мг/дл), вік ≥65 років, високий ризик розвитку СС- і церебральних хвороб, оскільки вони лікувалися від гіпертонії чи цукрового діабету 2 типу, або мали ХХН зі швидкістю клубочкової фільтрації (ШКФ) <60 і >30 мл/хв/1,73 м2, або раніше страждали на СС- чи церебральні хвороби [38]. Близько 1084 пацієнтів включили в дослідження та рандомізували в групу фебуксостату (починаючи з 10 мг/добу з наступним збільшенням до 40 мг/добу за рівня урикемії >2 мг/дл) і групу без фебуксостату (хворим дозволено приймати алопуринол 100 мг/добу; його отримували 27% пацієнтів групи без фебуксостату). Рандомізацію проводили за віком, ШКФ, цукровим діабетом, наявністю в анамнезі СС- або церебральних подій. Первинною кінцевою точкою була комбінована смерть від СС- або церебральних подій, уперше виниклий або рецидивний нефатальний інфаркт мозку або міокарда / нестабільна стенокардія, серцева недостатність, що потребувала госпіталізації, атеросклеротична хвороба, що потребувала лікування, ниркова недостатність і фібриляція передсердь. Дослідження тривало 36 місяців і характеризувалося високим рівнем відсіву учасників (61 і 65% у групі фебуксостату та без фебуксостату відповідно). Первинної кінцевої точки в групі фебуксостату та без фебуксостату досягли 23,3 та 28,7% пацієнтів відповідно (відношення ризиків (ВР) 0,750; 95% ДІ 0,59-0,95; р=0,017), при цьому сприятливий ВР корелював зі ступенем зниження урикемії. Щодо вторинних результатів дослідження: не виявлено різниці в показниках смертності від СС- або церебральних причин, а єдину статистично значущу відмінність спостерігали в нирковому результаті, який був краще в групи фебуксостату (ВР 0,745; 95% ДІ 0,56-0,087; р=0,041). Ці результати навряд чи можна порівняти з даними, отриманими в дослідженні CARES, оскільки включені пацієнти істотно відрізнялися (безсимптомна гіперурикемія у FREED, подагра в CARES), але вони свідчать про те, що зниження урикемії асоціюється з кращими СС- і церебральними наслідками, – гіпотеза, котра не аналізувалася в дослідженні CARES, у якому не було групи плацебо.
У клінічній практиці
На нашу думку, порядок призначення пероральних УЗП у разі подагри має залежати від наявності або відсутності чинників ризику непереносимості алопуринолу.
- Ми вважаємо, що алопуринол має бути УЗП першої лінії в пацієнтів із подагрою за умови відсутності попередньої непереносимості алопуринолу, походження з етнічних популяцій із низькою поширеністю HLA-B5801 (рис. 1). Хоча в рекомендаціях ACR рекомендовано як фебуксостат, так і алопуринол як препарати першої лінії урикозуричної терапії, опубліковане FDA попередження про громадську безпеку змусило нас рекомендувати алопуринол як єдиний інгібітор ксантиноксидази першої лінії для наших пацієнтів [36], незважаючи на певну невизначеність. Алопуринол слід починати з низьких доз (50-100 мг/день) і поступово титрувати до досягнення цільового рівня СК, або максимально допустимого рівня кліренсу креатиніну, або максимально дозволеної дози – залежно від того, яка настанова (ACR або EULAR) застосовується.
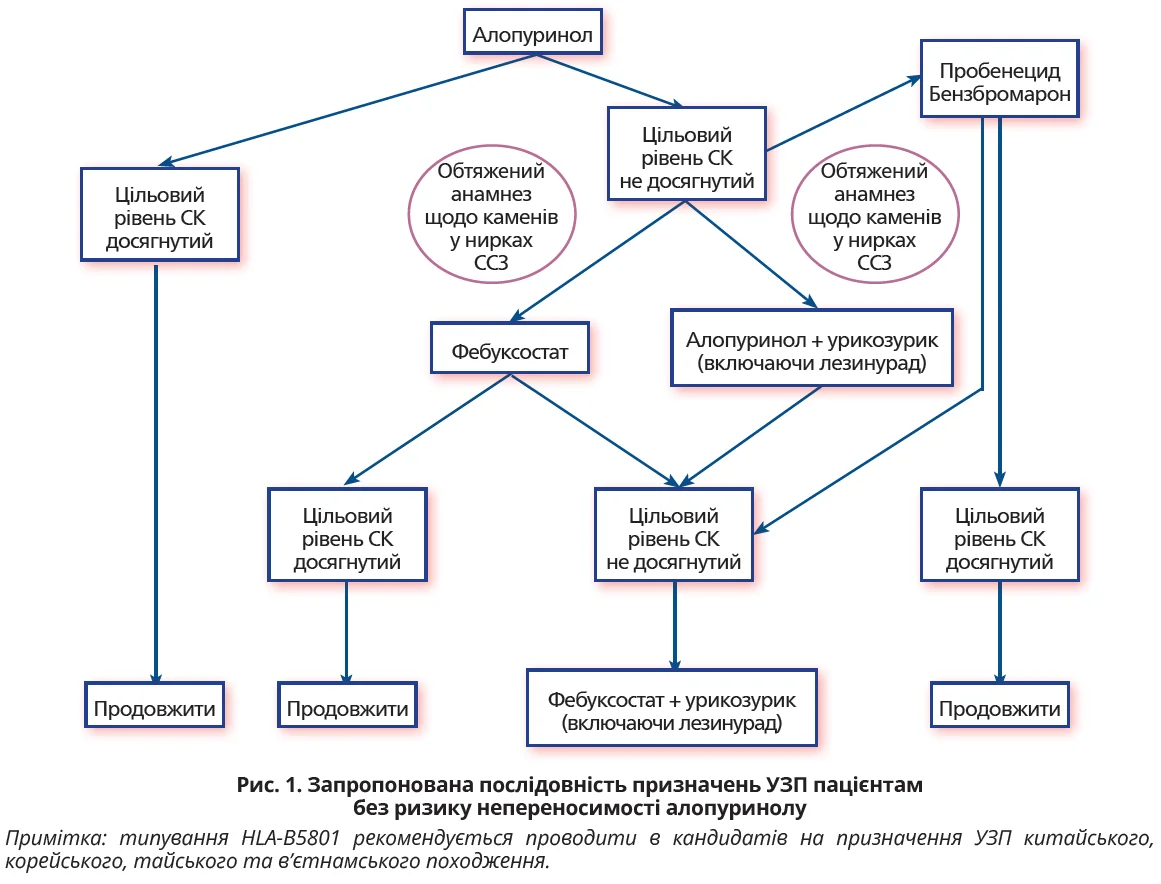
Якщо цільовий рівень СК не досягається прийомом алопуринолу, вибір має визначатися супутніми захворюваннями й обговорюватися з пацієнтом.
Ми вважаємо, що в разі СС- або цереброваскулярних захворювань варто додати урикозуричний препарат, за потреби поступово збільшуючи дозування до максимальної допустимої дози.
Якщо пацієнт не має серйозних ССЗ або чинників ризику, інсульту в анамнезі, може бути рекомендований перехід на фебуксостат, починаючи із 40 мг/добу з наступним поступовим титруванням, особливо при ХХН. Якщо монотерапія фебуксостатом не сприяє досягненню цільової урикемії, поінформованому пацієнту слід запропонувати комбінацію урикозуричного препарату з фебуксостатом.
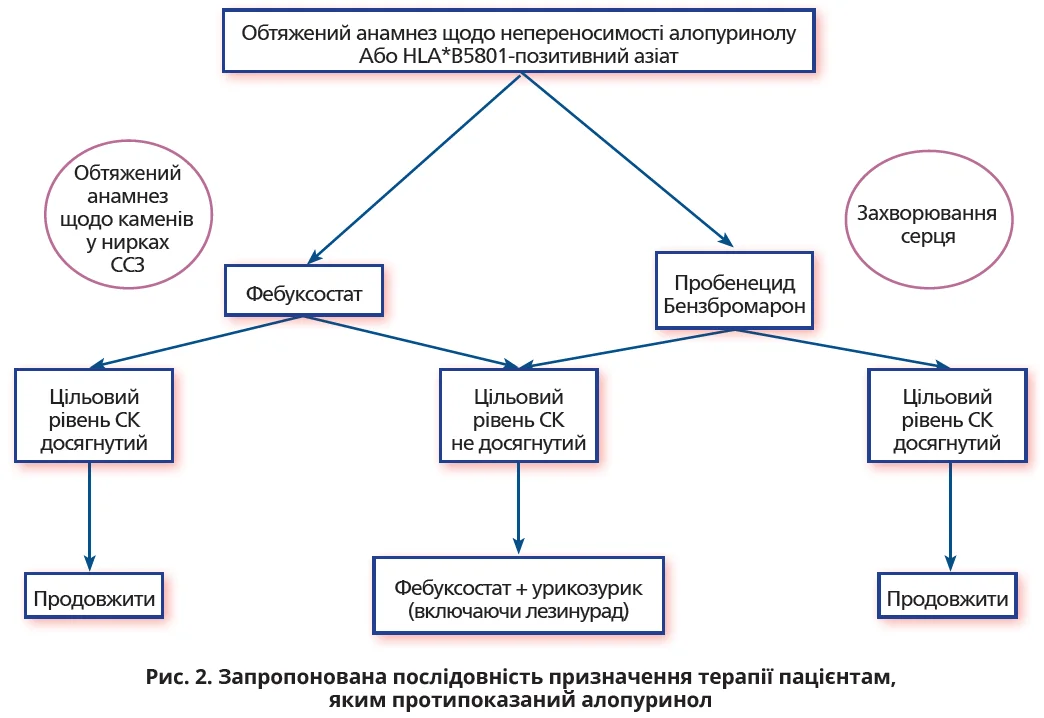
- Пацієнтам, яким протипоказаний алопуринол, варто призначити урикозурик або фебуксостат з урахуванням супутніх захворювань (рис. 2). Якщо цільова урикемія не досягається шляхом прогресивного підвищення дозування до максимально допустимої дози, то з пацієнтом слід обговорити комбінований прийом фебуксостату з урикозуричним засобом (рис. 2).
Висновок
Фебуксостат залишається корисним доповненням до УЗП, доступних для лікування подагри, та зменшує кількість пацієнтів, рефрактерних до пероральної уратознижувальної терапії. Проте нещодавнє посилення занепокоєння щодо СС-толерантності призводить до обмеження його ролі в лікуванні подагри.
Вітчизняний виробник «Київський вітамінний завод» презентує одразу два препарати, які можуть бути використані для корекції гіперурикемії та лікування подагри: фебуксостат під торговою назвою Подафеб і алопуринол, відомий як Алопуринол-КВ. Намагаючись забезпечити максимальну доступність ліків, які переконливо довели свої ефективність і безпечність у нормалізації рівня СК у сироватці крові, «Київський вітамінний завод» використовує всі ресурси та можливості не тільки для вироблення якісних препаратів, а й для використання їх у широкого кола пацієнтів.
Подафеб (фебуксостат) і Алопуринол-КВ (алопуринол) випускаються в таблетованій формі, мають невеликий розмір, зручні для ковтання. Ці препарати комфортно й легко використовувати завдяки наявності різного дозування: таблетки Подафеб, укриті плівковою оболонкою, представлені в дозах 80 і 120 мг, Алопуринол-КВ – 100 та 300 мг. Подафеб і Алопуринол-КВ мають зручний режим застосування, що передбачає одноразовий прийом протягом доби, але за потреби використання високих доз алопуринолу (понад 300 мг) добова доза Алопуринол-КВ може бути розділена на два прийоми.
Треба зазначити, що препарат Подафеб пройшов дослідження біоеквівалентності, відповідає оригінальній молекулі та є єдиним фебуксостатом українського виробника повного циклу виробництва. Якість Алопуринолу КВ підтверджена роками, він активно використовується як препарат першої та другої ліній терапії гіперурикемії завдяки переконливо доведеним ефективності та безпеці.
Література
Bardin T. The role of febuxostat in gout. Curr. Opin. Rheumatol. 2019; 31 (2): 152-158. doi: 10.1097/BOR.0000000000000573.
