Реферативний огляд клінічних практичних настанов 2023 р. Європейського товариства ендокринології в співпраці з Європейською мережею з вивчення пухлин надниркових залоз щодо лікування інциденталом надниркових залоз
Продовження. Початок у попередньому номері.
Формулювання й обґрунтування рекомендацій
- Загальні зауваження
- Рекомендація 1.1. Обговорення на зборах МДК за участю радіолога, ендокринолога та хірурга зі значним досвідом лікування пухлин наднирників рекомендується для пацієнтів з інциденталомами наднирників за наявності принаймні одного з таких критеріїв:
– результати візуалізації не відповідають доброякісній пухлині;
– є докази надлишку гормонів: MACS у пацієнтів із клінічно значущими супутніми хворобами, пов’язаними з кортизолом;
– розглядається операція на надниркових залозах;
– докази значного росту пухлини під час контрольної візуалізації.
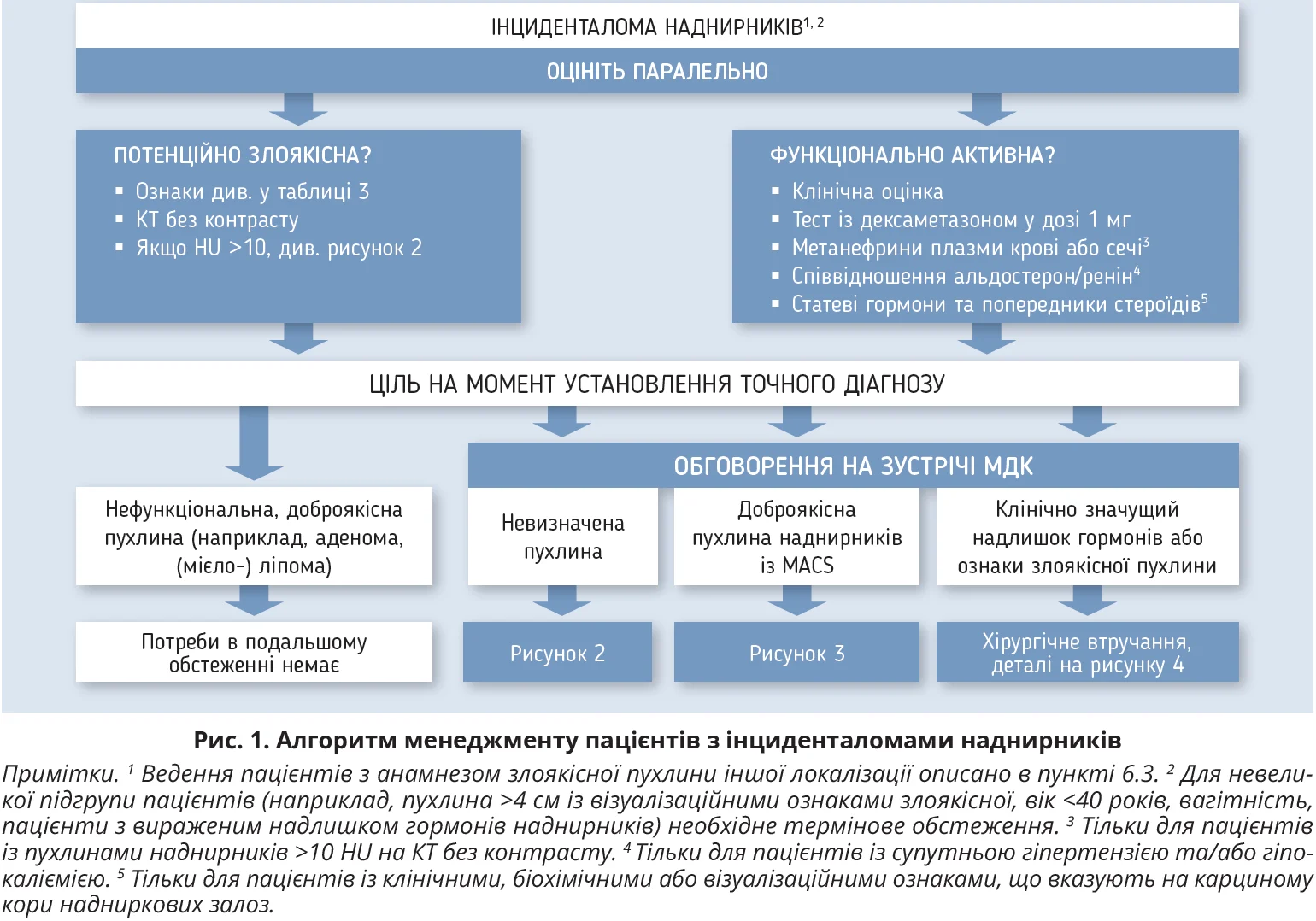
Обґрунтування: робоча група вважає, що ведення пацієнтів з інциденталомами має здійснювати МДК за участю ендокринолога, онколога й анестезіолога з досвідом лікування пухлин наднирників, хоча в багатьох закладах охорони здоров’я це нереалістичний сценарій. Визначено підгрупи пацієнтів, які, найімовірніше, матимуть користь від МДК. Для забезпечення якісної стандартизованої допомоги спеціалізований центр має встановити стандарти діагностики та лікування. Робоча група пропонує алгоритм менеджменту пацієнтів з інциденталомами наднирників (рис. 1).
-
Оцінка ризику злоякісної пухлини
- Рекомендація 2.1. Рекомендується якомога точніше встановлення доброякісності або злоякісності пухлини наднирників під час початкового виявлення.
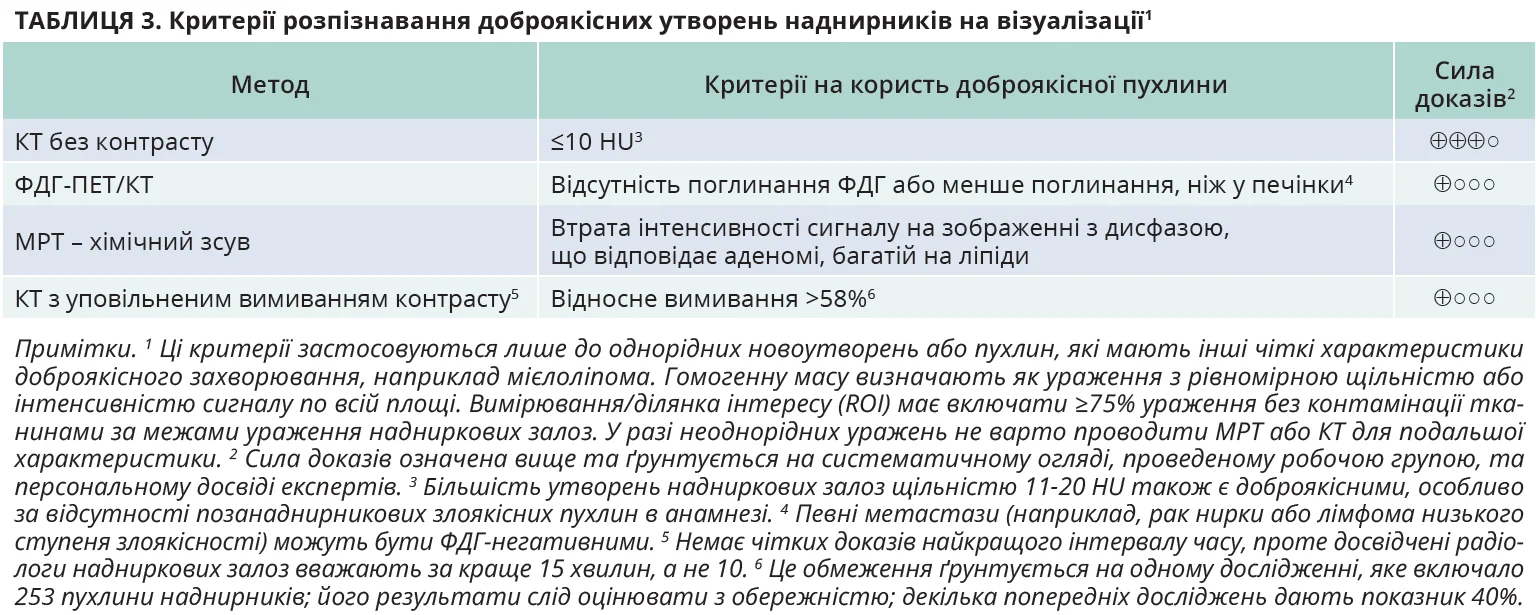
- Рекомендація 2.2. Рекомендується, щоб усі інциденталоми наднирників пройшли процедуру візуалізації для визначення ознак доброякісності – гомогенне утворення, багате на ліпіди (ÅÅÅ○). Із цією метою рекомендується виконати КТ без контрасту як перший метод візуалізації, якщо КТ ще не виконувалася (ÅÅÅ○).
- Рекомендація 2.3. Рекомендується не проводити додаткових методів візуалізації, якщо КТ без контрасту відповідає ознакам доброякісної пухлини наднирників: гомогенне утворення ≤10 HU (ÅÅÅ○).
- Рекомендація 2.4. Якщо КТ демонструє однорідну пухлину наднирників, 11-20 HU та розміром <4 см, а результати гормонального дослідження не вказують на значущий надлишок гормонів, пропонується негайна додаткова візуалізація, щоб уникнути будь-якої подальшої візуалізації (Å○○○). Альтернативно можна провести візуалізацію методом КТ (або МРТ) без контрасту через 12 місяців.
- Рекомендація 2.5. Якщо пухлина наднирників ≥4 см, неоднорідна чи >20 HU, існує певний ризик злоякісності. Тому такі випадки треба обговорювати на зборах МДК. Здебільшого лікуванням вибору буде негайна операція, але для деяких пацієнтів варіантом може бути додаткова візуалізація (Å○○○). Перед операцією пропонується визначити стадію, виконавши принаймні КТ грудної клітки та/або ФДГ-ПЕТ/КТ (Å○○○). Якщо хірургічне втручання не проводилося, рекомендується повторна візуалізація через 6-12 місяців (Å○○○).
- Рекомендація 2.6. Якщо пухлина наднирників не відповідає жодній із вищевказаних категорій (наприклад, пухлина 11-20 HU ≥4 см; або <4 см і >20 HU; або неоднорідна <4 см), пропонується індивідуальний підхід з обговоренням на зборах МДК (Å○○○). Імовірність злоякісності все ще низька. Тому зазвичай кращим варіантом є негайна додаткова візуалізація відповідно до досвіду та можливостей центру. Якщо пухлина все ще невизначена й операція не проводиться, рекомендується повторна візуалізація через 6-12 місяців методом КТ/МРТ без контрасту (Å○○○).
- Рекомендація 2.7. Під час діагностичного обстеження пацієнтів із новоутвореннями наднирників рекомендується не проводити біопсію наднирників за відсутності злоякісної пухлини поза наднирниками в анамнезі (див. рекомендацію 6.3.5).
- Рекомендація 2.8. Для пацієнтів із підозрою на карциному кори наднирників за клінічними ознаками або після візуалізації пропонується визначення статевих стероїдів і попередників стероїдогенезу, в ідеалі проведення мультистероїдного профілювання за допомогою тандемної мас-спектрометрії (ÅÅ○○).
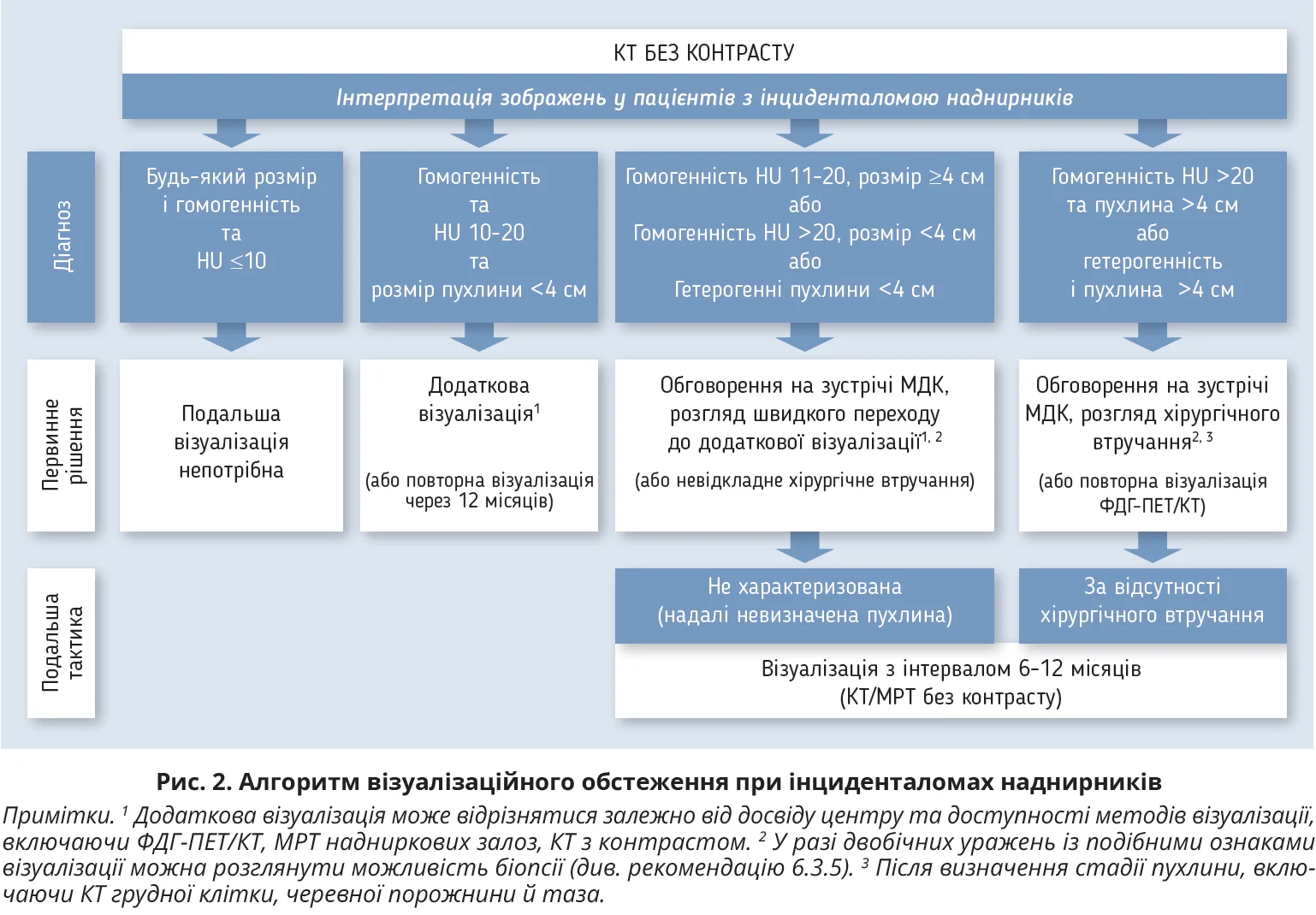
Обґрунтування: визначення злоякісності виявленої пухлини наднирників украй важливе для оцінки методу та невідкладності лікування. Усі зображення пацієнтів з інциденталомами наднирників має переглядати досвідчений радіолог, звертаючи увагу на стан іншої залози, яка часто також змінена (гіперплазія, вузли). У разі будь-яких сумнівів краще поводити обговорення на зустрічі МДК. Робоча група підсумовує критерії доброякісної пухлини наднирників, які можна отримати при різних методах візуалізації (табл. 3), і пропонує алгоритм візуалізаційного обстеження (рис. 2).
З’являється дедалі більше доказів, що в пацієнтів без анамнезу злоякісної пухлини іншої локалізації >90% гомогенних утворень наднирників щільністю 11-20 HU є доброякісними. Зрідка такі радіологічні характеристики можуть мати певні метастази й адренокортикальні карциноми. Тому, якщо візуалізація виявляє пухлину 11-20 HU розміром <4 см без гормональної активності, насамперед потрібно виконати додаткову візуалізацію (табл. 3). Якщо результати вказуватимуть на доброякісне ураження, подальша візуалізація не потрібна. Потенційно злоякісними вважаються пухлини ≥4 см, >20 HU або неоднорідні. У разі пухлин, які відповідають обом категоріям, імовірність злоякісного ураження в когорті інциденталом сягає 50%. Тому такі випадки потребують обговорення МДК та хірургічного втручання. Перед операцією потрібно визначити стадію пухлини, оскільки це впливає на вибір тактики лікування. Для цього обов’язково проводять КТ грудної клітки, оскільки карцинома кори наднирників відносно часто метастазує в легені.
Іноді пухлина не відповідає жодній із категорій, указаних на рисунку 2. Ґрунтуючись на власному досвіді та доступній літературі, робоча група вважає, що ризик злоякісності в цій підгрупі невисокий, але вищий, аніж у разі пухлин 10-20 HU розміром <4 см. Тому додаткове обстеження видається доречнішим, аніж негайне хірургічне втручання. Більшість експертів вважають, що діагностичне значення ФДГ-ПЕТ/КТ у таких випадках вище, ніж МРТ або КТ. Перевагою ФДГ-ПЕТ/КТ є низький ризик хибнонегативних результатів. Проте ця процедура є значно дорожчою та не завжди доступною; крім того, деякі доброякісні пухлини (наприклад, функціональні аденоми наднирників) можуть бути ФДГ-позитивними. Якщо додаткове зображення свідчить про злоякісну пухлину, рекомендується хірургічне втручання. Якщо новоутворення все ще невизначене, але хірургічне втручання не проводиться, рекомендується повторне обстеження через 6-12 місяців.
Багатообіцяльною альтернативою з високою специфічністю для карциноми кори наднирників є оцінка метаболоміки стероїдів у сечі за допомогою тандемної мас-спектрометрії. У проспективному дослідженні за участю 2017 пацієнтів з інциденталомою наднирників позитивна прогностична цінність цього методу становила 76,4%; негативна прогностична цінність – 99,7%.
Що стосується повторної оцінки пухлин, то деякі учасники робочої групи віддають перевагу проведенню двох візуалізацій – через 6 і 12 місяців. Чітких критеріїв щодо змін розміру чи об’єму, які вказували б на злоякісну пухлину, немає. Тому робоча група погодилася з використанням критеріїв RECIST 1.1: підозрілим варто вважати збільшення найбільшого діаметра пухлини >20% разом зі збільшенням цього діаметра принаймні на 5 мм. За відсутності змін у розмірі додаткові зображення не потрібні.
Біопсія має обмежену роль в оцінці пухлин наднирників. Здебільшого це діагностика позанаднирникових злоякісних пухлин, лімфоми, саркоми, інфільтративного або інфекційного процесу. Навіть у таких ситуаціях біопсію наднирників мають виконувати досвідчені фахівці після виключення феохромоцитоми та в разі, коли результати біопсії впливатимуть на рішення щодо лікування. Робоча група особливо наголошує, що біопсію не варто проводити за підозри на карциному кори наднирників через ризик дисемінації пухлини та погіршення виживання пацієнтів із I-II стадією хвороби.
Більш ніж 50% випадків карциноми кори наднирників призводить до підвищення рівнів статевих гормонів та/або попередників стероїдів. Робоча група не рекомендує рутинне визначення цих гормонів у пацієнтів з інциденталомами наднирників, але в разі невизначених пухлин або за наявності клінічних ознак надлишку андрогенів або естрогену (наприклад, швидка вірилізація в жінок або швидка поява гінекомастії в чоловіків) значне збільшення статевих гормонів або їхніх попередників може чітко вказувати на карциному кори наднирників. Отже, визначення сироваткових рівнів дегідроепіандростерон-сульфату (DHEA-S), андростендіону, 17-гідроксипрогестерону, 11-дезоксикортизолу, а також тестостерону в жінок та естрадіолу в чоловіків і жінок у постменопаузі чітко вказуватиме на адренокортикальну природу новоутворення наднирників.
-
Оцінка надлишку гормонів
- Рекомендація 3.1. Кожному пацієнту з інциденталомою наднирників рекомендується ретельне обстеження, включно з клінічним обстеженням на наявність симптомів та ознак надлишку гормонів надниркових залоз.
- Рекомендація 3.2. Для пацієнтів з інциденталомами надниркових залоз рекомендується провести СТД у дозі 1 мг на ніч, щоб виключити автономну секрецію кортизолу (ÅÅÅ○).
Для немічних пацієнтів з обмеженою очікуваною тривалістю життя цей тест може бути невиправданим. - Рекомендація 3.3. Результати СТД у дозі 1 мг на ніч рекомендується інтерпретувати як кількісний, а не якісний (так/ні) показник (Å○○○).
Як діагностичний критерій для виключення автономної секреції кортизолу рекомендується значення кортизолу в сироватці крові після введення дексаметазону ≤50 нмоль/л [≤1,8 мкг/дл] (ÅÅ○○). - Рекомендація 3.4. У пацієнтів без ознак і симптомів явного синдрому Кушинга концентрацію кортизолу в сироватці крові >50 нмоль/л
(>1,8 мкг/дл) після проведення СТД у дозі 1 мг на ніч рекомендується розглядали як MACS без будь-якої подальшої стратифікації за ступенем непригнічення кортизолу (ÅÅ○○). У таких пацієнтів рекомендується підтвердити незалежність від АКТГ. Для інтерпретації результатів тесту потрібно враховувати умови, які змінюють результати СТД. Рекомендується повторити СТД для підтвердження автономності секреції кортизолу. Корисними можуть бути додаткові біохімічні тести для оцінки ступеня секреції кортизолу. Проте основними чинниками для прийняття клінічного рішення щодо лікування є наявність супутніх захворювань, потенційно пов’язаних із надлишком кортизолу, вік і загальний стан пацієнта. - Рекомендація 3.5. Рекомендується не розглядати пацієнтів із MACS (без специфічних клінічних ознак синдрому Кушинга) як групу високого ризику виникнення явного синдрому Кушинга (ÅÅÅ○).
- Рекомендація 3.6. Для пацієнтів з інциденталомою наднирників і MACS рекомендується проводити скринінг артеріальної гіпертензії, цукрового діабету 2-го типу (ÅÅ○○) та пропонувати відповідне лікування вказаних станів.
- Рекомендація 3.7. Пацієнтам з інциденталомою наднирників і MACS пропонується скринінг
для виявлення переломів хребців (Å○○○) із розглядом відповідного лікування (Å○○○). - Рекомендація 3.8. Рекомендується обговорити можливість хірургічного втручання для пацієнтів із MACS, відповідною коморбідністю й однобічною пухлиною наднирників (Å○○○). Варто брати до уваги вік, стать, загальний стан здоров’я, ступінь і стійкість відсутності пригнічення кортизолу після СТД, тяжкість супутніх захворювань і побажання пацієнта (Å○○○).
В усіх випадках пропозиція щодо проведення хірургічного втручання має бути сформульована мультидисциплінарною командою. - Рекомендація 3.9. Усім пацієнтам із пухлинами наднирників та ознаками, нетиповими для доброякісної аденоми, рекомендується виключити феохромоцитому шляхом вимірювання вільних метанефринів у плазмі крові або фракціонованих метанефринів у сечі.
- Рекомендація 3.10. Пацієнтам із супутньою артеріальною гіпертензією або нез’ясованою гіпокаліємією рекомендується оцінити співвідношення альдостерон/ренін для діагностики первинного альдостеронізму.
Обґрунтування: для виявлення явного надлишку гормонів усі пацієнти повинні бути ретельно обстежені (докладний анамнез, об’єктиве обстеження). Клінічна оцінка та подальші діагностичні процедури при синдромі Кушинга, первинному альдостеронізмі та феохромоцитомі докладно описані в інших настановах. Швидкий початок і прогресування гірсутизму або вірилізації вказують на пухлину, що продукує андрогени; таким пацієнтам потрібно визначити рівні тестостерону та попередників андрогенів DHEA-S, андростендіон. Нещодавня поява гінекомастії потребує оцінки сироваткового рівня 17-β-естрадіолу.
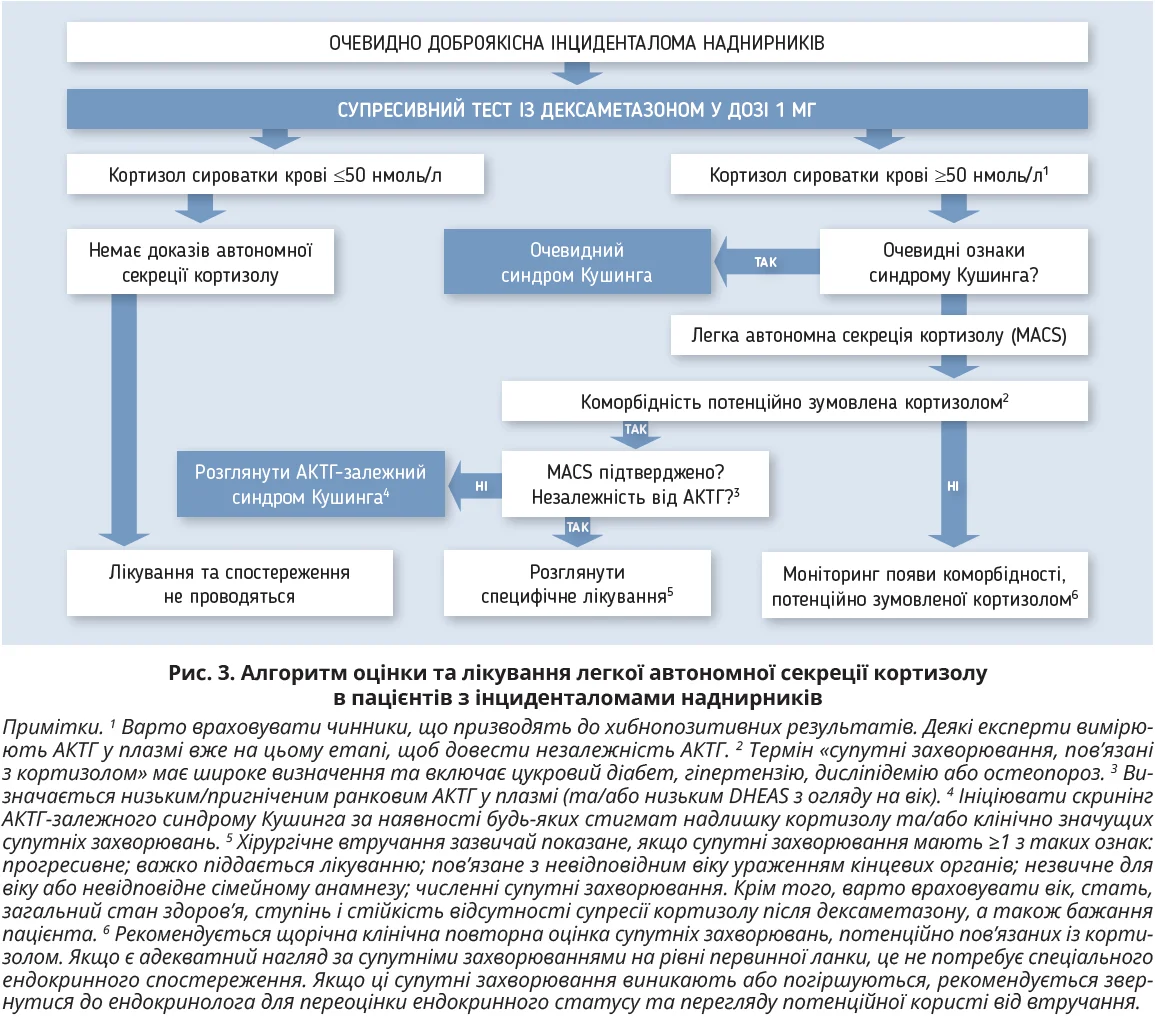
Робоча група пропонує діагностичний алгоритм для оцінки та лікування MACS у пацієнтів з інциденталомами наднирників (рис. 3).
Значення кортизолу 50 нмоль/л (1,8 мкг/дл) після СТД пропонують як точку відсіку, що дає змогу відрізнити автономну секрецію кортизолу від фізіологічної секреції. У деяких дослідженнях пацієнти з відсутністю пригнічення кортизолу після СТД були додатково розподілені на дві категорії: в межах 50-138 нмоль/л (1,9-4,9 мкг/дл) і ≥138 нмоль/л (≥5,0 мкг/дл).
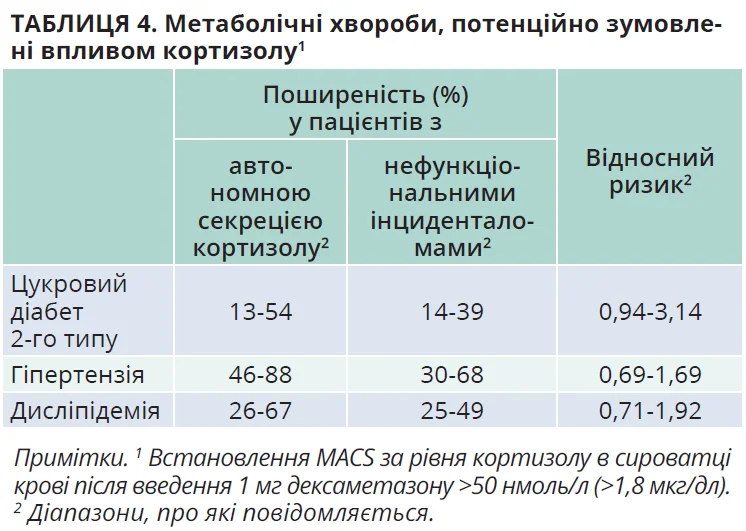
Будь-яке граничне значення кортизолу після СТД має доволі низьку точність для прогнозування поширених супутніх захворювань; однак існує зв’язок між прогресивним підвищенням рівня кортизолу після СТД та більшим ризиком коморбідності. Велике когортне дослідження вказує на значне збільшення смертності лише при значеннях кортизолу після СТД ≥83 нмоль/л (3 мкг/дл). Робоча група постановила: існують переконливі докази того, що рівень кортизолу >50 нмоль/л (>1,8 мкг/дл) диференціює пацієнтів із підвищеним ризиком супутніх захворювань, зумовлених надлишком кортизолу (табл. 4), та смерті.
Робоча група вважає, що попередня стратифікація на «можливу автономну секрецією кортизолу» (рівень кортизолу сироватки крові після СТД у межах 51-138 нмоль/л) й «автономну секрецією кортизолу» (рівень кортизолу >138 нмоль/л) недоцільна, та пропонує термін «MACS». Пацієнти, в яких після СТД рівень кортизолу знижується <50 нмоль/л, не потребують подальшого обстеження або спостереження ендокринолога. Пацієнти з MACS можуть потребувати повторного клінічного обстеження для виявлення ознак явного синдрому Кушинга, які могли бути пропущені під час першого обстеження, та підтвердження незалежності АКТГ шляхом демонстрації пригніченого або принаймні низького нормального ранкового АКТГ у плазмі крові (рис. 3).
Деякі експерти вважають, що визначення рівня DHEA-S у сироватці крові з поправкою на вік і стать корисне для ідентифікації MACS, особливо коли є ризик хибнопозитивного результату СТД, оскільки хронічне пригнічення осі гіпоталамус – гіпофіз – наднирники призводить до зниження DHEA-S. Нещодавно запропоновано новий підхід до діагностики незалежності АКТГ шляхом вимірювання АКТГ після СТД, який потребує перевірки.
Оцінка супутніх захворювань, потенційно пов’язаних із кортизолом (табл. 4), надзвичайно важлива для орієнтації лікування. Проте їх імовірність також зростає у віці після 65 років, як і рівень кортизолу після СТД. Є докази щодо зниження клінічної значущості MACS у пацієнтів після 65 років. Тому в пацієнтів похилого віку рішення треба приймати індивідуально. Зокрема, в слабких пацієнтів документування MACS, найімовірніше, не матиме особливого значення, тому за відсутності явного синдрому Кушинга СТД у цій групі проводити недоцільно. Пацієнтам без пов’язаної з кортизолом коморбідності не показане хірургічне втручання; вони потребують подальшого спостереження щодо появи цих станів. Натомість у пацієнтів із коморбідністю потрібно розглянути можливість втручання (рис. 3).
Деякі експерти вказують на важливість проведення додаткових біохімічних тестів для підтвердження секреторної автономності кортизолу й оцінки ступеня секреції кортизолу, зокрема вимірювання 24-годинного вільного кортизолу в сечі та/або кортизолу в слині пізно вночі. Інші експерти використовують вищі дози дексаметазону в СТД (3, 2×2 або 8 мг), дотримуючись концепції незалежності секреції кортизолу від АКТГ у пацієнтів із MACS. Утім, дані літератури доволі суперечливі й обмежені, щоби зробити певні висновки. Однак через те що результат СТД може бути хибнопозитивним, тест слід повторити всім пацієнтам із MACS, у яких розглядається хірургічне втручання. Додаткове визначення рівня дексаметазону в сироватці крові після СТД може допомогти виключити хибнопозитивні результати СТД через погане всмоктування або підвищений метаболізм дексаметазону.
За даними досліджень, явний синдром Кушинга виникає в <1% пацієнтів з інциденталомами та MACS, але ризик гіпертензії, діабету й дисліпідемії високий. Усі ці стани, спричинені надлишком кортизолу, є незалежними серцево-судинними чинниками ризику. Тому робоча група рекомендує скринінг (артеріальний тиск (в ідеалі амбулаторне вимірювання), HbA1c, холестерин ліпопротеїнів низької та високої щільності, тригліцериди й маса тіла) та відповідне лікування цих стадій за сучасними рекомендаціями. Деякі дослідження виявили вищу частоту безсимптомних переломів хребців у пацієнтів із MACS. Точна оцінка (мікро-) переломів на рентгенівських знімках не завжди можлива в клінічній практиці, тому під час діагностики потрібно виявити принаймні явні переломи, розпитавши пацієнтів про нетравматичні переломи в анамнезі й оцінивши результати КТ або рентгенографії хребта. Оцінка мінеральної щільності кісткової тканини за допомогою рентгенівської абсорбціометрії з подвійною енергією є неоптимальним інструментом для діагностики остеопорозу, спричиненого глюкокортикоїдами, оскільки надлишок глюкокортикоїдів більше впливає на мікроархітектуру кістки, ніж на ареальну мінеральну щільність кісткової тканини. Декілька досліджень із застосуванням неінвазивної радіологічної оцінки мікроархітектури кістки (сканування трабекулярної кістки) виявили якісне погіршення стану кістки при MACS. У зв’язку з тим що цей метод малодоступний, робоча група рекомендує визначення мінеральної щільності кісток у пацієнтів із MACS із клінічною підозрою на остеопороз або за наявності супутніх чинників ризику остеопорозу.
Через відсутність високоякісних доказів робоча група не змогла визначити точні показання до хірургічного втручання в пацієнтів із MACS. Два невеликі рандомізовані дослідження вказують на покращення гіпертензії та гіперглікемії після хірургічного втручання, але оцінка й лікування супутніх захворювань в оперованих і неоперованих пацієнтів після рандомізації не були стандартизовані, що перешкоджає точній оцінці переваг операції. Відсутні дані про вплив хірургічного втручання на смертність або серйозні серцево-судинні події. Отже, рішення про хірургічне втручання має прийматися індивідуально з урахуванням чинників, які пов’язані з результатом: вік пацієнта, ступінь і стійкість автономності кортизолу принаймні у двох окремих оцінках, тривалість і розвиток супутніх захворювань, ступінь їх контролю, наявність і ступінь ураження кінцевих органів. Було погоджено, що операція може бути показана пацієнту з однобічною пухлиною наднирників, рівнем кортизолу після СТД >50 нмоль/л (>1,8 мкг/дл) і наявністю коморбідності, потенційно пов’язаної з кортизолом, яка має ≥1 з таких ознак: 1) прогресивна; 2) важко піддається лікуванню; 3) пов’язана з пошкодженням кінцевих органів, що не відповідає віку; 4) нетипова за віком або невідповідна сімейному анамнезу; 5) множинна. На думку експертів, наявність таких ознак може свідчити про те, що нормалізація автономії кортизолу, ймовірніше, принесе користь прооперованим пацієнтам. Два нещодавні великі дослідження вказують, що смертність пацієнтів із MACS вища в когорті віком до 65 років; в одному з досліджень особливо постраждали жінки <65 років. Відповідно, ці групи пацієнтів потенційно можуть отримати максимальну користь від хірургічного втручання.
Робоча група дійшла згоди: якщо хірургічне втручання розглядається через MACS, потрібно довести незалежність від АКТГ пригніченим або низьким базальним ранковим АКТГ у плазмі. Якщо ні, слід розглянути інші причини надлишку кортизолу. Відсутність пригнічення кортизолу має бути підтверджено шляхом повторення СТД у дозі 1 мг до операції.
Нещодавні дослідження показали, що ймовірність феохромоцитоми в пухлин наднирників ≤10 HU на КТ без контрасту близька до нуля. Тому визначати рівень метанефринів у пацієнтів із чіткими КТ-ознаками аденоми недоцільно.
У пацієнтів із невизначеними ознаками візуалізації феохромоцитому слід виключити навіть за відсутності підозрілих симптомів, особливо якщо планується біопсія або видалення пухлини. Якщо КТ без контрасту не виконується, доцільно вимірювати вільні метанефрини в плазмі крові або фракціоновані метанефрини в сечі.
Далі буде.
Література
Fassnacht M., Tsagarakis S., Terzolo M., Tabarin A., Sahdev A., Newell-Price J., Pelsma I., Marina L., Lorenz K., Bancos I., Arlt W., Dekkers O.M. European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors. European Journal of Endocrinology. 2023 July; 189 (1): G1-G42. doi: 10.1093/ejendo/lvad066.