Радіойодрезистентні метастази диференційованих карцином щитоподібної залози: патогенез, частота, лікувальні можливості
Автор: Б.Б. Гуда, М.В. Остафійчук, І.І. Комісаренко, А.В. Тимків, І.В. Гамезардашвілі, ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ)
Лікування пацієнтів з диференційованим раком щитоподібної залози (ЩЗ) складається переважно з тиреоїдектомії, видалення уражених метастазами лімфатичних вузлів, радіойодтерапії (РЙТ) і гормонального пригнічення тиреотропного гормону шляхом приймання препаратів гормонів ЩЗ. Зазначимо, що для останнього препаратом вибору є Еутирокс – єдиний в Україні левотироксин, який відповідає найжорсткішим специфікаційним вимогам щодо вмісту левотироксину в кожній таблетці [1], завдяки чому гарантується точність дозування, що є вкрай важливим при лікуванні хворих, зважаючи на необхідність пожиттєвого приймання препарату після тотального видалення ЩЗ. Крім того, Еутирокс містить лимонну кислоту, желатин та маніт, які дають змогу зберігати стабільність гормону впродовж 3 років [2].
РЙТ є основою лікування пацієнтів з диференційованим раком ЩЗ після тиреоїдектомії й охоплює: 1) абляційне (знищення залишків ЩЗ для спрощення подальшого спостереження та реалізації прогностичної цінності визначення рівня тиреоглобуліну); 2) ад’ювантне (знищення мікроскопічних субстратів хвороби для зменшення ризику рецидивів і покращення виживання пацієнтів без захворювання); 3) терапевтичне (в разі макроскопічних уражень); 4) діагностичне (за допомогою сканування всього тіла для виявлення локорегіонарних чи віддалених вогнищ пухлини) [3].
Проте певна частка пацієнтів (близько 15%) з рецидивною карциномою мають метастази, які не концентрують радіоактивний йод, що призводить до клінічних проблем і поганого прогнозу для пацієнтів [4]. Хоча 5-річне виживання хворих з метастазами диференційованих карцином ЩЗ становить понад 90%, за зниження чи відсутності поглинання йоду клітинами метастазів на початку РЙТ або поступово під час лікування термін виживання хворих істотно знижується (до 50-60%) при підвищеній частоті рецидивів [5, 6]. Для хворих з віддаленими радіойодрезистентними метастазами 10-річне виживання становить лише 10% з очікуваною тривалістю життя 3-5 років [7].
З метою розроблення методів подолання радіойодрезистентності та відновлення чутливості пухлинних клітин до радіойоду з’ясовують молекулярні механізми, що задіяні в її формуванні [8]. Відомо, що активна концентрація йоду в клітинах ЩЗ залежить від функціонування симпортера натрію/йодиду (NIS) – білкового комплексу в базолатеральній плазматичній мембрані епітеліальних клітин ЩЗ, який транспортує йод усередину клітини [9].
Ця особлива здатність поглинати й організовувати йод притаманна як нормальним, так і пухлинним клітинам ЩЗ (останнім меншою мірою). Для успішної РЙТ, тобто для накопичення тієї кількості радіойоду, яка потрібна для того, щоб він ставав пухлиноцидним і його β-випромінення ефективно руйнувало пухлинні клітини внаслідок активації апоптозу та пошкодження ДНК, необхідні достатня експресія, точна локалізація й активна функція NIS. Зменшення кількості йоду в клітинах відбувається переважно через втрату експресії чи функції NIS [10].
Основними чинниками, що можуть впливати на зниження функціонування NIS, є: генні мутації [11-13], дефекти транспортування радіойоду в клітини ЩЗ [14], порушення механізмів впливу тиреотропного гормону [15], окисно-відновний дисбаланс [16], порушення енергетичного метаболізму [17] та дисфункція імунної системи [18].
У хворих з диференційованим раком ЩЗ можливе формування як первинної, так і вторинної (індукованої) радіойодрезистентності. Первинна пов’язана з виживанням переважно низькодиференційованих клітин із властивою їм низькою авідністю до йоду [19]. Вторинна виникає внаслідок численних курсів РЙТ, використання необґрунтовано низької активності радіойоду, розвитку ефектів глушіння при проведенні діагностичних сканувань, а також раннього використання променевої терапії на післяопераційному етапі [19].
У науковій літературі та практичних рекомендаціях ідентифікація пацієнтів з радіойодрезистентним раком ЩЗ видається складною через відсутність консенсусу щодо його визначення. Більшість публікацій розглядають такі критерії: 1) відсутність будь-якого захоплення радіойоду в усіх ураженнях під час першого сканування всього тіла; 2) втрата поглинання радіойоду після успішних курсів лікування; 3) наявність гетерогенного поглинання, тобто існування авідних і неавідних до радіойоду метастазів; 4) прогресування метастатичного захворювання впродовж 6-12 місяців після останнього лікування радіойодом, незважаючи на поглинання йоду при скануванні після терапії; 5) застосування без успіху максимальної рекомендованої активності радіойоду (22,2 ГБк / 600 мКі) [21]. Передбачити виникнення радіойодрезистентних метастазів до проведення операції та РЙТ складно. Були зроблені певні спроби на цьому шляху, але реальні результати незначні з огляду на їх можливе значення в клінічній практиці.
Встановлено, що метастазування диференційованих карцином ЩЗ починається з утворення метастазів у центральних лімфатичних вузлах шиї та що близько 80% пацієнтів з первинними характеристиками карцином N0 можуть мати мікрометастази цієї локалізації [23]. Це зумовлює пошуки прогностичних чинників ризику метастазування карцином до лімфовузлів центрального відділу шиї. Інформація про наявність «прихованих» метастатичних лімфовузлів центрального компартменту шиї є важливою для стратифікації ризику латеральних метастазів, віддалених метастазів, а також рецидивів, але зв’язок їх з іншими чинниками ризику залишається все ще неясним [23]. Окрім того, досі незрозуміло, як точно оцінити наявність метастазів у лімфовузлах центрального компартменту перед операцією, що важливо для складання плану хірургічного втручання, особливо обсягу лімфатичної дисекції [24].
Особливо важливим це є в разі втрати метастазами авідності до йоду, бо існування радіойодрезистентних метастазів, що виявляють уже після видалення карциноми при проведенні радіойодабляції з наступним скануванням тіла хворого, впливає на ефективність РЙТ. Передбачити до лікування (хірургічного та РЙТ) наявність «прихованих» метастатичних лімфовузлів (особливо в центральному компартменті лімфовідтоку шиї, які в повному обсязі неможливо виявити при проведенні ультразвукового дослідження), за результатами досліджень пухлин категорії N0, неможливо, як і прогнозувати розвиток їх радіойодрефрактерності.
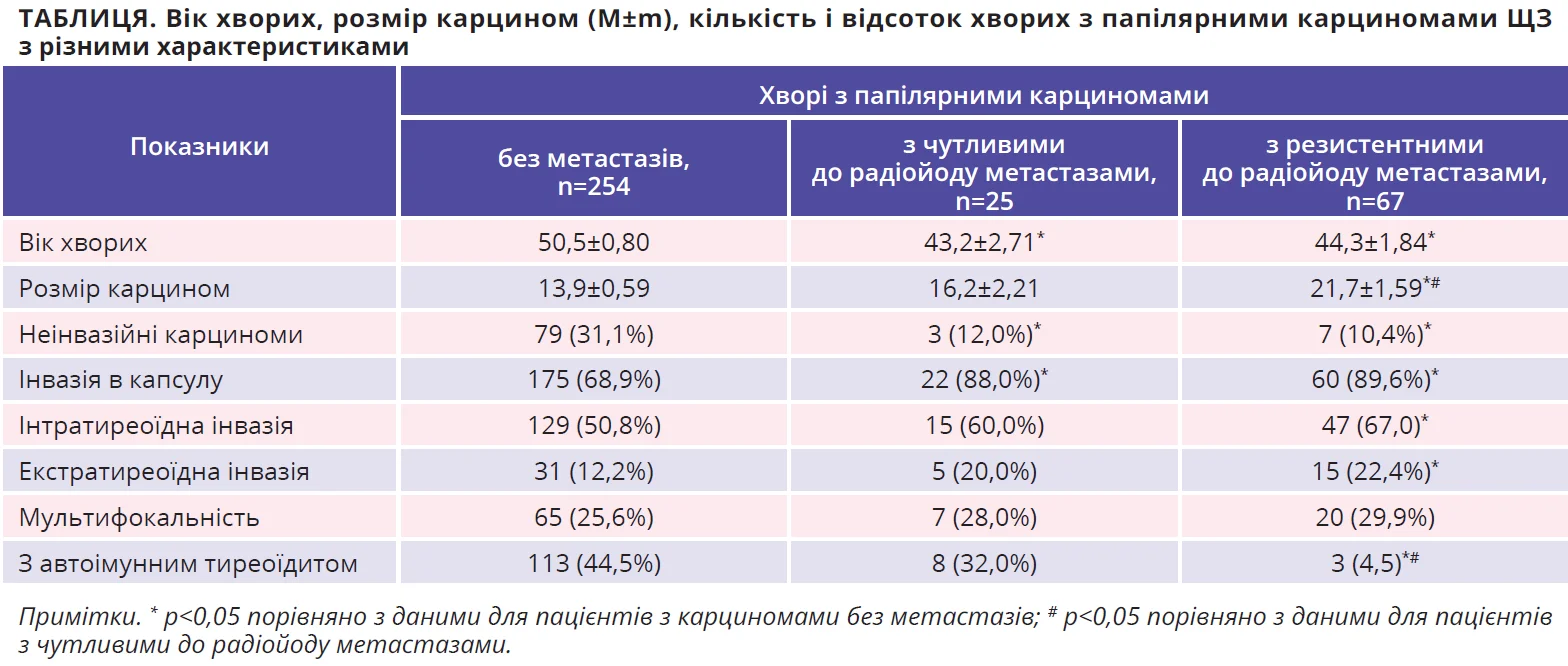
Проводячи дослідження щодо реєстрації кількості видалених метастатичних лімфовузлів різної локалізації, ми встановили, що частка лімфовузлів, уражених метастазами, була однаково високою за карцином категорії N1a та N1ab (тобто переважно в лімфовузлах центрального відсіку шиї хворих). При цьому частка лімфовузлів, уражених радіойодрезистентними метастазами (серед усіх видалених метастатичних лімфовузлів) істотно вища саме за карцином категорії N1a (рис.).
Результати проведених нами досліджень указують на відсутність чітких і специфічних прогностичних доопераційних чинників виникнення саме радіойодрезистентних метастазів, за винятком хіба що розміру карциноми та наявності хронічного автоімунного тиреоїдиту в ЩЗ, які можна певною мірою оцінити за даними доопераційного ультразвукового дослідження (табл.).
У зв’язку з цим реалістичним і логічним видається шлях профілактично-терапевтичного видалення лімфовузлів центрального компартменту шиї одночасно з проведенням тотальної тиреоїдектомії з метою запобігання рецидивам і формуванню прогресивної метастатичної хвороби [25]. Такий підхід підтримує значна кількість дослідників, зазначаючи, що одними з найважливіших умов проведення лімфодисекції є досвід хірурга й адекватне ставлення до рекомендацій і настанов компетентних фахових асоціацій.
Після того як метастази діагностовано як рефрактерні до радіойоду, поточні протоколи рекомендують уникати подальшого його застосування [26]. Терапія рецидивів і метастазів дедиференційованого радіойодрезистентного раку ЩЗ складна. Лікування включає місцеві втручання (хірургічне, абляційне лазерне лікування, зовнішнє променеве опромінення, стереотаксичну радіохірургію, радіочастотну термічну абляцію, трансартеріальну хіміоемболізацію), терапію таргетними препаратами чи радіонуклідну терапію з використанням аналогів соматостатину [26, 27]. Для прийняття рішення про хірургічний доступ потрібні докази структурного, а не біохімічного рецидиву.
Зважаючи на успіх РЙТ як цільової й ефективної терапії для більшості хворих з диференційованим раком ЩЗ, є великий інтерес і сподівання щодо можливості підвищення чи відновлення авідності метастазів до радіойоду. З огляду на знання молекулярної патології проводять спроби повторно диференціювати клітини раку ЩЗ для відновлення експресії NIS і, як наслідок, радіойодавідності, націлюючись, зокрема, на центральні медіатори сигнальних онкологічних шляхів (таргетна терапія) [27-29].
Водночас наразі застосування мультикіназних чи селективних інгібіторів тирозинкіназ може лише стабілізувати, але не вилікувати пухлинний процес, про що свідчить той факт, що в багатьох пацієнтів згодом хвороба прогресує, а до препаратів, які за своєю природою не є пухлиноцидними, виникає резистентність. Зазначають, що жодне специфічне лікування ще не змогло забезпечити повну позитивну відповідь і жодна цільова терапія ще не продемонструвала покращення загального виживання в будь-якій когорті чи підгрупі пацієнтів, які отримували лікування таргетними препаратами в будь-якому з відомих на сьогодні досліджень [як-от 30, 31]. Значна різноманітність генетичних і метаболічних порушень, що спричиняють радіойодрефрактерність [32], неабияк ускладнює реалізацію потенційних терапевтичних стратегій. Цей висновок підтверджено результатами досліджень, які свідчать, що генетичні аномалії в первинній пухлині та метастатичних ділянках можуть бути гетерогенними з появою в метастазах нових мутацій, які не притаманні первинній пухлині [33].
Отже, на сьогодні тактика одночасного виконання тотальної тиреоїдектомії та лімфодисекції центрального компартменту лімфовідтоку шиї є корисною не лише з погляду видалення «прихованих» уражених лімфовузлів, але й для запобігання розвитку їх радіойодрезистентності. Підтримуючи цю хірургічну тактику, ми у своїх дослідженнях показали, що за проведення центральної лімфодисекції частота повторних операцій у 13,9 раза (19,4 та 1,3% відповідно), а їх кількість – у 47 разів (143 та 3) менші порівняно з такими в разі виконання лише тиреоїдектомії [34].
UA-EUTH-PUB-112024-089
Література
- Gottwald-Hostalek U., Uhl W., Wolna P., Kahaly G.J. New levothyroxine formulation meeting 95-105% specification over the whole shelf-life: results from two pharmacokinetic trials. Curr. Med. Res. Opin. 2017 Feb; 33 (2): 169-174.
- Опис винаходу до патенту № 115247 на твердий фармацевтичний препарат, що містить левотироксин натрію; власник – компанія Меrck KGaA [Електронний ресурс]. – Режим доступу: https://base.uipv.org/searchinv/search.php? action=viewdetails&IdClaim=239759&chapter=description.
- Pacini F., Fuhrer D., Elisei R., Handkiewicz-Junak D., Leboulleux S., et al. 2022 ETA consensus statement: what are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur. Thyroid J. 2022; 11 (1): e210046. doi: 10.1530/ETJ-21-0046.
- Faugeras L., Pirson A.S., Donckier J., Michel L., Lemaire J., Vandervorst S., D’Hondt L. Refractory thyroid carcinoma: which systemic treatment to use? Ther. Adv. Med. Oncol. 2018; 10: 1758834017752853. doi: 10.1177/1758834017752853.
- Laetitia G., Sven S., Fabrice J. Combinatorial therapies in thyroid cancer: an overview of preclinical and clinical progresses. Cells. 2020; 9 (4): 830. doi: 10.3390/cells9040830.
- Tumino D., Frasca F., Newbold K. Updates on the management of advanced, metastatic, and radioiodine refractory differentiated thyroid cancer. Front. Endocrinol. (Lausanne). 2017; 8: 312. doi: 10.3389/fendo.2017.00312.
- Mu Z.Z., Zhang X., Lin Y.S. Identification of radioactive iodine refractory differentiated thyroid cancer. Chonnam. Med. J. 2019; 55 (3): 127-135. doi: 10.4068/cmj.2019.55.3.127.
- Silaghi H., Lozovanu V., Georgescu C.E., Pop C., Nasui B.A., Cătoi A.F., Silaghi C.A. State of the art in the current management and future directions of targeted therapy for differentiated thyroid cancer. Int. J. Mol. Sci. 2022; 23 (7): 3470. doi: 10.3390/ijms23073470.
- Yavuz S., Puckett Y. Iodine-131 uptake study [Updated 2023 Oct 29]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024. Available at: https://www.ncbi.nlm.nih.gov/books/NBK559283.
- Zhang L., Li Z., Zhang M., Zou H., Bai Y., Liu Y., et al. Advances in the molecular mechanism and targeted therapy of radioactive-iodine refractory differentiated thyroid cancer. Med. Oncol. 2023; 40 (9): 258. doi: 10.1007/s12032-023-02098-3.
- Liu J., Liu R., Shen X., Zhu G., Li B., Xing M. The genetic duet of BRAF V600E and TERT promoter mutations robustly predicts loss of radioiodine avidity in recurrent papillary thyroid cancer. J. Nucl. Med. 2020; 61 (2): 177-182. doi: 10.2967/jnumed.119.227652.
- Anekpuritanang T., Uataya M., Claimon A., Laokulrath N., Pongsapich W., Pithuksurachai P. The association between radioiodine refractory in papillary thyroid carcinoma, sodium/iodide symporter expression, and BRAFV600E mutation. OncoTargets Ther. 2021; 14: 3959-3969. doi: 10.2147/OTT.S308910.
- Oh J.M., Ahn B.-C. Molecular mechanisms of radioactive iodine refractoriness in differentiated thyroid cancer: impaired sodium iodide symporter (NIS) expression owing to altered signaling pathway activity and intracellular localization of NIS’. Theranostics. 2021; 11 (13): 6251-6277. doi: 10.7150/thno.57689.
- Smith V.E., Read M.L., Turnell A.S., Watkins R.J., Watkinson J.C., Lewy G.D., Fong J.C., et al. A novel mechanism of sodium iodide symporter repression in differentiated thyroid cancer. J. Cell Sci. 2009; 122 (Pt. 18): 3393-3402. doi: 10.1242/jcs.045427.
- Samimi H., Haghpanah V. Molecular evidence reveals thyrotropin intervention enhances the risk of developing radioiodine-refractory differentiated thyroid carcinoma. Cancer Cell Int. 2022; 22: 61. doi: 10.1186/s12935-022-02484-3.
- Cazarin J., Dupuy C., Pires de Carvalho D. Redox homeostasis in thyroid cancer: implications in Na+/I- symporter (NIS) regulation. Int. J. Mol. Sci. 2022; 23 (11): 6129. doi: 10.3390/ijms23116129.
- Ha L.N., Iravani A., Nhung N.T., Hanh N.T.M., Hutomo F., Son M.H. Relationship between clinicopathologic factors and FDG avidity in radioiodine-negative recurrent or metastatic differentiated thyroid carcinoma. Cancer Imaging. 2021; 21 (1): 8. doi: 10.1186/s40644-020-00378-z.
- Shi Z.Y., Zhang S.X., Li C.H., Fan D., Xue Y., Cheng Z.H., et al. Differential distribution and prognostic value of CD4+ T cell subsets before and after radioactive iodine therapy in differentiated thyroid cancer with varied curative outcomes. Front. Immunol. 2022; 13: 966550. doi: 10.3389/fimmu.2022.966550.
- Robbins R.J., Wan Q., Grewal R.K., Reibke R., Gonen M., Strauss H.W., et al. Real-time prognosis for metastatic thyroid carcinoma based on 2-[18F]fluoro-2-deoxy-D-glucose-positron emission tomography scanning. J. Clin. Endocrinol. Metab. 2006; 91 (2): 498-505. doi: 10.1210/jc.2005-1534.
- Zelinskaya A., Kvachenyuk A., Kulinichenko G., Moroz V. Cytological characteristics of postoperative metastases of papillary thyroid cancer during the development of secondary radioiodine refractoriness. Eureca: Life Science. 2020; 1: 3-10. doi: 10.21303/2504-5695.2020.001117.
- Aashiq M., Silverman D.A., Na’ara S., Takahashi H., Amit M. Radioiodine-refractory thyroid cancer: molecular basis of redifferentiation therapies, management, and novel therapies. Cancers (Basel). 2019; 11 (9): 1382. doi: 10.3390/cancers11091382.
- Cracchiolo J.R., Wong R.J. Management of the lateral neck in well differentiated thyroid cancer. Eur. J. Surg. Oncol. J. Eur. Soc. Surg. Oncol. Br. Assoc. Surg. Oncol. 2018; 44 (3): 332-337. doi: 10.1016/j.ejso.2017.06.004.
- Lei J., Zhong J., Jiang K., Li Z., Gong R., Zhu J. Skip lateral lymph node metastasis leaping over the central neck compartment in papillary thyroid carcinoma. Oncotarget. 2017; 8 (16): 27022-27033. doi: 10.18632/oncotarget.15388.
- Sorrenti S., Carbotta G., Di Matteo F.M., Catania A., Pironi D., Tartaglia F., et al. Evaluation of clinicopathological and molecular parameters on disease recurrence of papillary thyroid cancer patient: a retrospective observational study. Cancers. 2020; 12 (12): 3637. doi: 10.3390/cancers12123637.
- Medas F., Canu G.L., Cappellacci F., Boi F., Lai M.L., Erdas E., et al. Predictive factors of lymph node metastasis in patients with papillary microcarcinoma of the thyroid: retrospective analysis on 293 cases. Front. Endocrinol. (Lausanne). 2020; 11: 551. doi: 10.3389/fendo.2020.00551.
- Haugen B.R., Alexander E.K., Bible K.C., Doherty G.M., Mandel S.J., Nikiforov Y.E., et al. American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 2015; 26: 1-133. doi: 10.1089/thy.2015.0020.
- Nervo A., Retta F., Ragni A., Piovesan A., Gallo M., Arvat E. Management of progressive radioiodine-refractory thyroid carcinoma: current perspective. Cancer Manag. Res. 2022; 14: 3047-3062. doi: 10.2147/CMAR.S340967.
- Hamidi S., Hofmann M.C., Iyer P.C., Cabanillas M.E., Hu M.I., Busaidy N.L., Dadu R. Review article: new treatments for advanced differentiated thyroid cancers and potential mechanisms of drug resistance. Front. Endocrinol. (Lausanne). 2023; 14: 1176731. doi: 10.3389/fendo.2023.1176731.
- Van Nostrand D., Veytsman I., Kulkarni K., Heimlich L., Burman K.D. Redifferentiation of differentiated thyroid cancer: clinical insights from a narrative review of literature. Thyroid. 2023; 33 (6): 674-681. doi: 10.1089/thy.2022.0632.
- Liu Y., Wang J., Hu X., Pan Z., Xu T., Xu J., et al. Radioiodine therapy in advanced differentiated thyroid cancer: resistance and overcoming strategy. Drug Resist. Updat. 2023; 68: 100939. doi: 10.1016/j.drup.2023.100939.
- Fallahi P., Ferrari S.M., Galdiero M.R., Varricchi G., Elia G., et al. Molecular targets of tyrosine kinase inhibitors in thyroid cancer. Semin. Cancer Biol. 2022; 79: 180-196. doi: 10.1016/j.semcancer.2020.11.013.
- Leandro-García L.J., Landa I. Mechanistic insights of thyroid cancer progression. Endocrinology. 2023; 164 (9): bqad118. doi: 10.1210/endocr/bqad118.
- Gomes-Lima C.J., Shobab L., Wu D., Ylli D., Bikas A., McCoy M., et al. Do molecular profiles of primary versus metastatic radioiodine refractory differentiated thyroid cancer differ? Front. Endocrinol. (Lausanne). 2021; 12: 623182. doi: 10.3389/fendo.2021.623182.
- Гуда Б.Б., Остафійчук М.В. Приховані радіойодчутливі та радіойодрезистентні метастази папілярної карциноми щитоподібної залози: клінічні аспекти. Проблеми ендокринної патології. 2024; 2: 20-30. doi: 10.21856/j-PEP.2024.3.03.