Поєднання цукрового діабету 1-го типу та міастенії: клінічний випадок і огляд літератури
Переклала й адаптувала канд. мед. наук Ольга Королюк
Цукровий діабет (ЦД) 1-го типу та міастенія – це автоімунні хвороби, поєднання котрих є дуже рідкісним. У літературі знайдено опис декількох випадків, коли діагноз ЦД 1-го типу встановлено до або одночасно з діагнозом міастенії. Це перший опис, коли в дівчинки спочатку діагностовано міастенію, а через 7 років – ЦД 1-го типу.
ЦД 1-го типу – одне з найпоширеніших автоімунних захворювань у дітей та осіб молодого віку, що виникає внаслідок автоімунного руйнування β-клітин і абсолютного дефіциту інсуліну. Особи з ЦД 1-го типу мають підвищений ризик певних автоімунних розладів, найчастіше автоімунних захворювань щитоподібної залози та целіакії.
Серед інших автоімунних станів із ЦД 1-го типу асоціюються первинна недостатність надниркових залоз, автоімунний гепатит, автоімунний гастрит, дерматоміозит, зрідка міастенія. Міастенія ґравіс (myasthenia gravis) – це автоімунна хвороба з наявністю антитіл до рецептора ацетилхоліну або пов’язаних із рецептором білків у постсинаптичній мембрані нервово-м’язового з’єднання. Опосередковане антитілами порушення впливу ацетилхоліну призводить до м’язової слабкості, передусім очних, бульбарних, дихальних м’язів і скелетних м’язів кінцівок.
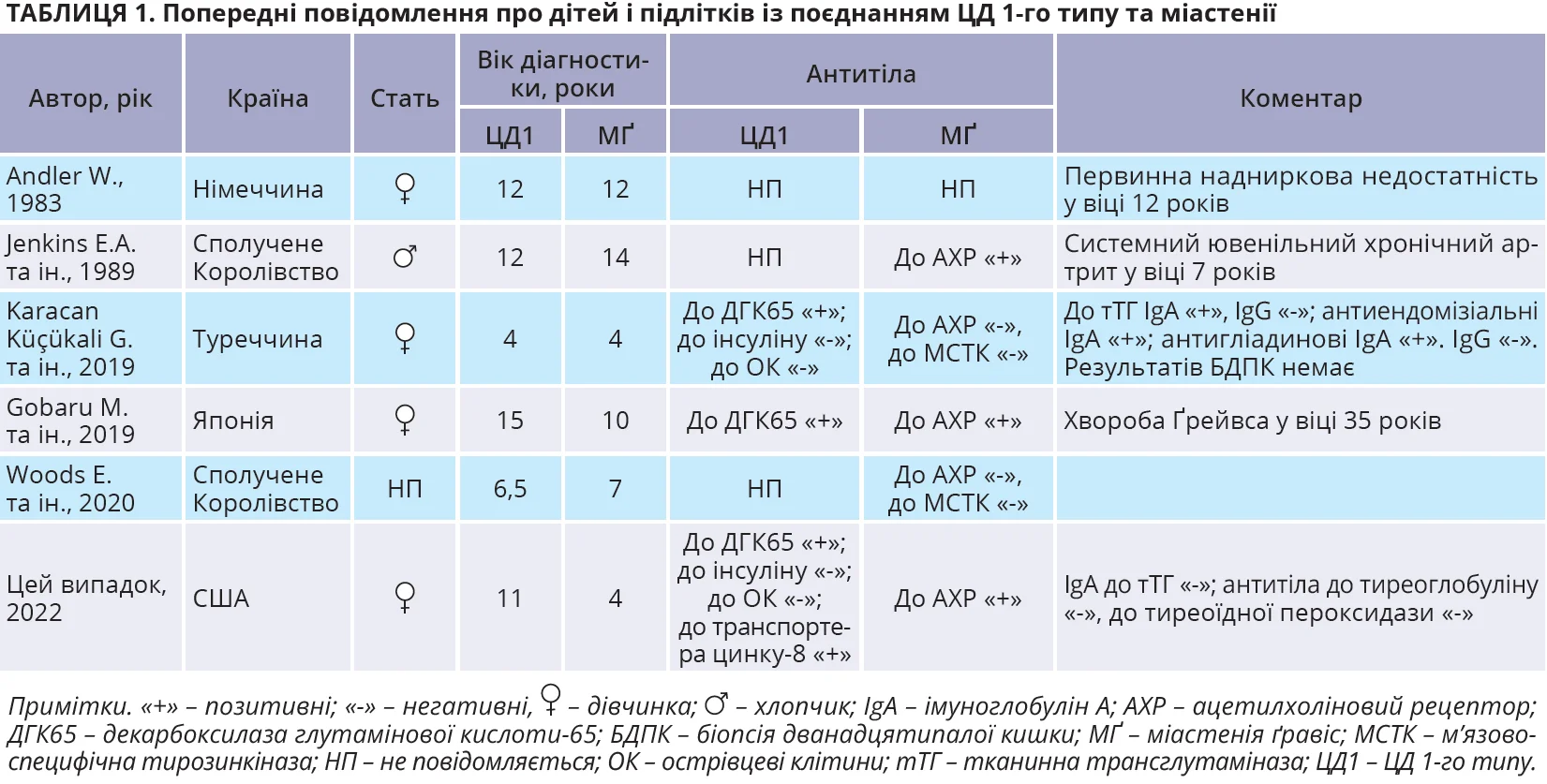
У літературі знайдено п’ять повідомлень про поєднання ЦД 1-го типу та міастенії в дітей віком до 18 років. У всіх випадках міастенію діагностовано після або одночасно з ЦД 1-го типу (табл. 1). У цьому клінічному випадку в дитини з анамнезом міастенії згодом виник ЦД 1-го типу.
Опис клінічного випадку
Дівчинка віком 11 років звернулася до відділення невідкладної допомоги із сильним болем у м’язах, м’язовими судомами, які почалися раптово під час гри на майданчику з друзями. Пацієнтка заперечувала пошкодження або травми в анамнезі. Лихоманки, набряку м’язів або слабкості не було.
Міастенію діагностовано 7 років тому, у віці 4 років, коли впродовж 1 місяця виник прогресивний птоз. На момент установлення діагнозу рівень зв’язувальних антитіл до ацетилхолінових рецепторів у м’язах був 0,20 нмоль/л (норма ≤0,02 нмоль/л), рівень модулювальних антитіл – 71% (норма – 0-20%). Комп’ютерна томографія не виявила тимоми. На момент звернення міастенія понад 1 рік була в стані ремісії на тлі застосування піридостигміну. В анамнезі не було повторних інфекцій, які потребували б госпіталізації. Розвиток дівчинки був нормальним. Етнічне походження батьків – Кабо-Верде. Випадків ЦД 1-го типу, міастенії або інших автоімунних захворювань у сім’ї не було.
При обстеженні дитина бадьора, артеріальний тиск – 112/73 мм рт. ст., частота дихання – 24 на хвилину, температура тіла в нормі, маса тіла – 28,7 кг (8-й процентиль за діаграмою зросту CDC), 4 місяці тому маса тіла становила 32,4 кг. Індекс маси тіла також знизився з 18,1 до 15,8 кг/м2.
Молочні залози й оволосіння на лобку відповідало I стадії за шкалою Таннера. Локалізованої болючості чи слабкості кінцівок не виявлено. Щитоподібна залоза не збільшена. Обстеження інших органів і систем у межах норми.
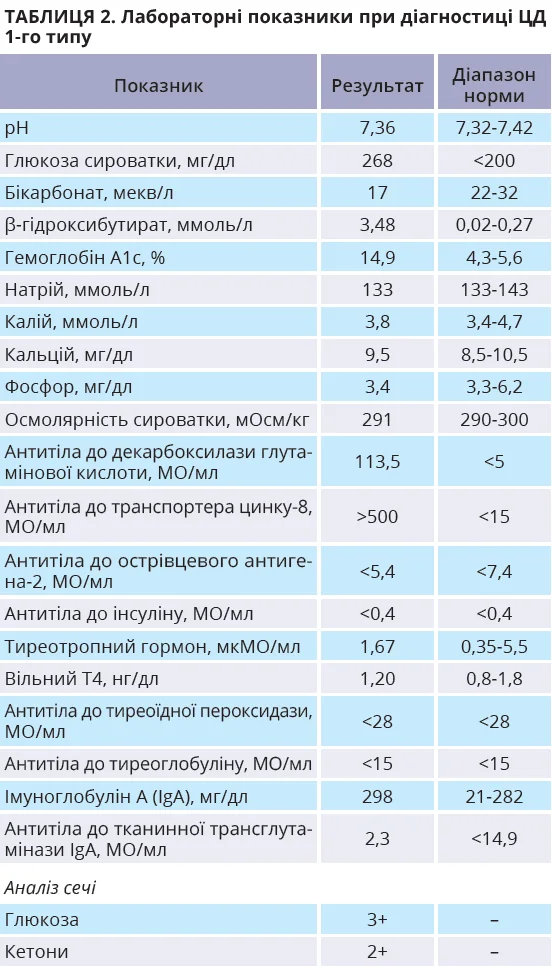
Початковим діагнозом був рабдоміоліз. Діагностичний пошук виявив гіперглікемію, глюкозурію та кетоз без ацидозу; пацієнтка заперечувала поліурію, полідипсію, поліфагію та ніктурію. Детальніше подальше обстеження підтвердило діагноз ЦД 1-го типу; скринінг на автоімунну хворобу щитоподібної залози та целіакію виявився негативним (табл. 2).
Розпочато базально-болюсне підшкірне введення інсуліну. На тлі терапії пацієнтка почувалася добре, під час останнього обстеження рівень гемоглобіну A1c становив 7,8%; загальна доза інсуліну – 0,3 одиниці/кг/добу.
Обговорення
Автоімунні хвороби вражають 3-5% загальної популяції. Вважається, що їх виникнення зумовлене зовнішніми тригерами в генетично сприйнятливих осіб. Генетична сприйнятливість може проявлятися у формі генетичних варіантів головного комплексу гістосумісності (MHC), що кодує білки, відповідальні за презентацію антигена; генів, які беруть участь у вродженому й адаптивному імунітеті: нерецептор протеїну тирозинфосфатази типу 22 (PTPN22), домен BTB і гомолог CNC 2 (BACH2), ген автоімунного регулятора (AIRE) та ген Forkhead Box P3 (FOXP3). Можливі також епігенетичні механізми: метилювання, ацетилювання, убіквітування та фосфорилювання, кожен з яких спричиняє специфічні автоімунні хвороби. Генетична сприйнятливість, імовірно, пояснює виникнення кількох автоімунних захворювань в однієї людини, а також підвищений ризик автоімунних розладів у інших членів сім’ї.
Іншим чинником автоімунних захворювань є порушена імунологічна толерантність. Дослідження на тваринах указує, що дисфункція регуляторних Т-клітин призводить до недостатності периферичної імунологічної толерантності та може відігравати певну роль у виникненні ЦД 1-го типу. Пацієнтка не мала рецидивів інфекцій в анамнезі; рівень імуноглобуліну А був нормальним.
У дівчинки спостерігалася очна міастенія з ізольованим ураженням очних м’язів, яка частіше виникає в препубертатному віці та становить 10-35% усіх випадків міастенії. Автоімунні стани, що асоціюються з ЦД 1-го типу включають целіакію й автоімунні хвороби щитоподібної залози. Натомість міастенія частіше пов’язана з ревматоїдним артритом, системним червоним вовчаком і автоімунними хворобами щитоподібної залози. Алелі лейкоцитарного антигена людини (HLA) та/або локуси гена, відмінного від HLA, підвищують ризик розвитку як ЦД 1-го типу, так і міастенії. Наприклад, у серії випадків, що включала 10 пацієнтів із ЦД 1-го типу, автоімунною хворобою щитоподібної залози та міастенією, в усіх учасників виявлено підтип HLA DR9/DQ9. Автори вважають доцільним скринінг ЦД 1-го типу в пацієнтів з очним типом міастенії та підтипом HLA DR9/DQ9.
Скринінг на автоантитіла має як плюси, так і мінуси. Раннє виявлення дітей із передсимптомним ЦД 1-го типу дає змогу ознайомити опікунів із симптомами гіперглікемії, що може знизити ризик діабетичного кетоацидозу, позитивно впливає на глікемічний контроль, а отже, сприяє зменшенню гострих і хронічних ускладнень. Проте знання позитивного статусу автоантитіл може спричинити підвищену тривогу серед пацієнтів та осіб, які забезпечують догляд, зокрема через непередбачуваність початку хвороби та відсутність терапевтичних утручань для дітей віком до 8 років із діабетом I стадії (позитивні автоантитіла з еуглікемією).
Для відтермінування ЦД 1-го типу в дітей віком від 8 років із діабетом II стадії (позитивні автоантитіла та дисглікемія) схвалено імуномодулятор теплізумаб.
У великих популяційних дослідженнях поліморфізм гена CTSL2, що кодує цистеїнову протеазу катепсину V, який бере участь у презентації антигена в кортикальних епітеліальних клітинах тимуса, був пов’язаний як із ЦД 1-го типу, так і з раннім (у віці до 40 років) початком міастенії. На жаль, типування HLA та визначення поліморфізму гена CTSL2 не були доступні для цієї пацієнтки.
У дітей поєднання міастенії та ЦД 1-го типу є рідкісним. Велике ретроспективне дослідження за участю 260 пацієнтів віком від 3 до 23 років із діагнозом ЦД 1-го типу виявило міастенію лише в 1 хворого (0,4%) впродовж 14 років. В іншому дослідженні за участю 149 дітей із міастенією, діагностованою у віці до 17 років, за 17 років спостереження ЦД 1-го типу виник лише в 3 пацієнтів (2,01%). У літературі знайдено 5 повідомлень про випадки, які описують одночасну появу ЦД 1-го типу та міастенії в дітей віком до 18 років, – четверо пацієнтів з Європи та один з Азії (табл. 1). Автоімунним хворобам притаманна значна гетерогенність за расою та географічним регіоном. У всіх попередніх випадках, окрім одного з Японії, ЦД 1-го типу діагностовано до або одночасно з міастенією. У цієї пацієнтки, навпаки, спочатку діагностовано міастенію, а через 7 років – ЦД 1-го типу.
Висновки
Це рідкісний випадок поєднання серопозитивної міастенії та ЦД 1-го типу в дитини препубертатного віку зі Сполучених Штатів. Автоімунна хвороба в анамнезі підвищує ризик розвитку інших автоімунних захворювань. У пацієнтів із міастенією варто розглянути можливість скринінгу на ЦД 1-го типу та пропонувати лікування особам віком понад 8 років із ЦД 1-го типу II стадії для відтермінування явного діабету. Можливість ЦД 1-го типу також слід розглядати за наявності в пацієнтів із міастенією неспецифічних симптомів як-от утома та втрата маси тіла.
Література
Sasidharan Pillai S., Millington K. Co-existence of type 1 diabetes mellitus and myasthenia gravis: a case report and review of the literature. AACE Clin. Case Rep. 2023 Dec 18; 10 (2): 52-54. doi: 10.1016/j.aace.2023.12.004.