Підсумки Ради експертів «Сучасні можливості лікування та запобігання прогресуванню судинних ускладнень у пацієнтів із цукровим діабетом»
Підготувала канд. мед. наук Ольга Королюк
За даними Міжнародної федерації діабету, за останнє десятиліття поширеність цукрового діабету (ЦД) серед людей віком 20-79 років зросла зі 151 млн до 463 млн, що становить 9,3% населення світу. Без достатніх заходів боротьби з епідемією ЦД поширеність хвороби надалі зростатиме: за оцінками експертів, до 2045 р. кожен 10-й житель планети житиме з діабетом. ЦД вкорочує тривалість життя в середньому на 15 років, а також збільшує ризик серцево-судинних захворювань (ССЗ) у 2-4 рази. Саме ССЗ спричиняють 49% смертей у цій когорті. Хронічні ускладнення ЦД (мікро- та макроангіопатії) є причиною інвалідизації внаслідок ниркової недостатності, ампутації нижніх кінцівок і втрати зору.
Засідання Ради експертів. Головує академік НАМН України, доктор медичних наук, професор М.Д. Тронько
6 липня 2023 р. у Києві відбулося засідання Ради експертів «Сучасні можливості лікування та запобігання прогресуванню судинних ускладнень у пацієнтів із цукровим діабетом», метою якого був пошук нових додаткових можливостей у лікуванні та запобіганні прогресуванню судинних ускладнень ЦД і покращення прогнозу в пацієнтів з ускладненнями.
Головував на Раді експертів президент Української діабетичної федерації, віцепрезидент НАМН України, академік НАМН України, член-кореспондент НАН України, директор ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), доктор медичних наук, професор Микола Дмитрович Тронько. Голова наголосив, що ЦД займає третє місце за поширеністю після ССЗ й онкологічних захворювань, і навів сумну статистику діабету в Україні. Поширеність хвороби у світі становить 7,3%, тобто це близько 3,5 млн осіб в Україні.
Проте, на жаль, діагностовано лише близько 1 млн 400 тис. випадків, а отже, частка недіагностованого ЦД в Україні (60%!) удвічі вища, ніж у Великій Британії та Польщі. В Україні також значно вища кількість діабетичних ускладнень, аніж у країнах Європи. На момент діагностики хвороби в половини пацієнтів є клінічні ознаки ускладнень. Майже 3% первинної інвалідності дорослого населення є наслідком ЦД. Що стосується економічних витрат, то станом на 2021 р. вони дорівнюють 36-104 млрд грн на рік (1-2,5% ВВП), причому прямі витрати (наприклад, на медикаменти, обладнання, стаціонар, прийом лікаря тощо) становлять 60%; близько 35% – це непрямі витрати, що виникають унаслідок втрати дієздатності людей із ЦД через ускладнення. Зважаючи на це, пріоритетними є протидіабетичні засоби, що знижують кардіоваскулярний і ренальний ризики та мають низький ризик гіпоглікемії. В Україні основними причинами значної поширеності ЦД, його тяжкого перебігу та виникнення інвалідизувальних ускладнень є:
- Відсутність культури збереження та відповідальності населення за своє здоров’я й ведення здорового способу життя.
- Збільшення кількості населення віком понад 40 років, людей із генетичною схильністю до ЦД, ожирінням, малорухливим способом життя, хронічними стресами, курінням і алкоголізмом.
- Відсутність системного підходу до раннього виявлення ЦД на всіх рівнях і чіткого розподілу функцій медичних працівників на різних рівнях надання медичної допомоги хворим на діабет.
- Потреба вдосконалення системи контролю ефективності лікування ЦД.
- Недосконалість організації навчання в школах самоконтролю хворих на ЦД через відсутність нормативних актів щодо штатного розкладу.
- Недосконалість нормативно-правових і організаційно-структурних засад для надання медичної допомоги та соціального захисту хворих на ЦД.
В обговоренні брали участь провідні профільні експерти країни. Керівниця відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», старший науковий співробітник, доктор медичних наук Любов Костянтинівна Соколова зупинилася на проблемі коморбідних станів. Вагомий внесок у поширеність ЦД у світі мала нещодавня пандемія коронавірусної хвороби (COVID-19). Установлено негативний вплив інфекції на β-клітини підшлункової залози, зумовлений прямою цитопатичною дією вірусу, імунними механізмами та можливістю виникнення гострого панкреатиту. З іншого боку, відповідь на стрес, цитокіновий шторм і застосування кортикостероїдів порушують чутливість до інсуліну. Вказані чинники не лише збільшили кількість нових випадків ЦД обох типів, а й зумовили тяжчий перебіг хвороби через погіршення глікемічного контролю та збільшення випадків діабетичного кетоацидозу. Певну негативну роль відігравав і локдаун через посилення стресу, відсутність доступу до якісної та своєчасної медичної допомоги, а також неможливість дотримання призначеного режиму лікування або рекомендацій щодо способу життя (Unnikrishnan R., Misra A., 2021).
В Україні ситуація ще гірша через війну, адже гострий і тривалий стрес спричиняє виділення контрінсулярних гормонів, що, своєю чергою, призводить до дисліпідемії, артеріальної гіпертензії (АГ) та вищого ризику ССЗ. Відомо також про так званий психосоціальний тип ожиріння, коли стрес зумовлює нездоровий спосіб життя через «заїдання», безсоння, низьку самооцінку та нехтування власних потреб. За цих умов часто виникають тривога й депресія, замикаючи згубне коло, яке призводить до метаболічного синдрому навіть у дітей і підлітків (Pervanidou P., Chrousos G.P., 2011).
На особливу увагу заслуговують судинні ускладнення ЦД. Від ССЗ (діабетичної макроангіопатії) помирають 8 із 10 пацієнтів. Смертність від гострого порушення мозкового кровообігу в пацієнтів із ЦД у 2-4 рази вища, ніж в осіб без ЦД. Що стосується діабетичних мікроангіопатій, то ретинопатія є основною причиною сліпоти в дорослих працездатного віку, хронічна хвороба нирок (ХХН) діабетичного генезу (діабетична нефропатія) – основною причиною термінальної ниркової недостатності, нейропатія – основною причиною нетравматичних ампутацій нижніх кінцівок. У разі ЦД 1-го типу впродовж перших 5 років посилюються запалення, синтез колагену та позаклітинного матриксу, зменшується щільність капілярів. Через кілька років після виникнення ЦД спостерігаються тяжка ендотеліальна дисфункція й атеросклеротичні макроваскулярні ускладнення, що зумовлені ураженням органів- мішеней: інфаркт міокарда (ІМ), серцева недостатність (СН), захворювання периферичних артерій (ЗПА), транзиторні ішемічні атаки або інсульт, тяжка протеїнурія та термінальна стадія ниркової недостатності. При ЦД 2-го типу ССЗ насамперед зумовлені дисфункцією ендотелію (ДЕ) й негативним впливом гіперглікемії, інсулінорезистентності та дисліпідемії. За інсулінорезистентності виникає ціла низка коморбідних станів, які, крім відомих компонентів метаболічного синдрому (ожиріння, АГ, дисліпідемія, гіперглікемія), включають також запалення, нервову дегенерацію, автономну дисфункцію, стеатотичну хворобу печінки, що асоційована з метаболічною дисфункцією, й обструктивне апное уві сні.
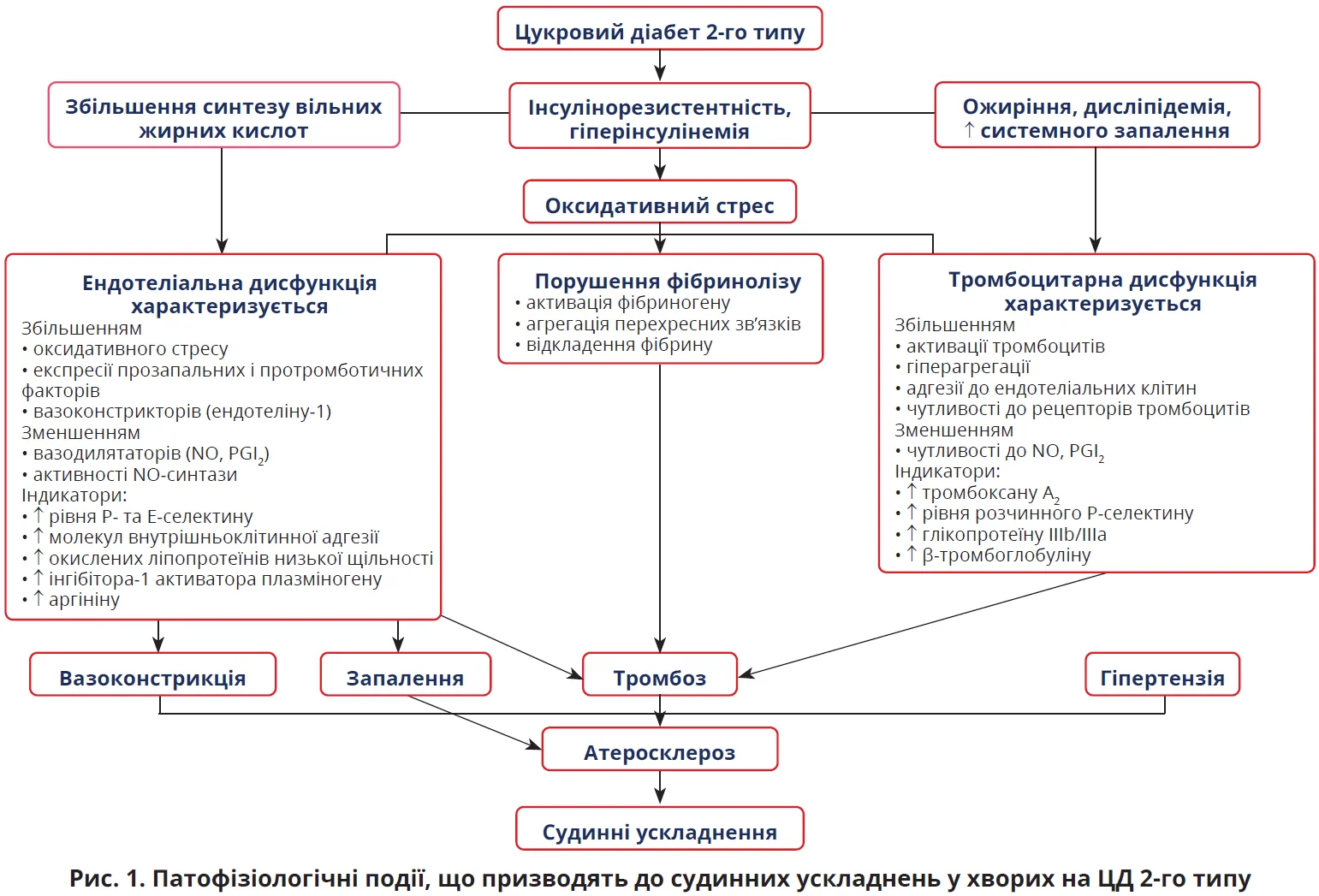
Обговорення патогенезу судинних ускладнень ЦД продовжила заступниця директора з наукової роботи клініки ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», доктор медичних наук Валерія Леонідівна Орленко. Доповідачка зазначила, що ДЕ є центральною ланкою патогенезу найрізноманітніших захворювань, як-от ЦД, хронічні захворювання вен, тромботичні стани, атеросклероз і COVID-19 (Sena C.M. et al., 2013; Carrizzo A. et al., 2018). У пацієнтів із ЦД 2-го типу оксидантний стрес призводить до ДЕ, яка, своєю чергою, зумовлює розвиток різних судинних ускладнень (рис. 1).
При обох типах ЦД стійка гіперглікемія спричиняє низку молекулярних змін, які призводять до ДЕ. Зокрема, посилення глікування білків з утворенням кінцевих продуктів глікації (AGEs); збільшення секреції судинозвужувальних факторів; зниження біодоступності оксиду азоту (NO) з утворенням активних форм кисню; посилення запального статусу. Високі циркулювальні рівні AGEs зумовлюють пошкодження тканин і судинної стінки, збільшуючи експозицію колагену, vWF, тканинного фактора. Одночасно підвищений рівень глікованого гемоглобіну (HbA1c) індукує експресію глікопротеїнових рецепторів GPIIb/IIIa на поверхні тромбоцитів, сприяючи їх активації (Carrizzo A. et al., 2018).
Вагомий вплив на загострення хвороби має стресова гіперглікемія. Виділення стресових гормонів знижує чутливість м’язів до інсуліну та підвищує синтез глюкози в печінці. Як наслідок не лише виникає гіперглікемія, а й збільшується рівень вільних жирних кислот, що призводить до низки небажаних наслідків: порушення гемодинаміки, втрати електролітів, пошкодження міокарда, оксидантного стресу, гіперкоагуляції, імунних порушень, запалення та ДЕ (Marik P., Bellomo R., 2013).
Отже, ДЕ є ключовим механізмом виникнення судинних ускладнень, а відновлення та захист ендотелію відіграють провідну роль у їх профілактиці. Важливу захисну роль відіграє глікокалікс – поверхневий шар ендотелію ворсинчастої структури. Непошкоджений глікокалікс захищає й ізолює ендотеліоцити від циркулювальних клітин і підтримує нормальну функцію ендотелію. Ушкодження глікокаліксу оголює ендотеліальні клітини та приводить до їх гіперплазії. Віруси, запалення, гіпоксія або гіперглікемія руйнують глікокалікс (Calabrese F. et al., 2020; Menter T. et al., 2020). Зі зруйнованих ендотеліальних клітин виділяється значна кількість тромботичних речовин, що спричиняє адгезію тромбоцитів і тромбоз. Пошкодження ендотелію призводить до адгезії лейкоцитів і запалення, адгезії моноцитів/макрофагів і атерогенезу, міграції стовбурових клітин, що відіграє певну роль в ангіогенезі й онкогенезі (Sokologorskiy S.V., 2018).
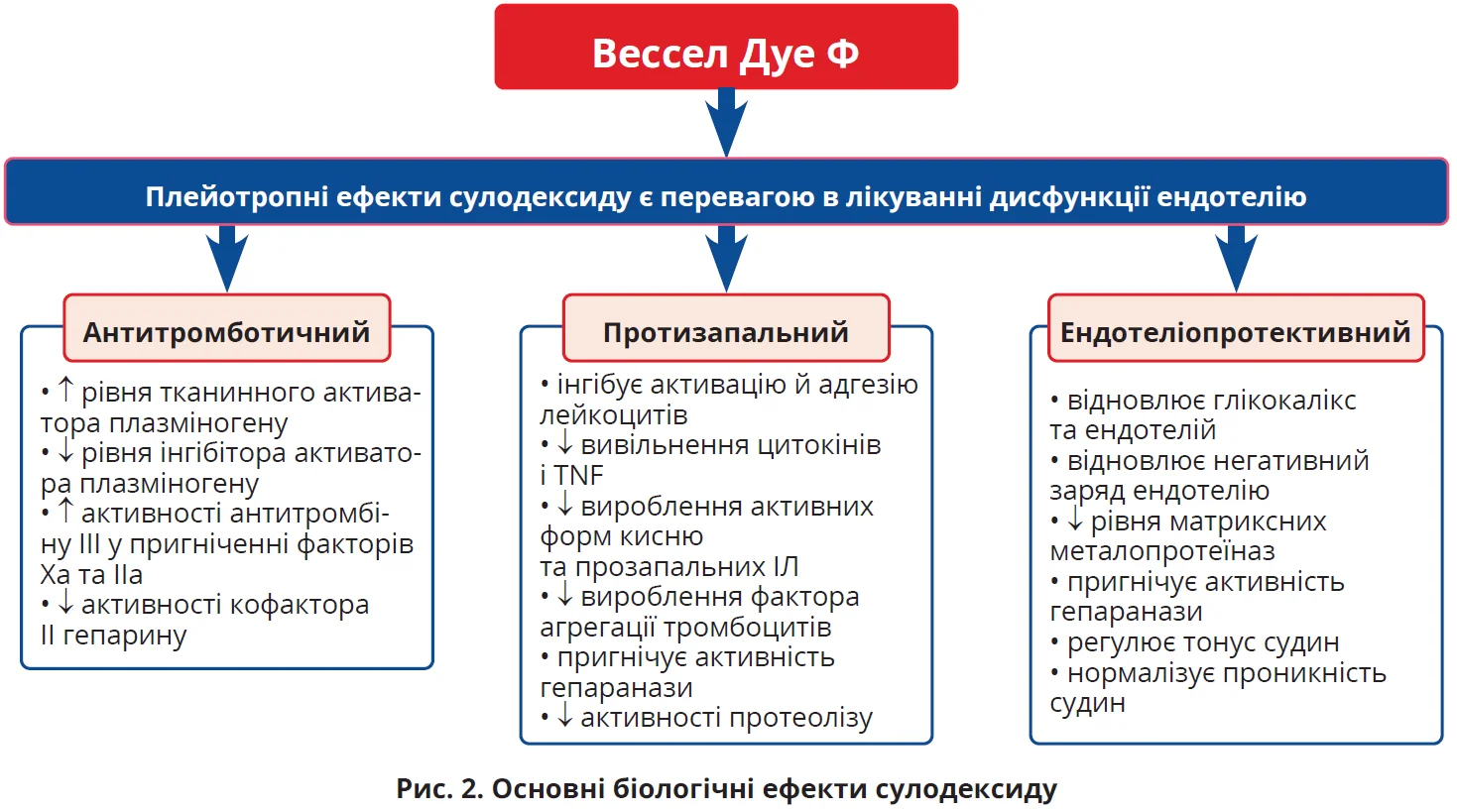
Варто підкреслити негативний вплив гіперглікемії на глікокалікс, що особливо важливо в пацієнтів із ЦД. Зокрема, 6-годинний вплив гострої гіперглікемії 16 ммоль/л істотно зменшує об’єм глікокаліксу навіть у здорових добровольців (Gouverneur M. et al., 2006). Захисний вплив на глікокалікс та ендотелій у багатьох дослідженнях, у тому числі при ЦД, продемонстрував сулодексид – природна суміш глікозаміногліканів, що заміщує втрачені глікозаміноглікани в глікокаліксі та відновлює природний шар ендотеліальних клітин і електронегативний заряд судинної стінки, сприяючи правильному функціонуванню ендотелію. Через 8 тижнів терапії сулодексидом спостерігалися значуще збільшення товщини ендотеліального глікокаліксу та зменшення проникності судин як у здорових добровольців, так і в пацієнтів із ЦД 2-го типу (Broekhuizen L. et al., 2010). Тож основні біологічні ефекти сулодексиду – захист і відновлення ендотелію, антитромботична та протизапальна дії – дають змогу впливати на головні ланки патогенезу діабетичного ураження судин (рис. 2) (Carroll B. et al., 2019).
Завідувачка відділу еферентних технологій ДУ «Інститут нефрології НАМН України» (м. Київ), доктор медичних наук, професор Ірина Олексіївна Дудар охарактеризувала проблему ХХН. Доповідачка зазначила, що 1 із 7 людей на планеті має ХХН. Як наслідок недооцінювання цієї проблеми захворюваність на ХХН за період із 1990 по 2017 р. збільшилася до 89%, а смертність зросла на 41,5%. Кількість пацієнтів, які лікуються методами діалізної нирковозамісної терапії, збільшилася на 43,1%, а кількість пацієнтів із функціональними трансплантатами – на 34,4% (Yie Y. et al., 2020). До груп ризику ХХН відносять пацієнтів віком понад 65 років, осіб із ЦД, ожирінням, АГ, ССЗ, а також пацієнтів із гострим пошкодженням нирок в анамнезі або сімейним анамнезом ХХН (Shlipak M. et al., 2021; House A. et al., 2019). Спостереження за пацієнтами із ЦД 2-го типу без ССЗ (n=772 336) упродовж 4,5 років продемонструвало виникнення ускладнень у 18% учасників. П’ять найчастіших ускладнень включали: ХХН (36%), СН (24%), інсульт (16%), ІМ (14%) і ЗПА (10%). Протеїнурія негативно впливає на виживання пацієнтів із ХХН (Wühl E., Schaefer F., 2011). У пацієнтів із ЦД 2-го типу альбумінурія значно підвищує ризик ускладнень (Rachmani R. et al., 2000). В основі ураження нирок за ХХН лежить пошкодження ендотелію (Oppelaar J., Vogt L., 2019).
Критеріями діагнозу діабетичної хвороби нирок є співвідношення альбумін/креатинін сечі 30 мг/г або рівень екскреції альбуміну із сечею ≥30 г / 24 години та/або розрахована швидкість клубочкової фільтрації (ШКФ) <60 мл/хв/1,73 м2. Лікування цього стану включає контроль артеріального тиску, ліпідів і глюкози крові з пріоритетним застосуванням протидіабетичних засобів, які належать до класів інгібіторів натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2), агоністів рецепторів глюкагоноподібного пептиду-1 (арГПП-1) та інгібіторів дипептидилпептидази-4. Потенційні лікувальні можливості має сулодексид (Wang J. et al., 2021). Лікування сулодексидом значно зменшує альбумінурію, покращує функцію нирок, збільшує вміст гломерулярного гепарансульфату, знижує експресію колагену 1-го та 4-го типів і ознаки запалення, запобігає розвитку гломерулосклерозу й фіброзу. Також сулодексид пригнічує активність ферменту гепаринази, яка руйнує ендотеліальний глікокалікс у разі ЦД, що призводить до альбумінурії. Лікування сулодексидом забезпечувало поліпшення гістологічного стану нирок – зниження «індексу склерозування», що супроводжувалося значним зменшенням площі клубочків (Yung S. et al., 2013).
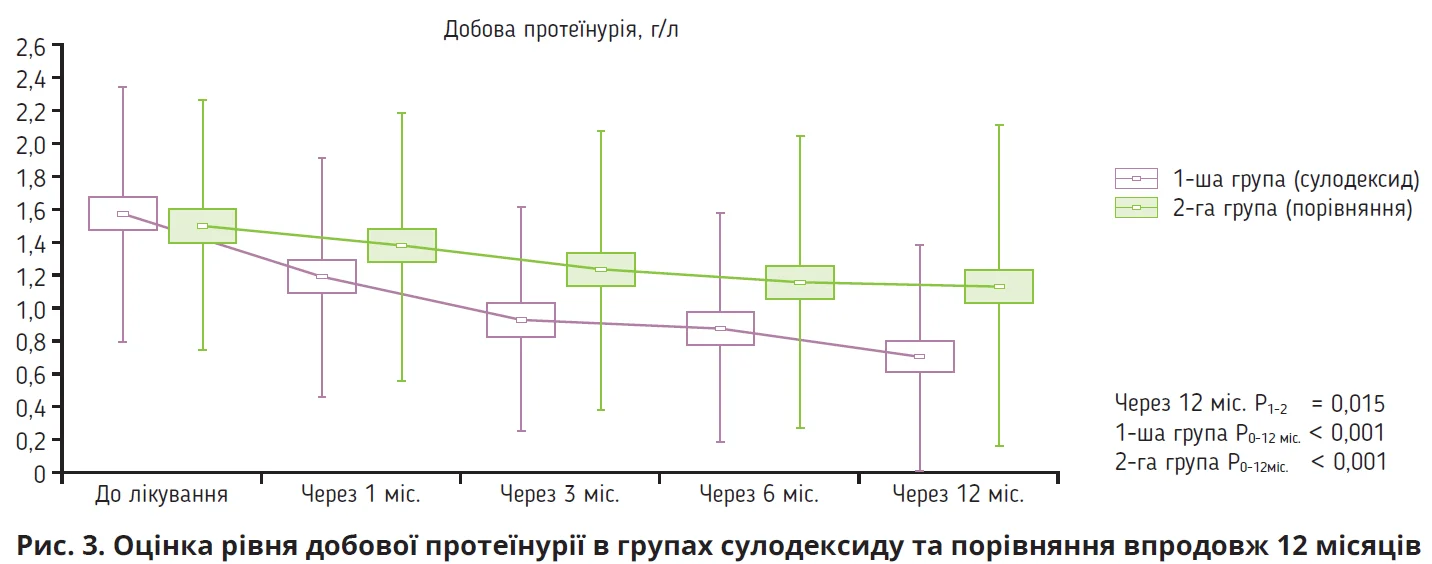
І.О. Дудар продемонструвала результати власних досліджень, які вивчали особливості нефропротективного впливу сулодексиду у хворих на діабетичну нефропатію (рис. 3). Через 12 місяців лікування сулодексидом спостерігалося значуще зниження добової протеїнурії (р<0,001). Якщо порівнювати річну динаміку добової протеїнурії, то в пацієнтів із ХХН ІІ стадії на тлі лікування сулодексидом відбулося зменшення протеїнурії на 1 г/добу проти 0,4 г/добу в групі порівняння (р<0,001); у пацієнтів із ХХН ІІІ стадії показники протеїнурії в указаних групах зменшилися на 0,8 та 0,4 г/добу відповідно (р=0,001). Збільшення ШКФ під впливом сулодексиду спостерігалося вже через 1 місяць після початку лікування. Через 3 місяці лікування сулодексидом спостерігалося значуще зменшення рівнів інтерлейкіну-1β (ІЛ-1β) й інтерферону-γ; натомість рівень ІЛ-10 значуще підвищився, внаслідок чого суттєво знизилося співвідношення інтерферон-γ/ІЛ-10 (Лобода О.М. та ін., 2009; Тopchiy I. et al., 2017).
Результати метааналізу 45 досліджень за участю 2817 пацієнтів щодо впливу сулодексиду на запобігання та/або лікування ускладнень на тлі ЦД обох типів (34 дослідження включали пацієнтів із діабетичною нефропатією) вказують, що сулодексид зменшує рівні мікро- й макроальбумінурії, покращує стан сітківки та сприяє швидшому загоєнню діабетичних трофічних виразок. Лікувальний ефект зберігається впродовж декількох місяців після закінчення курсу лікування. Відзначено тенденцію до підвищення ефективності сулодексиду залежно від тривалості терапії. Тому рекомендовано двоетапний курс лікування: І етап – внутрішньом’язові ін’єкції 15-20 днів; ІІ етап – капсули для перорального застосування впродовж 2-3 місяців (Bignamini A. et al., 2021).
Кандидат медичних наук Катерина Миколаївна Тронько (ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України») висвітлила проблему діабетичної ретинопатії (ДРП). Поширеність ДРП у світі на кінець 2019 р. становила 162 млн випадків. Це ускладнення виникає в кожного третього пацієнта з ЦД.
За даними Всесвітньої організації охорони здоров’я, щороку реєструється 15 млн сліпих і слабкозорих унаслідок ЦД. Найважливішим чинником ризику ДРП є тривалість діабету: після 10 років хвороби частота цього ускладнення становить 50%, після 30 років – 90%. Іншими чинниками ризику є неефективний контроль ЦД (рівні HbA1c вище цільових), вагітність, АГ, ССЗ, нещодавно перенесений інсульт, нефропатія, гіперліпідемія, куріння, ожиріння й анемія (Kański J.J., Bowling B., 2013). ДРП класифікується на три стадії: непроліферативну, препроліферативну та проліферативну. На перших двох стадіях можливі васкулярна, ішемічна, ексудативна й геморагічна форми; проліферативна стадія включає неоваскулярну та гліозну форми. Макулярний набряк (МН) може бути першим симптомом ДРП або виникати на будь-якій стадії її розвитку. Частота МН збільшується пропорційно до тривалості та тяжкості діабету.
При ЦД 1-го типу МН виникає в 42% пацієнтів, у разі ЦД 2-го типу – в понад 80% пацієнтів. Із кожним роком кількість пацієнтів із МН збільшується на 5-10%.
До тяжких ускладнень проліферативної ДРП відносять відшарування сітківки та рубеоз райдужної оболонки, що може призвести до неоваскулярної глаукоми.
За патогенезом ДРП – це мікросудинне ускладнення ЦД, що характеризується порушенням ендотеліального гемато-ретинального бар’єра та високим рівнем фактора росту ендотелію судин (VEGF) у склоподібному тілі ока. Останнім часом дедалі більше уваги приділяють потенційній ролі ендотеліального глікокаліксу в патогенезі хвороби. Глікокалікс – це желеподібний шар, що покриває просвітну поверхню ендотелію. До складу глікокаліксу входять протеоглікани, глікопротеїни й адсорбовані білки плазми. Глікокалікс бере участь у таких важливих функціях, як гемостаз, транспорт гормонів і макромолекул, активація нейтрофілів, коагуляція та фібриноліз. Руйнування глікокаліксу при атеросклерозі та ЦД збільшує ендотеліальну й судинну проникність лейкоцитів, що посилює запальний компонент хвороби (Giurdanella G. et al., 2017).
Сулодексид – природний агент, який захищає ендотеліальні клітини. Дія препарату полягає в пригніченні внутрішньосудинної запальної реакції шляхом зменшення концентрації в крові прозапальних цитокінів і VEGF. Серед інших механізмів дії сулодексиду можна назвати зниження сприйнятливості клітин до цитотоксичного ефекту гіперглікемії, пригнічення внутрішньоклітинного оксидантного стресу та запалення. У хворих на ЦД спостерігається витончення шару глікокаліксу в ендотелії судин, що призводить до більшої проникності судинної стінки для макромолекул. Застосування сулодексиду впродовж 2 місяців сприяє потовщенню шару глікокаліксу судин сітківки та зниженню їх проникності. Після лікування сулодексидом спостерігається також зниження активності гіалуронідази. Ці ефекти вказують на здатність сулодексиду підтримувати цілісність глікокаліксу та захищати його від пошкоджень. Деякі дослідження також указують на можливість блокування активності ферментів, здатних розкладати глікокалікс. Сулодексид зберігає життєздатність ендотеліальних клітин сітківки від пошкодження, запобігає порушенню проникності гемато-ретинального бар’єра та формуванню нових судин (Połubinska A. et al., 2013; Ciszewicz M. et al., 2009; Bręborowicz A., 2019; Broekhuizen L. et al., 2010; Paneni F., Cosentino F., 2013). При застосуванні сулодексиду на тлі впливу високого рівня глюкози відзначалося зниження секреції IЛ-6 і VEGF-A клітинами ендотелію сітківки. Отже, сулодексид знижує рівень глюкозо-індукованого ушкодження ендотеліальних клітин сітківки.
Доповідачка представила результати власного дослідження, в якому пацієнтам (середній вік – 29,6±0,97 року, середня тривалість ЦД 1-го типу – 10,95±0,97 року, середній рівень HbA1c – 7,7±0,14%) у комплексну стандартну терапію ДРП було включено сулодексид у дозі 600 ліпопротеїнліпазних одиниць (ЛО) внутрішньом’язово протягом 10 діб, надалі в капсулах по 250 ЛО двічі на день упродовж 6 місяців. Після лікування спостерігалося покращення гостроти зору та картини очного дна зі значущим зменшенням крововиливів і твердих ексудатів. Окрім того, терапія сулодексидом позитивно вплинула на показники коагулограми (значуще зниження протромбінового індексу й фібрину) та сприяла суттєвому зниженню ІЛ-6. Отже, включення сулодексиду до комплексної терапії підвищує ефективність консервативного лікування ДРП: покращує гостроту зору, зменшує крововиливи та тверді ексудати, сприяє нормалізації реологічних властивостей крові, зменшує запалення (Тронько К.М. та ін., 2012).
Польське офтальмологічне товариство рекомендує сулодексид як допоміжну терапію при лікуванні легкої та помірної ДРП у режимі дозування 1 капсула 250 ЛО двічі на день між прийомами їжі (Szaflik J. et al., 2021).
Віцепрезидентка Асоціації судинних хірургів, флебологів і ангіологів України, головний науковий співробітник відділу хірургії магістральних судин Національного наукового центру хірургії та трансплантології ім. О.О. Шалімова (м. Київ), доктор медичних наук, професор Лариса Михайлівна Чернуха представила сучасні погляди на патогенез хронічного захворювання вен (ХЗВ) нижніх кінцівок і діабетичної мікроангіопатії, а також можливості патогенетичного лікування ХЗВ у пацієнтів із діабетом. Оскільки ХЗВ і діабетична мікроангіопатія мають низку спільних чинників ризику та схожі патофізіологічні й патогенетичні механізми, терапевтичні підходи, які покращують функцію ендотелію, запобігаючи дисфункціональним порушенням із виникненням ДЕ, та знижують запалення, можуть бути корисними для обох захворювань. Важливу роль у лікуванні також відіграє модифікація способу життя – фізична активність і нормалізація маси тіла. Одним із перспективних напрямів медикаментозної терапії ХЗВ є застосування екзогенних глікозаміногліканів – сулодексиду. Дослідження продемонстрували ендотелійпротекторну дію сулодексиду завдяки захисту глікокаліксу, його регенерації та пригніченню гепаринази. Крім того, сулодексид пригнічує вивільнення низки цитокінів, хемокінів, колонієстимулювальних факторів і матриксної металопротеїнази-2, -9. Відновлення негативного заряду глікокаліксу на мембрані ендотелію перешкоджає адгезії лейкоцитів і тромбоцитів. Чинні європейські й українські рекомендації щодо ведення пацієнтів із ХЗВ включають сулодексид у комплексне лікування як на ранніх стадіях, так і на стадії венозних трофічних виразок (високий рівень доказовості), а також у разі виникнення діабетичної стопи. Систематичний огляд і метааналіз 26 рандомізованих контрольованих досліджень (РКД) показав, що сулодексид збільшує безболісну та максимальну відстань ходьби при ЗПА, прискорює загоєння трофічних виразок у разі ЦД. Дослідження, котрі вивчали вплив сулодексиду на загоєння виразок у пацієнтів із ХЗВ класу C6 за CEAP і ЦД 2-го типу, вказують, що внутрішньом’язові ін’єкції препарату в дозі 600 ЛО щодня впродовж 3 тижнів із наступним пероральним застосуванням у дозі 250-500 ЛО двічі на день протягом 4-7 тижнів забезпечили загоєння трофічних виразок у середньому на 27 днів раніше, ніж у контрольній групі. Отже, мультимодальна активність сулодексиду, яка поєднує ендотеліопротекторний, протизапальний, флебодинамічний і антитромботичний, профібринолітичний ефекти, впливає на ключові механізми ХЗВ і діабетичної ангіопатії, покращуючи прогноз захворювання та знижуючи ризик розвитку тяжких ускладнень.
Питання макросудинних ускладнень ЦД та можливості їх профілактики висвітлив член-кореспондент НАМН України, керівник відділу інтенсивної терапії та реанімації ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска НАМН України» (м. Київ), доктор медичних наук, професор Олександр Миколайович Пархоменко. За оцінками, проведеними в США, пацієнт із ЦД має вдвічі-втричі вищий ризик ССЗ, вдвічі-вчетверо вищу захворюваність і смертність від ССЗ та 60% шанс померти від ССЗ.
У людей із ЦД поширеність ішемічної хвороби серця (ІХС) становить 14-21%, поширеність СН – 19-26%, ЗПА – 16-29%, інсульту – 8-12% (Dal Canto E. et al., 2019). Існує низка спільних чинників ризику для ССЗ та діабету. Зокрема, АГ є основним чинником ризику ССЗ й інсульту. При цьому дослідження показали зв’язок між високим тиском і резистентністю до інсуліну. Коли в пацієнта співіснують АГ та ЦД, ризик розвитку ССЗ суттєво зростає. Гіперхолестеринемія й високий рівень тригліцеридів крові часто трапляються в пацієнтів із передчасною ІХС і діабетичною дисліпідемією. Слід зазначити, що ожиріння також є чинником ризику ССЗ і тісно пов’язане з резистентністю до інсуліну. Ці два патологічні стани часто поєднуються з іншими чинниками ризику, зокрема з АГ. Важливим модифікованим чинником ризику інсулінорезистентності та ССЗ також є відсутність фізичної активності. Куріння (незалежно від того, є діабет чи ні), своєю чергою, підвищує ризик ССЗ й інсульту (AHA, 2021).
Основні механізми діабетичного ураження серця включають: оксидантний стрес, запалення, зміни метаболічних шляхів (аномалії в утилізації субстрату, порушення функції мітохондрій, утворення AGEs тощо), зміни на рівні регуляції інсуліну, регуляції генів, стрес ендоплазматичного ретикулуму, нейрогуморальну активацію та загибель клітин серця (Ritchie R., Abel E., 2020).
Важливо пам’ятати, що збільшення частоти макросудинних ускладнень ЦД 2-го типу спостерігається навіть за умови контролю таких чинників ризику, як АГ, HbА1с, куріння, холестерин ліпопротеїнів низької щільності й альбумінурія (Rawshani A. et al., 2018). Тому ці хворі потребують особливої уваги та ретельного контролю всіх відомих чинників ризику. СН – одне з перших клінічних проявів діабет-асоційованих ССЗ (Shah A. et al., 2015). Результати дослідження SAVOR-TIMI 53 продемонстрували, що ССЗ є основною причиною смерті пацієнтів із ЦД 2-го типу – 66,3%. У структурі серцево-судинної смертності переважає раптова серцева смерть (30,1%), решту становить смерть від СН (10,5%), цереброваскулярних хвороб (7,1%), гострого ІМ (5,3%) та інших імовірно серцево-судинних станів (13,3%).
Сучасна стратегія ведення пацієнтів високого ризику із ЦД 2-го типу передбачає модифікацію способу життя, контроль глікемії й артеріального тиску, корекцію ліпідів крові, антитромбоцитарну терапію, корекцію кардіоренального ризику (іНЗКТГ-2, арГПП-1) та реваскуляризацію. Проте така стратегія не забезпечує повного запобігання небажаним подіям: є певний «залишковий ризик», який потребує додаткової патогенетичної терапії.
Негативний вплив діабету на серцево-судинну систему реалізується багатьма механізмами, проте центральною ланкою патогенезу є ДЕ (Oto A., 2013). Можливість впливу на цю патогенетичну ланку було вивчено в дослідженні ІРО-V2, яке включало 3986 пацієнтів у ранні терміни після перенесеного ІМ. Упродовж періоду спостереження 12 місяців зареєстровано 237 смертей: 7,1% у групі контролю та 4,8% у групі сулодексиду (зниження ризику на 32%, р=0,0022). У групі сулодексиду ризик смерті від СН знизився на 58% (р=0,007), раптової смерті – на 36% (р=0,046), виникнення повторного ІМ – на 28% (р=0,035) (Condorelli M. et al., 1994).
У нещодавньому систематичному огляді та метааналізі проаналізовано 340 досліджень, з яких відібрано 6 РКД за участю 7596 пацієнтів з ІМ в анамнезі, венозною тромбоемболією, ЗПА чи факторами ризику ССЗ і нефропатією. Середня тривалість спостереження становила 11,6 місяця. Серед усіх пацієнтів 3811 приймали сулодексид, 3785 становили групу контролю. Кінцеві точки оцінки ефективності результатів включали: смертність від усіх причин, серцево-судинну смертність, ІМ, тромбоз глибоких вен (ТГВ), легеневу емболію, інсульт і кровотечі. Використання сулодексиду асоціювалося зі зниженням ризику виникнення ІМ на 32% порівняно з контролем, зниженням ризику смерті від усіх причин на 33% та ризику серцево-судинної смерті на 60% порівняно з контролем (Bikdeli B. et al., 2019).
Продовжив тему ССЗ старший науковий співробітник відділу інтенсивної терапії та реанімації ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України», доктор медичних наук Ярослав Михайлович Лутай. Доповідач наголосив, що інсулінорезистентність і гіперглікемія в пацієнтів із ЦД спричиняють активацію тромбоцитів і білків системи зсідання крові, а також зменшують потужність фібринолітичного потенціалу. Це створює передумови для розвитку не тільки артеріальних, а й венозних тромбозів та емболій, що підтверджується даними реальної клінічної практики.
Зокрема, при аналізі національної бази даних Іспанії (47 190 пацієнтів із тромбоемболією легеневої артерії – ТЕЛА) ЦД виявився незалежним чинником ризику ТЕЛА, ймовірність розвитку якої за наявності ЦД збільшувалася на 22% у чоловіків і на 83% у жінок (p<0,001). При цьому ЦД був також незалежним чинником ризику смерті від усіх причин у пацієнтів із ТЕЛА поряд із такими чинниками, як літній вік (понад 60 років), супутні захворювання, ступінь обструкції легеневої артерії та фібриляція передсердь (Jiménez-García R. et al., 2020). За даними національної бази даних Німеччини (1 174 196 пацієнтів із ТЕЛА), у хворих із ТЕЛА та супутнім ЦД визначено не тільки значно вищі тромботичні ризики, а й більшу частоту геморагічних ускладнень із боку шлунково-кишкового тракту та внутрішньомозкових кровотеч (усі р<0,001) (Schmitt V.H. et al., 2022).
Подібні результати було отримано також Z. Zhang і співавт. (2017), які за результатами 3-місячного спостереження за дорослими пацієнтами з венозними тромбозами виявили збільшення ризику в 4,8 раза великих і 2,1 раза – клінічно значущих кровотеч у пацієнтів із супутнім ЦД. Отже, пацієнти з ЦД потребують проведення тривалішої й інтенсивнішої антикоагулянтної терапії, але лікування цих хворих має проводитися також з огляду на можливі геморагічні ускладнення.
Зважаючи на антитромботичну, протизапальну й ендотелійпротекторну дії сулодексиду, вивчалася ефективність його застосування для профілактики ТЕЛА та ТГВ. Багатоцентрове РКД SURVET проводилося в 7 країнах Європи за участю 615 пацієнтів із першим епізодом ідіопатичної венозної тромбоемболії (ТГВ – 92%, ТЕЛА – 8%) після 3-12 місяців терапії антагоністом вітаміну К. Упродовж 2 років спостереження виявлено значно нижчий ризик повторних венозних тромбоемболій у групі сулодексиду порівняно з плацебо (коефіцієнт ризику 0,45 (0,24-0,81), р=0,01). Упродовж періоду спостереження в кожній із груп виникло по 2 клінічно значущі кровотечі, великих кровотеч не було (Andreozzi G.M. et al., 2015). Настанови Європейського кардіологічного товариства з менеджменту легеневої емболії рекомендують розглянути застосування сулодексиду для подовженої вторинної профілактики венозних тромбоемболій пацієнтам, які відмовляються від прийому пероральних антикоагулянтів або не переносять їх (Konstantinidis S. et al., 2019).
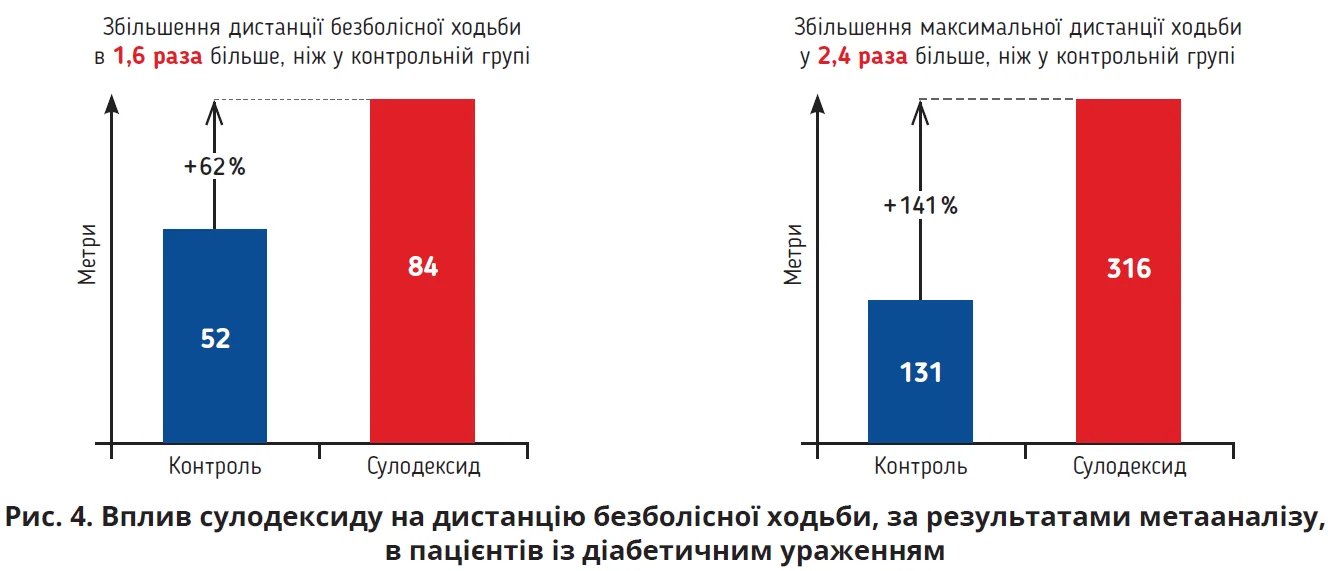
Що стосується проблеми периферичного атеросклерозу, то 16% людей віком ≥55 років мають атеросклероз артерій нижніх кінцівок. Окрім віку, чинниками ризику цього стану є куріння та діабет. Понад 50% пацієнтів не мають симптомів, понад 60% пацієнтів мають атеросклероз інших судинних басейнів. Цій когорті рекомендовано антитромбоцитарну терапію. Проте, незважаючи на прийом ацетилсаліцилової кислоти, ризик ІМ, інсульту чи раптової смерті залишається високим – до 9% на рік. За результатами останніх метааналізів, у пацієнтів із діабетичним ураженням периферичних артерій у групі лікування сулодексидом дистанція безболісної ходьби збільшилася в середньому на 84 метри, тобто в 1,6 раза порівняно з контрольною групою; максимальна дистанція ходьби збільшилася в середньому на 316 метрів, тобто у 2,4 раза порівняно з групою контролю (рис. 4); загоєння діабет-асоційованих трофічних виразок відзначалося в середньому на 27 днів раніше, ніж у групі контролю (Bignamini A., 2021; Gaddi A.V. et al., 2020).
Старший науковий співробітник відділу інтенсивної терапії та реанімації ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України», доктор медичних наук Олег Ігорович Іркін зупинився на проблемі оптимального лікування СН. Доповідач зауважив, що СН – це глобальна пандемія, котра охоплює 26 млн людей у світі, й одна з найпоширеніших коморбідностей ЦД 2-го типу (Ambrosy A. et al., 2014). Незадовільний глікемічний контроль діабету подвоює ризик СН (Dei Cas A. et al., 2015). Збільшення HbA1c на кожен 1% підвищує ризик виникнення СН на 15%, госпіталізації через СН – на 36% (Erqou S. et al., 2013; van Melle J. et al., 2010). ЦД часто спричиняє діастолічну дисфункцію. Незалежно від показників фракції викиду лівого шлуночка виживання в пацієнтів із СН і діабетом значно нижче, ніж у пацієнтів без діабету. У пацієнтів із ЦД може виникати діабетична кардіоміопатія, найнадійнішими критеріями якої є сироваткові рівні NT-proBNP >125 пг/мл в осіб із нормальною або надмірною масою тіла та >100 пг/мл у людей з ожирінням у поєднанні з принаймні двомаз таких ехокардіографічних аномалій: збільшення лівого передсердя, гіпертрофія лівого шлуночка, діастолічна дисфункція. Отже, діабетична кардіо-міопатія є ознакою високого ризику СН незалежно від діагностичних критеріїв, які застосовуються. Ризик діабетичної кардіоміопатії вищий серед пацієнтів старшого віку з вищими показниками глікемії натще й індексу маси тіла, а також у разі погіршення функції нирок (Segar M. et al., 2021).
ЦД 2-го типу є вагомим чинником ризику СН як безпосередньо через порушення функції серця, так і опосередковано через такі супутні стани, як АГ, ІХС, ниркова дисфункція, ожиріння й інші порушення обміну речовин. Серед пацієнтів із СН поширеність ЦД 2-го типу становить 20-40% залежно від досліджуваної популяції, характеристик чинників ризику, географічного регіону та віку, що пов’язано з гіршим прогнозом. З іншого боку, пацієнти із СН демонструють підвищений ризик виникнення ЦД 2-го типу порівняно з тими, хто не має СН. Здебільшого це зумовлено механізмами, пов’язаними з резистентністю до інсуліну, зокрема запаленням та оксидантним стресом (Palazzuoli A., Iacoviello M., 2023). Отож оптимальна терапія СН у цій когорті має враховувати метаболічні ефекти препаратів.
Важливу роль у патогенезі СН відіграє ДЕ. Як відомо, нормальний ендотелій виконує низку важливих функцій: урівноважує клітинну проліферацію та загибель; регулює фібриноліз за допомогою збалансованого вироблення антикоагулянт них і прокоагулянтних факторів; генерує велику кількість біоактивних молекул – NO, простагландини, цитокіни, які відіграють вирішальну роль у фізіологічному перерозподілі регіонального кровотоку (Giannitsi S. et al., 2019). Серед чинників, які призводять до ДЕ й атеросклерозу, розглядають ЦД, резистентність до інсуліну, дисліпідемію, ожиріння, стрес, куріння, віруси, гомоцистеїнемію та запалення. Існує декілька механізмів, за якими ДЕ порушує функцію кардіоміоцитів: гіпоксія, зумовлена вазоконстрикцією, порушенням капілярів і протромботичним фенотипом; фіброз; запалення; порушення бар’єрної функції (Cornuault L. et al., 2022). Установлено, що за наявності діабету ДЕ часто зумовлена саме порушенням глікокаліксу (Qiu Y. et al., 2022). Результати низки досліджень свідчать про здатність сулодексиду протидіяти ДЕ, спричиненій метаболічними та неметаболічними стресами, шляхом залучення внутрішньоклітинного шляху автофагії. Цей досвід значно розширює знання про механізми дії сулодексиду при ДЕ та підтримує його використання для лікування ССЗ (De Felice F. et al., 2019).
За підсумками Ради експертів прийнято резолюцію щодо сучасного рівня контролю ЦД і можливостей його підвищення.
Для ефективного та безпечного лікування людей із ЦД і запобігання розвитку діабетичних ускладнень потрібно:
- Оптимізувати наявні стандарти лікування пацієнтів із ЦД, включивши в перелік сучасні препарати з доведеною ефективністю, спрямовані не тільки на лікування, а й на профілактику ускладнень ЦД.
- Рекомендувати сулодексид (Вессел Дуе Ф) для комплексного лікування та запобігання прогресуванню судинних ускладнень у пацієнтів із ЦД 1-го та 2-го типів і покращення їх прогнозу.
- Забезпечити умови для соціального захисту та реабілітації людей із ЦД.