Оновлений огляд питання діабетичної нефропатії: діагноз, прогноз, цілі лікування й останні рекомендації
Підготувала канд. мед. наук Лариса Стрільчук
Діабетична нефропатія (ДН) – це клінічний синдром, який характеризується стійкою альбумінурією та прогресивним погіршенням функції нирок. ДН виникає у 20-50% пацієнтів із цукровим діабетом (ЦД) та є найпоширенішою причиною термінальних стадій хронічної хвороби нирок (ХХН). ДН асоціюється з артеріальною гіпертензією (АГ), підвищеною серцево-судинною захворюваністю та смертністю. Втручання з добре вивченою доказовою базою, як-от застосування інгібіторів ренін-ангіотензин-альдостеронової системи (РААС), сприяли значущому покращенню прогнозу для таких пацієнтів. Слід зауважити, що ДН не завжди прогресує й регресія альбумінурії не є рідкісним явищем. Оптимізму додає також поява нових засобів для лікування ЦД, наприклад інгібіторів натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2).
Діагностика
Відповідно до рекомендацій Ініціативи з покращення глобальних наслідків захворювань нирок (KDIGO, 2012) терміни «мікроальбумінурія» та «макроальбумінурія» вже не застосовуються, натомість слід послуговуватися трьома категоріями, які описують тяжкість альбумінурії (табл.).

Клінічні ознаки ДН
Ключовою ознакою ДН є стійка альбумінурія (категорія A3, значно підвищена) з одночасною наявністю ретинопатії та відсутніми доказами інших хвороб нирок. ДН рідко виникає в осіб із ЦД 1 типу протягом перших 10 років після встановлення діагнозу, але в проміжку від 10 до 20 років ДН розвивається приблизно в 3% пацієнтів щороку. Через 20 років показник захворюваності на ДН знижується. Загалом ризик розвитку ДН є індивідуальним і на нього впливають тривалість ЦД, глікемічний контроль, артеріальний тиск (АТ) та генетична схильність.
Епідеміологія ДН у разі ЦД 2 типу є ще варіабельнішою, ніж у разі ЦД 1 типу, та є різною у різних країнах і етнічних групах. На момент встановлення діагнозу ЦД 2 типу близько 3% пацієнтів уже мають ДН, що зумовлено тривалим недіагностованим діабетом або предіабетом.
У разі ЦД 2 типу супутня ретинопатія супроводжує ДН лише в 1/3 випадків.
Помірно підвищена альбумінурія
Помірно підвищена альбумінурія (А2), яку раніше називали мікроальбумінурією, свідчить про підвищення кардіоваскулярного ризику при обох типах ЦД та виступає предиктором ДН. На початку дослідження HOPE, у якому пацієнтів із підвищеним кардіоваскулярним ризиком рандомізували в групи раміприлу або плацебо, помірну альбумінурію (A2) мали 31,8% осіб із ЦД 2 типу. Через 4,5 років спостереження клінічно виражена нефропатія розвинулася у 20% учасників із мікроальбумінурією та лише у 2% без неї. На основі цього й інших спостережень було зроблено висновок, що помірна альбумінурія є першою стадією ДН, яку можна виявити клінічно та яка за відсутності втручання може прогресувати до тяжких незворотних стадій хвороби нирок. Цей висновок підтверджує й наявність гістологічних ознак діабетичної гломерулопатії, які супроводжують помірну альбумінурію ще до появи клінічних проявів. Інші дані, проте, спростовують цю концепцію та свідчать, що неминуче прогресування альбумінурії від помірної до тяжкої, а згодом до прогресивного зниження швидкості клубочкової фільтрації (ШКФ) спостерігається не в усіх пацієнтів із ДН, а частота зменшення альбумінурії при обох типах ЦД може бути вищою, ніж вважалося раніше. Наприклад, у дослідженні Y. Bentata та співавт. (2016) через 6 років постереження за 386 особами з ЦД 1 типу та помірною альбумінурією (A2) альбумінурія прогресувала до ступеня A3 лише в 19% осіб і регресувала до нормоальбумінурії в 59%.
Методологічні особливості оцінки альбумінурії
Оцінку альбумінурії ускладнює виражена варіабельність екскреції альбуміну в того самого пацієнта. Враховуючи це, для оцінки альбумінурії в клінічній практиці перевагу слід віддавати визначенню ВАК. Більшість рекомендацій, у тому числі рекомендації Американської діабетологічної асоціації (ADA), Національного інституту здоров’я й удосконалення медичної допомоги Великої Британії (NICE) та Європейської асоціації з вивчення діабету (EASD), радять проводити щорічний скринінг ВАК для виявлення помірної альбумінурії (A2) в усіх осіб із діабетом, а в разі виявлення підвищеного показника – повторювати аналіз. На фізіологічну варіабельність ВАК слід зважати й під час оцінки відповіді на лікування: краще порівнювати не окремі результати, а тенденції в динаміці.
Варто також пам’ятати про стани, які можуть призводити до минущих підвищень альбумінурії, зокрема інфекції сечовидільних шляхів, активне системне запалення/інфекції, значні фізичні навантаження протягом попередніх 12-24 годин, серцеву недостатність, тяжку АГ, менструації, тяжку гіперглікемію.
Застосування тест-смужок не дає змоги кількісно визначити альбумінурію й не рекомендоване для моніторування ступеня альбумінурії.
Неальбумінурична ДН
Зниження ШКФ у разі ЦД 1 та 2 типів може відбутися на тлі нормальної екскреції альбуміну із сечею. Загалом непротеїнуричні ХХН зазвичай свідчать про ішемічну природу хвороби або наявність тубулоінтерстиційної патології, але описано й непротеїнуричну ДН із типовими для діабетичної гломерулопатії гістопатологічними змінами. Проте ступінь протеїнурії залишається потужним предиктором ризику прогресування. У дослідженні M. Yamanouchi та співавт. (2019) п’ятирічна виживаність без прогресування ХХН у групі без протеїнурії становила 86,6%, а в групі з протеїнурією – 30,3%. Розвиток непротеїнуричної ДН можна пояснити коморбідною наявністю васкулярної патології, тубулоінтерстиційного ушкодження, попереднього гострого ушкодження нирок або зниженням протеїнурії на тлі прийому інгібіторів РААС.
Клінічний підхід до діагностики ДХН
У більшості випадків діабетична хвороба нирок (ДХН) є клінічним діагнозом. Золотим стандартом діагностики та прогнозування є біопсія нирок, але в більшості медичних закладів вона виконується лише за підозри на альтернативну патологію.
Скринінг
ДХН зазвичай є асимптоматичною, тому рекомендації ADA та робочої групи KDIGO радять оцінювати функцію нирок і визначати альбумінурію всім особам із діабетом під час установлення діагнозу та щороку після того в разі ЦД 2 типу; в разі ЦД 1 типу цю тактику можна впроваджувати через 5 років після встановлення діагнозу. Альбумінурію найкраще оцінювати за допомогою ВАК у зразках сечі, в ідеалі ранкових; можуть також застосовуватися зразки сечі, зібраної протягом 24 годин, але це менш зручно й асоціюється з похибками. Функцію нирок слід оцінювати за допомогою розрахунку ШКФ за формулою CKD-EPI.
Підтвердження стійких відхилень від норми
Якщо було виявлено зниження ШКФ або зростання альбумінурії, це потрібно підтвердити повторним аналізом протягом 3-6 місяців. Для точного виявлення підвищеної альбумінурії потрібно отримати щонайменше два збільшені показники ВАК з інтервалом не менш ніж 3 місяці. Це потрібно для того, щоб відрізнити минущі зміни й особисту варіабельність ВАК. Аналогічно для встановлення діагнозу ХХН потрібні два виміри ШКФ <60 мл/хв/1,73 м2 з інтервалом не менш ніж 90 днів.
Клінічний діагноз ДХН
У разі ЦД 1 типу клінічний діагноз ДХН можна встановити за наявності стійкої помірної (A2) або тяжкої (A3) альбумінурії чи стійкого зниження ШКФ до <60 мл/хв/1,73 м2, які виникли щонайменше через 5 років після початку діабету. У >95% випадків буде також наявна діабетична ретинопатія, а клінічні ознаки інших хвороб нирок – відсутні. За стійко зниженої ШКФ для встановлення діагнозу ДХН альбумінурія не потрібна, але цей клінічний сценарій потребує розгляду інших форм неальбумінуричних хвороб нирок (див. далі). Аналогічне стосується й альбумінурії за відсутності ретинопатії.
При ЦД 2 типу клінічна діагностика є складнішою у зв’язку з більшою гетерогенністю клінічних проявів, хоча застосовуються ті самі принципи стійкої альбумінурії або стійко зниженої ШКФ.
У разі стійкої ШКФ <60 мл/хв/1,73 м2 наявність альбумінурії також не потрібна для встановлення діагнозу. Свідченнями на користь діагнозу ДХН є більша тривалість діабету та наявність ретинопатії, але ні коротка тривалість ЦД, ні відсутність ретинопатії не дають можливості виключити ДХН у разі ЦД 2 типу. Тому важливо виявляти ознаки, які можуть свідчити про інші захворювання нирок, і в разі діагностичних сумнівів застосувати біопсію. Цей підхід до діагностики узагальнено на рисунку.
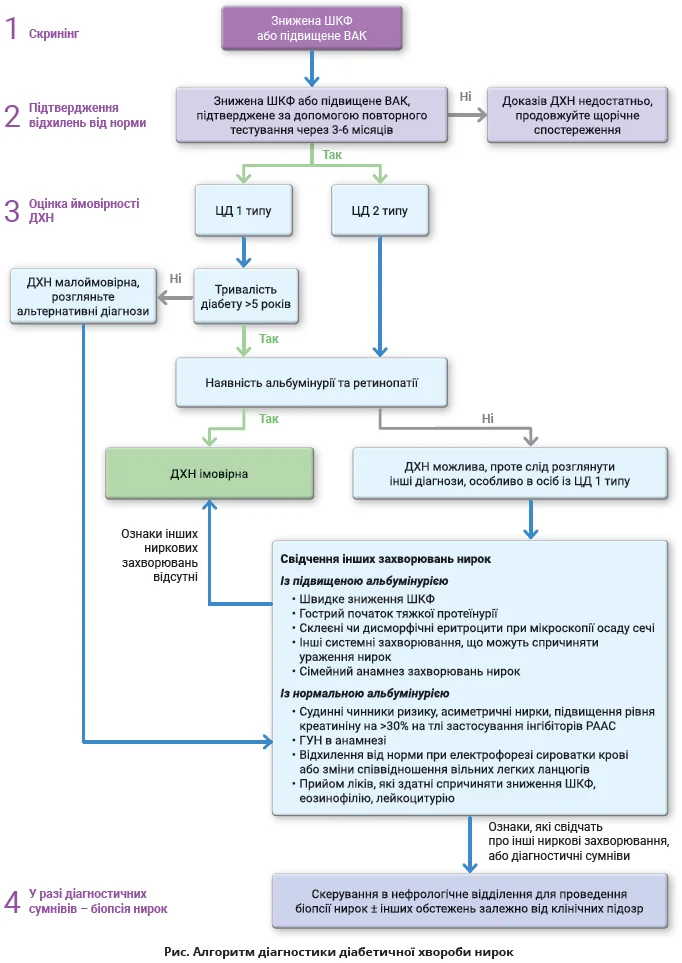
Ознаки, які свідчать про інші захворювання нирок
Про недіабетичне ураження нирок можуть свідчити такі ознаки:
- атипова траєкторія зниження ШКФ або початку альбумінурії. Швидке зниження ШКФ (>5 мл/хв/рік) або раптовий початок альбумінурії не типові для ДН, як і тяжка альбумінурія в перші 5 років після встановлення діагнозу ЦД 1 типу. Аналіз показників ШКФ у динаміці дає змогу виявити попередні епізоди гострого ушкодження нирок (ГУН), які можуть асоціюватися з початком і прогресуванням ХХН;
- дуже тяжка альбумінурія (ВАК >300 мг/ммоль, або >3000 мг/г) чи нефротичний синдром. Хоча ДН є визнаною причиною нефротичного синдрому, в таких умовах імовірніше первинне гломерулярне ураження, особливо за гострого початку нефротичного синдрому;
- виражені зміни в осаді сечі. Мікрогематурія не є типовою для ДН, але може її супроводжувати, тому наявність гематурії не дає змоги розрізнити діабетичну та недіабетичну хворобу нирок. Утім, склеєні чи дисморфічні еритроцити в зразку сечі частіше свідчать про гломерулонефрит;
- виявлення клінічних ознак, притаманних іншому системному захворюванню, яке спричиняє ураження нирок (наприклад, хвороби сполучної тканини, ВІЛ-інфекції);
- сімейний анамнез недіабетичних хвороб нирок.
Диференційний діагноз у разі неальбумінуричної ДХН
- Ішемічна нефропатія. На користь цього діагнозу свідчить наявність інших судинних захворювань, анамнез куріння, АГ, хвороби аорти чи асиметрія нирок при ультразвуковому обстеженні. Реноваскулярні хвороби також можна запідозрити по значному (>30%) зниженню ШКФ після початку вживання інгібіторів РААС.
- Хвороби нирок, зумовлені диспротеїнемією (моноклональна гаммопатія). Скринінг на ці хвороби проводиться за допомогою електрофорезу сироватки й аналізу вільних легких ланцюгів сироватки.
- Попередні епізоди ГУН.
- Тубулоінтерстиційний нефрит. Ця хвороба зазвичай асоціюється з еозинофілією та лейкоцитурією, хоча може супроводжуватися й нормальним осадом сечі. Причиною тубулоінтерстиційного нефриту зазвичай є медикаменти (нестероїдні протизапальні препарати, інгібітори протонової помпи, антибіотики, діуретики), тому потрібен ретельний аналіз анамнезу для виявлення зв’язку між прийомом цих препаратів і початком зниження ШКФ. Для діагностики потрібна біопсія нирок.
Цілі лікування
Існує дві основні цілі лікування ДН: збереження функції нирок із метою уникнення розвитку термінальних стадій ниркової недостатності та зниження ризику кардіоваскулярних подій і смертності.
Спосіб життя
Нефармакологічні стратегії мають включати зниження маси тіла, підвищення фізичної активності, зниження вживання натрію та відмову від куріння. Пацієнтів слід заохочувати активно брати участь у власному лікуванні й узгоджувати його цілі разом із лікарем.
Зниження рівня ліпідів і зменшення кардіоваскулярного ризику
Розвиток хвороби нирок у осіб із діабетом супроводжується значним підвищенням кардіоваскулярної смертності, тому всі такі пацієнти потребують агресивної модифікації чинників ризику. Показано, що при ХХН гіперліпідемія спричиняє гломерулосклероз, а зниження рівня ліпідів здатне сприяти збереженню ШКФ або зниженню альбумінурії, хоча це ще остаточно не доведено.
Глікемічний контроль
Покращення глікемічного контролю сповільнює розвиток і прогресування ДН. За даними дослідження DCCT (1993), в осіб із ЦД 1 типу інтенсивна інсулінотерапія призводила до достовірного зниження кількості випадків розвитку помірної (A2) чи тяжкої (A3) альбумінурії. Тривале спостереження за учасниками виявило, що інтенсивна інсулінотерапія сповільнювала зниження ШКФ і зменшувала частку осіб, у яких виникало стійке зниження ШКФ до <60 мл/хв/1,73 м2, на 50% порівняно з групою стандартної інсулінотерапії.
При ЦД 2 типу результати є більш суперечливими, проте загалом вважається, що інтенсивний глікемічний контроль за обох типів діабету здатен зменшити ризик розвитку ДН і сповільнити її прогресування, навіть якщо такий контроль супроводжується більшою кількістю епізодів гіпоглікемії. Слід зауважити, що інтенсивний глікемічний контроль не може повністю усунути ризик розвитку ДН чи зменшити ризик її прогресування до термінальних стадій хронічної ниркової недостатності (ХНН), а його переваги є меншими на пізніх стадіях ДХН. У зв’язку із цим цілі глікемічного контролю мають бути персоналізовані та встановлені після ретельного обговорення ризиків і переваг для кожного окремого пацієнта.
У разі ЦД 2 типу важливе значення має вибір глюкозознижувального препарату. Показано, що іНЗКТГ-2 знижують ризик розвитку термінальних стадій ХНН, подвоєння вмісту креатиніну в сироватці крові чи смерті від ниркових або кардіоваскулярних причин (зниження відносного ризику на 30%) у осіб із ЦД 2 типу, альбумінуричною ДН (ШКФ – 30-90 мл/хв/1,73 м2 і тяжкою (A3) альбумінурією), які отримують інгібітори РААС. іНЗКТГ-2 рекомендовані для пацієнтів із ЦД 2 типу й ХХН рекомендаціями ADA та EASD. Слід зауважити, що ренопротекторні ефекти іНЗКТГ-2 більшою мірою є незалежними від їхніх гіпоглікемічних ефектів.
ADA дає аналогічну рекомендацію й щодо агоністів рецепторів глюкагоноподібного пептиду-1 (ГПП-1). Показано, що ліраглутид зменшує кількість пацієнтів, у яких уперше виникає тяжка (A3) альбумінурія, подвоюється вміст креатиніну в сироватці крові, розвиваються термінальні стадії ХНН чи ХХН призводить до смерті. Аналогічні тенденції продемонстровано й для дулаглутиду. На противагу цьому в інгібіторів дипептидилпептидази-4 ренопротекторні ефекти відсутні, незважаючи на їхню здатність підвищувати рівень ГПП-1.
Збереження функції нирок
Наріжним каменем лікування ДН є пригнічення РААС. У разі ЦД 1 типу дослідження чітко продемонстрували переваги інгібіторів ангіотензинперетворювального ферменту (іАПФ). Наприклад, у нормотензивних осіб із ЦД 1 типу та помірною альбумінурією застосування каптоприлу сприяло зниженню ризику прогресування альбумінурії до тяжкої на >60% (The Microalbuminuria Captopril Study Group, 1996). іАПФ збільшували частку осіб, які досягли зниження екскреції білка із сечею до <1 г/24 год, навіть у осіб із протеїнурією в нефротичному діапазоні (Hebert L.A. et al., 1994).
При ЦД 2 типу найпотужніша доказова база щодо пригнічення РААС стосується блокаторів рецепторів до ангіотензину (БРА). У дослідженні IDNT 1715 осіб із ЦД 2 типу, зниженою ШКФ і тяжкою альбумінурією було рандомізовано в групи ірбесартану, амлодипіну чи плацебо (Lewis E.J. et al., 2001). Ірбесартан сприяв зниженню частоти досягнення комплексної кінцевої точки, яка включала подвоєння вмісту креатиніну в сироватці крові, термінальні стадії ХНН або смерть від будь-яких причин, приблизно на 20%. Цей ефект не залежав від АТ. Аналогічні результати було отримано в дослідженні RENAAL, у якому лозартан забезпечував зниження частоти досягнення такої самої кінцевої точки на 16% (Brenner B.M. et al., 2001). Окрім того, спостерігалося зниження ризику госпіталізації з приводу серцевої недостатності.
Імовірно, іАПФ мають такий самий вплив, як і БРА. Це доводить вторинний аналіз даних дослідження ADVANCE й інших рандомізованих контрольованих досліджень. Показано, що потужніше зниження альбумінурії у відповідь на застосування інгібіторів РААС асоціюється з кращими наслідками для пацієнтів незалежно від рівнів АТ, тому виникло припущення, що комбінація іАПФ і БРА чи поєднання засобу одного з цих класів із прямим інгібітором реніну може надати пацієнтові додаткову перевагу завдяки більшому зниженню альбумінурії. Проте перевірка цієї гіпотези в дослідженнях ONTARGET і VA NEPHRON-D виявила, що подвійна блокада РААС не сприяла покращенню наслідків, натомість супроводжувалася більшою частотою побічних ефектів, включаючи гіперкаліємію та ГУН.
Отже, пацієнтам із ЦД 1 чи 2 типу з АГ, високим/нормальним АТ і помірною або тяжкою альбумінурією, а також зі зниженою ШКФ доцільно призначати інгібітори РААС.
Контроль АГ є важливим підґрунтям зниження ризику прогресування ХХН і зменшення кардіоваскулярного ризику. Це було підтверджено в метааналізі 40 рандомізованих контрольованих досліджень (n >100 000), відповідно до якого кожні 10 мм рт. ст. зниження систолічного АТ супроводжувалися зниженням смертності на 17%, кардіоваскулярних подій – на 11% і альбумінурії – на 17% (Emdin C.A. et al., 2015). Ці ефекти були приблизно однаковими для різних класів антигіпертензивних засобів. Окрім інгібіторів РААС, знижувати альбумінурію спроможні недигідропіридинові блокатори кальцієвих каналів дилтіазем і верапаміл, але не показано, що зниження альбумінурії за допомогою цих препаратів забезпечує покращення наслідків для пацієнта.
Існує консенсус, що в осіб із діабетом і альбумінурією для досягнення оптимальної ниркової та кардіоваскулярної протекції АТ варто знижувати до <130/80 мм рт. ст. (для пацієнтів, схильних до постуральної гіпотензії, потрібно застосовувати менш суворі цілі). Ефективним складником антигіпертензивної терапії є обмеження вживання солі: рекомендації ADA радять обмежити щоденне надходження натрію до <2300 мг.
Комбіновані втручання
Пацієнти з ЦД потребують комплексної діагностики й лікування, спрямованого на зниження ризику всіх макро- та мікросудинних ускладнень, тобто модифікації поведінки й фармакотерапії гіперглікемії, АГ, дисліпідемії та мікроальбумінурії. Така тактика сприяє зменшенню частоти розвитку нефропатії, ретинопатії, автономної нейропатії, тяжкої альбумінурії та кардіоваскулярних катастроф, а в довготривалій перспективі – до зниження смертності від усіх причин, сповільнення зниження ШКФ і зменшення ризику прогресування ХХН до термінальних стадій ХНН.
Підсумки
ДХН – вагома проблема охорони здоров’я та поширена причина термінальних стадій ниркової недостатності. Крім того, ДХН асоціюється з кардіоваскулярними подіями й несприятливо впливає на виживаність. Прояви та прогноз у разі ДХН є дуже гетерогенними: наприклад, можливі неальбумінурична ДХН і регресія альбумінурії, проте тяжка альбумінурія, особливо в поєднанні з підвищеним АТ, залишається важливим маркером прогресування ураження нирок.
Лікування ДХН потребує комплексного підходу, який поєднує зниження кардіоваскулярного ризику із заходами для сповільнення прогресування хвороби нирок (контроль глікемії, пригнічення РААС і зниження АТ). Ефективне впровадження такого підходу зменшує ймовірність прогресування ДХН, кількість інших мікроваскулярних ускладнень і серцево-судинних подій, а також смертність.
Література
Selby N.M., Taal M.W. An updated overview of diabetic nephropathy: diagnosis, prognosis, treatment goals and latest guidelines. Diabetes Obes. Metab. 2020; 22 (Suppl. 1): 3-15. https://doi.org/10.1111/dom.14007.
