Новини конгресів ESC та EASD 2025 року з акцентом на системний метаболічний розлад і нейроускладнення діабету
Підготувала канд. мед. наук Ольга Королюк
Метаболічні розлади, як-от ожиріння й цукровий діабет (ЦД) 2-го типу, сягають масштабів пандемії та є однією з основних причин захворюваності та смертності у світі. 25 жовтня в Києві відбулася зустріч фахівців-ендокринологів «Endostory з Надією та Любов’ю», присвячена обговоренню найновіших даних, які висвітлювалися на конгресі Європейського товариства кардіологів (ESC), проведеному в Мадриді (Іспанія) з 29 серпня до 1 вересня, і Європейської асоціації з вивчення діабету (EASD), що відбувся у Відні (Австрія) 15-19 вересня.
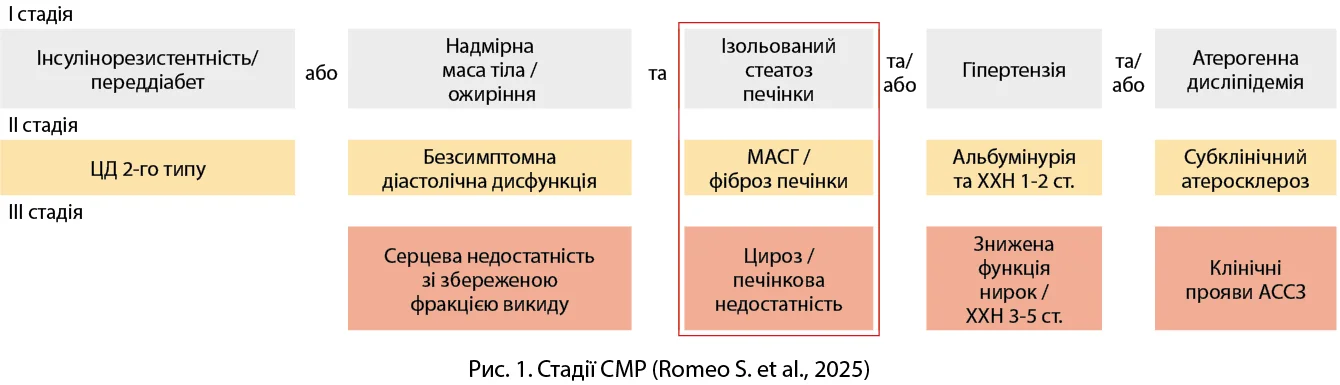
 Відкрила зустріч Любов Костянтинівна Соколова, докторка медичних наук, старша наукова співробітниця, завідувачка відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Вона наголосила на активному обговоренні проблеми системного метаболічного розладу (СМР), який став парадигмою сучасного життя. Практично в кожного пацієнта спостерігаються певні складові СМР, урахування котрих допомагає обрати найоптимальнішу персоніфіковану терапію. Цей термін запропоновано консенсусом Європейського товариства з вивчення атеросклерозу (Romeo S. et al., 2025). СМР охоплює сукупність метаболічних порушень, які вражають декілька органів і призводять до підвищеної захворюваності та смертності як від серцево-судинних захворювань (ССЗ), так і від інших причин. Етіологія СМР гетерогенна, з різноманітними, хоча й схожими за наслідками патогенетичними механізмами, які прогресують, формуючи згубне коло, що ускладнює ідентифікацію початкових причин хвороби та перешкоджає комплексному підходу до профілактики. Початок СМР можуть зумовлювати різні етіопатогенетичні чинники, які визначаються генетичною вразливістю окремих органів до нездорового харчування та малорухливого способу життя. Поступове порушення метаболічного гомеостазу на рівні кількох органів запускає прогресування СМР, який перетворюється на відносно дедиференційований розлад з накопиченням численних супутніх захворювань. Розрізняють три стадії СМР: I стадія визначається як наявність ізольованих а) інсулінорезистентності/переддіабету чи б) надмірної маси тіла / дисфункціонального ожиріння та принаймні однієї з таких ознак: ізольований стеатоз печінки, гіпертензія або атерогенна дисліпідемія; ІІ стадія визначається як ЦД 2-го типу, безсимптомна діастолічна дисфункція, метаболічно-асоційований стеатогепатит (МАСГ) / фіброз печінки, альбумінурія та хронічна хвороба нирок (ХХН) 1-2 ст., субклінічний атеросклероз без подій в анамнезі; ІІІ стадія визначається як симптоматична серцева недостатність зі збереженою фракцією викиду (СНзбФВ), цироз печінки або печінкова недостатність, знижена функція нирок / ХХН 3-5 ст., клінічний прояв атеросклеротичних ССЗ (АССЗ) (рис. 1).
Відкрила зустріч Любов Костянтинівна Соколова, докторка медичних наук, старша наукова співробітниця, завідувачка відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Вона наголосила на активному обговоренні проблеми системного метаболічного розладу (СМР), який став парадигмою сучасного життя. Практично в кожного пацієнта спостерігаються певні складові СМР, урахування котрих допомагає обрати найоптимальнішу персоніфіковану терапію. Цей термін запропоновано консенсусом Європейського товариства з вивчення атеросклерозу (Romeo S. et al., 2025). СМР охоплює сукупність метаболічних порушень, які вражають декілька органів і призводять до підвищеної захворюваності та смертності як від серцево-судинних захворювань (ССЗ), так і від інших причин. Етіологія СМР гетерогенна, з різноманітними, хоча й схожими за наслідками патогенетичними механізмами, які прогресують, формуючи згубне коло, що ускладнює ідентифікацію початкових причин хвороби та перешкоджає комплексному підходу до профілактики. Початок СМР можуть зумовлювати різні етіопатогенетичні чинники, які визначаються генетичною вразливістю окремих органів до нездорового харчування та малорухливого способу життя. Поступове порушення метаболічного гомеостазу на рівні кількох органів запускає прогресування СМР, який перетворюється на відносно дедиференційований розлад з накопиченням численних супутніх захворювань. Розрізняють три стадії СМР: I стадія визначається як наявність ізольованих а) інсулінорезистентності/переддіабету чи б) надмірної маси тіла / дисфункціонального ожиріння та принаймні однієї з таких ознак: ізольований стеатоз печінки, гіпертензія або атерогенна дисліпідемія; ІІ стадія визначається як ЦД 2-го типу, безсимптомна діастолічна дисфункція, метаболічно-асоційований стеатогепатит (МАСГ) / фіброз печінки, альбумінурія та хронічна хвороба нирок (ХХН) 1-2 ст., субклінічний атеросклероз без подій в анамнезі; ІІІ стадія визначається як симптоматична серцева недостатність зі збереженою фракцією викиду (СНзбФВ), цироз печінки або печінкова недостатність, знижена функція нирок / ХХН 3-5 ст., клінічний прояв атеросклеротичних ССЗ (АССЗ) (рис. 1).
Доповідачка зазначила, що скринінг факторів ризику має включати:
- Скринінг соціальних детермінант здоров’я (спосіб життя, шкідливі звички, сон, стрес, рівень освіти, соціальний статус).
- Вимірювання індексу маси тіла й окружності талії, співвідношення талії до зросту щорічно.
- Скринінг компонентів класичного метаболічного синдрому (артеріальний тиск >140/90 мм рт. ст.; рівень тригліцеридів ≥1,7 ммоль/л, холестерин ліпопротеїнів високої щільності <1,03 ммоль/л для чоловіків та <1,3 ммоль/л для жінок, гіперглікемія натще ≥5,6 ммоль/л або ≥7,8 ммоль/л через 2 години після стандартного навантаження глюкозою чи глікозильований гемоглобін (HbA1c) ≥5,7%; індекс НОМА ≥2,5) – щорічно для пацієнтів з СМР ІІ стадії; що 2-3 роки для пацієнтів з СМР I стадії або з анамнезом гестаційного діабету; що 3-5 років для решти осіб.
- Скринінг прогресування фіброзу печінки, пов’язаний з метаболічно-асоційованою стеатотичною хворобою печінки (МАСХП), – що 1-2 роки для осіб з діабетом, переддіабетом або ≥2 факторами метаболічного ризику за допомогою індексу FIB-4 = вік (роки) х АСТ (Од/л) / кількість тромбоцитів
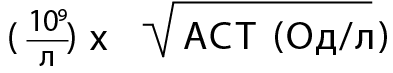 ); на низьку ймовірність цирозу; значення 1,45-3,25 відповідають проміжному ризику; значення >3,25 указують на високу ймовірність цирозу).
); на низьку ймовірність цирозу; значення 1,45-3,25 відповідають проміжному ризику; значення >3,25 указують на високу ймовірність цирозу). - Оцінка співвідношення альбуміну до креатиніну в сечі разом із сироватковими рівнями креатиніну / цистатину С для точної класифікації KDIGO щорічно для пацієнтів з СМР ІІ стадії; частіше для пацієнтів з СМР ІІІ стадії.
- Індексацію коронарного кальцію для осіб із проміжним 10-річним ризиком АССЗ для визначення потреби в інтенсивнішій профілактичній терапії.
- Скринінг субклінічної серцевої недостатності за допомогою ехокардіографії та/або серцевих біомаркерів з огляду на вік, супутні хвороби та фактори ризику.
Любов Костянтинівна зауважила, що МАСХП присутня на всіх стадіях СМР. Окрім того, встановлено, що МАСХП посилює ризик розвитку ішемічної хвороби серця, інфаркту міокарда, фібриляції передсердь, інсульту та СНзбФВ. Спільні патофізіологічні механізми охоплюють інсулінорезистентність, хронічне запалення, оксидативний стрес, ендотеліальну дисфункцію й атерогенну дисліпідемію, які разом спричиняють як фіброгенез печінки, так і пошкодження судин. Стадія фіброзу, найсильніший предиктор печінкових наслідків, також корелює із субклінічним атеросклерозом і серцево-судинною смертністю, проте залишається неврахованою в сучасних моделях ризику ССЗ. Неінвазивні маркери фіброзу, як-от FIB-4 й еластографія, набувають дедалі більшої популярності у стратифікації серцево-судинного ризику.
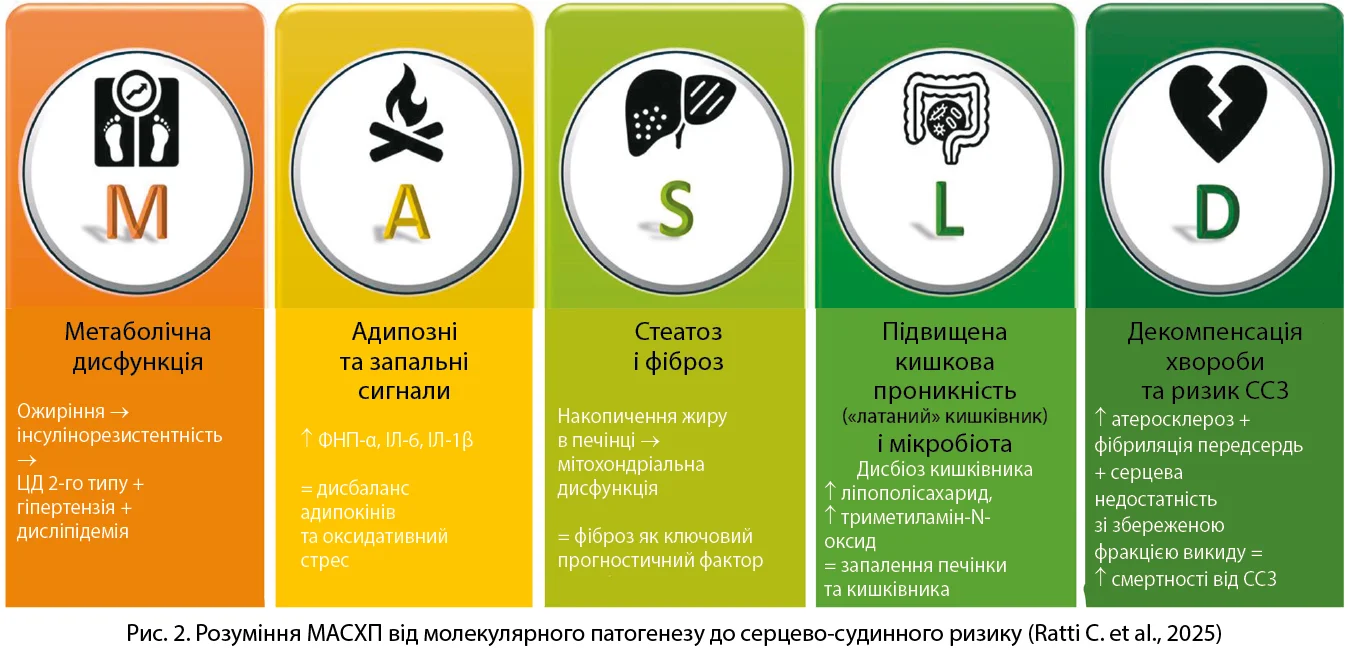
Ба більше, абревіатура МАСХП (англ. MASLD – metabolic dysfunction-associated steatotic liver disease) підсумовує багатосистемну патофізіологію, яка пов’язує метаболічне захворювання печінки із серцево-судинним ризиком (рис. 2). Метаболічна дисфункція ініціює стеатоз печінки. Адипозапалення, тобто запалення, спричинене жировою тканиною, й оксидативний стрес зумовлюють прогресування стеатозу, що переростає у фіброз печінки – ключовий прогностичний маркер. Синдром підвищеної кишкової проникності та дисбактеріоз посилюють ураження печінки й судин. Прогресування хвороби призводить до атеросклерозу, СНзбФВ та серцево-судинних подій. Ця інтегративна модель підкреслює необхідність міждисциплінарної допомоги та раннього оцінювання кардіометаболічного ризику в пацієнтів з МАСХП (Ratti C. et al., 2025).
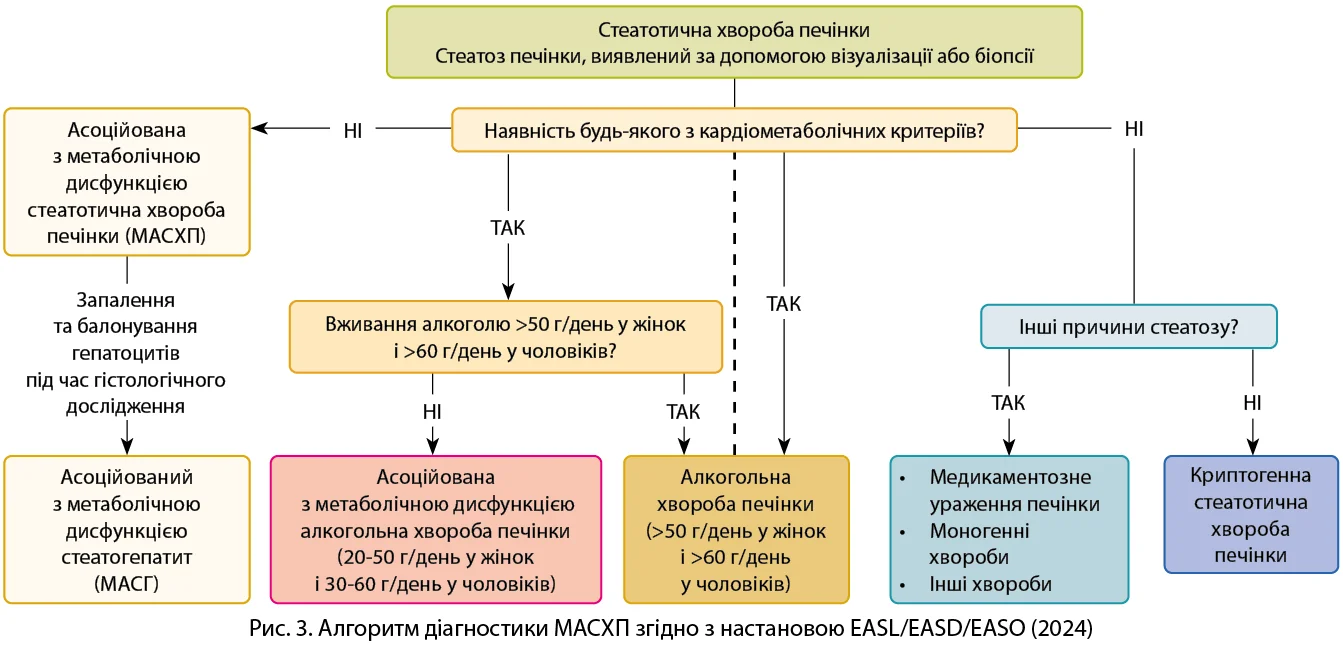
Діагноз МАСХП установлюється після виявлення стеатозу печінки методом візуалізації, за наявності будь-яких кардіометаболічних критеріїв і за відсутності надмірного вживання алкоголю або інших причин стеатозу печінки (рис. 3).
Що стосується лікування, то пацієнтам з МАСХП рекомендується схуднення. Втрата ≥7-10% маси тіла забезпечує зниження фіброзу печінки. Навіть пацієнтам з МАСХП і нормальною вагою рекомендується втрата 3-5% маси тіла. Для профілактики МАСХП і гепатоцелюлярної карциноми (ГЦК) настанови акцентують на запобіганні ожиріння, здоровому харчуванні, регулярній фізичній активності, уникненні куріння та вживання алкоголю (рис. 4).
Окрім модифікації способу життя, пацієнтам з МАСГ і фіброзом F2-F3 настанови пропонують призначення ресметирому – часткового активатора рецептора тиреоїдних гормонів β, що зменшує накопичення жиру в печінці. Препарат схвалений Управлінням США з контролю продовольства та медикаментів (FDA) й у деяких країнах Європи. На сьогодні це єдиний варіант фармакотерапії МАСГ, що має застосовуватися разом з дієтою та фізичними вправами. Доказовою базою ресметирому є дослідження MAESTRO-NASH за участю 966 пацієнтів, які були рандомізовані до приймання ресметирому в дозах 80 мг (n=322), 100 мг (n=323) або плацебо (n=323). Резолюція стеатогепатиту без погіршення фіброзу була досягнута у 25,9 та 29,9% пацієнтів у групах, що отримували 80 і 100 мг ресметирому відповідно, порівняно з 9,7% пацієнтів у групі плацебо (P <0,001 для обох порівнянь із плацебо). Покращення фіброзу щонайменше на один ступінь без погіршення показника активності МАСХП було досягнуто у 24,2 та 25,9% пацієнтів у групах, що отримували 80 і 100 мг ресметирому відповідно, порівняно із 14,2% пацієнтів у групі плацебо. Проте на сьогодні ресметиром не зареєстрований в Україні.
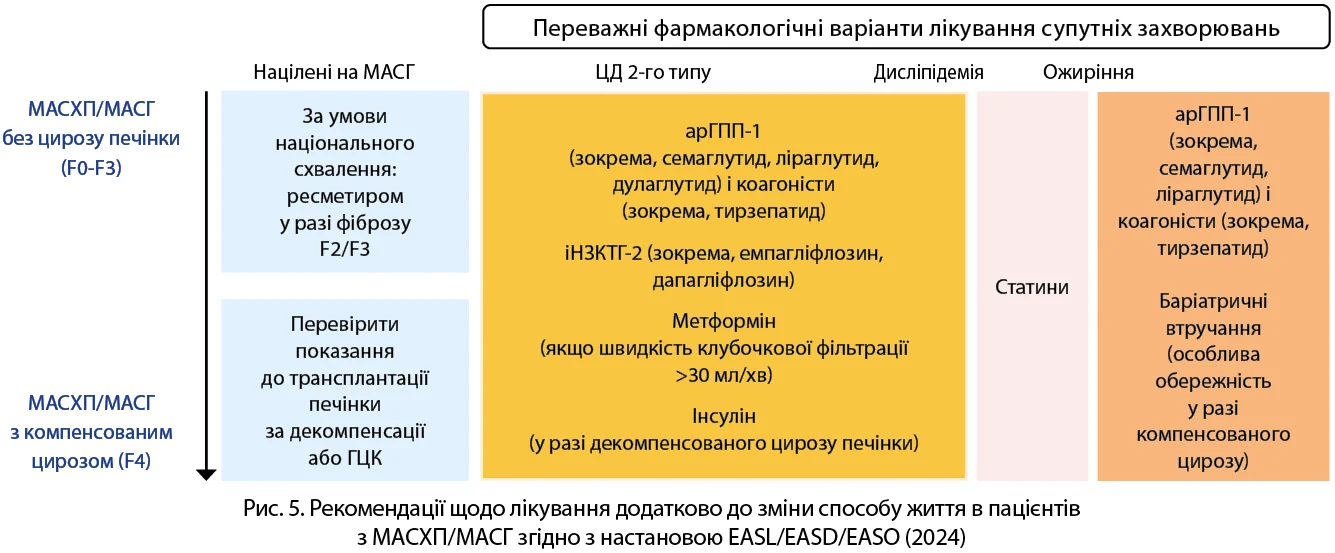
Настанови акцентують на важливості адекватного лікування супутніх захворювань, які асоціюються з МАСХП, – ЦД 2-го типу, дисліпідемії й ожиріння. Пріоритетними засобами для лікування ЦД 2-го типу в пацієнтів з МАСХП є агоністи рецепторів глюкагоноподібного пептиду-1 (арГПП-1) та інгібітори натрієзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2), які демонструють певні переваги щодо покращення печінкових, метаболічних і серцево-судинних наслідків (рис. 5). Для корекції дисліпідемії пріоритетними залишаються статини, котрі, як відомо, можуть підвищувати рівні трансаміназ, тому їх застосування в пацієнтів з МАСГ часто проблематичне.
Л.К. Соколова зазначила: враховуючи складність патофізіології МАСХП/МАСГ, треба впливати на декілька цілей і шляхів для покращення результатів фармакологічного втручання, що обґрунтовує доцільність комбінованої терапії. Препарати з різними механізмами дії, спрямовані на стеатоз печінки, запалення та фіброз, можна комбінувати. Такі комбінації повинні бути безпечними й мати позитивні ефекти за межами печінки, зокрема сприяти втраті маси тіла, захисту серцево-судинної системи, сенсибілізації інсуліну та зниженню ліпідів.
На думку доповідачки, одним з таких засобів є L-Бетаргін® – багатофункціональний метаболічний цитопротектор. До його складу входять три компоненти – бетаїн (1 г), L-карнітин (300 мг) і аргініну цитрат (1 г), які відіграють ключову роль у підтриманні метаболічного здоров’я, особливо в разі МАСХП і діабету. Вказаним станам притаманні порушення циклу метилювання, котрий залежить від збалансованої взаємодії метаболізму фолатів, метіоніну та транссульфурації гомоцистеїну. Порушення цього циклу впливає на експресію генів, обмін амінокислот і ліпідів, гормональну регуляцію, імунну відповідь і детоксикацію.
Основним донором метильної групи в метіонін-гомоцистеїновому циклі є бетаїн, який сприяє перетворенню гомоцистеїну на метіонін, особливо при дефіциті вітаміну B12 або фолієвої кислоти, що дає змогу знизити ризик розвитку ССЗ, інсулінорезистентності та фіброзу печінки. Бетаїн бере участь у синтезі фосфатидилхоліну через шлях Кеннеді, підтримує баланс глутатіону й S-аденозилметіоніну, знижує оксидативний стрес, запалення, стеатоз і фіброз. Він необхідний для цілісності клітинних мембран, нейросигналізації, синтезу білка та внутрішньоклітинної гідратації. Дослідження показали, що доза бетаїну 2,5 г/добу протягом 9 тижнів сприяє зниженню маси тіла, а доза понад 360 мг/добу – зниженню гомоцистеїну, С-реактивного білка (СРБ), фактора некрозу пухлин α (ФНП-α) й інтерлейкіну-1β (ІЛ-1β) (Alfthan G. et al., 2004; Kathirvel E. et al., 2010; Detopoulou P. et al., 2008).
Карнітин – ендогенна речовина, що забезпечує транспортування жирних кислот у мітохондрії для β-окислення. При ЦД 2-го типу його рівень знижується, що погіршує чутливість до інсуліну. L-карнітин покращує утилізацію глюкози, знижує рівні глікемії натще, холестерину та холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ). Він також чинить протизапальну дію, нормалізує вміст гомоцистеїну й активує антиоксидантні механізми, зокрема підвищує активність супероксиддисмутази та знижує рівні маркерів окисного стресу.
L-аргінін є попередником оксиду азоту (NO), що регулює судинний тонус і покращує функцію ендотелію, тобто є фізіологічним ангіопротектором.
Він знижує адгезію лейкоцитів до судинної стінки та їхню ушкоджувальну дію на ендотелій; пригнічує адгезію й агрегацію тромбоцитів і пристінкове тромбоутворення, знижує проліферацію гладком’язових клітин і зміну стінки судини.
L-аргінін стимулює проліферацію та поділ β-клітин, знижує запалення, покращує мікроциркуляцію, зменшує оксидативний стрес і сприяє зниженню рівня глюкози шляхом підвищення вивільнення інсуліну, що може відтермінувати виникнення діабету. Крім того, L-аргінін допомагає при кетоацидозі: підсилює синтез NO, що покращує мікроциркуляцію, доставлення кисню та знижує тканинну гіпоксію, яка посилює кетогенез. Здатність активувати цикл сечовини сприяє виведенню аміаку та зменшенню метаболічної інтоксикації. L-аргінін також покращує утилізацію кетонових тіл, зменшуючи кислотне навантаження; захищає ендотелій і мітохондрії, які страждають у разі кетоацидозу через оксидативний стрес; підтримує глюконеогенез та енергетичний баланс, допомагає клітинам швидше виходити з енергетичної кризи. При хронічних захворюваннях печінки знижуються активність і кількість ендотеліальної NO-синтази, зменшується синтез NO. Це призводить до втрати здатності судин до вазодилатації, зниження кровопостачання та фіброутворення. L-аргінін чинить судинорозширювальний вплив, знижує опір печінкових синусоїдів, підвищує печінковий кровотік завдяки збільшенню утворення NO (антигіпоксичний ефект), покращує оксигенацію тканин печінки (Kakumitsu S. et al., 1998). Крім того, аргінін усуває енергодефіцит шляхом синтезу аденозинтрифосфату (АТФ) у циклі Кребса, покращує мікроциркуляцію, знешкоджує токсичний аміак, прискорює виведення токсичних метаболітів і ксенобіотиків. Аргінін знижує в’язкість білково-ліпідного контакту мембран гепатоцитів (Liang M. et al., 2018; Häberle J. et al., 2019).
Важливо, що завдяки метаболічній активації, покращенню ліпідного обміну та підвищенню енергетичного потенціалу клітин L-Бетаргін® опосередковано сприяє зниженню маси тіла.
Бетаїн зменшує жирову масу шляхом стимуляції утилізації нейтрального жиру гепатоцитами, покращує внутрішньоклітинну гідратацію та створює сприятливі умови для синтезу білка. Він також активує метаболічні процеси, що забезпечує «спалювання» жиру, особливо в умовах обмеження калорій. L-карнітин посилює β-окислення жирних кислот у мітохондріях, що сприяє зменшенню жирових запасів, покращенню енергозабезпечення тканин і зниженню енергодефіциту (Stephens F.B. et al., 2013; Musazadeh V. et al., 2023). Це особливо важливо для підтримання фізичної активності й витривалості. Рекомендовані дози для метаболічної підтримки та зменшення жирової маси становлять від 1 до 6 г/добу. Отже, L-Бетаргін® може сприяти корекції маси тіла в пацієнтів з СМР, особливо в поєднанні з дієтою та фізичною активністю.
Відзначено гепато-, кардіо- й ангіопротекторну дії L-Бетаргіну. Він зменшує стеатоз, покращує ліпідний обмін, знижує рівень глікемії натще, нормалізує портальний кровотік і знижує ризик прогресування МАСХП, атеросклерозу й інсулінорезистентності.
Дослідження показали, що 12-тижневе використання засобу забезпечує зменшення цитолізу, стеатозу та покращення метаболічного профілю.
Антифібротична дія L-Бетаргіну пояснюється синергічним впливом його компонентів на ключові патогенетичні механізми фіброзу печінки при МАСХП і метаболічному синдромі. Зокрема, бетаїн знижує рівень гомоцистеїну – амінокислоти, яка стимулює фіброгенез, а також нормалізує метаболічний баланс між глутатіоном і S-аденозилметіоніном, що сприяє зменшенню оксидативного стресу та запалення. Він також стабілізує мембрани гепатоцитів і зменшує стеатоз, що запобігає переходу жирової інфільтрації у фібротичні зміни. L-карнітин покращує мітохондріальну функцію, знижує накопичення токсичних ліпідів і забезпечує енергетичну підтримку клітин, що зменшує ушкодження печінкової тканини та пригнічує фіброгенез. Аргініну цитрат покращує мікроциркуляцію й оксигенацію тканин, забезпечує регенерацію гепатоцитів і знижує ендотеліальну дисфункцію – чинник, який супроводжує прогресування фіброзу. Завдяки цим механізмам L-Бетаргін® сприяє зменшенню фібротичних змін у печінці, покращує її функціональний стан і знижує ризик переходу МАСХП у МАСГ або цироз. Фармакодинамічні ефекти L-Бетаргіну підсумовує таблиця 1.
Отже, компоненти L-Бетаргіну діють на всіх стадіях розвитку МАСХП (стеатоз, стеатогепатит, фіброз і цироз), а також позитивно впливають на інші компоненти СМР – інсулінорезистентність, ожиріння, дисліпідемію, діабет, метаболічний синдром та ССЗ. Завдяки метаболічній дії L-Бетаргін® сприяє зниженню маси тіла – основного чинника, що впливає на прогноз пацієнтів з СМР загалом і МАСХП зокрема. На вітчизняному ринку L-Бетаргін® (фармацевтична компанія Vorwarts Pharma) доступний у формі питного розчину по 10 мл у стіках. Завдяки добрій переносимості може застосовуватися навіть у дітей.
Рекомендовані дози для дітей від 3 років – 1 стік 1-2 рази на день після їди; для дорослих – 1 стік 2-3 рази на день після їди впродовж 1-3 місяців.
 Продовжила зустріч Надія Миколаївна Жердьова, докторка медичних наук, професорка, заслужена діячка науки і техніки України, завідувачка відділу діагностики та лікування метаболічних захворювань ДНУ «Центр інноваційних медичних технологій НАМН України». Вона зупинилася на понятті діабетичного дистресу – однієї з найпоширеніших проблем психічного здоров’я в людей з діабетом, який впливає на якість життя та компенсацію ЦД. Це фактор ризику субоптимальних глікемічних результатів, порушення самоконтролю, зниження якості життя та депресії. Лікування дистресу потребує індивідуального підходу.
Продовжила зустріч Надія Миколаївна Жердьова, докторка медичних наук, професорка, заслужена діячка науки і техніки України, завідувачка відділу діагностики та лікування метаболічних захворювань ДНУ «Центр інноваційних медичних технологій НАМН України». Вона зупинилася на понятті діабетичного дистресу – однієї з найпоширеніших проблем психічного здоров’я в людей з діабетом, який впливає на якість життя та компенсацію ЦД. Це фактор ризику субоптимальних глікемічних результатів, порушення самоконтролю, зниження якості життя та депресії. Лікування дистресу потребує індивідуального підходу.
Ключовим питанням є визначення факторів, які спричиняють дистрес. Проведено два дослідження – DIA-LINK1 при ЦД 1-го типу та DIA-LINK2 при ЦД 2-го типу, в яких визначали взаємозв’язок між віком, статтю, індексом маси тіла, країною, де народилися пацієнти, рівнем освіти, тривалістю діабету, концентрацією HbA1c, режимом лікування діабету (інсулінотерапія та її тип, застосування інших протидіабетичних засобів), часом виникнення ускладнень, психологічним здоров’ям, діабетичним дистресом, симптомами депресії, глікемічним контролем за результатами безперервного моніторингу рівня глюкози в крові, зокрема часу в цільовому діапазоні. При обох типах діабету факторами, які спричиняли дистрес, були гіпоглікемія (<3,9 ммоль/л), гіперглікемія (>8,3 ммоль/л) і варіабельність глікемії, причому найчастіше дистрес виникав у разі гіперглікемії >10 ммоль/л (Lehmann G. et al., 2024).
За даними метааналізу 55 досліджень, які сумарно включали 36 998 учасників, дистрес виявлено у 20-40% пацієнтів із ЦД 1-го типу та 36% пацієнтів із ЦД 2-го типу (Perrin N.E. et al., 2017). Дистрес у разі діабету погіршує якість життя, призводить до депресії, порушення самоконтролю діабету та субоптимального глікемічного контролю.
Надія Миколаївна наголосила на результатах дослідження, що порівнювали впливи двох нейролептиків (оланзапін, клозапін) з контролем. Було виявлено, що обидва антипсихотичні препарати підвищували рівні глікемії натще та після їди. Такі результати пояснюються зменшенням кількості β-клітин з одночасним збільшенням кількості α-клітин, що призводить до зменшення секреції інсуліну та збільшення секреції глюкагону. Оланзапін і клозапін порушують чутливість до інсуліну шляхом впливу на тирозин β-субодиниці інсулінового рецептора та фосфорилювання Аkt у різних тканинах – печінці, м’язах, жировій тканині, що призводить до порушення толерантності до вуглеводів. Окрім того, вони негативно модулюють кишкову мікробіоту, дегранулюють і ультраструктурно змінюють клітини підшлункової залози (Panariello F. et al., 2012; Qian L. et al., 2023). Отже, призначення антипсихотичних препаратів може навіть погіршити стан пацієнтів.
Що стосується діабету та деменції, то метааналіз, який сумарно включав понад 8,8 мільйона пацієнтів з діабетом, показав, що 60% з них мають деменцію (Cao F. et al., 2024). Механізмами нейрональної дисфункції та деменції є насамперед гіперінсулінемія й інсулінорезистентність головного мозку – так званий четвертий рівень інсулінорезистентності з порушенням інсулінового сигналінгу. Іншим чинником ураження інсулінових рецепторів у головному мозку та загибелі нейрональних клітин є гіпоглікемія. Вміст глікогену в головному мозку мінімальний. У разі рецидивів гіпоглікемії принаймні раз на тиждень глікоген не встигає відновитися, що неминуче призводить до апоптозу нейронів. Біологічні дослідження показали, що ускладнення, пов’язані з діабетом, як-от інсулінорезистентність, гострі коливання рівня глюкози в крові, зміни швидкості кровотоку та хронічне запалення, посилюють ризик деменції. Дослідження на тваринах з діабетом продемонстрували, що зменшення проліферації гранулярних клітин у ділянках гіпокампа CA1 і CA3 призводить до апоптозу нейронів і, як наслідок, до деменції. Діабет також асоціюється з атрофією головного мозку, змінами судинної системи мозку, порушеннями синаптичної пластичності й дисфункцією нейрогліальних клітин, що в сукупності негативно впливає на функціонування мозку. Візуалізаційні та нейропатологічні дослідження показують, що мозок пацієнтів з діабетом може зазнавати змін, схожих на ті, які спостерігаються в пацієнтів на ранній стадії хвороби Альцгеймера. Хвороба Альцгеймера характеризується накопиченням білків β-амілоїду, гіперфосфорилюванням t-білка й утворенням нейрофібрилярних сплетінь, що спричиняє розвиток деменції. Останні дослідження підтверджують: деменція та когнітивні порушення є значними ускладненнями, пов’язаними із ЦД 2-го типу (Cao F. et al., 2024).
Доповідачка зауважила: крім правильної індивідуальної протидіабетичної терапії, потрібна також метаболічна підтримка для когнітивного відновлення. На тлі дистресу та вже наявних когнітивних розладів доцільно використовувати нейропротектори – засоби, що мають прямий активувальний вплив на навчання, покращення пам’яті та розумової діяльності, а також підвищують стійкість організму до агресивних впливів гіпоксії й інтоксикації. Зокрема, це Когнітіум®, який містить N-ацетил-L-аспарагінову кислоту – синтетичний аналог N-ацетиласпартату (NAA), що є одним з найважливіших метаболітів центральної нервової системи. В організмі NAA синтезується в мітохондріях нейронів з аспартату й ацетил-КоА. Частина NAA транспортується до олігодендроцитів, де розщеплюється на ацетат і аспартат. Ацетат використовується для синтезу ліпідів, необхідних для мієлінізації нервових волокон, а аспартат – для вироблення енергії шляхом окисного фосфорилювання. В організмі NAA перетворюється на N-ацетил-аспартил-глутамат (NAAG), який виконує нейропротекторну функцію, активуючи пресинаптичний метаботропний глутаматний рецептор mGluR3, що знижує вивільнення глутамату, зменшуючи ризик глутаматергічної ексайтотоксичності – одного з ключових механізмів нейродегенерації, зокрема при хворобі Альцгеймера. Отже, NAAG забезпечує ендогенний механізм нейропротекції, захищаючи нейрони від токсичності глутамату.
Обидва метаболіти, NAA та NAAG, відіграють критичну роль у підтриманні функціональної цілісності нейронів, регуляції нейромедіаторної передачі, енергетичному забезпеченні клітин, синтезі мієліну й захисті від токсичних впливів. Зниження рівня NAA спостерігається при діабеті, депресії, тривожних розладах і нейродегенеративних хворобах, що робить його важливим маркером нейрональної активності та потенційною мішенню для терапії.
Когнітіум® є джерелом N-ацетил-L-аспарагінової кислоти, що сприяє підвищенню рівнів NAA та NAAG у мозку, забезпечуючи: 1) стійкість нейронів до пошкоджень; 2) активацію внутрішніх резервів мозку; 3) покращення синаптичної передачі; 4) зниження оксидативного стресу; 5) стабілізацію нейрональної активності; 6) посилення ефекту анксіолітичних препаратів; 7) нормалізацію загального та церебрального метаболізму.
Крім того, NAA здатний пригнічувати ранні етапи утворення β-амілоїду, запобігаючи формуванню його токсичних агрегатів. Існують дані, що NAA змінює конформацію β-амілоїду на неамілоїдогенну форму. Отже, підвищення рівня NAA шляхом стимуляції його синтезу або замісної терапії (Когнітіумом) розглядається як перспективна стратегія профілактики та лікування хвороби Альцгеймера. Завдяки високій біодоступності Когнітіум® рекомендований для перорального приймання. Він сприяє підвищенню стійкості нейронів до стресу, нормалізує передачу імпульсів. Засіб не має седативної дії, це когнітивний модифікатор з нейропротекторною дією.
N-ацетил-L-аспарагінова кислота має комплексний метаболічний вплив на нервову систему, що сприяє корекції емоційно-когнітивних порушень у пацієнтів із хронічними соматичними хворобами в умовах перманентного стресу (Чабан О.С., Хаустова О.О., 2023). Механізми дії охоплюють відновлення нейромедіаторної регуляції, стабілізацію церебрального метаболізму, зменшення проявів тривоги, астенії та когнітивного виснаження. N-ацетил-L-аспарагінова кислота впливає на кальцієвий гомеостаз у нейронах, зокрема регулює внутрішньоклітинний обмін іонів кальцію (Ca2+), що є критично важливим для синаптичної передачі, нейропластичності, захисту нейронів від індукованої глутаматом ексайтотоксичності; стабілізує кальцієві канали, що сприяє зниженню нейрональної гіперзбудливості – важливого механізму при тривожних і астенічних розладах; опосередковано знижує рівень індукованого стресом нейрозапалення, котре часто супроводжується порушенням кальцієвого обміну. Фармакодинамічні ефекти Когнітіуму підсумовує таблиця 2.
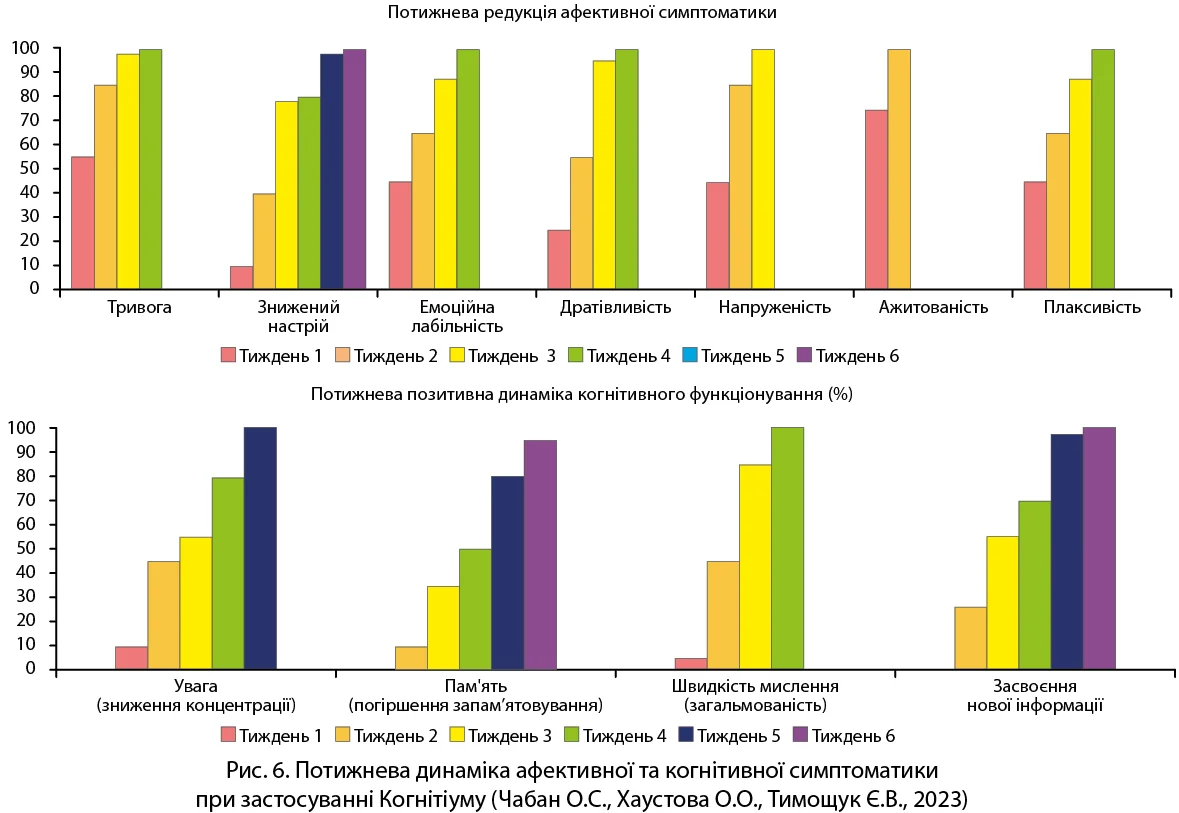
Дослідження, проведене О.С. Чабаном та О.О. Хаустовою (2023), продемонструвало, що застосування Когнітіуму протягом 60 днів у пацієнтів із хронічними соматичними хворобами сприяло зниженню симптомів тривожності та депресії вже на 7-й день лікування; крім того, спостерігалося покращення когнітивних функцій – пам’яті, уваги, швидкості мислення й засвоєння нової інформації (рис. 6).
Продемонстровано добру переносимість засобу. Автори дійшли висновку, що Когнітіум® діє як багатофункціональний нейрометаболіт, який підтримує енергетичний баланс, нейромедіаторну регуляцію та когнітивну стабільність у пацієнтів із психоемоційними порушеннями на тлі соматичних захворювань.
Зважаючи на значну поширеність діабетичного дистресу, когнітивних розладів та уражень нервової системи в осіб з діабетом і СМР, їхні негативні впливи на захворюваність, смертність та якість життя пацієнтів, негативні впливи застосування традиційних антидепресантів, у комплексній терапії доцільно використовувати Когнітіум® для корекції емоційно-когнітивних порушень. На вітчизняному ринку Когнітіум® (фармацевтична компанія Vorwarts Pharma) доступний у формі питного розчину по 10 мл в ампулах. Завдяки добрій переносимості він може застосовуватися навіть у дітей. Рекомендовані дози для дітей 3-6 років – по 1/2 ампули (5 мл) вранці; для дітей 6-18 років – по 1 ампулі вранці; для дорослих – 2 ампули на добу (вранці та вдень).
Переваги Когнітіуму в багатодисциплінарному контексті:
- добре переноситься пацієнтами з артеріальною гіпертензією, ЦД, постковідним синдромом;
- не впливає на артеріальний тиск, не спричиняє седації та звикання;
- може використовуватися в пацієнтів, які відмовляються від психотропів через стигму;
- сумісний з базовою фармакотерапією (антидепресанти, анксіолітики, ноотропи, цукрознижувальні засоби);
- не потребує титрування або поступового скасування;
- дає ранній клінічний ефект, що важливо для мотивації пацієнтів.