Неалкогольна жирова хвороба печінки та метаболічна дисфункція, асоційована із жировою хворобою печінки: нюанси діагностики та лікування
Підготувала канд. мед. наук Тетяна Можина
Неалкогольна жирова хвороба печінки (НАЖХП) визнана провідною причиною хронічних захворювань печінки в усьому світі з рівнем глобальної поширеності 25-30%. Ця патологія асоціюється з вірогідною трансформацією в цироз, гепатоцелюлярну карциному та супроводжується значним економічним тягарем (Younossi Z. et al., 2023). Згідно з рекомендаціями Американської асоціації з вивчення захворювань печінки (AASLD, 2023) НАЖХП діагностують на підставі виявлення макровезикулярного стеатозу печінки з ураженням ≥5% гепатоцитів за відсутності альтернативних причин стеатозу.
Зважаючи на тісний зв’язок НАЖХП із такими етіологічними чинниками, як ожиріння, метаболічний синдром і цукровий діабет (ЦД) 2 типу, прогнозоване зростання поширеності цих метаболічних захворювань супроводжуватиметься збільшенням захворюваності на НАЖХП. У зв’язку із цим 2020 року міжнародна група експертів із 22 країн запропонувала змінити термін «НАЖХП» і модифікувати дефініцію захворювання на таку, що точніше відображає патогенез (Eslam M. et al., 2020). Так з’явився новий термін – метаболічна дисфункція, асоційована із жировою хворобою печінки (МАЖХП), яку пропонується діагностувати за одночасного виявлення надлишкової ваги / ожиріння, або ЦД, або ознак метаболічної дисфункції (Eslam M. et al., 2020). Зазначена семантична модифікація не лише вплинула на формулювання захворювання, торкнулася діагностичних алгоритмів, а й сколихнула хвилю обговорень щодо оптимального лікування НАЖХП/МАЖХП.
Розгляду цього питання була присвячена доповідь асистентки кафедри загальної практики (сімейної медицини) Національного медичного університету ім. О.О. Богомольця (м. Київ), кандидата медичних наук Олени Олександрівни Погребняк «Метаболічні дисфункції при НАЖХП: наслідки та сучасні шляхи їх корекції», яка пролунала під час щорічного освітнього проєкту «Школа ендокринолога». Розкриваючи цю тему, доповідачка зазначила основні відмінності та подібності діагностичного алгоритму НАЖХП та МАЖХП, а також сучасні терапевтичні підходи до корекції цієї патології.
Від дефініції до етіопатогенезу
О.О. Погребняк підкреслила, що корекція дефініції захворювання зумовила появу певних змін у діагностичному алгоритмі. Раніше підтвердження діагнозу НАЖХП передбачало застосування сироваткових біомаркерів, візуалізаційних методів дослідження, за потреби – гістологічного аналізу біоптатів за відсутності надмірного вживання алкоголю, хронічного вірусного гепатиту й інших конкурувальних причин стеатозу печінки. Встановлення діагнозу МАЖХП ґрунтується на одночасному виявленні ознак стеатозу печінки з наявністю одного з трьох метаболічних станів: ЦД, надмірної ваги / ожиріння або щонайменше двох метаболічних порушень (рис. 1).
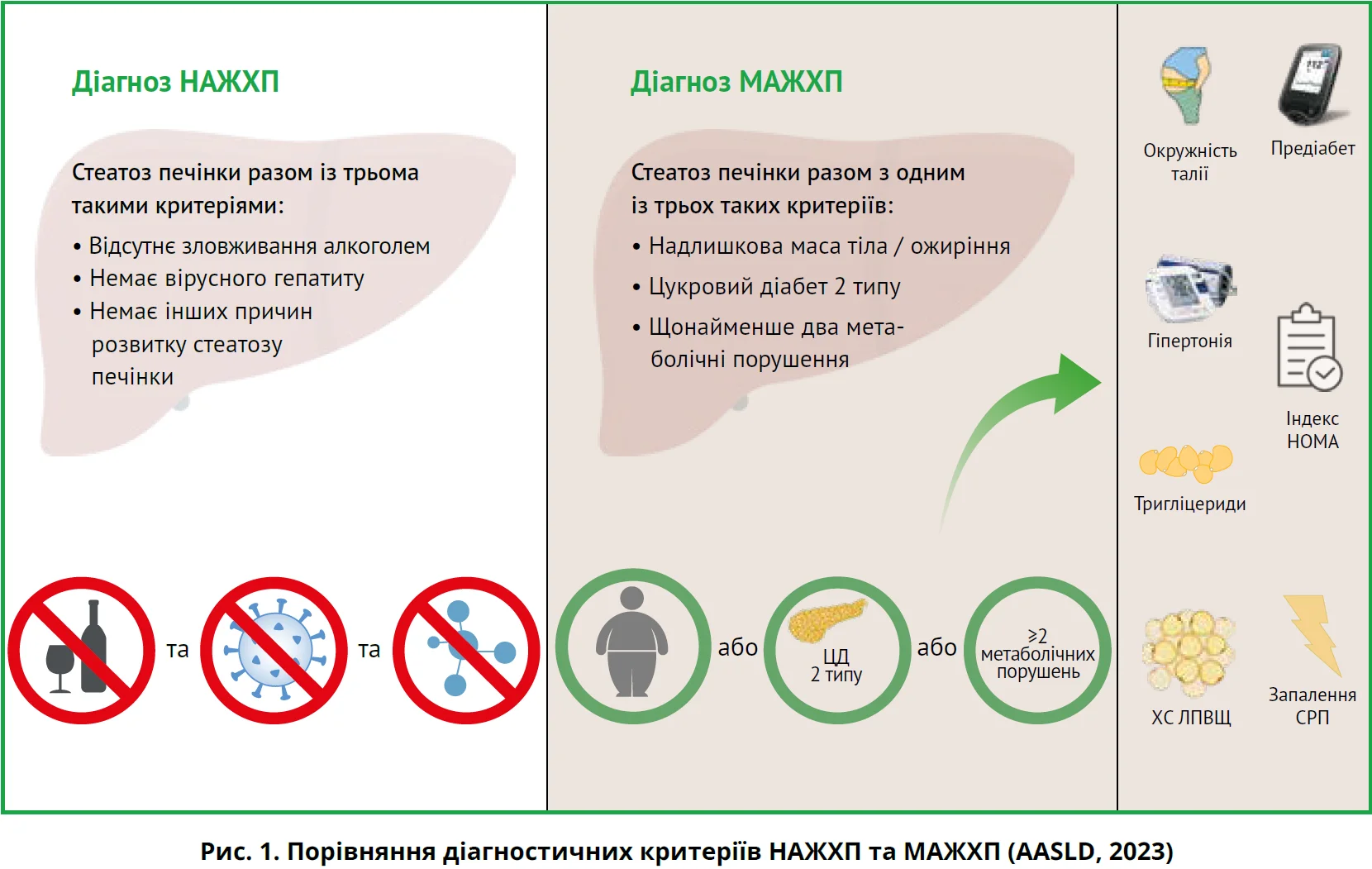
Перелік метаболічних порушень залишився незміненим:
- окружність талії >90 см у чоловіків і >80 см у жінок;
- предіабет (глікозильований гемоглобін 5,7-6,4%, або рівень глікемії натще в діапазоні 5,6-6,9 ммоль/л, або концентрація глюкози через 2 години після навантаження 7,8-11,0 ммоль/л);
- артеріальний тиск >130/85 мм рт. ст. або без застосування гіпотензивних лікарських засобів;
- холестерин ліпопротеїнів високої щільності (ХС ЛПВЩ) <1,0 ммоль/л для чоловіків та <1,3 ммоль/л для жінок або медикаментозна терапія;
- наявність інсулінорезистентності (індекс HOMA-IR ³2,5);
- системне запалення, рівень якого відображає рівень високочутливого С-реактивного протеїну (СРП >2 мг/л).
Чинники ризику НАЖХП, які спричиняють розвиток патології в дітей і дорослих, також залишилися незміненими: гіподинамія, збагачення раціону насиченими жирами, фруктозою та зменшення частки складних вуглеводів, чоловіча стать, вік, пубертатний період, дефіцит естрогенів, надмірна вага, вісцеральне ожиріння, інсулінорезистентність. Імовірність розвитку НАЖХП збільшується на тлі предіабету, метаболічного синдрому, ЦД 2 типу, артеріальної гіпертензії, дисліпідемії, генетичної схильності, порушення мікробіому, хронічних інфекцій (вірусний гепатит), впливу токсинів, ліків, алкоголю. До ймовірних чинників ризику відносять гіпотироїдизм, гіпопітуїтаризм, гіпогонадизм, обструктивне апное уві сні, синдром полікістозних яєчників, парентеральне харчування, стрімку втрату ваги, народження з низькою вагою або надвагою, перенесену панкреатодуоденальну резекцію.
Патогенетичний ланцюг МАЖХП подібний до НАЖХП: збільшення надходження жирних кислот до печінки, зменшення транспорту ліпопротеїнів низької щільності / тригліцеридів, інгібування β-окислення жирних кислот спричиняють ушкодження гепатоцитів унаслідок активації оксидативного стресу. Вивільнення прозапальних цитокінів із наступною активацією імунних механізмів, фіброгенезу зумовлює трансформацію стеатозу в неалкогольний стеатогепатит, цироз печінки, який супроводжується розвитком печінкової недостатності
та трансформацією в гепатоцелюлярну карциному.
Авторитетні медичні спільноти визнають доцільність заміни терміна «НАЖХП» на «МАЖХП»: Міжнародний експертний консенсус (2020) підтримав необхідність зміни дефініції, Американська асоціація серця (2022) визнала МАЖХП незалежним чинником розвитку серцево-судинних захворювань. Клінічне значення МАЖХП настільки велике, що деякі експерти прогнозують: невдовзі буде введений рутинний скринінг МАЖХП для оцінки серцево-судинного ризику, а корекція цієї метаболічної патології, можливо, сприятиме зниженню цього ризику.
Діагностика
Діагностика НАЖХП базується на комплексному аналізі декількох важливих параметрів: відсутність зловживання алкоголю (припустимий рівень вживання <30 г/добу для чоловіків та <20 г/добу для жінок), обтяжений сімейний анамнез щодо ЦД, артеріальної гіпертензії, серцево-судинної патології, прийом ліків, здатних спровокувати розвиток стеатозу печінки (EASL, 2016). Під час об’єктивного дослідження обов’язково вимірюються індекс маси тіла, окружність талії, під час лабораторно-інструментального дослідження доводять відсутність інфікування вірусними гепатитами В, С, аналізують показники загального аналізу крові, визначають рівень печінкових ферментів (АЛТ, АСТ, ГГТП), глюкози плазми натще, глікозильованого гемоглобіну, інсуліну, індексу НОМА-IR, ХС ЛПВЩ, тригліцеридів, сечової кислоти. Проводять пероральний глюкозотолерантний тест, ультразвукове дослідження органів черевної порожнини та органів малого таза.
Золотим стандартом у діагностиці стеатозу та фіброзу печінки залишається біопсія, але через її інвазивність, високу вірогідність ускладнень, пов’язаних з хірургічним втручанням, та незручність використання в динаміці лікування, у повсякденній клінічній практиці рекомендується використовувати неінвазивні методи. Найпоширенішим неінвазивним маркером фіброзу є індекс фіброзу-4 (FIB-4). Розрахунок цього показника визнано найбільш доцільним через те, що діагностична цінність FIB-4 перевершує таку інших неінвазивних маркерів фіброзу та його можна проводити неодноразово.
Алгоритм діагностики НАЖХП, запропонований AASLD (2023), передбачає визначення FIB-4 за підозри на НАЖХП із метою виключення прогресування фіброзу. Якщо значення FIB-4 становить <1,3, то такого пацієнта можна спостерігати в умовах первинної медичної допомоги. Повторювати клінічну оцінку стану хворого без предіабету / ЦД 2 типу з 1-2 метаболічними чинниками ризику потрібно що 2-3 роки. Вищі значення FIB-4 у хворих із супутнім предіабетом / ЦД 2 типу або ≥2 метаболічними чинниками ризику є показанням для контрольного огляду що 1-2 роки. Згідно з рекомендаціями ESPEN/UEG (2022) усі хворі на НАЖХП повинні пройти скринінг таких неінфекційних хронічних захворювань, як ЦД, дисліпідемія, серцево-судинні захворювання, хронічна хвороба нирок, синдром полікістозних яєчників, обструктивне апное уві сні, остеопороз, саркопенія, шляхом аналізу анамнезу та виконання необхідних тестів за наявності відповідної підозри.
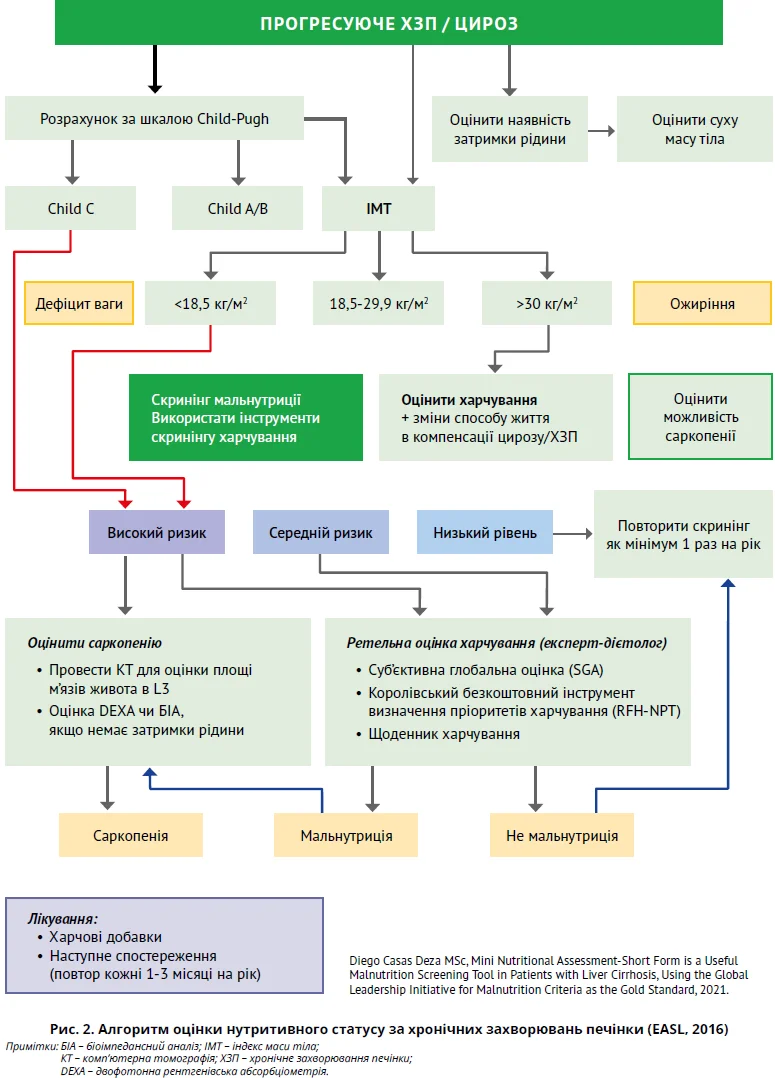
Рекомендації EASL (2016) передбачають проведення обов’язкового та додаткового лабораторного обстеження з метою уточнення функціонального стану печінки й виключення рідкісних захворювань (хвороба Вілсона – Коновалова, автоімунна патологія, дефіцит α1-антитрипсину). Інша нещодавно опублікована настанова EASL (2021) рекомендує гастроентерологам обов’язково проводити скринінг мальнутриції (недостатнього харчування) за хронічних захворювань печінки (рис. 2).
Діагностика НАЖХП передбачає проведення ультразвукового дослідження, комп’ютерної томографії, фіброеластографії, магнітно-резонансної еластографії, а також гістологічного дослідження, але останнє не є обов’язковим для підтвердження діагнозу МАЖХП. Такі просунуті сонографічні методи діагностики стеатозу печінки, як стеатометрія та еластографія, рекомендовані провідними товариствами з вивчення печінки через їхні зручність, швидкість та неінвазивність.
Підходи до допомоги пацієнтам Із НАЖХП/МАЖХП
В основі лікування НАЖХП/ МАЖХП лежать збалансоване харчування, припинення вживання алкоголю/тютюну, регулярні фізичні активності, нормалізація ваги та медикаментозна корекція патологічних порушень у гепатоцитах та холангіоцитах.
Загальна мета харчування полягає в тому, щоб знайти найкращий режим харчування та макроелементний склад для запобігання, послаблення або зворотного розвитку стеатозу печінки та його прогресування до стеатогепатиту.
Дієти, які можуть покращити інсулінорезистентність, окислювальний стрес або запалення, є потенційно хорошими кандидатами для лікування НАЖХП.
Отже, рекомендовано:
- Дотримуватися індивідуального плану харчування (розробленого лікарем-дієтологом).
- Нездоровий режим харчування, що включає насичені жири, трансжири, прості цукри та тваринний білок (червоне та оброблене м’ясо), призводить до збільшення загальної та вісцеральної маси жиру, резистентності до інсуліну, посилення ліпогенезу в печінці de novo та кишкового дисбактеріозу. За цих умов і паралельно діючи, жир накопичується в печінці, викликаючи ліпотоксичність, підвищений окислювальний стрес і мітохондріальну дисфункцію, додаючи генетичну або екологічну схильність до накопичення ліпідів у печінці («гіпотеза множинних ударів»). Надмірне споживання фруктози пов’язане із запаленням, клітинним стресом, дисбактеріозом і стеатозом печінки.
- Хворим на стеатоз слід намагатися знизити масу тіла на 3-5%, а при бажанні досягти ремісії НАЖХП, регресу фіброзу зменшення ваги має бути більш значним та становити 7-10%.
- Хворим зі стеатогепатитом на фоні зайвої ваги / ожиріння енергетичну цінність раціону зменшуємо поступово – спочатку переводимо на раціон з фізіологічною нормою енергії, виключивши шкідливі продукти.
Призначення низькоенергетичних раціонів у хворих зі стеатозом печінки / стеатогепатитом від самого початку лікування може мати негативний ефект і підсилювати стеатоз за рахунок мобілізації ЖК із жирової тканини, їх надходження в печінку та збільшення синтезу тригліцеридів.
- У стадії ремісії – створюємо дефіцит енергетичної цінності раціону (до 500-750 ккал/добу від добової потреби людини), але повноцінного за білком, вітамінами, мінералами та ліпотропними факторами (метіонін, лецитин, холін, вітаміни В1, В6, В12, фолієва кислота).
- Втрата зайвої ваги на >5% достовірно поліпшує клінічні показники (глікемічний контроль, ліпіди, артеріальний тиск, стан печінки).
Не варто перебільшувати швидкість втрати ваги – 1,0-1,6 кг/тиж.
Опублікована цьогоріч настанова AASLD підкреслює відсутність фармакологічних стандартів лікування НАЖХП та препаратів, схвалених Управлінням із контролю за якістю харчових продуктів та лікарських засобів США (FDA), для корекції цього захворювання. Сучасний алгоритм ведення хворих на НАЖХП, запропонований експертами AASLD (2023), передбачає можливість призначення препаратів, схвалених для лікування супутніх захворювань, та/або молекул, які можуть бути потенційно ефективними у терапії НАЖХП через здатність нормалізувати печінкові ферменти, зменшувати стеатоз печінки або поліпшувати гістологічну картину печінки. Одним із таких засобів може бути S-аденозил-L-метіонін (SAMe), який не лише довів свою результативність у лікуванні стеатозу печінки вагітних, але й підтвердив здатність відновлювати баланс у циклі метилювання, який має місце при НАЖХП. Доведено, що SAMе притаманна жовчогінна дія завдяки синтезу таурину, метилюванню мембранних фосфоліпідів, які забезпечують плинність мембран гепатоцитів і підвищують активність ферменту Na+-K+-АТФази – основної рушійної сили секреції та відтоку жовчі. Будучи попередником цистеїну й основного ендогенного антиоксиданту – глутатіону, SAMе чинить антиоксидантну дію. Його здатність інгібувати синтез колагену 1 типу та зменшувати вміст прозапальних цитокінів лежить в основі антифіброзувальної та протизапальної активності SAMе. Активна участь SAMе у синтезі цистеїну, таурину та глутатіону, збільшенні вмісту ацетилкоензиму, аденозинтрифосфату є проявом детоксикувальної й енергетичної дій. Властивість SAMе сприяти активації синтезу фосфоліпідів і нейромедіаторів, у тому числі ацетилхоліну, дофаміну, адреналіну, серотоніну, пояснює його нейропротекторну дію. Здатність віддавати метильну групу, сприяючи утворенню нуклеїнових кислот, фосфоліпідів, гістонів, біогенних амінів і білків, путресцину, спермідину та сперміну пояснює регенераторну активність SAMе. Крім цього, SAMе запобігає апоптозу гепатоцитів та індукує апоптоз пухлинних клітин завдяки гіперметилюванню ДНК, яке зазвичай пов’язане з припиненням експресії генів, зменшення розвитку, росту та метастазування пухлини. Перелічені фармакологічні властивості SAMe обґрунтовують доцільність його застосування при НАЖХП/МАЖХП із метою послаблення окисного стресу та стеатозу, індукованих жирними кислотами, в гепатоцитах і ендотеліальних клітинах.
На відміну від більшості генеричних SAMe-вмісних засобів, Гептрал® являє собою запатентований оригінальний препарат адеметіоніну з високим умістом S-ізомерів, які й забезпечують фармакологічну активність молекули. Сприяючи синтезу фосфатидилхоліну, глутатіону, таурину та чинячи антиоксидантну й дезінтоксикаційну дії, Гептрал® відновлює структуру мембран гепатоцитів, сприяє виведенню токсичних жовчних кислот і нівелюванню внутрішньопечінкового холестазу (ВПХ), покращує синтез нейромедіаторів, зменшуючи явища депресії й ознаки гепатогенної втоми, що є одним із симптомів ВПХ. Отже, Гептрал® має подвійний фокус дії, спрямований на відновлення печінки та покращення функціонування головного мозку.
Схема призначення препарату Гептрал® хворим на НАЖХП передбачає два варіанти терапії – застосування таблетованої форми або ін’єкційної (внутрішньовенне чи внутрішньом’язове введення препарату в дозі 500-1000 мг на добу протягом 14 днів) із подальшим прийомом таблеток (2-3 таблетки на добу протягом 2 місяців). Парентеральне введення препарату Гептрал® асоційовано з високим рівнем біодоступності (96-100%), яка забезпечується його надходженням у печінку через печінкову артерію. Всмоктування пероральної форми відбувається в тонкому кишківнику, надходження в печінку здійснюється через ворітну вену, яка забезпечує 70-75% кровотоку печінки, що пояснює достатню біодоступність таблеток. Клінічну ефективність оригінального препарату SAMe можна спостерігати досить швидко: вже із 7-ї доби лікування поліпшується настрій, відзначається позитивна динаміка печінкових проб, знижується прояв гепатогенної втоми як одного із симптомів ВПХ, через 1 місяць покращується ультразвукова картина печінки, після 2 місяців лікування нормалізуються показники ліпідограми.
Зміни дефініції та діагностики НАЖХП не відобразилися на стратегіях лікування НАЖХП/МАЖХП: основні постулати так само передбачають корекцію дієти, нормалізацію маси тіла та збільшення рухової активності.
Література
- Younossi Z.M., Wong G., Anstee Q.M., Henry L. The Global Burden of Liver Disease. Clin. Gastroenterol. Hepatol. 2023 Apr 28: S1542-3565(23)00315-4. doi: 10.1016/j.cgh.2023.04.015.
- Chalasani N., Younossi Z., Lavine J.E., Charlton M., Cusi K., Rinella M., et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018; 67 (1): 328-357. doi: 10.1002/hep.29367.
- Eslam M., Sanyal A.J., George J., International Consensus Panel MAFLD: a consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 2020; 158 (7): 1999-2014.e1. doi: 10.1053/j.gastro.2019.11.312.
- Eslam M., Newsome P.N., Sarin S.K., Anstee Q.M., Targher G., Romero-Gomez M., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J. Hepatol. 2020; 73 (1): 202-209. doi: 10.1016/j.jhep.2020.03.039.
- Bischoff S.C., Barazzoni R., Busetto L., Campmans-Kuijpers M., Cardinale V., Chermesh I., Eshraghian A., Kani H.T., Khannoussi W., Lacaze L., Léon-Sanz M., Mendive J.M., Müller M.W., Ockenga J., Tacke F., Thorell A., Vranesic Bender D., Weimann A., Cuerda C. European guideline on obesity care in patients with gastrointestinal and liver diseases – Joint ESPEN/UEG guideline. Clin. Nutr. 2022 Oct; 41 (10): 2364-2405. doi: 10.1016/j.clnu.2022.07.003.
- EASL–EASD–EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. Journal of Hepatology. 2016 June; 64 (6): 1388-1402. doi: 10.1016/j.jhep.2015.11.004.
- Manzillo G., Piccinino F., Surrenti C., et al. Multicentre double-blind placebo-controlled study of intravenous and oral S-adenosyl-L-methionine (SAMe) in cholestatic patients with liver disease. Drug Invest. 1992; 4 (Suppl. 4): 90-100. doi: 10.1007/BF03258369.
- Anstee Q.M., et al. S-adenosylmethionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility. J. Hepatology. 2012; 57: 1097-1109.
- Подымова С.Д. Адеметионин: фармакологические эффекты и клиническое применение препарата. РМЖ. 2010; 13.
- Fiorelli G., et al. S-adenosylmethionine in the treatment of intrahepatic cholestasis of chronic liver disease: a field trial. Current Therapeutic Research. 1999; 60 (6): 335-348.
- Frezza et al. Oral S-adenosylmethionine in the symptomatic treatment of intrahepatic cholestasis. A double-blind, placebo-controlled study. Gastroenterology. 1990; 99: 211-215.
- Барановский А.Ю., Райхельсон К.Л., Марченко Н.В. Применение S-аденозилметионина (Гептрал®) в терапии больных неалкогольным стеатогепатитом. Клинические перспективы гастроэнтерологии, гепатологии. 2010; 1-6.
- Liao Boming. Observation of efficacy of ademetionine for treating non-alcoholic fatty liver disease. Chinese Hepatol. 2011; 16 (4).
- Інструкція до медичного застосування препарату Гептрал®.
UKR2278895
