Неалкогольна жирова хвороба печінки та діабет 2 типу: оновлення
Переклала Ольга Королюк
За даними Міжнародної федерації діабету, 10,5% дорослого населення планети хворіють на діабет. За таких темпів до 2045 р. кожен восьмий дорослий планети житиме з діабетом. Неалкогольна жирова хвороба печінки (НАЖХП) уражає чверть населення світу. До спектра НАЖХП відносять ізольований стеатоз печінки (СП), неалкогольний стеатогепатит (НАСГ), фіброз печінки (ФП), цироз печінки (ЦП), гепатоцелюлярну карциному (ГЦК) та пов’язану з ними смертність.
Серед патогенетичних чинників НАЖХП основну роль відіграють ожиріння, інсулінорезистентність і цукровий діабет (ЦД) 2 типу. Поширеність НАЖХП у пацієнтів із ЦД 2 типу вдвічі вища, ніж у загальній популяції, сягаючи 60%, причому в третині випадків спостерігається НАСГ.
Серед пацієнтів, яким виконано біопсію печінки, в 17% відзначався значний ФП – визначальний чинник смертності від усіх причин і пов’язаних із печінкою несприятливих наслідків на різних стадіях НАЖХП. Зважаючи на значну поширеність ожиріння й ЦД 2 типу, нездоровий спосіб життя та старіння населення, до 2030 р. очікується збільшення смертності від ГЦК та печінкових ускладнень, пов’язаних із НАСГ, на 137 і 178% відповідно. За результатами математичного моделювання впродовж двох наступних десятиліть поєднання ЦД 2 типу й НАСГ спричинятиме 1,27 мільйона людино-років декомпенсованого ЦП, 479 тисяч людино-років ГЦК, 29% трансплантацій печінки, 812 тисяч смертей унаслідок печінкової патології та 1,37 мільйона смертей від серцево-судинних захворювань (ССЗ). Отже, це глобальна проблема, що потребує комплексної боротьби за участю гепатологів, ендокринологів і лікарів первинної ланки.
Взаємозв’язок НАЖХП та ЦД 2 типу
Діабет 2 типу спричиняє виникнення ЦП, вдвічі-втричі підвищуючи ризик смерті. Глікемія посилює ФП: кожен 1% підвищення середнього рівня глікованого гемоглобіну (HbA1c) збільшує ймовірність значного ФП на 15%, а варіабельність HbA1c від візиту до візиту є незалежним предиктором НАЖХП. Окрім того, ЦД 2 типу – основний чинник ризику ГЦК. Серед пацієнтів із НАСГ- індукованим цирозом діабет учетверо збільшував ризик розвитку ГЦК. У нещодавньому реальному дослідженні за участю 18 мільйонів дорослих європейців із НАЖХП наявність діабету виявилася найсильнішим незалежним прогностичним чинником ГЦК.
З іншого боку, НАЖХП негативно впливає на ЦД 2 типу. Метааналіз за участю понад 500 тисяч осіб середнього віку з Азії, США та Європи продемонстрував, що НАЖХП асоціюється з удвічі вищим ризиком ЦД 2 типу після поправки на вік, стать, параметри ожиріння й інші метаболічні чинники ризику. Загальнонаціональне популяційне дослідження в Кореї за участю понад 5 мільйонів молодих дорослих також показало, що НАЖХП уп’ятеро збільшує частоту діабету, особливо в чоловіків, курців і тих, хто веде малорухливий спосіб життя та має надмір маси тіла (індекс маси тіла ≥25 кг/м2).
Нещодавнє менделівське рандомізоване дослідження показало, що генетичними чинниками НАЖХП є гени білка-3, що містить домен пататиноподібної фосфоліпази (PNPLA3) і трансмембранного 6-го члена надродини-2 (TM6SF2), які також пов’язані з виникненням діабету. Крім того, НАЖХП асоціюється з іншими хворобами, зокрема ССЗ та хронічною хворобою нирок (ХХН), які водночас є класичними судинними ускладненнями діабету. Результати двох нещодавніх метааналізів указують на те, що НАЖХП підвищує ризик розвитку фатальних і нефатальних ССЗ та ХХН ≥3 стадії на 45%, причому цей ризик прямо корелює з тяжкістю ФП. У проспективному дослідженні за участю понад 4000 осіб як НАЖХП, так і прогресування ФП за шкалою NFS були пов’язані з появою ХХН. У разі ЦД 2 типу вимірювання жорсткості печінки як ознаки ФП методами вібраційно-контрольованої транзиторної еластографії (ВКТЕ) або магнітно-резонансної еластографії асоціювалися з вищим ризиком розвитку ССЗ. Значний ФП є незалежним чинником ризику появи або посилення альбумінурії при ЦД 2 типу.
Метаболічно-асоційована жирова хвороба печінки (МАЖХП)
У 2020 р. міжнародні експерти запропонували нову категорію – MAЖХП, зумовлену порушеннями метаболізму. НАЖХП – це діагноз виключення, що встановлюють на підставі виявлення жирової дистрофії печінки за відсутності надуживання алкоголю, застосування стеатогенних ліків (тамоксифен, метотрексат), вірусного гепатиту й інших хронічних захворювань печінки. Діагноз MAЖХП встановлюють на підставі СП у поєднанні з будь-яким із таких трьох критеріїв: надмірна маса тіла / ожиріння, наявність ЦД 2 типу або ознак метаболічної дисфункції. Отже, всі хворі на ЦД 2 типу із жировою дистрофією печінки мають MAЖХП, але не обов’язково належать до популяції НАЖХП, якщо вони надуживають алкоголь та/або мають супутню хронічну патологію печінки. Дослідження, опубліковані після запровадження цього терміна, показали значний збіг між пацієнтами обох категорій. З’ясування відмінностей виникнення віддалених несприятливих наслідків у цих двох групах потребує подальшого вивчення.
Дисфункція жирової тканини як підґрунтя НАЖХП за ЦД 2 типу
Початковими патогенетичними механізмами ЦД 2 типу та НАЖХП є дисфункція жирової тканини й запалення. Перша призводить до зміни продукції адипокінів у бік прозапального, діабетогенного й атерогенного профілю зі збільшенням прозапальних і зниженням протизапальних адипокінів. Прозапальні адипокіни активують c-Jun NH2-кінцеву кіназу та шляхи ядерного фактора κВ, запускаючи хибне коло інсулінорезистентності та запалення в жировій тканині, а надалі спричиняють системне запалення й інсулінорезистентність усього тіла. Висока швидкість спонтанного ліполізу посилює відтік вільних жирних кислот, що за умови інсулінорезистентності зумовлює ліпогенез de novo в печінці з подальшим накопиченням жиру. Разом із мітохондріальною дисфункцією, окисним стресом і стресом ендоплазматичного ретикулуму виникає глюко- та ліпотоксичність, змінюється мікробіом кишківника. Усі вказані зміни спричиняють запалення в печінці, капіляризацію синусоїдальних ендотеліальних клітин, що призводить до активації зірчастих клітин, які зумовлюють фіброз.
У патогенезі НАЖХП та ЦД 2 типу задіяно декілька адипокінів. Дія адипонектину інсуліносенсибілізувальна, протизапальна й антиатерогенна. Низькі рівні циркулювального адипонектину асоціюються з виникненням ЦД 2 типу та вираженішим фіброзом печінки. Лікування рекомбінантним адипонектином зменшує НАСГ у мишей. Надлишок багатої на лейцин повторюваної протеїнової фосфатази-2 у домені гомології плейкстрину адипоцитів при ожирінні може зменшити активність рецептора α, що активує проліферацію пероксисом (PPARa) та секрецію адипонектину, що зменшує окислення жирних кислот у гепатоцитах. Отже, миші з адипоцитоспецифічною абляцією цього домену мали вищі експресію адипоцитів і циркулювальний рівень адипонектину та були захищені від жирової хвороби печінки.
Білок, що зв’язує жирні кислоти адипоцитів (AFABP), – це цитозольний білок, який секретується адипоцитами в кров і є прозапальним цитокіном. Його експресія також можлива в макрофагах, включно з печінковими клітинами Купфера. Підвищений рівень циркулювального AFABP є незалежним предиктором ЦД 2 типу та пов’язаний з усіма компонентами метаболічного синдрому – центральним ожирінням, інсулінорезистентністю, атерогенною дисліпідемією й гіпертензією. Дослідження за участю японців середнього та літнього віку показало, що високий рівень циркулювального AFABP незалежно пов’язаний із НАЖХП у пацієнтів із ЦД 2 типу, а також із MAЖХП. Рівень циркулювального AFABP корелює з лобулярним запаленням і стадією фіброзу в осіб із підтвердженою біопсією НАЖХП, навіть після корегування індексів ожиріння та глікемічного статусу. Встановлено, що миші з ФП мають підвищену експресію AFABP у синусоїдальних ендотеліальних клітинах печінки. Тож AFABP підсилює капіляризацію синусоїдальних ендотеліальних клітин і потенціює ФП через посилення утворення трансформувального фактора росту-β1 зірчастими клітинами. За даними доклінічних досліджень, фармакологічне пригнічення AFABP у мишей полегшує як НАСГ, так і ФП. Отже, цей білок може виявитися потенційною терапевтичною ціллю при НАЖХП та ЦД 2 типу.
Іншим адипокіном, пов’язаним із НАЖХП та ЦД 2 типу, є гремлін-1 – основний ендогенний антагоніст, який пригнічує вплив кісткового морфогенетичного протеїну-4 на залучення й диференціацію клітин-попередників жирової тканини, а також індукцію бежевого та коричневого адипогенезу. Встановлено, що гремлін-1 порушує передачу сигналів інсуліну та його дію в клітинах жирової тканини, м’язів і печінки. В осіб із ЦД 2 типу його рівень у сироватці крові високий, а експресія месенджера гремліну-1 у печінці в пацієнтів із підтвердженим біопсією НАСГ значно вища, ніж в осіб з ізольованим СП.
Діагностика
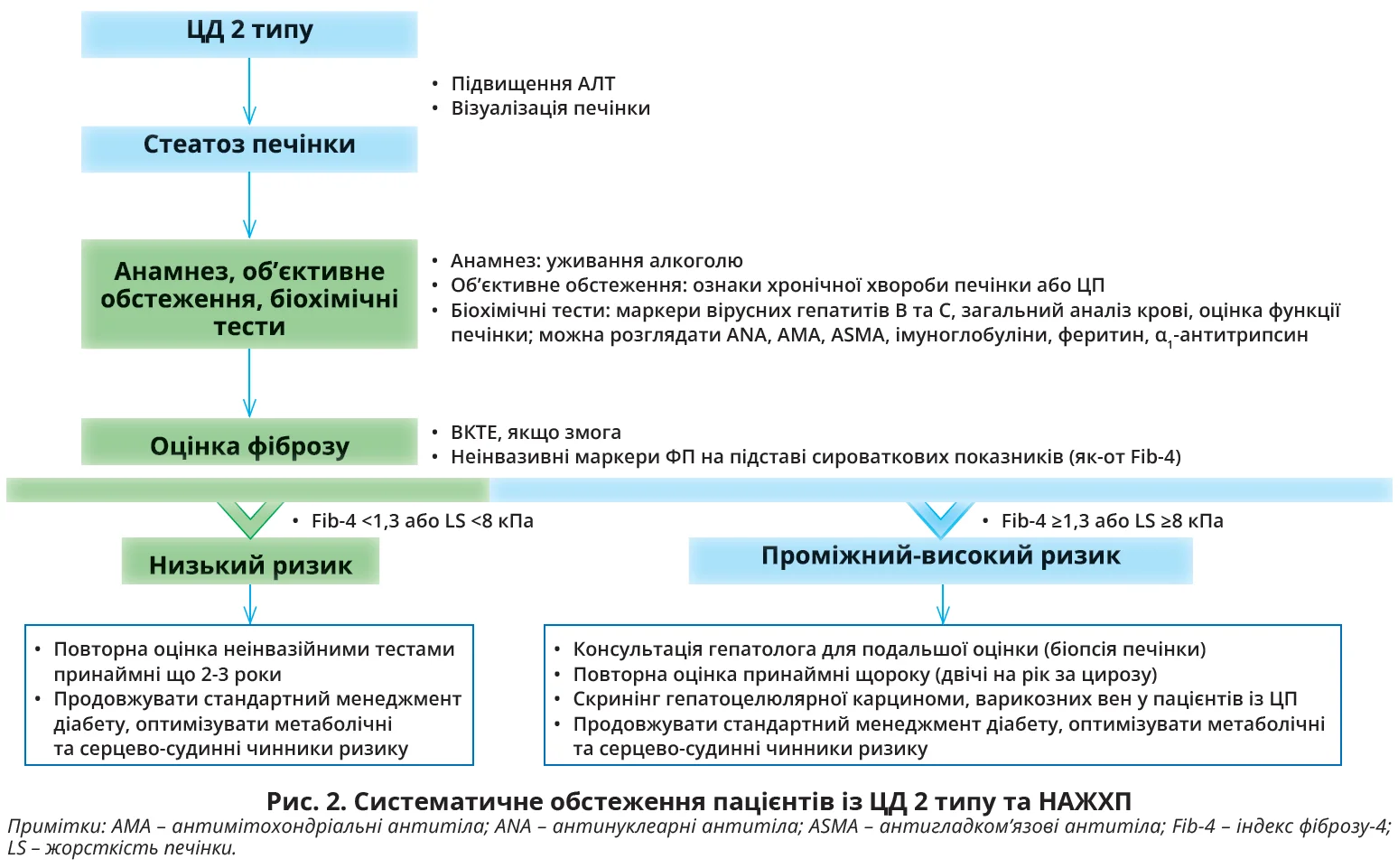
Робоча група Clinical Care Pathway рекомендує проводити скринінг на СП усіх пацієнтів із ЦД 2 типу. Азійсько-Тихоокеанська асоціація з вивчення MAЖХП й Азійсько-Тихоокеанська робоча група з НАЖХП рекомендують скринінг усіх пацієнтів із ЦД 2 типу методом ультразвукового дослідження (УЗД) печінки; для виявлення незначного СП можна використовувати ВКТЕ, якщо змога. Натомість настанови Американської асоціації з вивчення захворювань печінки не рекомендують систематичний скринінг на НАЖХП частково через занепокоєння щодо економічної ефективності. Проте нещодавній аналіз рентабельності з використанням моделі Маркова показав економічну ефективність виконання УЗД печінки всім пацієнтам із ЦД 2 типу та визначення активності трансаміназ, аланінамінотрансферази (АЛТ) або аспартатамінотрансферази (AСT) з подальшим виконанням ВКТЕ тим, хто найімовірніше матиме значний ФП та потребуватиме інтенсивного втручання в спосіб життя. Настанови Європейської асоціації з вивчення діабету спільно з Європейськими асоціаціями з вивчення печінки й ожиріння рекомендують проводити скринінг НАЖХП у групах високого ризику, зокрема в осіб із ЦД 2 типу. Із 2019 р. Американська діабетична асоціація також рекомендує скринінг НАСГ і ФП особам із підвищеним рівнем АЛТ або СП за даними УЗД.
Оцінка фіброзу
Прогностичне значення ФП щодо віддалених несприятливих наслідків добре встановлено. У нещодавньому проспективному дослідженні за участю 1773 осіб із підтвердженою біопсією НАЖХП і середньою тривалістю спостереження 4 роки смертність від усіх причин була майже вдвічі вищою при ФП та вчетверо вищою при ЦП. Тому останні настанови рекомендують оцінку ФП в осіб із жировою дистрофією печінки, зокрема пацієнтів із ЦД 2 типу та НАЖХП. Для пацієнтів із проміжним ризиком запропоновано дворівневий алгоритм скринінгу з використанням неінвазивних сироваткових маркерів і наступною оцінкою методом ВКТЕ. Формули для оцінки ФП на підставі сироваткових показників, як-от NFS та Fib-4, які добре працюють у загальній популяції НАЖХП, стають менш інформативними в пацієнтів із ЦД 2 типу. Зокрема, в нещодавньому перехресному дослідженні за участю 162 пацієнтів із ЦД 2 типу та НАЖХП за даними біопсії жоден із неінвазивних показників не дав кращих результатів, аніж рівень АСТ у плазмі крові. Тому декілька дослідних груп розробили специфічні для діабету неінвазивні методи оцінки ФП, використовуючи виключно когорти пацієнтів із ЦД 2 типу та підтвердженою біопсією НАЖХП. Наприклад, нещодавно розроблено оцінку діабетичного ФП на підставі шести клінічних показників – вік, гіпертензія, ХХН, застосування гіполіпідемічних засобів, кількість тромбоцитів і рівень АСТ у сироватці крові. Були також пропозиції використання ВКТЕ для стратифікації ризику ФП у пацієнтів із ЦД 2 типу. Нещодавні дослідження підтвердили високу поширеність помірного та значного ФП у цій когорті з коливанням від 15 до 27%. Проте ВКТЕ не є широко доступним методом у галузі охорони здоров’я. Отже, доволі проблематично забезпечити своєчасне обстеження всіх пацієнтів як на первинній, так і на вторинній ланці медичної допомоги. Нещодавно розроблено неінвазивний показник діабетичного фіброзу для ідентифікації пацієнтів із ФП на підставі п’яти рутинних параметрів, які використовуються в стандартному менеджменті діабету: індекс маси тіла, тромбоцити, АСТ, холестерин ліпопротеїнів високої щільності й альбумінурія.
Фармакотерапія
Зміна способу життя, зокрема зниження маси тіла, залишається основою лікування НАЖХП та МАЖХП. Повідомлялося про зв’язок «доза – відповідь» між відсотком втрати маси тіла й загальним покращенням гістології печінки, причому для зникнення НАСГ і покращення ФП втрата маси має становити ≥7-10%. Поки що немає фармакологічних засобів, схвалених для лікування НАЖХП/НАСГ Управлінням із контролю якості харчових продуктів і медикаментів США чи Європейським агентством із лікарських засобів. Проте декілька класів протидіабетичних препаратів мають бути пріоритетними в цій когорті пацієнтів через підтверджений рандомізованими контрольованими дослідженнями (РКД) вплив на печінку або через здатність значного зниження не тільки HbA1c, а й маси тіла. Зокрема, настанови Американської діабетичної асоціації 2022 р. рекомендують піоглітазон й агоністи рецепторів глюкагоноподібного пептиду-1 (арГПП-1). Через те що НАЖХП тісно пов’язана з виникненням ССЗ та ХХН, треба віддавати перевагу засобам, які забезпечують кардіоренальну протекцію (рис. 1).
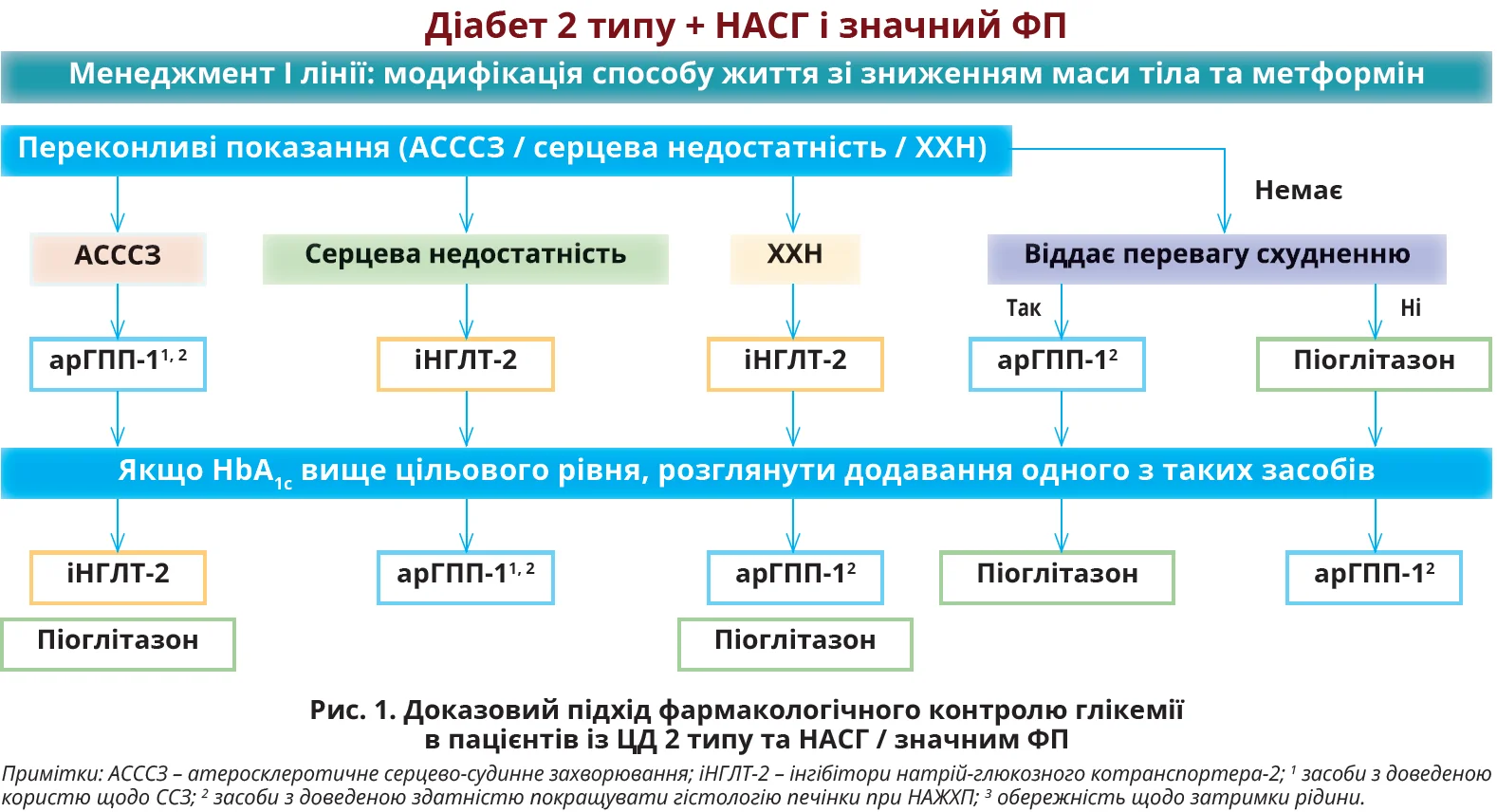
Агоністи PPAR
PPAR – це лігандозалежні білки ядерного рецептора, що функціонують як фактори транс- крипції, задіяні в метаболізмі глюкози та ліпідів.
Усі три ізоформи PPAR (a, b/d, c) мають значення в патогенезі НАСГ і ФП. Зокрема, PPARc підтримує зірчасті клітини печінки в стані спокою, а отже, його надмірна експресія може зменшити утворення колагену та фіброгенез. Метааналіз восьми РКД показав, що агоніст PPARc піоглітазон має потужний інсуліносенсибілізувальний ефект, покращує ФП, особливо за умови поєднання НАСГ і ЦД 2 типу.
Іншою потенційною терапевтичною стратегією є комбінований агонізм PPAR, адже α-рецептори беруть участь у транспортуванні жирних кислот і β-окисленні, рецептори b/d модулюють запальну активність у макрофагах і клітинах Купфера. Хоча подвійний агоніст PPARa/d елафібранор не зміг усунути НАСГ у дослідженні фази III, пан-агоніст PPAR ланіфібранор продемонстрував багатонадійні результати в нещодавньому РКД фази IIb за участю 247 учасників із НАСГ (42% – із ЦД 2 типу). Вища доза ланіфібранору (12,0 мг) забезпечувала досягнення основного результату – значного покращення НАСГ і ФП. У 2% учасників, які отримували ланіфібранор, спостерігалися периферичні набряки; збільшення маси тіла на 2,7 кг (3,1%) від початкового рівня при застосуванні ланіфібранору було подібним до того, про яке повідомляли дослідження з використанням піоглітазону (2-5%).
Терапія на основі інкретину
Іншим класом протидіабетичних засобів, який продемонстрував переваги для печінки при НАЖХП, є арГПП-1. Цей клас також знижує рівень глюкози крові та забезпечує захист серця та нирок. У дослідженні LEAN, яке вивчало безпеку й ефективність ліраглутиду в пацієнтів із НАСГ за участю 52 пацієнтів (~30% – із ЦД 2 типу), лікування ліраглутидом у дозі 1,8 мг на день упродовж 48 тижнів значно зменшило НАСГ, СП та ФП порівняно з плацебо. У нещодавньому РКД за участю 320 осіб із НАСГ (62% – із ЦД 2 типу; 49% – із ФП) лікування підшкірними ін’єкціями семаглутиду в дозах 0,4; 0,2 та 0,1 мг щодня впродовж 72 тижнів значно збільшило відсоток учасників, які досягли зникнення НАСГ без погіршення ФП порівняно з плацебо з відношенням шансів 6,87; 2,71 та 3,36 відповідно (всі P <0,05). Оскільки рецептори ГПП-1 відсутні в гепатоцитах, вважається, що сприятливий вплив арГПП-1 зумовлений схудненням, зменшенням дисфункції жирової тканини й ліпотоксичності, модуляцією портальних і периферичних плазмових рівнів інсуліну та глюкагону, а також покращенням функції мітохондрій гепатоцитів і чутливості печінки до інсуліну.
Інші види терапії на основі інкретину перебувають на стадії розробки. Вони сприяють потужнішому зниженню маси тіла, ніж арГПП-1. Препарат подвійної дії тирзепатид (арГПП-1 і глюкозозалежного інсулінотропного поліпептиду) продемонстрував додаткове зниження маси тіла на 8,6 кг і рівня HbA1c на 1,3% порівняно з дулаглутидом у дослідженні II фази. Лікування тирзепатидом у дозі 15 мг на добу істотно знизило рівень АЛТ, сироватковий маркер НАСГ фрагмент M30 кератину-18 і маркер фіброзу проколаген III у пацієнтів із ЦД 2 типу. У дослідженні фази IIb лікування пацієнтів із ЦД 2 типу подвійним арГПП-1 і глюкагону котадутидом упродовж 54 тижнів забезпечило значне покращення АЛТ, NFS, індексу Fib-4 та рівня проколагену III порівняно з плацебо.
Інгібітори натрій-глюкозного котранспортера 2 типу
ІНГЛТ-2 широко рекомендуються пацієнтам із ЦД 2 типу через суттєві кардіоренальні переваги, продемонстровані масштабними РКД. Імовірно, цей клас має сприятливий вплив у разі НАЖХП завдяки здатності знижувати масу тіла, проте поки що немає РКД за участю пацієнтів саме цієї когорти. У нещодавньому відкритому пілотному дослідженні за участю 9 пацієнтів із ЦД 2 типу та НАСГ лікування емпагліфлозином упродовж 24 тижнів значно покращило СП, балонну дистрофію гепатоцитів і ФП порівняно з плацебо, що відповідало результатам до клінічних досліджень. Метааналіз шести РКД за участю 309 пацієнтів із ЦД 2 типу дійшов висновку, що іНГЛТ-2 значно знижують рівень АЛТ у сироватці крові та фракцію жиру протонної щільності, виміряної методом магнітно-резонансної томографії. Інше РКД за участю 57 пацієнтів із ЦД 2 типу та НАЖХП також показало, що лікування дапагліфлозином упродовж 24 тижнів зменшило показник жорсткості печінки (LS) на ВКТЕ, причому покращення було значущим в осіб із початковими значеннями LS ≥8,0 кПа. Триває два РКД DEAN (Dapagliflozin Efficacy and Action in NASH) і COMBAT_T2_NASH (Combined Active Treatment in Type 2 Diabetes with NASH), які дадуть більше інформації щодо ролі іНГЛТ-2 в осіб із ЦД 2 типу та НАЖХП.
Моніторинг
Настанови Азійсько-Тихоокеанської асоціації з вивчення МАЖХП рекомендують контроль пацієнтів через регулярні проміжки часу відповідно до наявності ФП. Попереднє проспективне дослідження за участю 52 китайських пацієнтів із НАЖХП (50% – із ЦД 2 типу) з парною біопсією печінки через 3 роки показали ФП ≥1 стадії у 27%. В іншому дослідженні 80 азійських пацієнтів із НАЖХП парна біопсія печінки з інтервалом 1 рік показала прогресування ФП на ≥1 стадії в 11%. ЦД 2 типу значною мірою пов’язаний із групами високого ризику – відсутність покращення початкового ФП або виникнення ФП через 1 рік спостереження. Нещодавнє дослідження, в якому виконували ВКТЕ в 487 пацієнтів із ЦД 2 типу, продемонструвало, що впродовж 3,5 років лише в 4,3% спостерігалася LS ≥10 кПа. Інша дослідна група вказує, що серед 682 пацієнтів із ЦД 2 типу впродовж 1,5 року ФП (LS ≥9,6 кПа) виник у 8,8% пацієнтів. Підвищений ризик розвитку значного ФП мали пацієнти з ожирінням, низьким рівнем тромбоцитів і значним СП на початку дослідження. Тому рекомендується, щоб пацієнти з ознаками ФП проходили принаймні щорічний контроль; в осіб без ФП контроль можна здійснювати що 2-3 роки за відсутності погіршення супутніх метаболічних чинників ризику. Протокол моніторингу також має включати рутинну біо-
хімію крові й оцінку супутніх захворювань, як-от ожиріння, артеріальна гіпертензія та дисліпідемія. У нещодавньому проспективному дослідженні за участю понад 100 тисяч пацієнтів із предіабетом або ЦД 2 типу показано, що досягнення метаболічних цілей (HbA1c <6,5%, артеріальний тиск <130/80 мм рт. ст., холестерин ліпопротеїнів низької щільності <2,6 ммоль/л) допомагає зменшити ризик розвитку ССЗ та ХХН незалежно від тяжкості супутньої НАЖХП на підставі відношення АСТ/АЛТ.
Такі результати вказують на важливість оптимізації метаболічних параметрів у пацієнтів із ЦД 2 тип й НАЖХП для зниження ризику ССЗ та ХХН – основних ускладнень діабету, тісно пов’язаних із НАЖХП.
Пацієнтів із ЦД 2 типу із цирозом або високим ризиком прогресування ФП за результатами неінвазивного обстеження треба скеровувати до гепатолога для подальшого обстеження та моніторингу принаймні двічі на рік. На цьому етапі треба розглянути доцільність біопсії печінки, скринінг варикозно змінених вен і нагляд за ГЦК. Останні настанови передбачають, що особам із НАЖХП або двома неінвазивними маркерами (сироваткові показники фіброзу й еластографія), котрі узгоджено демонструють ознаки ФП або ЦП, треба проводити скринінг ГЦК шляхом УЗД печінки з/без визначення фетопротеїну двічі на рік. Рекомендації щодо моніторингу підсумовано на рисунку 2.
Висновок
Зазвичай прогресування від ізольованого СП до ЦП та ГЦК триває роками. Завдяки кращим стратегіям лікування ЦД 2 типу тривалість життя таких пацієнтів збільшується. Отже, настав час приділити більше уваги НАЖХП, підвищуючи обізнаність лікарів і сприяючи впровадженню клінічних шляхів лікування на рівні закладів охорони здоров’я й урядових програм для забезпечення більш систематичної оцінки (рис. 2).
Фармацевтичні компанії повинні інвестувати кошти в дослідження нових методів лікування НАСГ і ФП із залученням більшої кількості пацієнтів із ЦД 2 типу для з’ясування результатів у цій популяції. Лише тоді ми будемо краще підготовлені до боротьби із цим серйозним ускладненням діабету, поширеність якого невпинно зростає.
Література
Lee C.H., Lui D.T., Lam K.S. Non-alcoholic fatty liver disease and type 2 diabetes: an update. J. Diabetes Investig. 2022 Jun; 13 (6): 930-940. doi: 10.1111/jdi.13756. Epub 2022 Feb 14. PMID: 35080136; PMCID: PMC9153839.
