Можливості немедикаментозної корекції метаболічно-асоційованої стеатотичної хвороби печінки: погляд крізь призму фарнезоїдного X-рецептора
Підготувала канд. мед. наук Тетяна Можина
Стеатотична хвороба печінки (СХП), зокрема метаболічно-асоційована (МАСХП), набула масштабів епідемії в усьому світі [23]. За статистичними прогнозами, поширеність МАСХП у дорослій популяції продовжуватиме прогресивно зростати й у 2040 р. перевищить 55% [23]. Епідеміологічний тягар МАСХП, асоційований з гіперглікемією натще, становить 213,48 року життя, скорегованих на непрацездатність (DALYs), і 10,02 тис. смертей щорічно; порівняно з 1990 р. ці показники зросли у 2,96 та 3,32 раза відповідно [22].
Переконливі докази, отримані в метааналізі 33 досліджень (n=501 022), вказують на те, що МАСХП незалежно від наявності ожиріння й інших метаболічних факторів ризику асоційована, відповідно, з 2,2- та 3,4-разовим зростанням ризику розвитку цукрового діабету (ЦД) 2-го типу (дані 26 досліджень, 95% довірчий інтервал 1,93-2,48) і прогресивного фіброзу печінки (дані 5 досліджень, 95% довірчий інтервал 2,29-5,11) [12]. Цей ризик збільшується зі зростанням ступеня тяжкості МАСХП, тому пацієнти з тяжчими стадіями фіброзу печінки мають більший ризик розвитку ЦД 2-го типу [12].
Останніми роками виникнення СХП, МАСХП пов’язують з порушенням регуляторного впливу жовчних кислот (ЖК) й інгібуванням активності одного з їхніх рецепторів – фарнезоїдного X-рецептора (FXR) [7, 19]. У цьому огляді наведено сучасні дані, які доводять можливість немедикаментозної корекції МАСХП і вірогідні доступні способи агоністичного впливу на активацію FXR.
Патогенез МАСХП: роль FXR
ЖК відіграють важливу роль у гомеостазі холестерину, обміну ліпідів, абсорбції жирів і жиророзчинних вітамінів. Доведено, що порушення гомеостазу ЖК є важливим прогностичним фактором МАСХП, а прогресування МАСХП до гепатоцелюлярної карциноми прискорюється внаслідок декон’югації кишкових ЖК та впливу на гепатоцити токсичніших ЖК [8].
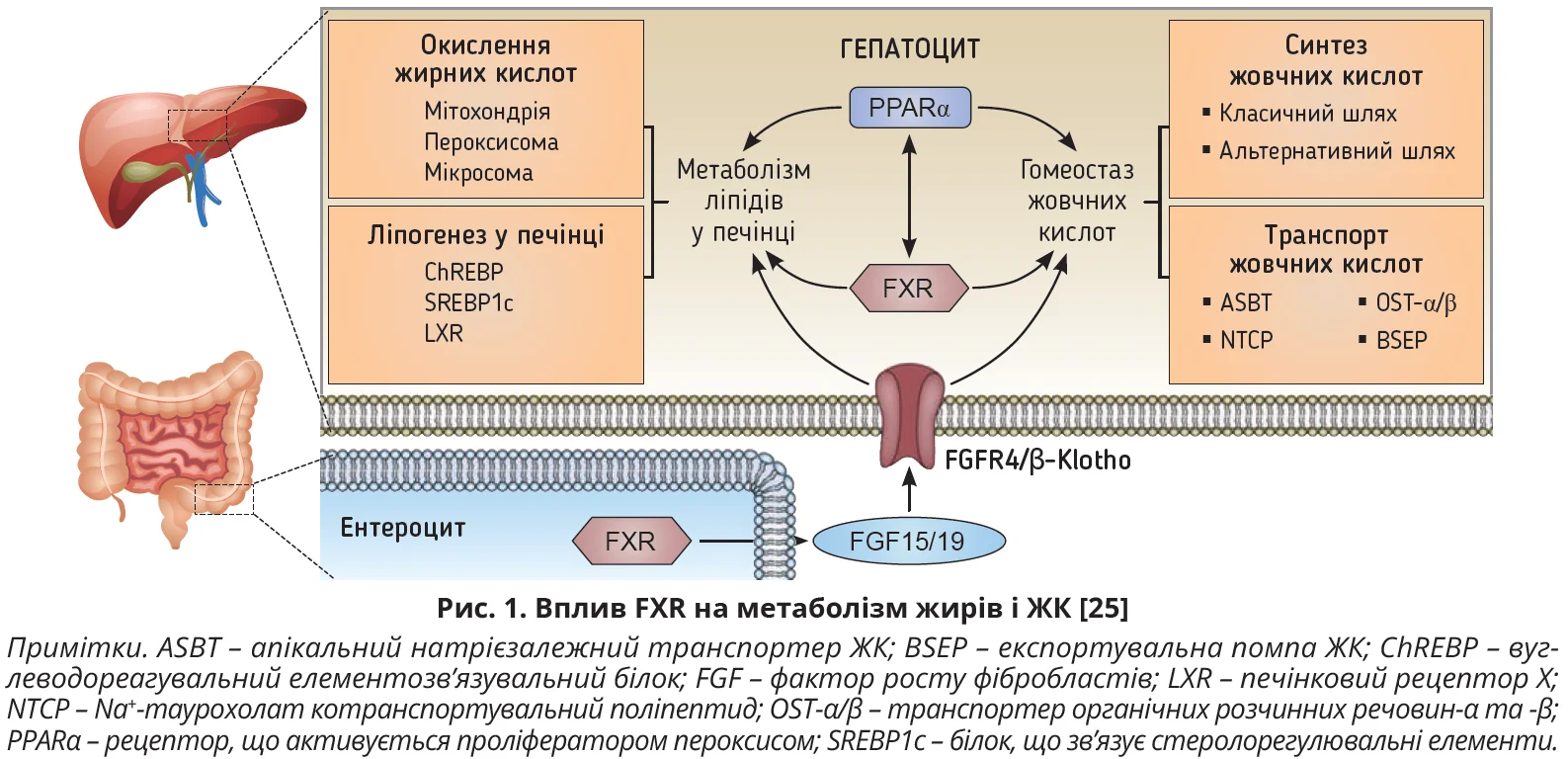
Будучи основними метаболітами холестерину, ЖК синтезуються в печінці й надзвичайно важливі для багатьох фізіологічних процесів: перетравлення, всмоктування та транспортування жиророзчинних поживних речовин. Первинні ЖК переважно виробляються в гепатоцитах з холестерину за участю субодиниць цитохрому Р450 (CYP) [1, 21]. На тлі МАСХП гомеостаз ЖК зазнає значних змін: порушуються процеси регуляції їх синтезу, поглинання й екскреції, котрі контролюють декілька спеціальних ядерних і поверхневих рецепторів і транспортерів, які за допомогою сигнальних каскадів реалізують різноманітні клінічні ефекти ЖК. Перелік найважливіших ядерних рецепторів ЖК очолює FXR, генетична структура якого кодується двома частинами: FXRα та FXRβ, причому останній є нефункціональним аналогом структурного гена, тому він нездатний кодувати білок і його роль поки остаточно не з’ясована [4, 21]. Ген FXRα, своєю чергою, має чотири ізоформи: FXRα1 і FXRα2 експресуються в клубовій кишці та надниркових залозах, а FXRα3 і FXRα4 – у клубовій кишці та нирках [4, 21]; найбільший рівень експресії FXR зафіксовано в гепатоцитах і тонкій кишці, але також підтверджено його експресію в інших позапечінкових органах – серці, білій жировій тканині, легенях, судинах, головному мозку, молочних залозах [1, 25]. Нині добре вивчена функція FXR у межах осі кишківник – печінка, зокрема його роль у синтезі та транспорті ЖК, а також окисленні жирів та їх синтезі de novo, в яких велике значення відводиться таким білкам, як короткий гетеродимерний партнер (SHP) та фактор росту фібробластів (FGF) (рис. 1).
FXR впливає на обмін ЖК на двох рівнях: стримуючи утворення ЖК в печінці й уповільнюючи активність ентерогепатичної циркуляції. Синтез первинних ЖК контролюється через печінковий шлях FXR – SHP та кишковий шлях FXR – FGF15/19, обидва з яких пригнічують експресію CYP7A1 і CYP8B1 у класичному каскаді ЖК [4, 21, 25]. FXR контролює ентерогепатичну циркуляцію ЖК через вплив на активність білків – переносників ЖК в кишківнику: ASBT, OST-α/β, NTCP та BSEP [25]. Головною функцією ASBT є реабсорбція ЖК в термінальному відділі клубової кишки, OST-α/β сприяє резорбції ЖК у верхніх відділах кишківника та захищає кишківник від пошкоджень, спричинених накопиченням ЖК, NTCP сприяє реабсорбції ЖК в портальній системі, полегшуючи захоплення ЖК гепатоцитами. BSEP являє собою білок, який обмежує швидкість експортування ЖК з гепатоциту в жовчні канальці [4, 21, 25].
FXR регулює ліпідний обмін завдяки впливу на ChREBP, SREBP1c, LXR. Печінкові ізоформи FXR, з одного боку, здатні зменшувати синтез ліпідів de novo через активацію шляху FXR – SHP – SREBP1c, з іншого боку, зумовлюють пригнічення експресії LXR і зменшення експресії ліпогенних генів [4, 21, 25]. На противагу цьому кишковий пул FXR здатний знижувати печінковий ліпогенез, індукуючи вироблення FGF15/19 і знижуючи таким чином експресію SREBP1c, пригнічуючи всмоктування ліпідів у кишківнику [25].
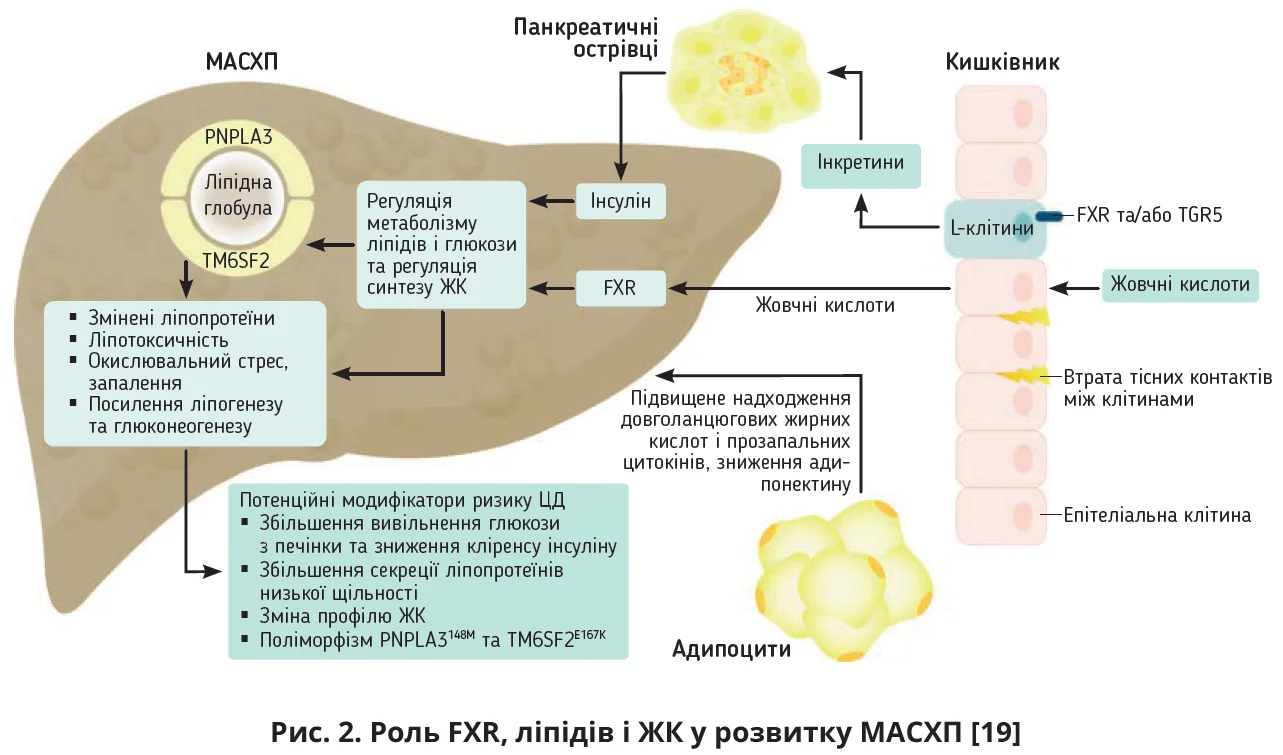
Крім печінки, FXR експресується в тканинах тонкої кишки, нирок, серцево-судинної системи та головного мозку, жировій тканині, підшлунковій залозі, завдяки чому FXR вважають «ключовим метаболічним регулятором системного гомеостазу енергії» [6]. У фізіологічних умовах активація FXR у підшлунковій залозі супроводжується інгібуванням глюкозостимульованої секреції інсуліну та зниженням ліпотоксичності. Зазначені властивості відіграють важливу роль у патогенезі та прогресуванні МАСХП: на тлі стеатозу печінки знижується активність FXR, зменшується його гальмувальний вплив на секрецію інсуліну, що призводить до розвитку інсулінорезистентності (ІР) та ЦД (рис. 2); безпосередня взаємодія FXR з ChREBP допомагає підтримувати баланс глюкози завдяки зниженню гліколізу та стимуляції накопичення глікогену після їди [7].
Фактично FXR являє собою сигнальний шлях, який з’єднує печінку, тонку кишку, жирову тканину та підшлункову залозу; FXR відіграє важливу роль у координації гомеостазу ЖК, ентерогепатичній циркуляції, обміні ліпідів, адже FXR не тільки регулює експресію генів, які відповідають за синтез ЖК та ліпідів de novo, а й контролює циркуляцію ЖК, впливаючи на специфічні білки-транспортери. Зниження експресії FXR зафіксовано при різноманітній гепатологічній патології: СХП, фіброзі та цирозі печінки, гепатоцелюлярній карциномі, медикаментозно-індукованому ураженні печінки [6].
Настанова EASL/EASD/EASO (2024): зосереджуємося на немедикаментозному лікуванні
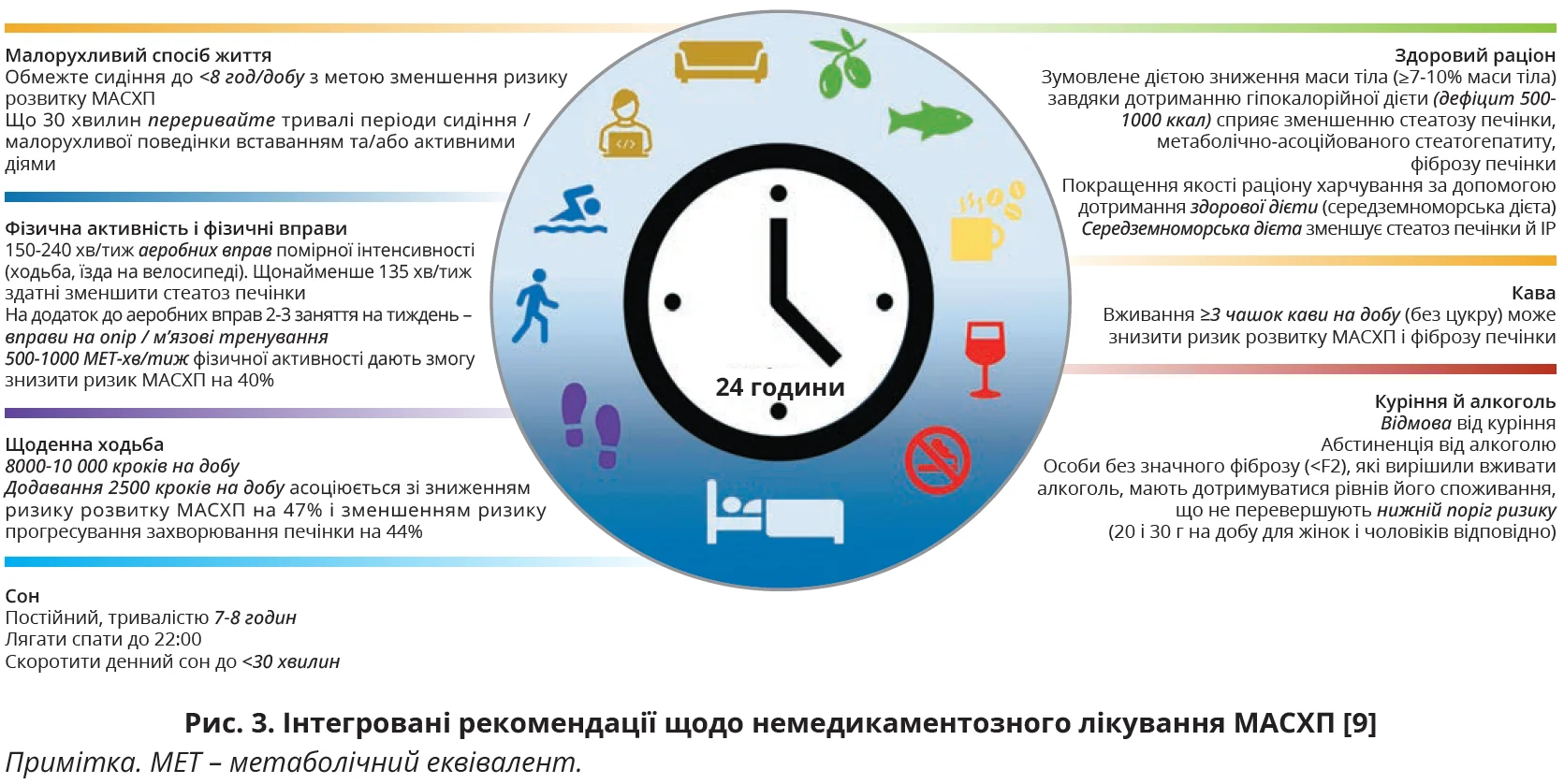
Провідними модифікованими факторами ризику МАСХП визнано малорухливий спосіб життя, переїдання, куріння, вживання алкоголю, надлишкова маса тіла / ожиріння, гіперглікемія натще [19]. Доведено, що МАСХП посилює явища ІР, як периферичної, так і внутрішньопечінкової, збільшує схильність до розвитку атерогенної дисліпідемії та спричиняє вивільнення системних прозапальних цитокінів і гепатокінів [19]. Саме тому наріжним каменем лікування МАСХП є рекомендації щодо корекції способу життя, котрі стосуються нормалізації дієти та заохочення до збільшення фізичної активності (рис. 3).
ІР, ключова патофізіологічна характеристика МАСХП, може бути ефективно зменшена за допомогою дієтичних утручань. Середземноморська дієта, багата на цільнозернові продукти, фрукти, овочі, бобові та корисні жири, продемонструвала багатонадійні результати в покращенні чутливості до інсуліну. Деякі компоненти середземноморської дієти, як-от мононенасичені жири та поліфеноли, мають протизапальну й антиоксидантну дію, тим самим зменшують стеатоз печінки та запалення.
На додаток до модифікації дієти фізичні вправи, особливо вправи з опором, відіграють вирішальну роль у підвищенні метаболічної гнучкості (рис. 3). Вправи з опором сприяють використанню ЖК як джерела енергії. Вони покращують поглинання глюкози м’язами та накопичення глікогену, зменшуючи таким чином навантаження на печінку, пов’язане з поглинанням надлишку глюкози в крові. Вправи з опором стимулюють синтез м’язового білка, сприяючи покращенню співвідношення м’язів до жиру та загальному метаболічному здоров’ю. Поєднання середземноморської дієти та силових вправ забезпечує синергічний взаємодоповнювальний ефект у боротьбі з МАСХП [11].
Відповідні положення містяться в практичній настанові Європейської асоціації з вивчення печінки (EASL), Європейської асоціації з вивчення діабету (EASD) та Європейської асоціації з вивчення ожиріння (EASO) з лікування МАСХП (2024) [5]. У цій настанові розглядаються ефективність і безпека декількох дієтичних стратегій у зменшенні маси тіла та гальмуванні прогресування МАСХП. Європейські експерти підкреслюють, що досягнення стійкої втрати маси тіла здатне зупинити прогресування МАСХП на всьому спектрі захворювання, причому обсяг зниження ваги є найважливішим фактором, який свідчить про поліпшення стану, незалежно від типу дотримуваної дієти [5]. Представники EASL/EASD/EASO зазначають, що нині недостатньо доказів ефективності та безпеки низьковуглеводних кетогенних дієт, зважаючи на потенційні серцево-судинні, ниркові й інші побічні ефекти дотримання зазначених дієт [5]. Експерти також розкривають переваги середземноморської дієти у вигляді одночасного зменшення стеатозу печінки, покращення кардіометаболічного здоров’я та можливості довгострокового дотримання [5]. «Інтервальне голодування поки що не має достатньої доказової бази щодо впливу на рівні печінкових проб, ліпідів у хворих на МАСХП», – вважають фахівці [5].
Представники EASL/EASD/EASO формулюють нижче наведені положення щодо дієтичного харчування хворих на МАСХП, не вказуючи найдоцільніший раціон харчування, але зазначаючи, що оптимальний раціон має бути «подібним до середземноморської дієти» [5].
Настанова EASL/EASD/EASO з лікування МАСХП (2024): дієтичні рекомендації [5]
- Дорослим з МАСХП слід рекомендувати знижувати масу тіла за допомогою дієти та поведінкової терапії з метою покращення стану печінки, який оцінюється гістологічно або неінвазивно (рівень доказовості 1, сильна рекомендація).
- Зменшення маси тіла на тлі дотримання дієти та поведінкової терапії в дорослих з МАСХП і надлишковою масою тіла має бути спрямоване на стійке утримання результату: зниження на ≥5% маси тіла асоційовано зі зменшенням стеатозу печінки, на 7-10% – зі зменшенням запального процесу в печінці, на ≥10% – зі зменшенням фіброзу (рівень доказовості 2, сильна рекомендація).
- Слід рекомендувати дорослим з МАСХП покращити якість харчування (подібно до середземноморської дієти), обмежити споживання ультраобробленої їжі (багатої на цукри, насичені жири), уникати вживання підсолоджених напоїв з метою зменшення ураження печінки, яке оцінюється гістологічно або неінвазивно (рівень доказовості 2, сильна рекомендація).
- Слід рекомендувати дорослим з МАСХП фізичну активність і фізичні вправи для зменшення стеатозу з огляду на вподобання та можливості пацієнта (бажано >150 хв/тиж за умови помірної інтенсивності або 75 хв/тиж за умови високої інтенсивності) (рівень доказовості 1, сильна рекомендація).
- Дорослим з МАСХП і нормальною вагою слід рекомендувати дієту та фізичні вправи для зменшення стеатозу печінки (рівень доказовості 3, сильна рекомендація).
- В обсерваційних дослідженнях уживання кави дорослими з МАСХП асоційовано зі зменшенням ураження печінки та покращенням клінічних наслідків, пов’язаних з печінкою (рівень доказовості 4, сильний консенсус).
Призначаючи лікування МАСХП: як вплинути на активність FXR?
Розглянувши рекомендації щодо дієтичного раціону та фізичної активності, важливо зазначити, що дискусії щодо застосування лікарських засобів з гепатотропною активністю у хворих на МАСХП не стихають навіть після публікації настанови EASL/EASD/EASO (2024): провідні гепатологи розглядають доцільність застосування препаратів, які комбінують потужний антиоксидантний, протизапальний потенціал з агоністичною активністю щодо FXR. Вважають, що застосування таких засобів допоможе зменшити надлишок жиру в гепатоцитах на тлі МАСХП.
Нині доведено, що при хронічних захворюваннях печінки будь-якої етіології знижується рівень S-аденозил-L-метіоніну (SAMе), основного донатора метильних груп, який проявляє антиоксидантні та протизапальні властивості [3]. З одного боку, діючи як донатор метильних груп, SAMе стабілізує мембрани гепатоцитів, з іншого – він є попередником синтезу глутатіону, завдяки чому поповнює внутрішньоклітинний запас аденозинтрифосфату (АТФ), зменшує активність запального процесу в печінці [20]. Протизапальна й антиоксидантна активність SAMе може бути використана при лікуванні МАСХП. Такого висновку дійшли автори декількох сучасних експериментальних досліджень. В одному з них морським свинкам зі стеатозом печінки, спровокованим дієтою з високим умістом жирів і холестерину, вводили SAMe; це сприяло зменшенню цитолізу печінкових клітин, зниженню вмісту в печінці загального холестерину, тригліцеридів, зменшенню експресії цитохрому p450-2E1е та гідроксипроліну, трансформувального фактора росту-β1, покращенню антиоксидантного балансу [2]. Крім цього, SAMe поліпшував гістологічний стан печінки, зменшуючи вираженість стеатозу, інтенсивність запалення та фіброзу.
В іншому експериментальному дослідженні вивчали здатність SAMe запобігати розвитку запального процесу: щурам лінії Вістар перед проведенням оперативного втручання, котре полягало в тимчасовій оклюзії ворітної вени та печінкової артерії з періодом реперфузії 10-120 хвилин, уводили SAMe за 15 хвилин до ішемії. Ішемічно-реперфузійне ушкодження печінки супроводжувалося зростанням рівнів ендотоксинів і перекисного окислення ліпідів, прозапальних цитокінів і маркерів апоптозу, а також зниженням умісту глутатіону, АТФ, інтерлейкіну-10 і фосфатидилхоліну. Проте введення SAMe ефективно запобігало виникненню бактеріальної транслокації, сприяло зниженню рівнів прозапальних цитокінів, вираженості окисного стресу та маркерів апоптозу, збільшенню виживаності лабораторних тварин [20].
У низці робіт демонструється вплив SAMe, основного клітинного донора метилу, на метаболізм ліпопротеїнів дуже низької щільності, які займають провідне місце в патогенезі МАСХП [14]. Нещодавно представлено експериментальну роботу, в якій описується участь SAMe у регуляції катаболічної відповіді на голодування шляхом модуляції активності ферменту фосфатидилетаноламін-N-метилтрансферази (PEMT), контактів між ендоплазматичним ретикулумом і мітохондріями, β-окислення та продукції АТФ у печінці, а також FGF21-опосередкованого ліполізу й термогенезу в жировій тканині [3]. Доведено, що глюкагон індукує експресію печінкового SAMе-синтезувального ферменту метіонінаденозилтрансферази-α1 (MAT1A), який транслокується на мембрани мітохондрій. Це сприяє утворенню метаболіту, який інгібує надмірне β-окислення та відновлює синтез мітохондріального АТФ, а отже, запобігає виникненню стресу ендоплазматичного ретикулуму та пошкодженню печінки [3].
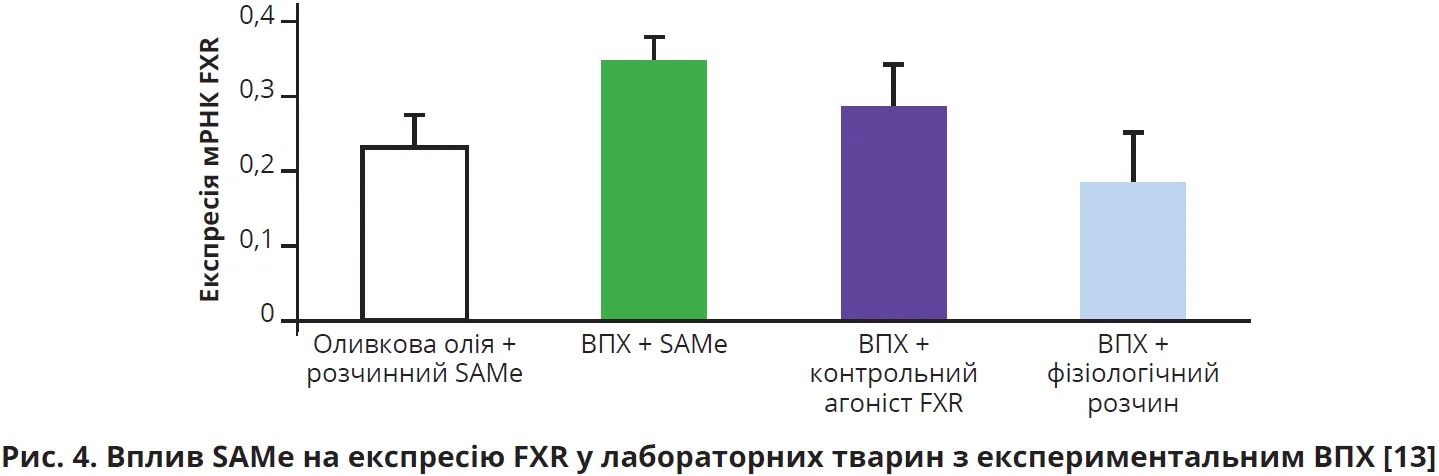
Нещодавно представлено експериментально обґрунтовані дані щодо наявності в SAMе здатності стимулювати FXR. Цікаві результати представили автори експериментальної роботи, в якій щурам лінії Sprague Dawley з α-нафтилізотіоціанат-індукованим внутрішньопечінковим холестазом (ВПХ) уводили SAMе (60 мг/кг) і досліджували рівень експресії FXR, BSEP, NTCP та білка, асоційованого з численною лікарською резистентністю (Mrp2) [13]. Тварин розподілили на декілька груп, у яких застосовували різноманітні способи контролю ефективності SAMе: таким чином створили групи «оливкова олія + розчинний SAMе», «ВПХ + SAMе», «ВПХ + контрольний агоніст FXR», «ВПХ + фізіологічний розчин». Застосування SAMе сприяло нівелюванню клініко-лабораторних ознак цитолізу, ВПХ та пом’якшенню дисліпідемії, а також забезпечувало вірогідне зростання експресії FXR, BSEP, NTCP, Mrp2 (рис. 4). Зазначені зміни супроводжувалися покращенням гістологічного стану печінки [13].
Слід додати, що SAMе має ще декілька властивостей, які дуже важливі при лікуванні МАСХП і метаболічно-асоційованого стеатогепатиту: крім нівелювання ознак ВПХ та зменшення активності цитолізу [16], він додатково має здатність зменшувати депресивні розлади [17], покращувати настрій пацієнта [24] та зменшувати втому при ВПХ на тлі хронічних захворювань печінки [18]. Можна припустити, що властива SAMе додаткова антидепресивна активність [17] і пов’язана з цим здатність позитивно впливати на якість життя пацієнта з хронічним захворюванням печінки здійснюються не лише завдяки інгібуванню окисного стресу та нейрозапалення [24], а й унаслідок впливу на FXR, які розташовані в головному мозку. У низці експериментальних досліджень продемонстровано здатність SAMe покращувати метаболізм глюкози [15] й утилізацію глюкози головним мозком в умовах ішемії [10].
Завдяки нещодавно виявленим властивостям молекули науковці вважають застосування SAMе в експериментальних моделях МАСХП патогенетично обґрунтованим [3] та ефективним у регресуванні зумовленого дієтою стеатотичного й запального ураження печінки [2, 14].
В Україні молекула SAMe представлена оригінальним препаратом Гептрал® у дозуванні 500 мг як у таблетованій, так і в ін’єкційній формі (для внутрішньовенного та внутрішньом’язового введення) із зареєстрованими показаннями: ВПХ у дорослих, у тому числі у хворих на хронічний гепатит різної етіології та цироз печінки, а також ВПХ у вагітних.
Висновки
МАСХП надзвичайно поширена у світі та в Україні та ставить багато викликів перед державою, системою охорони здоров’я, лікарями й пацієнтами. FXR вважають провідним ядерним рецептором, який впливає на гомеостаз ЖК, ліпідів, глюкози, чинить системні ефекти та займає провідне місце в патогенезі МАСХП. Наріжним каменем немедикаментозного лікування МАСХП є корекція способу життя, нормалізація дієти та збільшення фізичної активності. Сучасні рекомендації EASL/EASD/EASO (2024) з лікування СХП не називають найефективнішої дієти в зниженні маси тіла, проте рекомендують дотримуватися здорового раціону, «подібного до середземноморської дієти», якому притаманні протизапальні й антиоксидантні властивості. Схвалюється будь-яка фізична активність, як аеробна, так і тренування з опором, підбирати котру слід з огляду на вподобання пацієнтів та їхню фізичну підготовленість. Призначення агоністів FXR з метою нормалізації стану печінки, підшлункової залози вважається однією з провідних стратегій лікування різноманітних захворювань печінки. Агоністична активність SAMе щодо FXR, BSEP, NTCP, основних білків і рецепторів, які беруть участь у патогенезі МАСХП, а також протизапальні, антихолестатичні властивості, вплив на гепатогенну втому при ВПХ роблять SAMе багатообіцяльним препаратом для лікування МАСХП.
Література
- Anderson K., Gayer C.P. The pathophysiology of farnesoid X receptor (FXR) in the GI tract: inflammation, barrier function and innate immunity. Cells. 2021; 10 (11): 3206. doi: 10.3390/cells10113206.
- Bingül İ., Küçükgergin C., Fatih Aydın A., et al. Protective role of S-adenosylmethionine on high fat/high cholesterol diet-induced hepatic and aortic lesions and oxidative stress in guinea pigs. Gen. Physiol. Biophys. 2024; 43 (5): 411-421. doi: 10.4149/gpb_2024021.
- Capelo-Diz A., Lachiondo-Ortega S., Fernández-Ramos D. Hepatic levels of S-adenosylmethionine regulate the adaptive response to fasting. Cell Metab. 2023; 35 (8): 1373-1389.e8. doi: 10.1016/j.cmet.2023.07.002.
- Ding C., Wang Z., Dou X., et al. Farnesoid X receptor: from structure to function and its pharmacology in liver fibrosis. Aging Dis. 2023. doi: 10.14336/AD.2023.0830.
- European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO clinical practice guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). Obes. Facts. 2024; 17 (4): 374-444. doi: 10.1159/000539371.
- Han C.Y. Update on FXR biology: promising therapeutic target? Int. J. Mol. Sci. 2018; 19 (7): 2069. doi: 10.3390/ijms19072069.
- Hou Y., Zhai X., Wang X., et al. Research progress on the relationship between bile acid metabolism and type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2023; 15 (1): 235. doi: 10.1186/s13098-023-01207-6.
- Joon A., Sharma A., Jalandra R., et al. Nonalcoholic fatty liver disease and gut-liver axis: role of intestinal microbiota and therapeutic mechanisms. J. Transl. Gastroen. 2024; 2 (1): 38-51. doi: 10.14218/JTG.2023.00018.
- Keating S., Chawla Y., De A., et al. Lifestyle intervention for metabolic dysfunction-associated fatty liver disease: a 24-h integrated behavior perspective. Hepatol. Int. 2024; 18 (Suppl. 2): 959-976. doi: 10.1007/s12072-024-10663-9.
- Kobayashi K., Nakajima E., Kubo Y., et al. S-adenosyl-L-methionine ameliorates reduced local cerebral glucose utilization following brain ischemia in the rat. Jpn. J. Pharmacol. 1990; 52 (1): 141-148. doi: 10.1254/jjp.52.141.
- Mambrini S.P., Grillo A., Colosimo S., et al. Diet and physical exercise as key players to tackle MASLD through improvement of insulin resistance and metabolic flexibility. Front. Nutr. 2024; 11: 1426551. doi: 10.3389/fnut.2024.1426551.
- Mantovani A., Petracca G., Beatrice G., et al. Non-alcoholic fatty liver disease and risk of incident diabetes mellitus: an updated meta-analysis of 501 022 adult individuals. Gut. 2021; 70 (5): 962-969. doi: 10.1136/gutjnl-2020-322572.
- Mao H. Hepatoprotective effect of S-ademetionine in the treatment of intrahepatic cholestasis through farnesoid X receptor mechanism in rats. J. Biomol. Res. Ther. 2019; 8: 176. doi: 10.35248/2167-7956.19.8.176.
- Marigorta U.M., Millet O., Lu S., et al. Dysfunctional VLDL metabolism in MASLD. NPJ Metab. Health Dis. 2024; 2 (1): 16. doi: 10.1038/s44324-024-00018-1.
- Matsui Y., Yamagami I., Iwata N. S-adenosyl-L-methionine improves the changes of calcium content and glucose metabolism after transient ischemia in the rat.Jpn. J. Pharmacol. 1989; 49 (1): 119-124. doi: 10.1254/jjp.49.119.
- Noureddin M., Sander-Struckmeier S., Mato J.M. Early treatment efficacy of S-adenosylmethionine in patients with intrahepatic cholestasis: a systematic review. World J. Hepatol. 2020; 12 (2): 46-63. doi: 10.4254/wjh.v12.i2.46.
- Peng T.R., Cheng H., Wu T. S-adenosylmethionine (SAMe) as an adjuvant therapy for patients with depression: an updated systematic review and meta-analysis.Gen. Hosp. Psychiatry. 2024; 86: 118-126. doi: 10.1016/j.genhosppsych.2024.01.001.
- Raikhelson K.L., Kondrashina E. Аdеmethionine in the treatment of fatigue in liver diseases: a systematic review. Ter. Arkh. 2019; 91 (2): 134-142. doi: 10.26442/00403660.2019.02.000130.
- Targher G., Corey K.E., Byrne C.D., et al. The complex link between NAFLD and type 2 diabetes mellitus – mechanisms and treatments. Nat. Rev. Gastroenterol. Hepatol. 2021; 18: 599-612. doi: 10.1038/s41575-021-00448-y.
- Valdés S., Paredes S.D., García Carreras C., et al. S-adenosylmethionine decreases bacterial translocation, proinflammatory cytokines, oxidative stress and apoptosis markers in hepatic ischemia-reperfusion injury in Wistar rats. Antioxidants (Basel). 2023; 12 (8): 1539. doi: 10.3390/antiox12081539.
- Way G.W., Jackson K.G., Muscu S., et al. Key signaling in alcohol-associated liver disease: the role of bile acids. Cells. 2022; 11 (8): 1374. doi: 10.3390/cells11081374.
- Yang Z., Li A., Jiang Y., et al. Global burden of metabolic dysfunction-associated steatotic liver disease attributable to high fasting plasma glucose in 204 countries and territories from 1990 to 2021. Sci. Rep. 2024; 14 (1): 22232. doi: 10.1038/s41598-024-72795-0.
- Younossi Z.M., Kalligeros M., Henry L. Epidemiology of metabolic dysfunction-associated steatotic liver disease. Clin. Mol. Hepatol. 2024. doi: 10.3350/cmh.2024.0431.
- Zhang Y., Ma R., Deng Q., et al. S-adenosylmethionine improves cognitive impairment in D-galactose-induced brain aging by inhibiting oxidative stress and neuroinflammation. J. Chem. Neuroanat. 2023; 128: 102232. doi: 10.1016/j.jchemneu.2023.102232.
- Zhou S., You H., Qiu S., et al. A new perspective on NAFLD: focusing on the crosstalk between peroxisome proliferator-activated receptor alpha (PPARα) and farnesoid X receptor (FXR). Biomed. Pharmacother. 2022; 154: 113577. doi: 10.1016/j.biopha.2022.113577.