Моніторинг глікемії та менеджмент пацієнтів із цукровим діабетом і хронічною хворобою нирок
Переклала й адаптувала канд. мед. наук Ольга Королюк
Неконтрольований цукровий діабет (ЦД) призводить до ускладнень, зокрема хронічної хвороби нирок (ХХН). Майже половина всіх випадків термінальної стадії ниркової недостатності (ТСНН) у світі спричинена ЦД 2 типу. Скореговане виживання після 3 та 5 років гемодіалізу становить 55 і 40% відповідно, причому найгірші показники спостерігаються у хворих на ЦД. Крім того, ризик смерті й ускладнень у пацієнтів із ЦД та ХХН 4-5 стадії або розрахованою швидкістю клубочкової фільтрації (рШКФ) <30 мл/хв/1,73 м2 практично такий самий, як у пацієнтів із ТСНН на діалізі. Отже, пацієнти із ЦД та ХХН 4-5 стадії належать до групи високого ризику, яка потребує оптимізації стратегій контролю глікемії для покращення клінічних результатів.
Метаболізм глюкози й інсуліну в нормі та при діабеті
Стан еуглікемії – це баланс між швидкістю «появи» та «зникнення» глюкози в крові. Швидкість «появи» насамперед опосередкована глюкагоном і залежить від спорожнення шлунка, всмоктування в кишківнику, глікогенолізу та глюконеогенезу. «Зникнення» глюкози, тобто її поглинання кістково-м’язовою та жировою тканиною, утворення глікогену в печінці забезпечує інсулін (рис. 1).
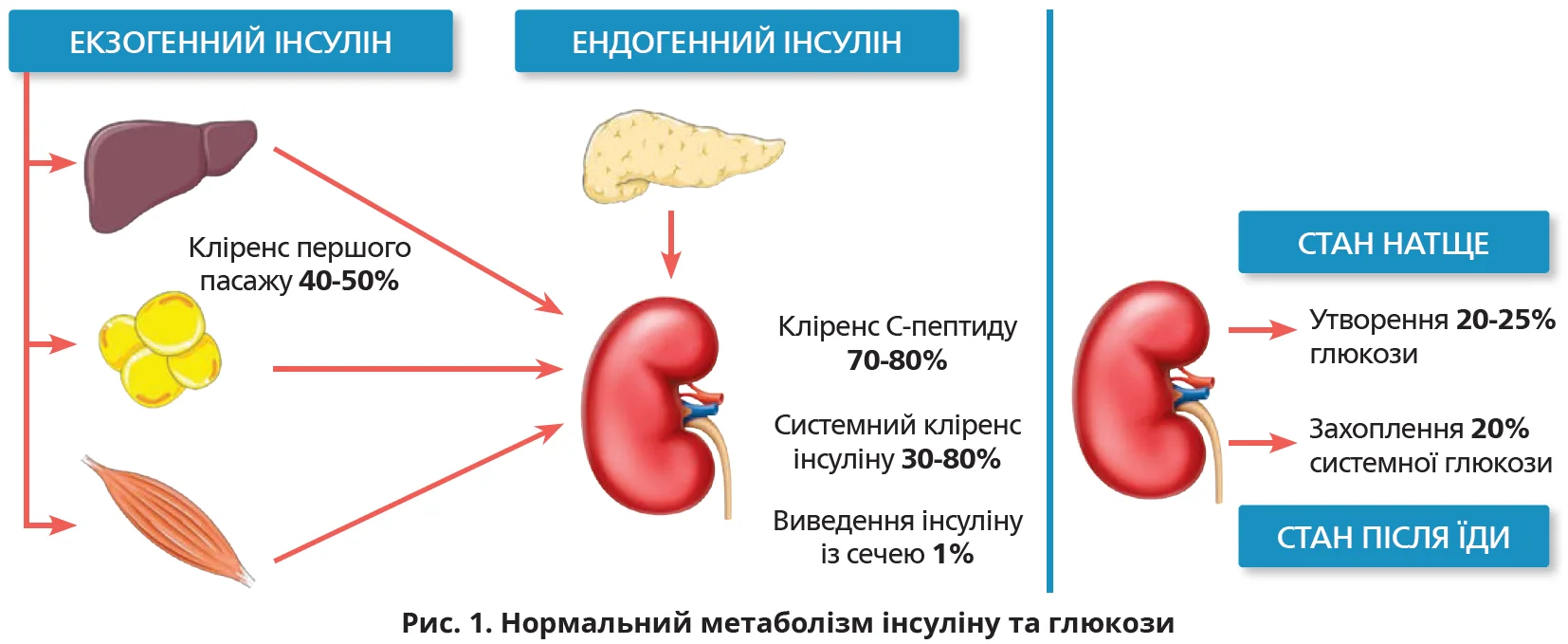
У нормі ендогенний інсулін утворюється безперервно зі швидкістю 0,5-1 од./год. Це базальна секреція, що становить ≈48-52% загальної добової продукції інсуліну. Впродовж перших 4 годин після їди секреція інсуліну збільшується в 3-10 разів. Опосередковані глікемією імпульсні викиди інсуліну мають двофазний характер: перший пік виникає через 3-5 хвилин після їди та триває до 10 хвилин; другий пік припадає на інтервал від 60 до 120 хвилин. В умовах голодування ендогенне утворення глюкози в перші 8-12 годин переважно відбувається в печінці шляхом глікогенолізу. Надалі включається глюконеогенез, причому близько 25% глюкози може утворюватися в нирках. Після прийому їжі нирки поглинають до 20% усієї глюкози, що виводиться з крові.
Близько 50% ендогенного інсуліну виводиться печінкою, решта надходить у системний кровообіг. Досягнувши нирок, до 65% інсуліну фільтрується клубочками та реабсорбується в проксимальних канальцях. Близько 35% інсуліну транспортується від постгломерулярних перитубулярних судин до проксимальних тубулярних клітин, де відбуваються деградація інсуліну та виведення із сечею (≈1%). Нирки метаболізують близько 80% екзогенного інсуліну, який не метаболізується під час першого проходження через печінку.
Патофізіологія діабету на пізніх стадіях ХХН
Посилення інсулінорезистентності на ранніх стадіях ХХН збільшує потребу в інсуліні в пацієнтів із ЦД 1 типу або його призначення в пацієнтів із ЦД 2 типу. Проте при ТСНН зниження кліренсу інсуліну посилює ризик розвитку гіпоглікемії. Після зниження рШКФ <20 мл/хв/1,73 м2 близько 30% пацієнтів із ЦД 2 типу потребують зменшення дози інсуліну або глюкозознижувальних засобів (ГЗЗ). Цей феномен зумовлений подовженням періоду напіввиведення ендогенного й екзогенного інсуліну, зменшенням резистентності до інсуліну внаслідок видалення уремічних токсинів шляхом діалізу, зниженням глюконеогенезу та недоїданням (рис. 2). Як наслідок, у пацієнтів із ЦД 1 типу добова доза інсуліну має зменшитися на 40%, у пацієнтів із ЦД 2 типу – на 50%.
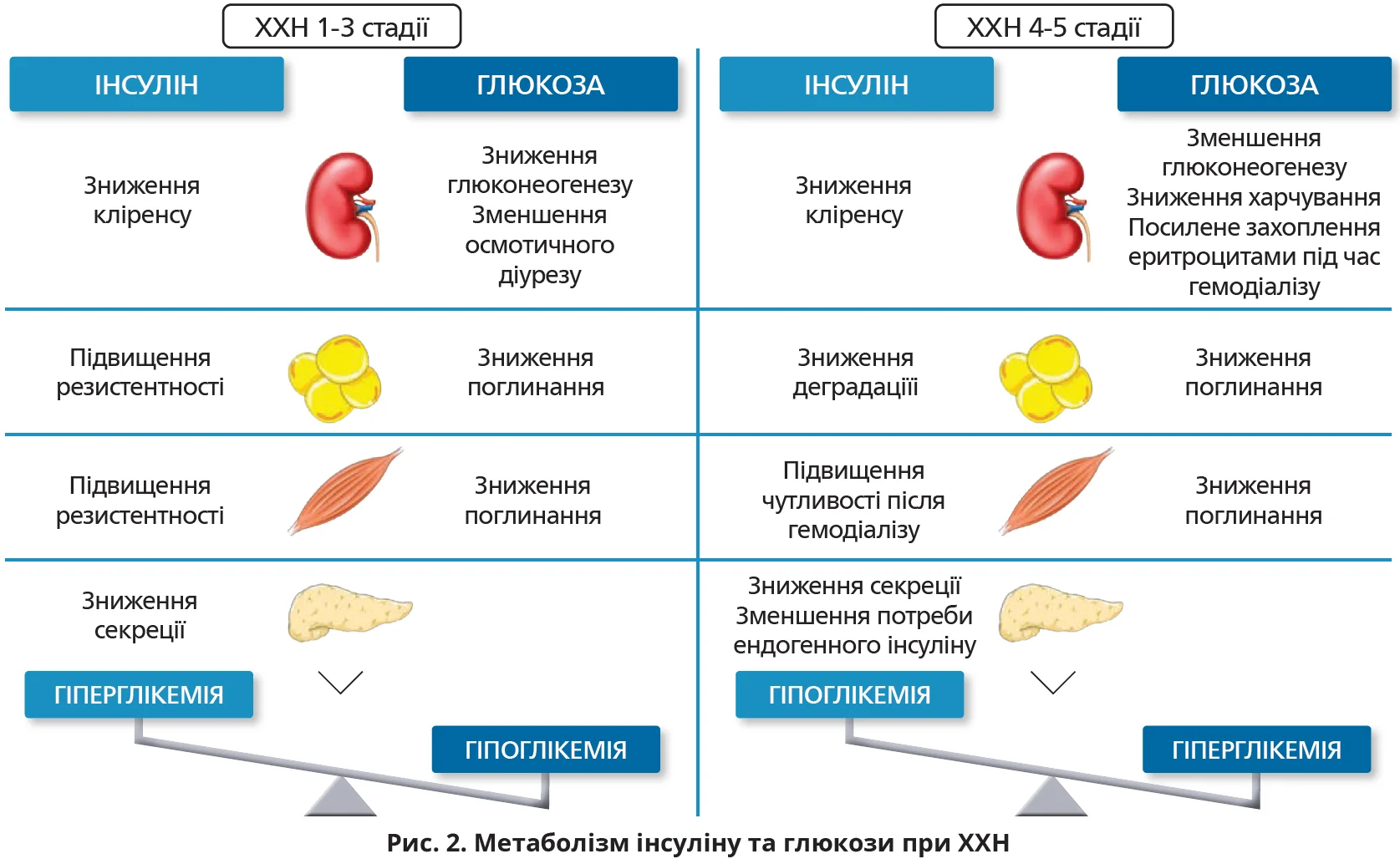
У пацієнтів на гемодіалізі часто виникають гіпоглікемічні епізоди, які потребують корегування або скасування інсуліну та пероральних ГЗЗ.
Визначено такі механізми гіпоглікемії:
1) зниження глюконеогенезу й порушення ниркового кліренсу інсуліну;
2) зниження деградації інсуліну в нирках, печінці та м’язах унаслідок уремії;
3) посилення захоплення глюкози еритроцитами під час гемодіалізу;
4) порушення контрінсулярних гормонів (кортизол, гормон росту);
5) аліментарна депривація;
6) мінливість впливу ГЗЗ й ефекту екзогенного інсуліну внаслідок гемодіалізу або частої зміни лікування.
Рівень глікемії після гемодіалізу насамперед залежить від концентрації глюкози в діалізаті. Раніше використовували діалізати з високою концентрацією глюкози (до 1600 мг/дл), що призводило до гіперглікемії. Завдяки прогресу техніки ультрафільтрації дедалі частіше застосовують діалізати без глюкози. Проте такий підхід часто спричиняє гіпоглікемію. Отже, стандартом вважається діалізат із концентрацією глюкози 100-200 мг/дл.
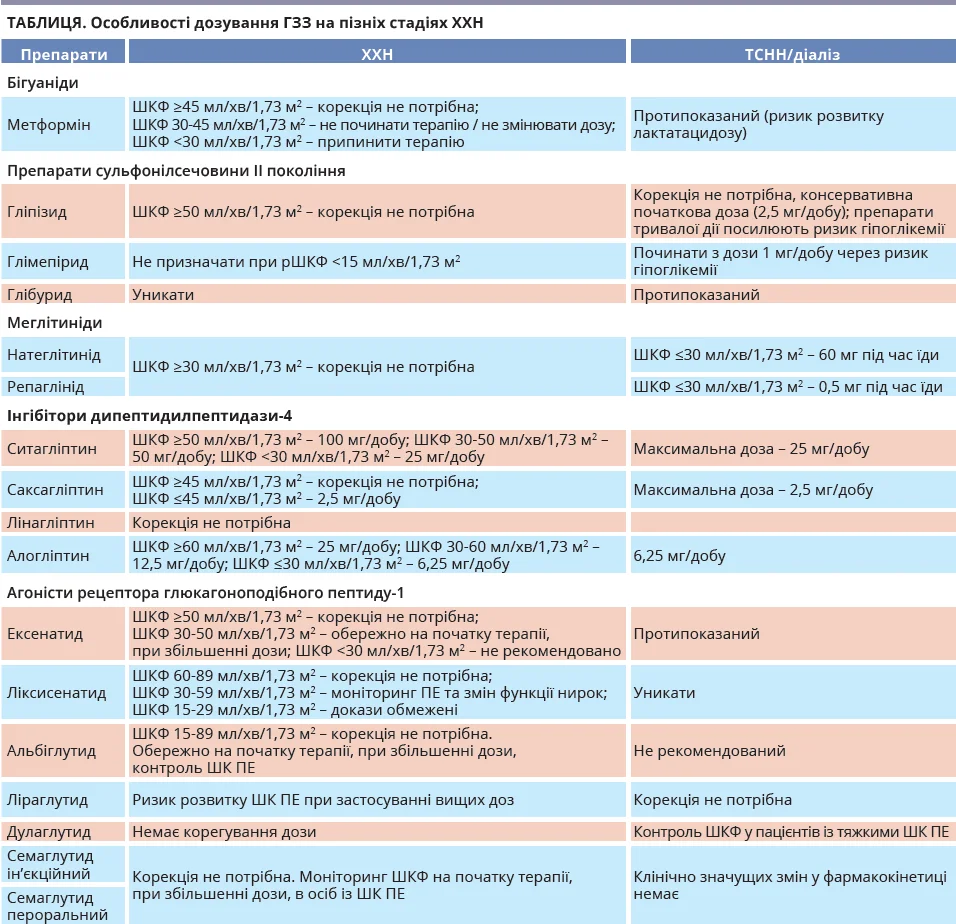
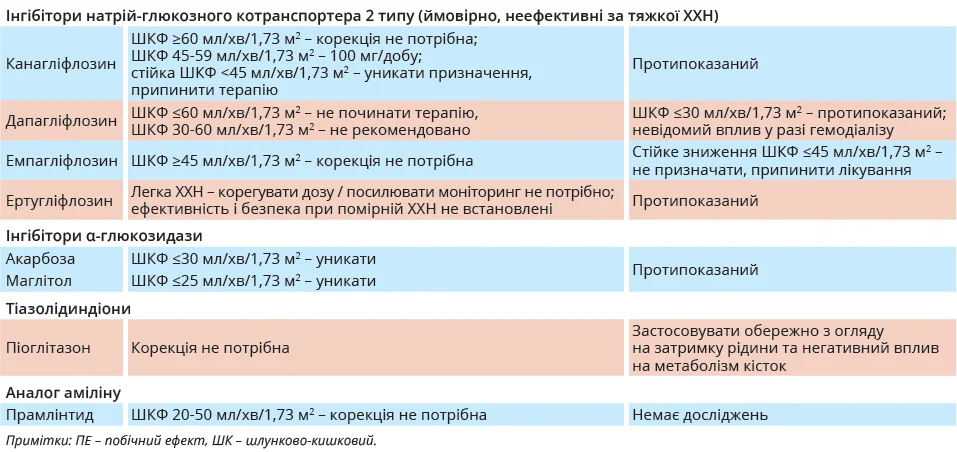
Зменшене виведення інсуліну з плазми під час гемодіалізу та змінна секреція інсуліну β-клітинами підшлункової залози також підвищують ризик розвитку гіпоглікемії. Через низьку молекулярну масу та градієнт концентрації виведення інсуліну відбувається шляхом дифузії або конвекції через мембрани діалізатора. Кліренс інсуліну вищий за умови застосування діалізаторів із полісульфоновими мембранами й нижчий у поліефірно-полімерних сплавів. Секреція інсуліну β-клітинами підшлункової залози визначається залишковою здатністю реагувати на зміни глікемії внаслідок діалізу. Отже, пацієнти з гіпофункцією β-клітин матимуть більше зниження рівня інсуліну та вищий ризик гіперглікемії після гемодіалізу, особливо при використанні полісульфонових мембран. І навпаки: пацієнти зі збереженою функцією β-клітин і секрецією інсуліну мають вищий ризик розвитку гіпоглікемії після гемодіалізу, що потребує зменшення доз ГЗЗ. Загалом пошук балансу дозування та часу прийому ГЗЗ відіграє головну роль в оптимізації лікування пацієнтів із ЦД на діалізі (табл.).
Альтернативним є перитонеальний діаліз, який дає змогу запобігти гіпоглікемії шляхом поглинання декстрози з діалізного розчину. У діалізний розчин можна також уводити інсулін, забезпечуючи відносно постійний рівень базального інсуліну через портальну циркуляцію для зменшення коливань глікемії. Проте збільшення калорій від поглинання декстрози може спричиняти збільшення маси тіла та підвищення потреби в інсуліні.
Результати тривалого моніторингу глюкози (ТМГ) вказують, що пацієнтам на гемодіалізі притаманна висока варіабельність глікемії (ВГ). Гіперглікемія збільшує утворення кінцевих продуктів глікації й активних форм кисню в клітинах ендотелію, подоцитах і мезангіальних клітинах, що призводить до хронічного прозапального стану. ВГ посилює окисний стрес і медіатори запалення. Пацієнти з ХХН та ЦД мають підвищений рівень окисного стресу та медіаторів запалення, що підвищує смертність.
Клінічні наслідки гіперглікемії в пацієнтів із тяжкою ХХН
Дослідження UKPDS за участю пацієнтів із ЦД 2 типу продемонструвало, що інтенсивний контроль глікемії знижує ризик мікросудинних ускладнень. Проте пізніші дослідження (ADVANCE, VADT, ACCORD) вказують, що інтенсивний контроль глікемії в осіб із тривалим ЦД 2 типу та ранніми стадіями ХХН не має переваг щодо серцево-судинних ускладнень і асоціюється з вищими показниками смертності. Проведені згодом метааналізи цих досліджень свідчать на користь інтенсивного контролю глікемії щодо серцево-судинних наслідків. Однак у зв’язку з тим що більшість досліджень не включали пацієнтів із пізніми стадіями ХХН, оптимальна довгострокова мета контролю глікемії за показником HbA1c дотепер не визначена.
Що стосується пацієнтів із ТСНН на діалізі, то рівні HbA1c ≥10% асоціюються з вищим ризиком смерті порівняно з показниками в межах 5-6%. Інше дослідження в цій когорті вказує, що ризик раптової смерті в підгрупі з рівнем HbA1c >8% удвічі вищий, аніж у підгрупі з HbA1c ≤6%. У пацієнтів на гемодіалізі з ЦД обох типів асоціація між рівнями HbA1c та ризиком смерті U-подібна з вищими показниками при рівнях <6 і ≥9%. Інший аналіз вказує на аналогічні результати для рівнів HbA1c <6,5 та >11%. У метааналізі 10 досліджень (83 684 пацієнти з діабетом обох типів на гемодіалізі) дійшли висновку, що рівень HbA1c >8,5% збільшує ризик смерті на 14% порівняно з HbA1c 6,5% і на 29% порівняно з HbA1c 7,4%.
У хворих із діабетичним кетоацидозом, які перебувають на гемодіалізі, частіше трапляється перевантаження об’ємом, аніж дегідратація (28 проти 3% в осіб зі збереженою функцією нирок, p<0,001), що зумовлено відсутністю осмотичного діурезу. Порівняно з пацієнтами зі збереженою функцією нирок рівень гіперглікемії в цій когорті істотно вищий (804,5±362,6 проти 472,5±137,7 мг/дл, р<0,001), незважаючи на нижчі середні показники HbA1c (9,6±2,1 проти 12,0±2,5%, р<0,001) і вищий ризик розвитку гіпоглікемії <70 мг/дл (34 проти 14%, p=0,002).
Клінічні наслідки гіпоглікемії в пацієнтів із ХХН
Як свідчать клінічні спостереження, за рік до початку діалізу епізоди гіпоглікемії виникають у 19,2% пацієнтів із ЦД. Гіпоглікемія асоціюється з високим ризиком захворюваності та смертності та ставить під сумнів переваги інтенсивного контролю глікемії в пацієнтів із тривалим ЦД 2 типу й поліморбідністю. Поширеність гіпоглікемії у хворих на ЦД на гемодіалізі становить 46-52%.
Що стосується тяжкості, то рівень глікемії <70 мг/дл виникає в 51% пацієнтів, <54 мг/дл – у 28%, <40 мг/дл – у 10%. У 35% пацієнтів виникають множинні епізоди гіпоглікемії.
Після початку діалізу гіпоглікемічні епізоди асоціюються з вищим ризиком повторної гіпоглікемії, серцевих аритмій, інсульту, судом, раптової серцевої смерті та загальної смертності. Важко сказати, чи гіпоглікемія є безпосередньою причиною несприятливих наслідків, чи маркером тяжкості поліморбідності, притаманної цій когорті. Ризик виникнення тяжкої гіпоглікемії вищий у пацієнтів із високими показниками HbA1c, цереброваскулярними хворобами, серцевою недостатністю та за інсулінотерапії. Найчастішими причинами гіпоглікемії були застосування ліків (46%), сепсис (39%) і недоїдання (7%).
Цілі глікемічної терапії
Цільові рівні HbA1c на пізніх стадіях ХХН мають відрізнятися від рекомендованих настановами цілей для інших популяцій хворих на діабет. Хоча цільовий рівень HbA1c <7% асоціюється з кращим виживанням пацієнтів із меншою коморбідністю й адекватним харчуванням, нижчі рівні HbA1c пов’язані з вищим ризиком смерті в пацієнтів із коморбідністю та недостатнім харчуванням. Настанови NKF-KDOQI рекомендують для більшості пацієнтів із ХХН цільовий рівень HbA1c ≈7%. Персоналізований підхід із менш суворими цільовими показниками глікемії (HbA1c 7-8%) схвалений NKF-KDOQI й іншими діабетичними настановами для пацієнтів на пізніх стадіях ХХН через меншу тривалість життя, значну поліморбідність і високий ризик гіпоглікемії. Значною мірою така рекомендація зумовлена високим ризиком ятрогенної гіпоглікемії. Нові засоби з меншим ризиком гіпоглікемії в цій когорті вивчені недостатньо. Крім того, на пізніх стадіях ХХН показники HbA1c є менш надійними, про що йтиметься далі (рис. 3). Отже, цільові показники глікемії для оптимізації клінічних результатів у цій когорті потребують подальшого вивчення.
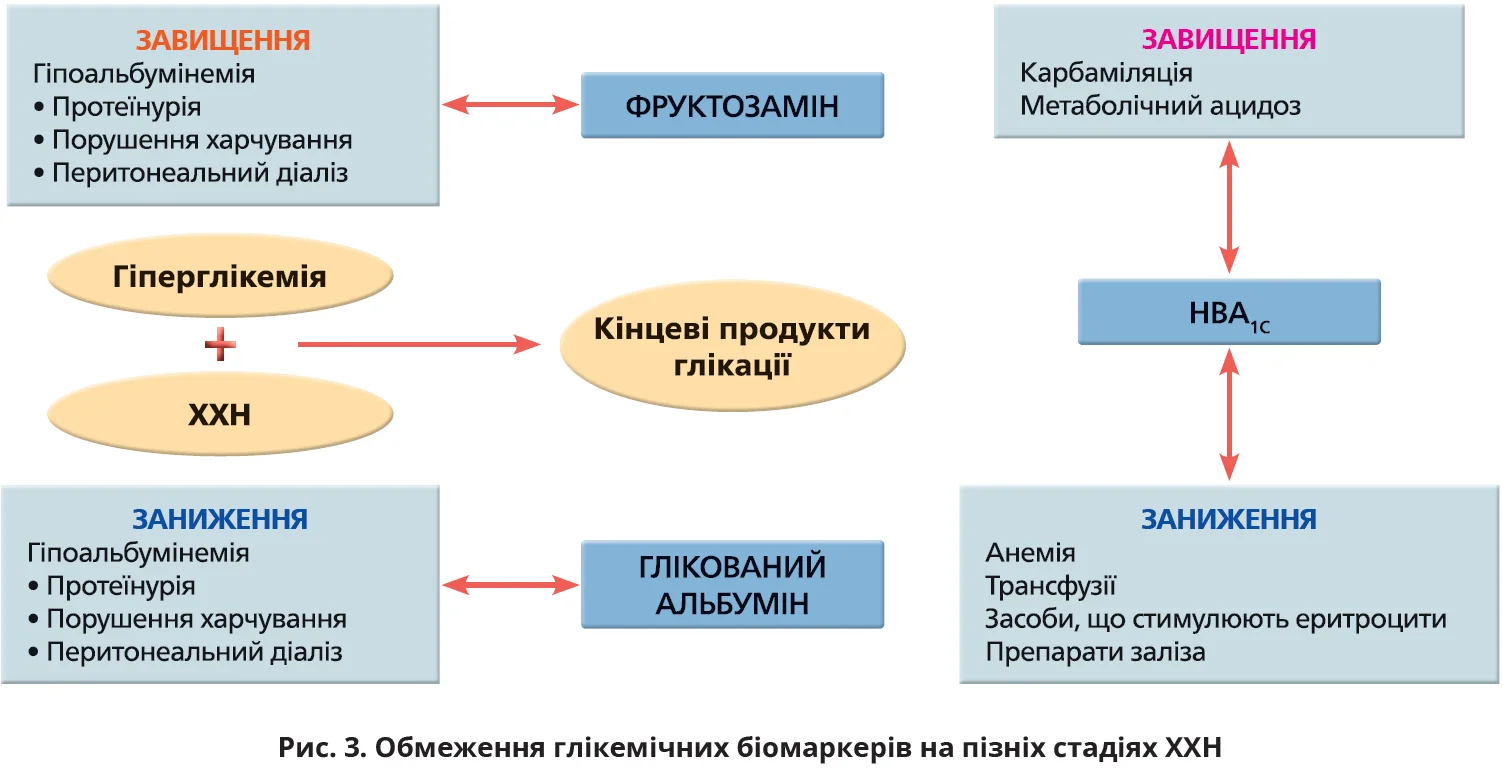
Моніторинг глікемії на пізніх стадіях ХХН
Глікований гемоглобін (HbА1с), фруктозамін, глікований альбумін. Настанови NKF-KDOQI рекомендують пацієнтам із ТСНН оцінювати глікемічний контроль за допомогою HbA1c у поєднанні із самоконтролем глікемії. Проте численні фактори, пов’язані з ТСНН, впливають на показники HbA1c. Завищення показників можливе за умови значної азотемії та метаболічного ацидозу через утворення карбамільованого гемоглобіну, який важко відрізнити від HbA1c. Заниження показників HbA1c часто виникає внаслідок анемії, застосування еритропоетиностимулювальних засобів, скорочення тривалості життя еритроцитів через уремію та лізис еритроцитів під час гемодіалізу. Тому запропоновано альтернативні глікемічні маркери – фруктозамін і глікований альбумін, які відображають глікемію за коротші проміжки часу (2-4 тижні). Глікований альбумін прогнозує загальну та серцево-судинну смертність у пацієнтів на хронічному гемодіалізі. Проте при гіпоальбумінемії, яка часто спостерігається у хворих на ХХН, показники глікованого альбуміну занижуються, а показники фруктозаміну – завищуються. Запропоновано спосіб корекції глікованого альбуміну на сироватковий альбумін у пацієнтів із тяжкою ХХН (Fukami K. et al., 2015). Отже, використання альтернативних маркерів має обмежену доступність, недостатню точність і невизначену валідність у пацієнтів на пізніх стадіях ХХН.
Самоконтроль глікемії капілярним глюкометром. Здебільшого лікарі та пацієнти з ТСНН приймають рішення щодо лікування та вибору дози інсуліну на підставі визначення глікемії на місці надання допомоги (ГнМНД). Проте на цей показник впливають анемія, гострі стани, ліки тощо. До ензиматичних методів вимірювання глюкози відносять глюкозооксидазний (GO), гексокіназний (HK) або глюкозодегідрогеназний (GDH) із трьома коферментами – піролохінолінхінон (GDH-PQQ), нікотинаденіндинуклеотид (GDH-NAD) і флавінаденіндинуклеотид (GDH-FAD). Ацетамінофен, аскорбінова кислота, ікодекстрин, мальтоза, тригліцериди, сечова кислота можуть впливати на датчик шляхом електрохімічних реакцій з електродом або перехресних ферментативних реакцій. У разі використання глюкометрів на основі GDH-PQQ можливі серйозні випадки гіпоглікемії, адже ця методика не відрізняє глюкозу від інших цукрів. Хибно завищені рівні глікемії можливі в пацієнтів, які використовують ікодекстриновмісні розчини для перитонеального діалізу. Повідомляють також про хибні результати в осіб, які використовують глюкометри GO. Відповідно, використання глюкометрів GDH-PQQ та GO не рекомендовано пацієнтам із ТСНН, які перебувають на діалізі або використовують ліки, що спричиняють похибки (імуноглобуліни, абатацепт, парентеральні розчини мальтози/галактози/ксилози тощо). Низький гематокрит <35%, рівень ацетамінофену в плазмі ≥8 мг/дл і гіпоксія (PaO2 <45 мм рт. ст.) можуть завищувати показники глікемії за умови використання глюкометра GO, тоді як киснева терапія (PaO2 >150 мм рт. ст.), навпаки, занижує результат. Високі рівні білірубіну, тригліцеридів, сечової кислоти (>20 мг/дл) зумовлюють псевдогіпоглікемію.
Підхід ГнМНД не дає можливості виявити безсимптомні або нічні гіпоглікемії, оцінити добовий глікемічний профіль, особливо під час сеансів гемодіалізу. Тому дуже важливо знайти стандартизований довгостроковий показник для контролю глікемії при лікуванні діалізом, який дасть пацієнтам та клініцистам змогу швидко приймати терапевтичні рішення для запобігання гіпоглікемії в режимі реального часу. Рекомендації щодо менеджменту таких пацієнтів підсумовано на рисунку 4.
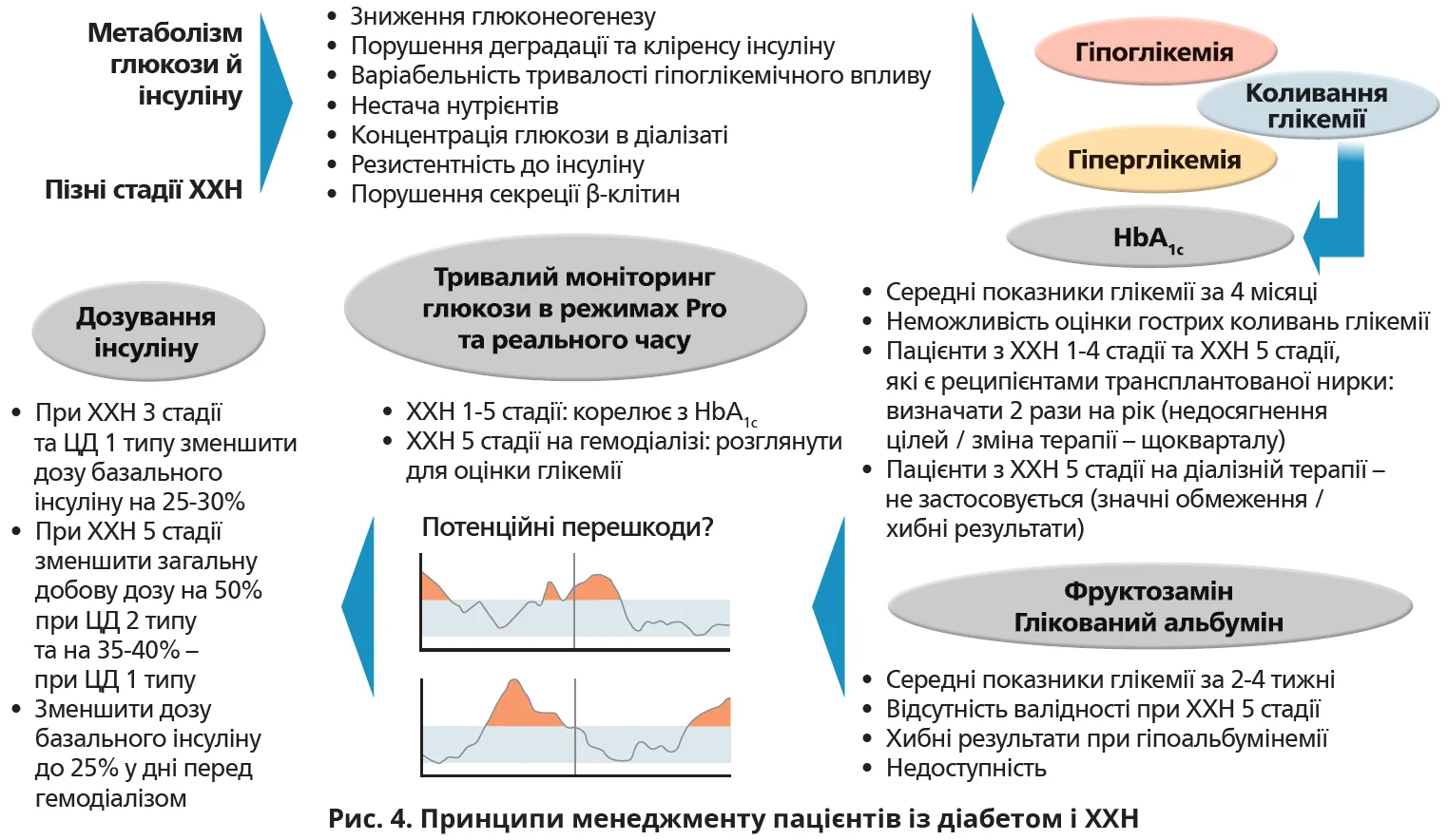
ТМГ на пізніх стадіях ХХН
ВГ та гіпоглікемія поширені навіть у пацієнтів із добре контрольованим ЦД 2 типу. В осіб без діабету середні показники глікемії нижчі під час гемодіалізу з мінімальними значеннями впродовж 3-ї години сеансу. У пацієнтів із ЦД обох типів спостерігалася тенденція до зниження рівня глюкози під час гемодіалізу з мінімальними показниками через 12 годин після сеансу. У дні без діалізу рівні глікемії були вищими. Дослідження за участю пацієнтів із ЦД 2 типу з використанням еуглікемічного клемп-тесту порівнювало потреби в інсуліні до та після гемодіалізу. Споживання калорій становило ≈2200 за 3 стандартні прийоми їжі та 2 перекуси, період голодування перед сеансом діалізу становив 8-24 години. Загальна добова доза інсуліну для досягнення еуглікемії до діалізу – 23,6±7,7 од./добу, після діалізу – 19,9±4,9 од./добу, що вказує на покращення чутливості до інсуліну. Базальна потреба в інсуліні після діалізу була на 25% нижчою.
Роль ТМГ на пізніх стадіях ХХН
Суттєвими перевагами ТМГ є краща оцінка добових глікемічних моделей (включаючи реакції на їжу, ліки, гострі стани, стресові чинники) та потреби в інсуліні. Цей метод позбавляє пацієнта тягаря постійних проколів для самоконтролю глікемії, допомагає виявити приховані епізоди гіпоглікемії та запобігти їх виникненню шляхом регуляції швидкості інфузії інсуліну («штучна підшлункова залоза» Tandem Basal and Control IQ, Medtronic G670).
Зважаючи на обмеження HbA1c й інших глікемічних біомаркерів, ТМГ може стати новим стандартом оцінки глікемічного контролю в пацієнтів із ЦД на діалізі. Цей метод оцінює декілька важливих показників:
1) час у цільовому діапазоні;
2) час у діапазоні гіперглікемії;
3) час у діапазоні гіпоглікемії;
4) ВГ.
За даними ТМГ можна розрахувати індекс моніторингу глікемії: ІМГ [%] = 3,31 + 0,02392 × [середнє значення глюкози, мг/дл] (Beck R. et al., 2017). Є також онлайн-калькулятор ІМГ (http://www.agpreport.org/agp/links). Цей показник може бути корисним для пацієнтів із тяжкою ХХН, у котрих діагностичне значення HbA1c обмежене.
Золотим стандартом ТМГ є Yellow Spring Instrument 2300 STAT. Біосенсор використовує мембрану на основі GO з окисленням глюкози до глюконолактону та перекису водню. Перекис водню окислюється на платиновому аноді електрохімічного зонда, утворюючи потік електронів, пропорційний концентрації глюкози в зразку. Серед комерційно доступних систем ТМГ у реальному часі системи Abbott FreeStyle Libre (Abbott Diabetes Care) та Dexcom G6 (Dexcom, Inc) фабрично відкалібровані й не потребують ручного калібрування за допомогою тест-смужок, що значно спрощує життя пацієнтам із ТСНН, які перебувають на діалізі. Системи Medtronic Guardian 3 та Enlite 2 (Medtronic, Inc), Dexcom G5 і Eversense (Senseonics, Inc) потребують ручного калібрування.
Неімплантовані ТМГ (Guardian, Dexcom, Abbott FreeStyle Libre) прикріплюються до шкіри рук або живота й використовують черезшкірне зондування за допомогою невеликої нитяної дротини, введеної в підшкірну клітковину для вимірювання рівня глюкози в інтерстиціальній рідині.
Їх використання цілком безпечне, повідомлення про інфекції, шкірні реакції або відкриті рани дуже рідкісні. Проте є декілька чинників, які впливають на показники: анемія, гіпоксія або введення кисню, високий рівень сечової кислоти, високі дози ацетилсаліцилової кислоти й ацетамінофену. Імовірні впливи можуть мати алкоголь, альбутерол, лізиноприл, атенолол і аторвастатин. Дані щодо інших клінічних ситуацій, поширених у пацієнтів із ХХН, як-от компонент перитонеального діалізу ікодекстрин, поки що відсутні. До отримання переконливих доказів датчики на основі GO (наприклад, FreeStyle Libre) не мають використовуватися в пацієнтів, які перебувають на перитонеальному діалізі та гемодіалізі.
Імплантовані датчики (наприклад, Eversense) менше підходять для пацієнтів із ТСНН на гемодіалізі з огляду на наявність судинних доступів (катетерів, фістул) на руках, де імплантується датчик. Датчики Eversense використовують неферментативний електрохімічний флуоресцентний полімер для вимірювання рівня глюкози в інтерстиціальній тканині. Тобто ймовірність впливу речовин на електрод або фермент у цьому випадку менша. Проте хибні значення можуть давати речовини, які зв’язуються з полімером або здатні поглинати флуоресцентне світло в спектрі датчика. Це лактат, леводопа, піроксикам, пралідоксиму йодид, саліцилова кислота, тетрациклін, рибоза та маніт. У дослідженнях на валідність датчиків лише манітол, сорбіт і тетрациклін показали значущі похибки при терапевтичних концентраціях препарату. Незважаючи на докази більшої точності цих датчиків за різних клінічних станів, немає досліджень у популяції пацієнтів із тяжкою ХХН.
Висновки
- На пізніх стадіях ХХН метаболізм глюкози й інсуліну суттєво змінюється.
- Збільшується ризик розвитку гіпоглікемії внаслідок порушення глюконеогенезу в нирках, зменшення ниркового кліренсу інсуліну та його неповноцінної деградації за умов уремії, підвищення поглинання глюкози еритроцитами під час гемодіалізу, порушення впливів контрінсулярних гормонів, недостатності харчування та нестабільності впливу ГЗЗ або екзогенного інсуліну.
- У пацієнтів із ТСНН часто виникають значні коливання глікемії, включно з гіпо- та гіперглікемією.
- Різноманітні стани, пов’язані з ХХН, можуть впливати на оцінку глікемії за НbA1c, занижуючи або завищуючи показники.
- При тяжкій ХХН найбільш сприятливою метою глікемії є діапазон HbA1c 7-8%.
- Використання ікодекстрину й неглюкозних цукрів у розчинах для перитонеального діалізу може впливати на правильність глюкометрії методами GO та GDH-PQQ. Докази щодо інших способів контролю глікемії в пацієнтів із ТСНН обмежені.
- Нові дані щодо використання ТМГ вказують на можливість точнішого моніторингу й корегування лікування в пацієнтів із ЦД та ХХН.
Література
Galindo R.J., Beck R.W., Scioscia M.F., Umpierrez G.E., Tuttle K.R. Glycemic monitoring and management in advanced chronic kidney disease. Endocrine Reviews. 2020; 41 (5): 756-774. https://doi.org/10.1210/endrev/bnaa017.
