Кишкова мікробіота як тригер метаболічного запалення при ожирінні та цукровому діабеті 2 типу
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
Поширеність цукрового діабету (ЦД) 2 типу, яка значною мірою зумовлена пандемією ожиріння, швидко зростає. Станом на 2019 рік на ЦД страждали близько 463 млн людей у всьому світі; очікується, що до 2030 року цей показник зросте до 578 млн [1].
ЦД 2 типу зазвичай передує розвиток інсулінорезистентності (ІР), що призводить до зменшення утилізації глюкози та порушення індукованого інсуліном пригнічення вироблення глюкози в печінці [2]. На ранніх стадіях IР підшлункова залоза компенсує нестачу ефектів інсуліну на периферії завдяки збільшенню вироблення інсуліну, проте, коли β-клітини вже не спроможні подолати високу потребу в інсуліні, розвивається гіперглікемія, що пов’язана з несприятливими мікро- та макроваскулярними ускладненнями ЦД [3, 4].
Протягом останніх декад одним із чинників розвитку ІР та її прогресування до ЦД 2 типу вважається хронічне метаболічне запалення низької інтенсивності, яке також називають метазапаленням [5]. Питання чинників, здатних запускати процеси метазапалення, продовжує вивчатися. Як один із цих чинників розглядається вплив кишкової мікробіоти, котра відіграє важливу роль у метаболізмі людини та виступає модулятором імунітету. Відомо, що ожирінню та ЦД 2 типу притаманні зміни складу мікробіоти кишківника [6-8]. Цей огляд присвячено тристоронній взаємодії між кишковою мікробіотою, імунною системою та шляхами метаболізму глюкози (рис. 1).
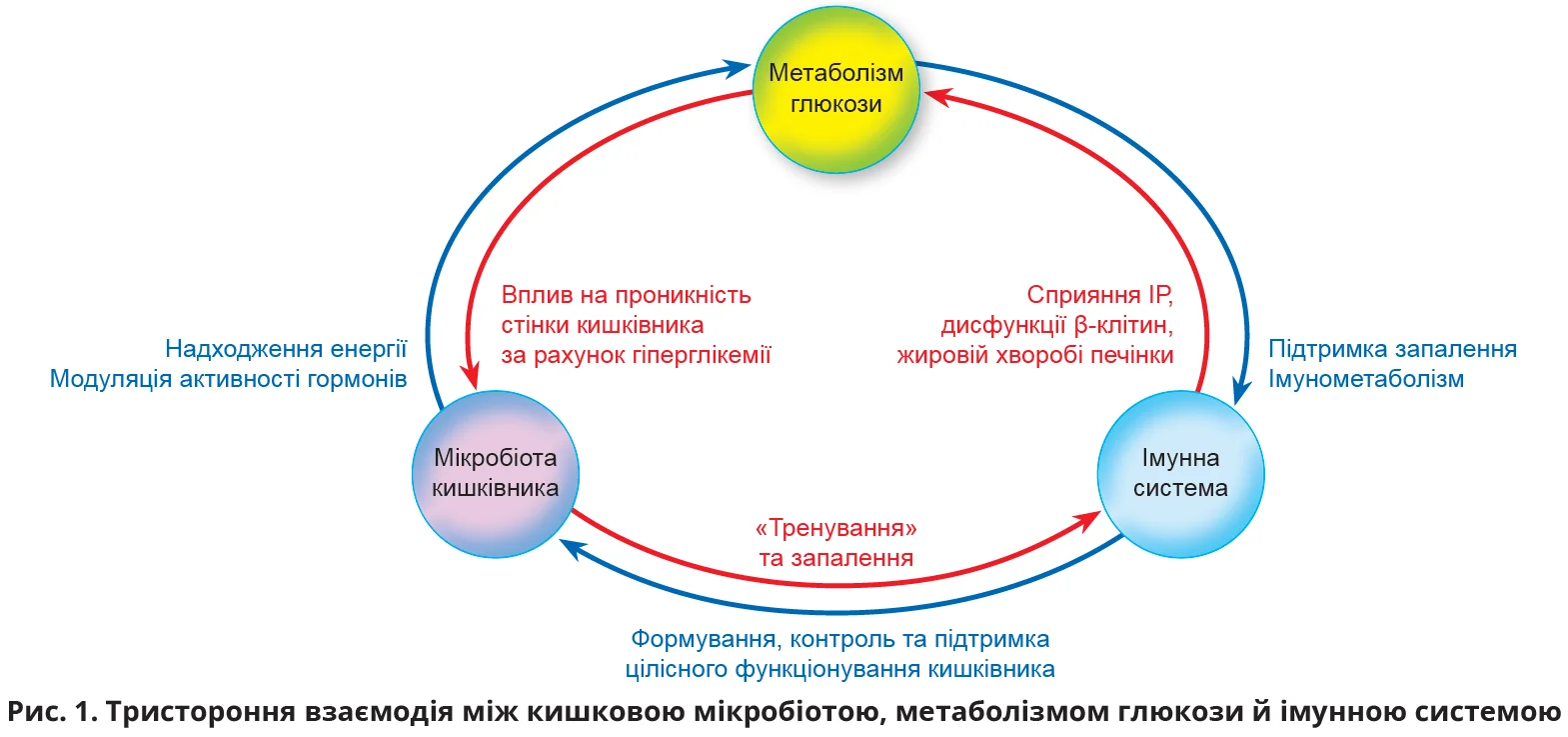
Запалення при ожирінні та ЦД 2 типу
Запалення низького рівня тісно пов’язане з розладами функціонування шляхів метаболізму глюкози. У крові осіб із метаболічним синдромом спостерігається підвищення деяких цитокінів, що має несприятливий вплив на стан здоров’я [9-11]. Зокрема, в осіб з ІР відзначаються прозапальний стан і змінена відповідь на респіраторні вірусні інфекції [12], а в пацієнтів з ожирінням – тяжчий перебіг астми, який одночасно асоціюється зі змінами мікробіоти кишківника [13]. У зв’язку із цим науковцями запропоновано низку фармакологічних методів лікування, спрямованих на зниження рівня запалення при метаболічних захворюваннях.
Запалення й ІР у жировій тканині тісно пов’язані. Нещодавнє дослідження продемонструвало, що асоційована з ожирінням ІР призводить до інфільтрації тканин прозапальними макрофагами [14], а це, своєю чергою, спричиняє перехід ІР у ЦД.
Окрім того, жирова тканина містить низку імунних клітин, які секретують протизапальні цитокіни, зокрема інтерлейкін-10 (ІЛ-10), здатні запобігати ІР за нормальної маси тіла [15, 16]. У мишей з ожирінням і людей із ЦД 2 типу спостерігаються нижча експресія ІЛ-10 і вища активність прозапальних сигнальних шляхів [15, 17]. Імовірно, саме цей ІЛ відіграє ключову роль у профілактиці запалення в осіб із метаболічними розладами. Іншими протизапальними цитокінами виступають ІЛ-4 й ІЛ-13.
Запалення – це біологічна відповідь імунної системи, що запускається при контакті з патогенами, пошкодженими клітинами та токсичними речовинами. Відомим тригером метаболічного запалення є ліпополісахариди (ЛПС) – складники клітинної стінки грамнегативних бактерій, підвищений уміст яких було виявлено в крові осіб із ЦД [18]. Вважається, що ЛПС переносяться в кровоплин разом із хіломікронами або через підвищену проникність стінки кишківника [19]. У літературі описано такі феномени, як метаболічна ендотоксемія [20, 21] та постпрандіальне запалення [22]. Поняття «метаболічна ендотоксемія» характеризує запальну відповідь на підвищений системний рівень ЛПС у разі так званого синдрому дірявого кишківника [23], а термін «постпрандіальне запалення» – підвищення вмісту циркулювальних ендотоксинів та інших запальних маркерів після прийому їжі, особливо багатої на жири [24-26]. Цікаво, що ЛПС і довголанцюгові насичені жирні кислоти, як-от пальмітат, діють синергетично, активуючи запальні сигнальні шляхи в макрофагах [27], що підтверджує наявність зв’язку між багатою на насичені жири західною дієтою та постпрандіальним запаленням [28].
Отже, наявні дані свідчать, що ожиріння, ЦД 2 типу та дисбаланс імунної системи тісно пов’язані. Деякі прозапальні агенти безпосередньо впливають на толерантність до глюкози, що обґрунтовує доцільність застосування терміна «метазапалення».
Кишкова мікробіота при метаболічних захворюваннях
У кишківнику людини існують складні двонаправлені зв’язки між трильйонами мікроорганізмів та організмом-господарем [29]. Стан мікробіоти кишківника має ключове значення для здоров’я людини, оскільки мікробіота не лише відіграє важливу роль у травленні, а й продукує метаболіти, здатні впливати на метаболізм і функціонування імунної системи [30-32]. Імуномодулювальні властивості кишкової мікробіоти особливо важливі в контексті метазапалення, що супроводжує ожиріння та ЦД 2 типу [33].
У мишей зі стерильним кишківником, вирощених в асептичних умовах, спостерігається недорозвинена імунна система та недостатня відповідь на вплив патогенів [34-36]. Заселення кишківника цих тварин бактеріями відновлює формування й функціонування імунної системи, що доводить зв’язок між імунітетом організму-господаря та його кишковою мікробіотою [37].
Миші зі стерильним кишківником резистентні до індукованого харчуванням ожиріння [38, 39], але введення бактерії, асоційованої з ожирінням (Enterobacter cloacae), зумовлює в цих тварин набір маси тіла та погіршення толерантності до глюкози [40]. Цікаво, що миші, яким було пересаджено мікробіоту донорів з ожирінням, отримували з тої самої їжі більшу кількість енергії, ніж миші, які стали реципієнтами мікробіоти донорів із нормальною масою тіла [41, 42].
Хоча визначення здорової мікробіоти кишківника наразі відсутнє, деякі хвороби характеризуються відмінностями в мікробіоті порівняно зі здоровою групою контролю [29, 43]. Для опису цих відмінностей застосовується термін «дисбіоз», який відображає посилене розростання патобіонтів, втрату коменсалів та/або зменшення різноманітності бактерійного складу [44]. Пацієнтам з ожирінням і ЦД притаманні зміни складу мікробіоти порівняно зі здоровими людьми [6, 41, 45, 46] (рис. 2).
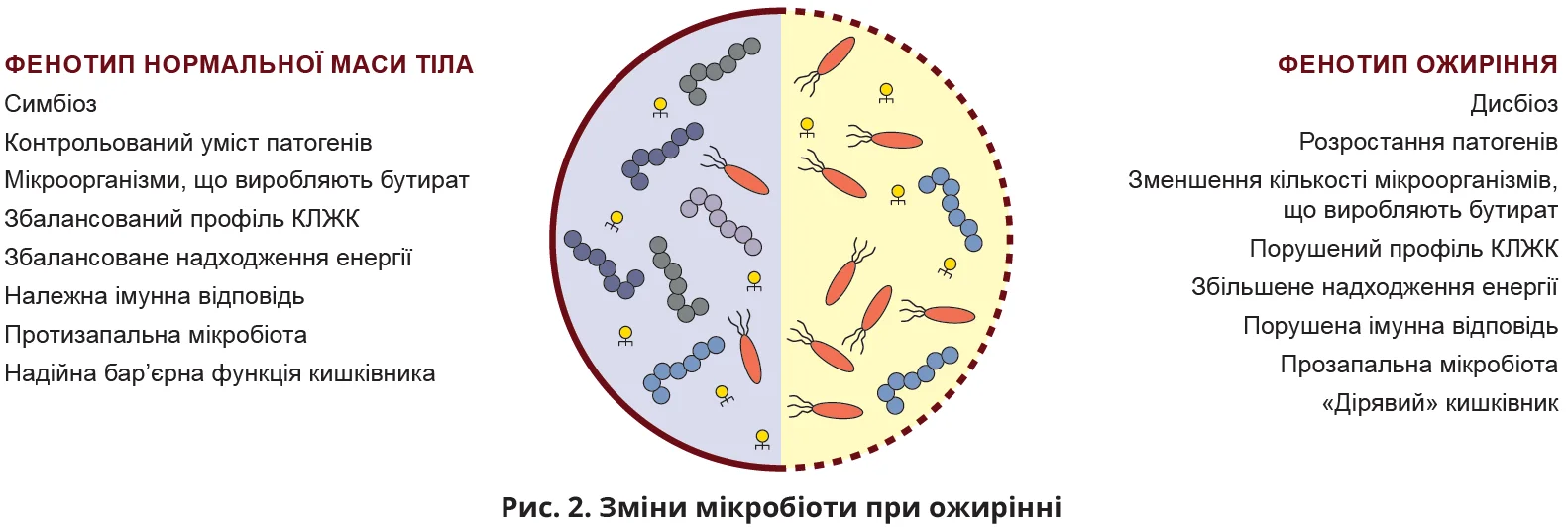
Окрім надмірного отримання енергії, мікробіота осіб з ожирінням і ЦД 2 типу характеризується збільшенням умісту прозапальних бактерій (наприклад, Escherichia coli) та зменшенням умісту протизапальних бактерій (наприклад, Fecalibacterium prausnitzii) [6, 7, 46]. Цей дисбаланс може виступати причиною метазапалення [47, 48]. Він також пов’язаний із порушенням вироблення мікробіотою коротколанцюгових жирних кислот (КЛЖК) [6], які утворюються при мікробному руйнуванні клітковини та мають сприятливий вплив на метаболізм організму-господаря [49].
Відповідно, зміни мікробного складу та менше його різноманіття в осіб з ожирінням асоціюється з прозапальним статусом [8, 50, 51].
Бар’єрна функція кишківника та метаболічне запалення
Належна бар’єрна функція кишківника запобігає проникненню бактерій у кровообіг і периферичні тканини. У пацієнтів із метаболічним синдромом спостерігаються порушення цієї функції та бактерійна транслокація [23]. Показано, що транслокована мікробіота може виступати джерелом ендотоксинів, а антибіотикотерапія здатна зменшувати кишковий і системний уміст ЛПС, покращуючи толерантність до глюкози [47]. ЛПС безпосередньо підвищують проникність стінки кишківника, даючи бактеріям змогу проникати в кровообіг [52].
У кровообігу осіб із ЦД було виявлено вищий уміст бактерійної ДНК порівняно з контрольною групою [53]. ДНК грамнегативних бактерій виявляли також у жировій тканині жінок з ожирінням [54].
На склад мікробіоти кишківника впливають імуноглобуліни, які також здатні нейтралізувати мікробні токсини [55]. Ожирінню притаманні розлади імуноглобулінової відповіді, що асоціюється з порушенням толерантності до глюкози та вищим умістом макрофагів у жировій тканині [56].
Отже, бактерійна транслокація може виступати поясненням запальних змін у тканинах на тлі ожиріння та ЦД, але доказова база із цього питання надзвичайно мала.
Індуковане мікробіотою метаболічне запалення
Хронічне запалення низької інтенсивності при ожирінні та ЦД 2 типу вивчається вже понад 25 років [57], а зміни кишкової мікробіоти при цих станах почали привертати увагу науковців не більш ніж 15 років тому [6, 41, 58].
Крім гіпотези, що кишкова мікробіота впливає на метаболізм організму-господаря через фізичну транслокацію в тканини та запуск запальної відповіді, існує й свіжіша теорія, відповідно до якої мікробіота опосередковує запалення та кардіометаболічні захворювання внаслідок вироблення активних метаболітів, що надходять у системний кровообіг [59].
Найвивченішими в цьому контексті метаболітами є КЛЖК, а саме ацетат, бутират і пропіонат, які утворюються при мікробній ферментації складних вуглеводів (клітковини) [60]. Високий рівень уживання клітковини має протективний ефект щодо низки метаболічних хвороб, у тому числі ЦД, покращує толерантність до глюкози та сприяє поліпшенню бар’єрної функції кишківника [61-63]. КЛЖК також беруть участь у регуляції апетиту [64, 65] та зменшують ІР [60, 66, 67], хоча не всі речовини цього класу мають сприятливий ефект. Наприклад, ацетат спричиняє збільшення ваги [68], а пропіонат знижує чутливість до інсуліну [69].
Значну увагу в контексті кардіометаболічних хвороб привернув також триметиламіну-N-оксид, високі рівні якого асоціюються з підвищеним ризиком розвитку атеросклеротичних серцево-судинних захворювань і серцевої недостатності [70].
Ще однією ланкою, що пов’язує метаболізм глюкози та мікробіоту кишківника, можуть виступати жовчні кислоти – кінцеві продукти обміну холестерину, які утворюються в печінці та з жовчю виділяються в кишківник [71]. Жовчні кислоти здатні впливати на склад кишкової мікробіоти та толерантність до глюкози [72, 73].
Хоча перелічені вище метаболіти й дають змогу покращити розуміння зв’язку між мікробі отою та станом організму-господаря, більшість цих даних отримані в експериментальних дослідженнях і потребують підтвердження в людей. Невідомо також, чи можливо впливати на метаболічні хвороби шляхом впливу на рівні цих метаболітів.
Втручання, спрямовані на відновлення балансу кишкової мікробіоти й усунення запалення
Деякі втручання здатні частково відновити симбіотичний склад мікробіоти та його метаболічні функції. Наприклад, дотримання певних дієт може сприятливо впливати на мікробіоту та знижувати інтенсивність метазапалення. Проте результати застосування дієт складно інтерпретувати, оскільки в дослідженнях зазвичай відзначається низька прихильність і висока варіабельність для різних людей. У зв’язку із цим існує потреба в специфічніших підходах. Із цією метою вивчаються селективні ферментовані засоби, здатні впливати на склад мікробіоти (пребіотики), певні штами бактерій (пробіотики) та трансплантація кишкової мікробіоти.
Дієти
Модуляція кишкової мікробіоти вважається інноваційним методом покращення метаболічних розладів, асоційованих з ожирінням і ЦД 2 типу.
Із цією метою можуть застосовуватися, наприклад, дієти зі збільшеним умістом рослинної клітковини та зменшеним умістом добавок на кшталт штучних підсолоджувачів [43]. Зокрема, збільшення вживання цільнозернових продуктів і пребіотиків сприяє зниженню кількості прозапальних бактерій родини Enterobacteriaceae та деяких запальних маркерів [74]. Уживання клітковини може збільшувати кількість біфідо- й лактобактерій, підвищуючи вміст бутирату в кишківнику [75]. Ці результати підтверджують вплив харчування на склад кишкової мікробіоти та протизапальні наслідки такого впливу [74].
Зміни харчування, особливо кількості нерозчинних складників їжі на кшталт клітковини, здатні змінювати склад кишкової мікробіоти [76]. Так званий західний тип раціону, який передбачає низький уміст клітковини, асоціюється зі зниженням кількості бактерій роду Firmicutes, які мають сприятливі ефекти, водночас зі збільшенням кількості протеобактерій, які здатні проникати крізь слизову оболонку кишківника [77]. Загалом несприятлива селекція бактерій унаслідок західної дієти спричиняє негативні наслідки для організму-господаря.
Пребіотики
Пребіотики – це селективно ферментовані речовини, які певним чином впливають на склад та/або активність шлунково-кишкової мікрофлори, покращуючи здоров’я організму-господаря [78]. Наразі більшість пребіотиків представлена складними вуглеводами, але пребіотичний вплив реалізують й інші сполуки (поліфеноли, поліненасичені жирні кислоти). Пребіотики не лише покращують консистенцію фекалій, а й ферментуються до КЛЖК, які мають власні сприятливі ефекти щодо стану здоров’я організму-господаря [79].
В експериментальних дослідженнях було показано, що застосування олігофруктози покращує толерантність до глюкози та зменшує запалення [80]. У дітей з ожирінням збагачений олігофруктозою інулін впливав на мікробний склад кишківника, сприяв зменшенню обсягу жирової тканини та знижував уміст ІЛ-6 [81].
Пробіотики
Пробіотики являють собою живі мікроорганізми, які за умови призначення в належній кількості чинять сприятливий вплив на стан здоров’я організму-господаря. Пробіотик має бути чітко визначеним таксономічно й мати доведені в клінічних дослідженнях ефективність і безпеку [82]. Найвивченішими пробіотиками є лакто- та біфідобактерії [83]. У дослідах на мишах Lactobacillus reuteri покращували чутливість до інсуліну та зменшували проникність стінки кишківника [84], а суміш різних видів Lactobacillus і Bifidobacterium сприяла нормалізації гомеостазу глюкози [85].
Наявні нині рандомізовані клінічні дослідження переважно характеризуються невеликою тривалістю, малою кількістю учасників і внаслідок перших двох умов суперечливими результатами. У двох метааналізах цих досліджень було виявлено певне покращення рівня глюкози натще (0,3-0,5 ммоль/л), але щодо рівня інсуліну натще або індексів чутливості до інсуліну було отримано суперечливі результати [86, 87]. Порівняно з нормоглікемічними учасниками з ожирінням вплив на метаболізм глюкози був вираженіший у пацієнтів із ЦД 2 типу. Ефективнішою виявилася також суміш пробіотиків, а не призначення одного певного виду [88, 89].
Новими напрямами у вивченні пробіотиків у разі метаболічних хвороб є дослідження відмінних від класичних видів бактерій (наприклад, Akkermansia muciniphila) [90] та модифікація наявних бактерій із метою формування здатності виробляти біологічно активні речовини [91].
Загалом, хоча в деяких дослідженнях і описано сприятливу роль пре- та пробіотиків у осіб із метаболічними хворобами, абсолютне покращення в клінічно значущих наслідках лікування (рівень глюкози крові натще або вміст глікованого гемо-глобіну) є досить малим. Наразі неможливо зробити остаточні висновки, оскільки наявні дослідження є невеликими, короткотривалими та гетерогенними. Крім того, дотепер не встановлено, чи здатні пробіотики після вживання колонізувати кишківник [92]. Нещодавнє дослідження продемонструвало, що колонізація кишківника залежить від організму-господаря, а це ставить під питання універсальність застосування пробіотиків і підкреслює важливість персоналізованої медицини [93].
Трансплантація фекальної мікробіоти (ТФМ)
У ході процедури ТФМ отримані від ретельно обстеженого здорового донора фекалії переносяться в тонкий або товстий кишківник реципієнта. У пілотному дослідженні ТФМ від струнких донорів чоловікам з ожирінням сприяла невеликому, але значущому покращенню інсуліночутливості периферичних тканин порівняно з контрольною групою. Результатами ТФМ у цьому дослідженні стали підвищення різноманітності мікробіоти та збільшення кількості бактерій, які продукують бутират [94]. Дані цього пілотного дослідження були підтверджені й у подальшому випробуванні, в якому алогенна ТФМ сприяла покращенню інсуліностимульованої утилізації глюкози скелетними м’язами. Ефект був найвираженішим у пацієнтів із низьким показником різноманітності мікробіоти на момент початку лікування [95, 96]. Проте через 18 тижнів після ТФМ жодного впливу на чутливість до інсуліну виявлено не було, а склад мікробіоти повернувся до вихідних показників [96].
Подальші дослідження в цій галузі мають передбачати розроблення стандартних процедур ТФМ, а також їх вивчення у великих популяціях пацієнтів, у тому числі осіб із ЦД 2 типу. Варто також дослідити перенесення окремих штамів, уведення бактерій у формі капсул, а не розчинів фекалій, комбінацію ТФМ із пребіотиками й антибіотиками, оптимальний підбір донорів тощо.

Висновки та подальші перспективи
Нині загальновизнано, що прозапальний статус впливає на метаболізм глюкози [57, 97]. Наприклад, це підтверджується тим, що в метаболічно активних тканинах осіб із ЦД спостерігається інфільтрація прозапальними імунними клітинами [15, 98]. Цей прозапальний фон має несприятливий вплив на функції тканин і органів, зокрема спричиняючи розвиток ІР і дисфункцію β-клітин [99, 100]. Роль кишкової мікробіоти в цих процесах продовжує вивчатися, але результати досліджень нерідко є суперечливими.
Дані літератури свідчать, що імунна система є складним утворенням, яке за своєю природою не є виключно проти- або прозапальним. Контрольована гостра запальна відповідь є необхідною передумовою боротьби з патогенами й усунення ушкоджених тканин, але за метаболічних хвороб ця відповідь може порушуватися з розвитком метазапалення. Причиною цих порушень є як генетичні чинники, так і чинники довкілля, передусім харчування [101, 102].
За даними літератури, ожиріння супроводжується порушенням імунної відповіді кишківника [56]. Організм-господар може впливати на цю імунну відповідь і на всю мікробіоту загалом за допомогою харчування. Впроваджуючи багатий на клітковину раціон, можна сприяти виробленню КЛЖК, здатних покращувати енергетичний обмін [64] і толерантність до глюкози [66], а також регулювати адекватність запальної відповіді [103].
Натепер описано кілька потенційних механізмів впливу мікробіоти на метаболізм глюкози та запалення [23, 104, 105], але суперечливість отриманих даних не дає змоги зробити однозначні висновки. Як основні теорії науковці розглядають бактерійну транслокацію та вплив окремих мікробних метаболітів. Слід зауважити, що, хоча було виділено певні види бактерій, які асоціюються з метаболічними розладами, кишкова мікробіота являє собою комплексну екосистему тисяч різних груп мікроорганізмів, взаємозв’язками між якими нехтувати не можна. Крім того, малодослідженою залишається роль вірому та мікобіому кишківника [106, 107].
Наявні наразі методи лікування, спрямовані на розростання пулу сприятливих бактерій або заміну дисбіотичної мікробіоти на симбіотичну, є багатонадійними, проте потребують подальшого вивчення. Помірний позитивний, але обмежений у часі вплив має ТФМ [96]; певних успіхів досягає також лікування пробіотиками [108]. Складнощами, що потребують подальшого вивчення, є індивідуальність мікробіому кожної людини, а отже, індивідуальна відповідь на бактерійне лікування [93, 96]. Імовірно, відмінності у відповіді опосередковані регіональними й етнічними особливостями [109, 110]. Інноваційним методом покращення відповіді на бактерійне лікування та регуляції запалення може бути модифікація наявних бактерій [91].
Загалом наукова галузь вивчення мікробіоти поки що є молодою, проте має велетенський потенціал. Комплексні зв’язки між мільйонами різних мікроорганізмів утруднюють розуміння точних механізмів впливу, але технічні вдосконалення в цій галузі тривають і невдовзі зможуть дати відповідь на наявні запитання.

Література
Scheithauer T.P.M., Rampanelli E., Nieuwdorp M., et al. Gut microbiota as a trigger for metabolic inflammation in obesity and type 2 diabetes. Front. Immunol. 2020; 11: 571731.
Коментар фахівця
 Анастасія Соколова
Анастасія Соколова
лікар-ендокринолог першої категорії, лікар-дієтолог, Національний медичний університет ім. О.О. Богомольця (м. Київ)
Цукровий діабет 2 типу – це хронічне прогресивне захворювання підшлункової залози, основним патогенетичним підґрунтям якого є інсулінорезистентність.
Люди з підвищеною масою тіла чи ожирінням мають підвищений ризик виникнення інсулінорезистентності через хронічне метаболічне запалення низької інтенсивності, що також називають метазапаленням. Основні чинники виникнення метазапалення наразі активно вивчаються. Одним із них є вплив кишкової мікробіоти. Стан мікробіоти кишківника має ключове значення для здоров’я людини, оскільки мікробіота не лише відіграє важливу роль у травленні, а й продукує метаболіти, здатні впливати на метаболізм і функціонування імунної системи. Підтвердженням цього є особливий склад мікробіоти кишківника в людей, які хворіють на цукровий діабет 2 типу та мають ожиріння.
Є дві провідні теорії щодо впливу мікробіоти на метаболізм людини із цукровим діабетом. Доведено, що кишкова мікробіота впливає на метаболізм організму-господаря завдяки фізичній транслокації до тканин і активації імунної відповіді через наявність ліпополісахаридів у клітинній стінці. Друга гіпотеза полягає в тому, що мікробіота опосередковує запалення та кардіометаболічні захворювання шляхом вироблення активних метаболітів, які надходять у системний кровообіг, як-от ацетат, бутират і пропіонат.
Активні метаболіти є кінцевими продуктами ферментації складних вуглеводів, тому важливим є правильне збалансоване харчування, що міститиме достатню кількість різних джерел клітковини.
На сьогодні існує декілька видів втручань із заселення «правильною» кишковою мікрофлорою. Насамперед важливим є індивідуально підібраний раціон харчування, збагачений клітковиною, джерелами біфідо- та лактобактерій. Харчування водночас може бути добрим пребіотиком.
Усі інші види втручань є обґрунтованими й ефективними тільки на тлі правильного харчування. Можливим є призначення додаткових таблетованих форм пребіотиків і пробіотиків.
Перспективний метод, який іще недостатньо поширений в Україні, – це трансплантація фекальної мікробіоти, що потребує розроблення стандартів і алгоритму процедури, а також її вивчення у великих популяціях пацієнтів із цукровим діабетом 2 типу.
Більшість даних про кишкову мікробіоту та її вплив на організм-господар отримана в дослідженнях на тваринах або за участю дуже обмежених груп людей.
Наявні наразі методи лікування, спрямовані на розростання конкретних сприятливих бактерій або заміну дисбіотичної мікробіоти на симбіотичну, потребують подальшого вивчення в осіб із цукровим діабетом.
