Корекція кардіометаболічних порушень у пацієнтів із жировою хворобою печінки та цукровим діабетом
Автор: Любов Костянтинівна СОКОЛОВА, докторка медичних наук, завідувачка відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ)
 У 2025 році п’ята частина населення Землі матиме надмірну вагу. Накопичення надмірної кількості жиру в організмі може спричинити цукровий діабет (ЦД) 2-го типу, який є відомим чинником ризику серцево-судинних захворювань, тоді як коморбідними станами дитячого ожиріння є метаболічно-асоційована жирова хвороба печінки (МАЖХП), інсулінорезистентність, артеріальна гіпертензія тощо.
У 2025 році п’ята частина населення Землі матиме надмірну вагу. Накопичення надмірної кількості жиру в організмі може спричинити цукровий діабет (ЦД) 2-го типу, який є відомим чинником ризику серцево-судинних захворювань, тоді як коморбідними станами дитячого ожиріння є метаболічно-асоційована жирова хвороба печінки (МАЖХП), інсулінорезистентність, артеріальна гіпертензія тощо.
Ожиріння та кардіометаболічний ризик
Нині надмірна маса тіла й ожиріння спричиняють більшу кількість смертей, аніж дефіцит маси тіла. Згідно з даними Всесвітньої організації охорони здоров’я за поширеністю ожиріння Україна займає одне з перших місць серед країн Європейського регіону. Найвищі темпи приросту ожиріння відзначаються в підлітків віком 15-17 років: рівень поширеності патології в цій віковій групі збільшився практично втричі за період із 2003 по 2016 рік (від 9,7 до 29,3 на 1000 дітей).
Саме проблемою дитячого ожиріння насамперед зумовлений розвиток так званої МАЖХП, яка є тяжчою формою неалкогольної жирової хвороби печінки (НАЖХП). Епідеміологічні дані свідчать про міцний зв’язок між НАЖХП, ожирінням, ЦД 2-го типу та підвищеним серцево-судинним ризиком.
Зростання поширеності ожиріння в усьому світі, ймовірно, відповідає за стале збільшення поширеності діабету, оскільки ожиріння впливає як на дію інсуліну, так і на функцію β-клітин. Накопичення надмірної кількості жиру в організмі спричиняє низку метаболічних аномалій і хвороб, включаючи резистентність до інсуліну, атерогенну дисліпідемію (високий рівень тригліцеридів у плазмі та низький рівень холестерину ліпопротеїнів високої щільності), НАЖХП, дисфункцію β-клітин, переддіабет і ЦД 2-го типу [1].
Наявність як надмірної маси тіла, так і метаболічної дисрегуляції має незалежний вплив на ризик розвитку MAЖХП і кардіометаболічні наслідки.
В обсерваційних дослідженнях було продемонстровано зв’язок між НАЖХП і діастолічною дисфункцією лівого шлуночка й іншими серцевими показниками після поправки на кардіометаболічні ризики. Отже, жирова хвороба печінки є незалежним чинником ризику серцево-судинних подій у дорослих пацієнтів із ЦД як 2-го, так і 1-го типу [3].
Також було продемонстровано тісний зв’язок між МАЖХП і ЦД 2-го типу: понад 70% пацієнтів із ЦД 2-го типу мають МАЖХП. Відомо, що інсулінорезистентність є основною причиною накопичення ліпідів у печінці та розвитку МАЖХП. Отже, МАЖХП часто трапляється при ЦД 2-го типу, який є важливим чинником ризику серцево-судинних захворювань, а інсулінорезистентність є маркером ожиріння та розвитку МАЖХП. Водночас неалкогольна жирова дистрофія печінки та фіброз пов’язані зі структурою й функцією серцево-судинної системи в молодих людей, а інсулінорезистентність на рівні печінки достатня для розвитку дисліпідемії та раннього атеросклерозу. Вочевидь такі пацієнти потребують нормалізації не тільки функціонального стану гепатобіліарної системи, а й серцево-судинної системи та обміну речовин, зокрема шляхом додавання до базисного лікування багатофункціонального метаболічного цитопротектора L-Бетаргіну, до складу якого входять бетаїн, L-карнітин і аргінін.
Бетаїн
Серед понад десяти ключових метаболічних шляхів, що порушуються в пацієнтів з НАЖХП та ЦД, одним з найважливіших є так званий цикл метилювання. Передумовою для оптимального метилювання є баланс між різними біохімічними метаболічними процесами. Натомість порушення процесу метилювання може негативно впливати на експресію генів і спричиняти порушення обміну амінокислот, ліпідів, імунної та гормональної регуляції, а також систем детоксикації.
Цикл метилювання передбачає взаємодію між метаболізмом фолатів, метіоніну, а також транссульфурацію гомоцистеїну. Організм постійно регулює ці взаємопов’язані шляхи для підтримки гомеостазу.
Бетаїн є основною біохімічною молекулою метіонін/гомоцистеїнового циклу та слугує донором метильної групи при трансметилюванні. Як відомо, дефіцит вітаміну B12 або фолієвої кислоти призводить до підвищення рівня гомоцистеїну – амінокислоти, що є одним із чинників ризику серцево-судинних захворювань та інсулінорезистентності, а також бере участь у розвитку фіброзу печінки.
Своєю чергою, бетаїн діє як донор метильної групи для перетворення гомоцистеїну на метіонін під час метаболічного стресу (наприклад, дії алкоголю) або при дефіциті вітаміну B12 і фолієвої кислоти.
Бетаїн бере участь у метилюванні фосфатидилетаноламіну до фосфатидилхоліну через шлях Кеннеді (важливий шлях до синтезу ліпопротеїнів дуже низької щільності) та відновлює співвідношення мітохондріального глутатіону й S-аденозилметіоніну, що в підсумку сприяє зниженню окисного стресу, запалення, стеатозу та фіброзу печінки.
Також бетаїн необхідний для холін-опосередкованого синтезу, підтримки цілісності клітинної мембрани, передачі сигналу та синтезу нейротрансмітерів. Бетаїн сприяє внутрішньоклітинній гідратації й тим самим створює сприятливіше середовище для синтезу білка [4].
Бетаїн покращує будову тіла завдяки зменшенню маси жиру, покращує працездатність і підвищує витривалість, а також є ефективною добавкою для зниження ваги, особливо для жінок, що дотримуються дієти з обмеженням калорій. Для покращення витривалості на тренуваннях і «спалювання» жиру необхідна кількість бетаїну становить від 1 до 6 г на добу [5].
Подвійне сліпе рандомізоване плацебо-контрольоване дослідження споживання жінками бетаїну в дозі 2,5 г на добу протягом 9 тижнів продемонструвало достовірне зниження маси тіла порівняно з плацебо [6].
У дослідженні ATTICA було оцінено ефективність прийому бетаїну в 1514 чоловіків (18-87 років) і 1528 жінок (18-89 років) з різними стадіями НАЖХП (стеатоз, стеатогепатит, фіброз, цироз) без історії серцево-судинних захворювань. Було продемонстровано, що споживання бетаїну в дозі >360 мг на добу сприяло зниженню гомоцистеїну на 10%, С-реактивного білка – на 19%, фактора некрозу пухлин-α (ФНП-α) – на 12%. Бетаїн мав тенденцію до зниження рівня глюкози натще, а також зменшував розвиток ендотеліальної дисфункції [7]. Також він пригнічує продукцію та вивільнення інтерлейкіну-1β (ІЛ-1β), що свідчить на користь його ефективності як ад’ювантної терапії при запальних захворюваннях, пов’язаних із секрецією ІЛ-1β [8].
Карнітин
Карнітин – ендогенний метаболіт і екзогенна поживна речовина, що відіграє ключову роль у ліпідному обміні й функціонуванні серцево-судинної системи та м’язів. Відомо, що рівень карнітину в плазмі знижується при ЦД 2-го типу [9]. L-карнітин сприяє належному використанню глюкози клітиною, тим самим покращуючи регуляцію метаболізму глюкози в пацієнтів із ЦД та запобігаючи ускладненням, як-от утома, безсоння та погіршення психічної активності [10].
Дефіцит карнітину порушує чутливість до інсуліну й може призвести до підвищення рівня глюкози натще. За даними систематичного огляду чотирьох досліджень (n=284), уведення перорального L-карнітину при ЦД 2-го типу сприяє зниженню рівнів глюкози в плазмі натще (-14,3 мг/дл), загального холестерину (-7,8 мг/дл), ліпопротеїнів низької щільності (-8,8 мг/дл) [9].
Карнітин може покращити метаболізм глюкози шляхом посилення мітохондріального окислення довголанцюгового ацил-КоА, накопичення котрого спричиняє резистентність до інсуліну в м’язах і серці; шляхом зміни гліколітичних і глюконеогенних ферментів, а також експресії генів, пов’язаних із сигнальним каскадом інсуліну, та через покращення утилізації глюкози серцем.
L-карнітин, що входить до складу L-Бетаргіну, чинить протизапальну дію та виявив здатність нормалізувати рівні гомоцистеїну, а також запобігати гомоцистеїн-індукованому окисному стресу та/або покращувати дію антиоксидантної системи. Систематичний огляд і метааналіз 44 рандомізованих контрольованих досліджень щодо впливу дієтичних добавок L-карнітину на показники запалення й окисного стресу показали, що прийом L-карнітину сприяє зниженню рівнів С-реактивного білка, ІЛ, ФНП-α, малондіальдегіду (маркера перекисного окислення жирів та окисного стресу), а також значному збільшенню супероксиддисмутази – ферменту антиоксидантного захисту [11].
Аргінін
Ця речовина стимулює новоутворення β-клітин завдяки збільшенню їхньої площі та є основним субстратом для продукції оксиду азоту в ендотеліальних клітинах, таким чином регулюючи судинний тонус і загальний серцево-судинний гомеостаз. Аргінін чинить сприятливий вплив на ендотелій, зумовлюючи розширення судин, зменшуючи запалення та покращуючи фізичні функції в пацієнтів, які перенесли коронарну реваскуляризацію після гострого інфаркту міокарда [12].
Аргінін зменшує окисний стрес, запобігаючи зниженню регуляції клітинних антиоксидантів, а також протидіє розвитку ЦД 2-го типу або відтерміновує його завдяки здатності знижувати рівні глюкози в крові натще й інсуліну в сироватці в пацієнтів з порушеннями метаболізму глюкози [13].
L-Бетаргін: командна робота в регуляції метаболічного профілю
L-Бетаргін чинить потужну гепато-, кардіо-, ангіопротекторну дію завдяки комбінації ефектів L-карнітину (300 мг), аргініну цитрату (1,0 г) та бетаїну (1,0).
L-карнітин зменшує стеатоз шляхом посилення β-окислення жирних кислот, зниження рівня холестерину, усунення мітохондріальної дисфункції й енергодефіциту тканин. Він чинить протизапальну дію, покращує утилізацію глюкози серцем і знижує рівень глюкози натще.
Бетаїн зменшує стеатоз шляхом утилізації нейтрального жиру гепатоцитами, стимулює синтез ендогенного карнітину, знижує рівень гомоцистеїну, запобігає прогресуванню атеросклерозу та тромбозу судин. Він бере участь у відновленні мембран гепатоцитів, чинить протизапальну й антифібротичну дії та знижує рівень глюкози натще.
Аргініну цитрат зменшує ендотеліальну дисфункцію й інсулінорезистентність, а також поліпшує мікроциркуляцію й оксигенацію тканин.
Він посилює вироблення АТФ, сприяє відновленню енергозабезпечення тканин і запобіганню або відтермінуванню розвитку ЦД 2-го типу в пацієнтів з порушенням толерантності до глюкози та метаболічним синдромом.
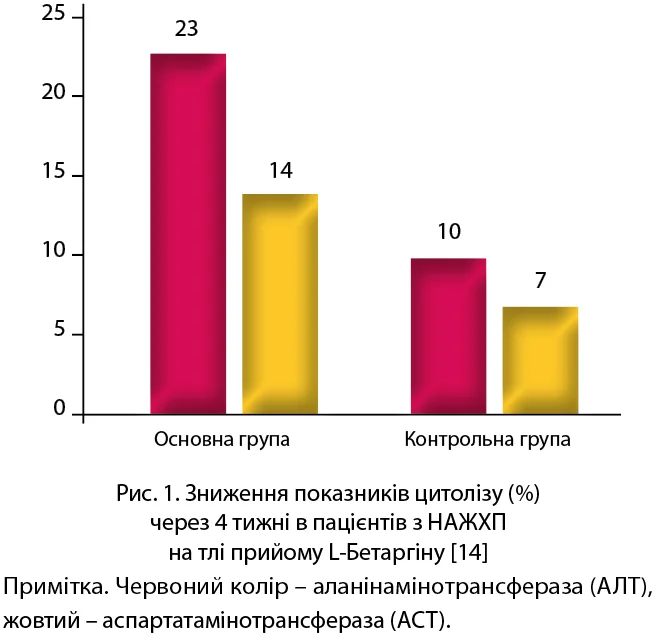
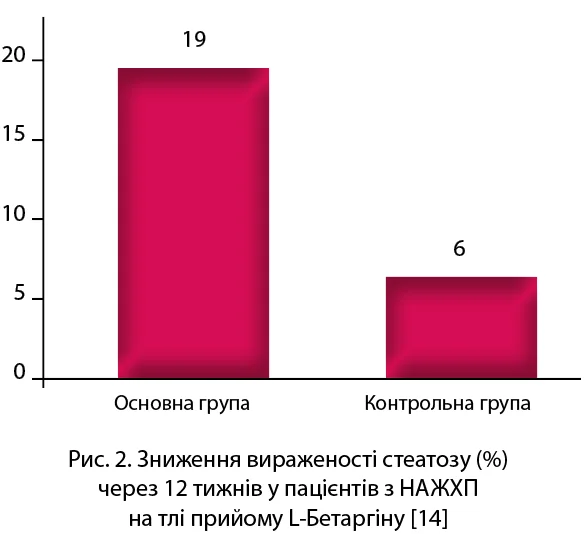
Ефективність застосування препарату L-Бетаргін у пацієнтів із ЦД та НАЖХП вивчено в численних дослідженнях. Зокрема, застосування L-Бетаргіну при НАЖХП протягом 12 тижнів (1 стік 3 рази на добу) сприяло статистично значущому пригніченню цитолізу, зменшенню ступеня стеатозу печінки, поліпшенню показників ліпідного обміну та швидкості портального кровотоку, а також зниженню ризику розвитку/прогресування атеросклерозу, серцево-судинних захворювань та інсулінорезистентності (рис. 1, 2) [14].
Ефективність гепатопротекторної терапії L-Бетаргіном було оцінено при застосуванні в дітей від 7 до 15 років з ожирінням і НАЖХП протягом 3 місяців. Було показано, що призначення L-Бетаргіну в поєднанні із заходами щодо зміни способу життя для дітей із зайвою масою тіла та початковими ознаками НАЖХП сприяє профілактиці прогресування хвороби, зокрема зменшенню частоти проявів астенічного та диспепсичного синдромів, достовірному зниженню активності печінкових ферментів і поліпшенню ліпідного спектра крові, а також зниженню ознак жирової дегенерації печінки за даними УЗД і транзієнтної еластографії [15].
Додавання L-Бетаргіну до базисного лікування (1 стік 3 рази на добу протягом 1 місяця) продемонструвало позитивну динаміку клінічних проявів показників вуглеводного й ліпідного обміну, рівнів вітамінів групи B та гомоцистеїну у хворих на ЦД 2-го типу з хронічним панкреатитом [16]. Призначення лише базисного лікування цим хворим
не впливало на показники ліпідного обміну, тоді як додаткове призначення L-Бетаргіну забезпечувало статистично достовірне зниження загального холестерину, тригліцеридів і ліпопротеїнів низької щільності.
Отже, застосування дієтичної добавки L-Бетаргін у комплексному лікуванні пацієнтів знижує кардіометаболічний ризик і покращує прогноз.
Література
- Klein S., Gastaldelli A., Yki-Järvinen H., et al. Why does obesity cause diabetes? Cell Metab. 2022; 34 (1): 11-20. doi: 10.1016/j.cmet.2021.12.012.
- Zhou Z., et al. Are people with metabolically healthy obesity really healthy? A prospective cohort study of 381,363 UK Biobank participants. Diabetologia. 2021. doi: 10.1007/s00125-021-05484-6.
- Mantovani A., Mingolla L., Rigolon R., et al. Nonalcoholic fatty liver disease is independently associated with an increased incidence of cardiovascular disease in adult patients with type 1 diabetes. Int. J. Cardiol. 2016; 225: 387-391. doi: 10.1016/j.ijcard.2016.10.040.
- Day C.R., Kempson S.A. Betaine chemistry, roles, and potential use in liver disease. Biochim. Biophys. Acta. 2016; 1860 (6): 1098-1106. doi: 10.1016/j.bbagen.2016.02.001.
- Gao X., Zhang H., Guo X.F., et al. Effect of betaine on reducing body fat – a systematic review and meta-analysis of randomized controlled trials. Nutrients. 2019; 11 (10): 2480. doi: 10.3390/nu111024806.
- Cholewa et al. The effects of chronic betaine supplementation on body composition and performance in collegiate females: a double-blind, randomized, placebo-controlled trial. Journal of the International Society of Sports Nutrition. 2018; 15 (1): 37. doi: 10.1186/s12970-018-0243-x.
- Detopoulou P., Panagiotakos D.B., Antonopoulou S., et al. Dietary choline and betaine intakes in relation to concentrations of inflammatory markers in healthy adults: the ATTICA study. Am. J. Clin. Nutr. 2008; 87 (2): 424-430. doi: 10.1093/ajcn/87.2.424.
- Xia Y., Chen S., Zhu G., et al. Betaine inhibits interleukin-1β production and release: potential mechanisms. Front. Immunol. 2018; 9: 2670. doi: 10.3389/fimmu.2018.02670.
- Vidal-Casariego A., Burgos-Peláez R., Martínez-Faedo C. Metabolic effects of L-carnitine on type 2 diabetes mellitus: systematic review and meta-analysis. Exp. Clin. Endocrinol. Diabetes. 2013; 121 (4): 234-238. doi: 10.1055/s-0033-1333688.
- Karalis D.T., Karalis T., Karalis S. L-carnitine as a diet supplement in patients with type II diabetes. Cureus. 2020; 12 (5): e7982. doi: 10.7759/cureus.7982.
- Fathizadeh H., Milajerdi A., Reiner Z. The effects of L-carnitine supplementation on indicators of inflammation and oxidative stress: a systematic review and meta-analysis of randomized controlled trials. J. Diabetes Metab. Disord. 2020; 19 (2): 1879-1894.
- Mone P., Izzo R., Marazzi G., et al. L-arginine enhances the effects of cardiac rehabilitation on physical performance: new insights for managing cardiovascular patients during the COVID-19 pandemic. J. Pharmacol. Exp. Ther. 2022; 381 (3): 197-203. doi: 10.1124/jpet.122.001149.
- Forzano I., Avvisato R., Varzideh F., et al. L-arginine in diabetes: clinical and preclinical evidence. Cardiovasc. Diabetol. 2023; 22 (1): 89. doi: 10.1186/s12933-023-01827-2.
- Dorofeev O., Rudenko M., Tkach S., et al. Complex therapy of non-alcoholic fatty liver disease in combination with the syndrome of excessive bacterial growth. Modern Gastroenterology. 2019; 1 (105).
- Abaturov Т.A., Kryuchko E.L., Krivusha O.A., et al. Efficacy of hepatoprotective therapy with betaine arginine complex “Betargin” in children with nonalcoholic fatty liver disease. Modern Pediatrics. 2018; 3 (91): 1-9.
- Сірчак Є.С., Барані В.Є., Сірчак С.С. Доцільність використання препарату L-Бетаргін у хворих на цукровий діабет 2 типу та хронічний панкреатит. Здобутки клінічної та експериментальної медицини. 2021; 1: 119-124. doi: 10.11603/1811-2471.2021.v.i1.12002.