Коли фармакотерапія може призводити до діабету?
Переклала й адаптувала Олена Зотова
На сьогодні відомо, що ціла низка лікарських засобів (ЛЗ), які досить часто використовують у клінічній практиці, можуть порушувати гомеостаз глюкози та провокувати порушення толерантності до глюкози, гіперглікемію або дебют цукрового діабету (ЦД), а також погіршувати контроль глікемії в осіб зі вже діагностованим ЦД [1]. До розвитку цих небажаних явищ особливо схильні люди, котрі мають відповідне генетичне тло та/або перебувають у несприятливих умовах навколишнього середовища, на які «накладаються» шкідливі ефекти ЛЗ. Медикаментозно-індукований (ятрогенний) діабет нині розглядають як один із типів вторинного діабету.
Різні ЛЗ можуть змінювати гомеостаз глюкози через різні механізми, зокрема шляхом:
- зниження чутливості тканин до інсуліну;
- сприяння збільшенню маси тіла;
- порушення секреції інсуліну.
Деякі інші механізми включають також збільшення продукції глюкози, провокування розвитку гострого панкреатиту або навіть прямий цитотоксичний вплив на β-клітини підшлункової залози (табл. 1).
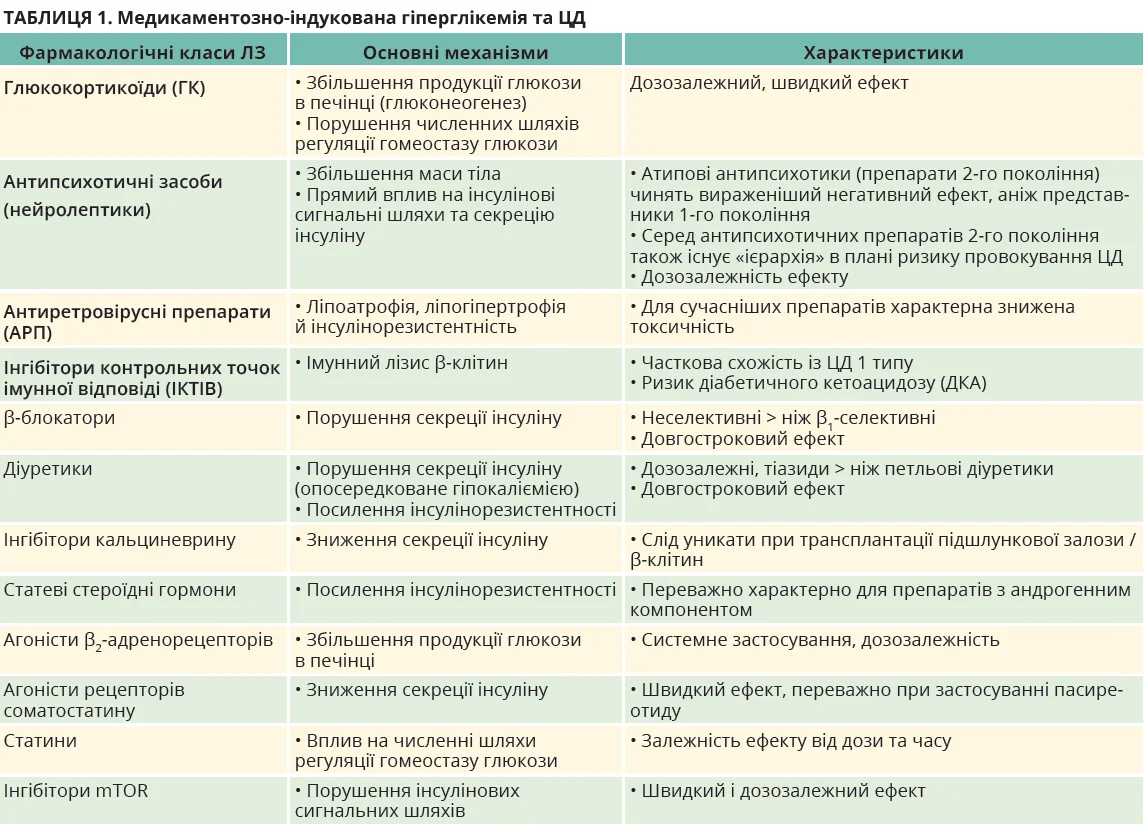
У цьому огляді основна увага буде приділена ГК, антипсихотичним препаратам, АРП та ІКТІВ. Саме ці ЛЗ на сьогодні дедалі ширше застосовуються в клінічній практиці та характеризуються потенційним ризиком розвитку тяжкої гіперглікемії / діабету. Інші препарати, як-от статини, також заслуговують на увагу, оскільки вони широко застосовуються в осіб як із ЦД, так і без нього. Метааналіз 14 досліджень засвідчив, що на тлі застосування статинів ризик дебюту діабету збільшується на 9-33%. Однак ризик порушення контролю глікемії, в тому числі в пацієнтів із ЦД, на тлі застосування цих препаратів зазвичай є незначним. Діабетогенна дія статинів, імовірно, є наслідком складної взаємодії між панкреатичними й екстрапанкреатичними ефектами. Утім, кардіоваскулярна протекція, котру забезпечує статинотерапія, переважає ризики, асоційовані з розвитком уперше виявленого діабету або з помірним погіршенням контролю глікемії в осіб зі вже діагностованим ЦД [3].
! Транзиторну оборотну (іноді – тяжку) гіперглікемію потрібно відрізняти від істинного діабету, який характеризується стійкою (проте менш тяжкою) гіперглікемією. Високі дози ГК, що вводяться протягом короткого періоду, можуть призводити до тяжкої гострої, але оборотної гіперглікемії; низькі дози ГК, нейролептики й АРП, котрі застосовують як тривалу терапію, можуть призвести до довгострокових ускладнень, пов’язаних із діабетом.
Медикаментозно-індукований діабет може бути оборотним, якщо припинити прийом відповідних ЛЗ; однак він може бути й стійким – це залежить від характеристик фармакотерапії (ЛЗ, доза, тривалість застосування) або фонових характеристик організму пацієнта (вік, маса тіла, сімейний анамнез). Пропозиції щодо медичного спостереження та лікування медикаментозно- індукованого діабету загалом дуже схожі на рекомендації щодо інших типів діабету (особливо ЦД 2 типу) – з акцентом на спосіб життя (дієта та фізичні вправи). Якщо це потрібно, призначають ступеневу цукрознижувальну терапію, яку зазвичай розпочинають із метформіну.
Глюкокортикоїди
ГК-індукований ЦД (ГКіЦД) відомий уже протягом більш ніж 60 років, при цьому саме застосування ГК найчастіше асоціюється з розвитком гострої гіперглікемії або діабету [4]. Проте важливість діагностування та лікування ГКіЦД все ще подекуди недооцінюється спеціалістами галузі охорони здоров’я, а проспективні дослідження, котрі порівнювали б ефективність і безпеку лікування ГК у цьому контексті, на жаль, відсутні.
Поширеність. ГКіЦД визначають як аномальне підвищення рівнів глюкози крові під час використання ГК в осіб із ЦД в анамнезі або без нього.
Якщо ЦД вже існує, то вплив екзогенних ГК систематично погіршує гомеостаз глюкози [5].
За умови попередньої відсутності ЦД поширеність ГКіЦД коливається від 2% у загальній амбулаторній практиці до 32% у пацієнтів, які перенесли трансплантацію органів або мають ревматоїдний артрит [4]. Однак той факт, що ЦД виникає не в усіх пацієнтів, які отримують ГК, свідчить про те, що він розвивається у вразливих категорій осіб, які мають таку схильність.
! Ключовими детермінантами ризику розвитку ГКіЦД є тривалість лікування та добова доза ГК [6].
Окрім того, схильність до розвитку ГКіЦД збільшують такі самі індивідуальні чинники ризику, як і при ЦД 2 типу (вищі значення індексу маси тіла, похилий вік, приналежність до негроїдної раси та діабет у сімейному анамнезі), а також гестаційний діабет або ГК-індукована гіперглікемія [4].
Клінічна картина. ГКіЦД зазвичай виникає в ранні терміни від початку лікування ГК. Вимірювання рівня глюкози в капілярній або венозній крові часто є достатнім для скринінгу ГКіЦД, хоча оцінка глікемії натщесерце демонструє незадовільну чутливість [6]. Безперервний моніторинг рівня глюкози крові продемонстрував, що гіперглікемія виникає в другій половині дня та ввечері [8], особливо в разі прийому ГК із середньою тривалістю дії (преднізон, преднізолон, метилпреднізолон) у вигляді одноразової ранкової дози (режим, який призначається найчастіше).
! Кориснішим критерієм для діагностики ГКіЦД є рівень глюкози крові >11,1 ммоль/л, зафіксований у будь-який час доби. Рівень HbA1c може бути прийнятним інструментом для діагностики ГКіЦД в осіб, які отримують лікування протягом понад 2 місяців; кращою альтернативою після короткочасного впливу ГК є тест на фруктозамін [4].
У пацієнтів із ЦД погіршення контролю глікемії спостерігається протягом уже декількох годин після початку прийому ГК, тоді як у осіб без діабету час до виникнення гіперглікемії є дуже варіабельним [9].
ГК, які зазвичай використовують у вигляді напівсинтетичного преднізолону (чи в деяких країнах його проліків – преднізону), здебільшого призначаються за двома основними схемами: короткочасне застосування в середніх або високих дозах із метою лікування широкого спектра запальних захворювань (при цьому більш ніж у половини госпіталізованих осіб без діабету розвивається гіперглікемія [9]) або ж довгострокове застосування (наприклад, <10 мг преднізолону на добу) для послаблення прогресування хронічного запального захворювання чи з метою запобігання відторгненню трансплантованого органа. Ці «нижчі» дози часто є вищими, ніж середня ендогенна продукція ГК (~3 мг преднізолону на добу). Цікаво, що при ГКіЦД дуже рідко розвивається ДКА чи гіперосмолярна декомпенсація [9].
Крім перорального застосування преднізону/преднізолону в клінічній практиці використовуються й інші режими терапії різними ГК, і відмінності в еквівалентності їхніх доз, протизапальній активності та біологічному t½ (табл. 2) можуть впливати на терапевтичні стратегії.

Місцеві ін’єкції (внутрішньосуглобові, епідуральні) ГК асоціюються (хоч і з відносно низькою частотою) з порушеннями глікемії в осіб без діабету в анамнезі або з погіршенням контролю глікемії в пацієнтів зі вже наявним ЦД [11, 12]. Однак реакції з боку глікемічного профілю, які виникають після внутрішньосуглобових ін’єкцій ГК, варіюють у широкому діапазоні – залежно від кількості уражених суглобів і типу та дози ГК, і це є важливим чинником для оцінки ризику розвитку діабету [12].
Патофізіологія/механізми. Механізми, що лежать в основі ГКіЦД, поєднують як інсулінорезистентність, так і порушену секрецію інсуліну β-клітинами підшлункової залози (рис.).
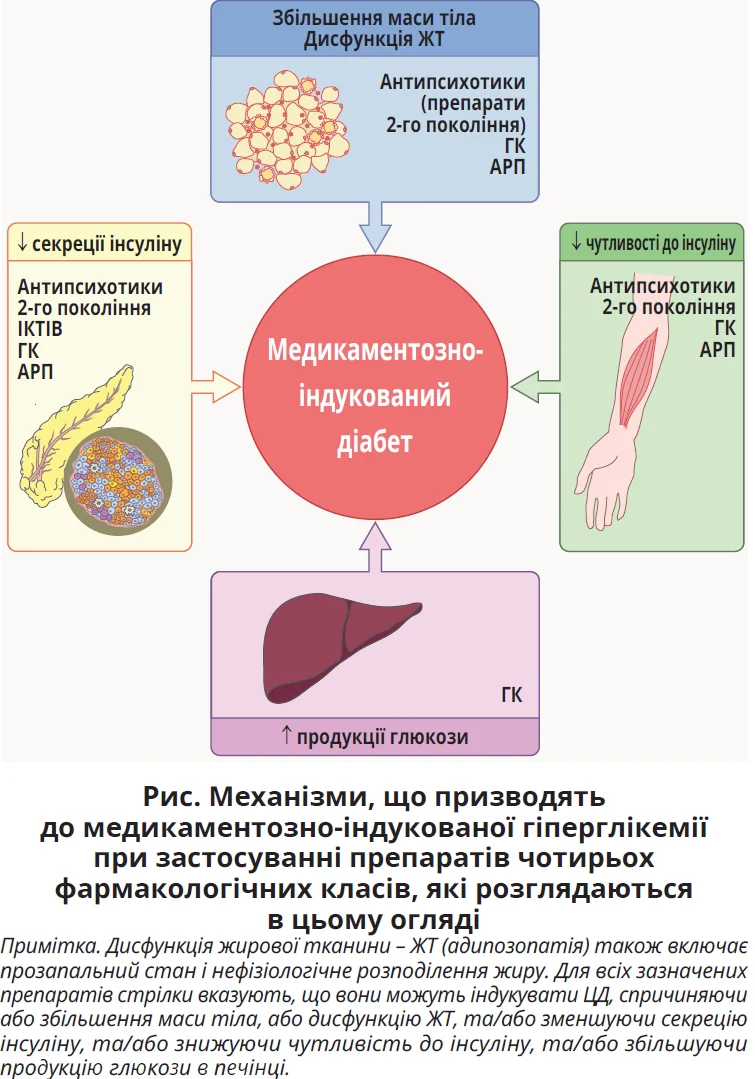
ГК збільшують продукцію глюкози в печінці шляхом індукції глюконеогенезу. Вони активують ферменти та гени, що беруть участь у метаболізмі глюкози, і потенціюють дію інших гормонів (як-от глюкагон), які регулюють гомеостаз глюкози, одночасно протидіючи метаболічній дії інсуліну [13, 14]. У скелетних м’язах ГК знижують чутливість до інсуліну, тим самим зменшуючи захоплення глюкози та пригнічуючи синтез глікогену з подальшим розвитком гіперглікемії [7]. ГК змінюють експресію та/або фосфорилювання основних ефекторів сигнального шляху інсуліну [15]. ГК чинять плейотропні ефекти на ЖТ і спричиняють порушення гомеостазу глюкози. Ці препарати призводять до надмірного збільшення вісцеральної ЖТ, що пов’язано з вищим ризиком розвитку діабету. Цей вплив може включати складні та взаємодоповнювальні механізми, зокрема більшу щільність ГК-рецепторів у вісцеральній ЖТ порівняно з іншими жировими депо та вищу активність у вісцеральній ЖТ 11β-гідроксистероїддегідрогенази 1 типу, яка відновлює кортизол із кортизону (або преднізолон із преднізону), підсилюючи локальну дію ГК [16]. ГК також модулюють експресію та секрецію адипокінів, як-от адипонектин, лептин і резистин [17]. Нещодавно було показано, що ГК-рецептори адипоцитів відіграють вирішальну роль у модулюванні збільшення ЖТ і гомеостазу глюкози в усьому організмі [18]. Хронічний вплив високих доз ГК пригнічує продукцію та секрецію інсуліну в β-клітинах підшлункової залози [19].
Медичне спостереження та ведення пацієнтів. Консенсусних рекомендацій або встановлених терапевтичних цілей для лікування осіб із ГКіЦД немає [4, 9]. У реальній практиці важливо диференціювати тимчасове та безстрокове лікування ГК. Під час визначення належного лікування потрібно враховувати клінічну картину, а також тип, дозу та частоту застосування ГК. У хворих на ЦД, які отримують інсулін, рекомендується корегувати його дози, щоб запобігти надмірним порушенням контролю рівня глюкози. Пацієнтам з уже наявним ЦД 2 типу рекомендується інтенсивніший самоконтроль рівня глюкози на початку терапії ГК.
! Вибір цукрознижувального препарату залежить від його потенційних переваг і недоліків, а також від типу та режиму терапії ГК [4, 9]. За легкої гіперглікемії насамперед часто розглядається призначення препаратів, які підвищують чутливість до інсуліну (наприклад, метформіну) [4, 9].
Препарати сульфонілсечовини також довели свою ефективність [21], але вони підвищують ризик розвитку гіпоглікемії, особливо при зниженні доз ГК. Міметики інкретину, як-от інгібітори дипептидилпептидази-4 й агоністи рецепторів глюкагоноподібного пептиду-1 (ГПП-1), можуть бути корисними для пацієнтів, які отримують високі дози преднізолону [22]. Слід зазначити, що ексенатид запобігає спричиненому преднізоном порушенню толерантності до глюкози та дисфункції острівцевих клітин у здорових людей [23].
! У разі тяжкої гіперглікемії рекомендується інсулінотерапія. Вона характеризується ефективністю, безпекою, негайним початком дії, необмеженою цукрознижувальною потужністю та легкою титрацією доз відповідно до даних моніторингу глікемії [9]. Через відносно короткочасний ефект більшості ГК кращою вважається ранкова ін’єкція базального інсуліну.
Зниження дози або припинення прийому ГК (коли це можливо) може зменшити резистентність до інсуліну та покращити контроль глікемії. Вкрай важливо уникати ризику розвитку гіпоглікемії на етапі зниження дози ГК [24]. Проте в деяких осіб із ГКіЦД після припинення терапії ГК вихідний рівень глікемії не відновлюється.
Антипсихотичні препарати
Антипсихотичні ЛЗ (нейролептики) поділяються на дві великі категорії: препарати 1-го покоління (типові антипсихотики) та препарати 2-го покоління (атипові антипсихотики) (табл. 3).
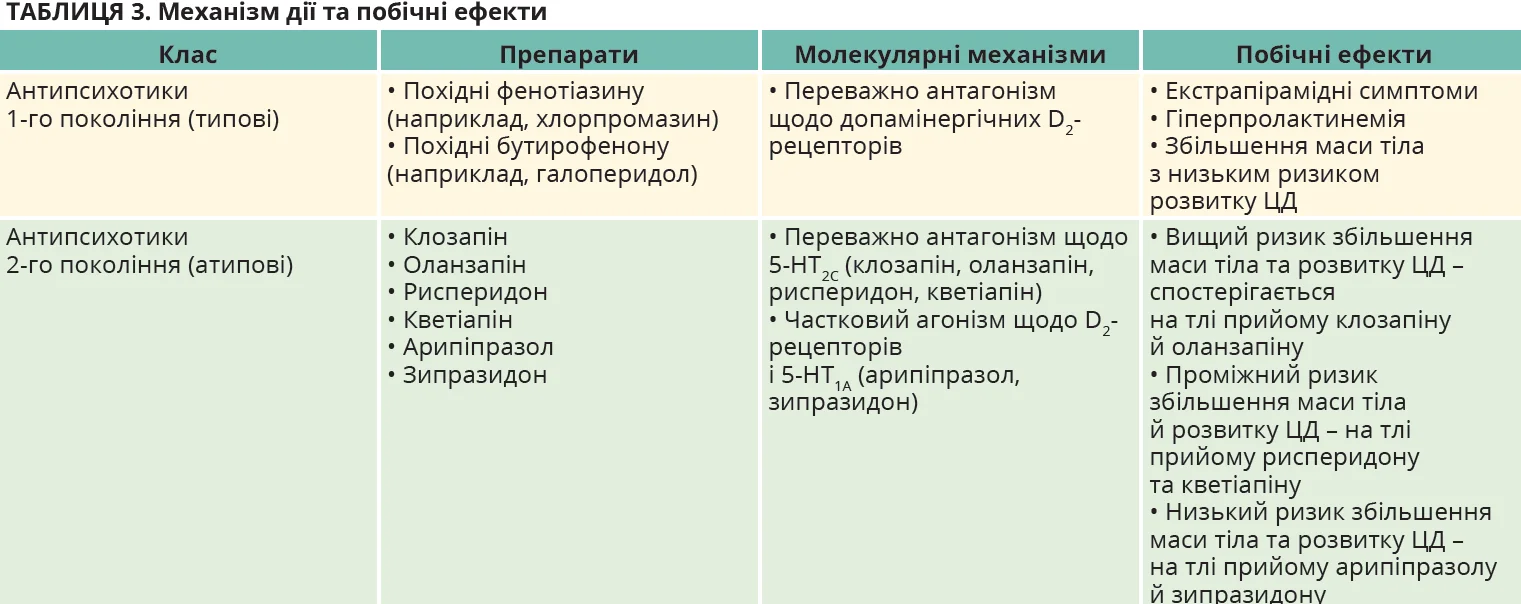
Похідні фенотіазину та бутирофенону є типовими антипсихотичними засобами 1-го покоління. Їхня основна антипсихотична активність зумовлена антагонізмом щодо допамінових D2-рецепторів у головному мозку, що, ймовірно, також призводить до екстрапірамідних рухових розладів і гіперпролактинемії. Антипсихотики 2-го покоління (атипові) були розроблені саме з метою мінімізації ризику виникнення цих побічних ефектів. Вони мають значно нижчу афінність до D2-рецепторів і виявляють свій антипсихотичний ефект через антагонізм до рецепторів 5-гідрокситриптаміну (5-HT2C) або, в разі з арипіпразолом, через агонізм до 5-HT1A [25]. Однак антипсихотики 2-го покоління можуть блокувати й рецептори для інших нейротрансмітерів у головному мозку (наприклад, адренергічні α1-рецептори, H1-рецептори гістаміну та мускаринові рецептори). У міру розширення використання антипсихотиків 2-го покоління почали з’являтися повідомлення про випадки значного збільшення маси тіла, дебют ЦД або погіршення перебігу вже наявного ЦД, а також про дисліпідемію [26].
Поширеність. В осіб із психічними розладами лікування антипсихотиками може майже вдвічі (порівняно з плацебо) підвищувати ризик клінічно значущого збільшення маси тіла (≥7%) [27].
! Серед осіб, які приймають антипсихотичні препарати, поширеність ЦД становить приблизно 10%, і це у 2-3 рази вище, ніж у загальній популяції відповідного віку.
Великий метааналіз даних про 438 245 пацієнтів із тяжкими психічними розладами продемонстрував, що поширеність ЦД до початку лікування антипсихотичними препаратами становила в середньому 2,9%. Водночас серед осіб, які вже отримували таке лікування, цей показник становив 11,3%. Вища поширеність ЦД спостерігалася при застосуванні всіх антипсихотиків (1-го та 2-го покоління), за винятком арипіпразолу й амісульпіриду [28]. Рандомізовані контрольовані дослідження й обсерваційні дослідження показали, що ризик розвитку ЦД помітно відрізняється на тлі застосування різних антипсихотиків: вищий ризик характерний для клозапіну й оланзапіну, проміжний ризик – для рисперидону та кветіапіну; найнижчий – для арипіпразолу, який має інший механізм дії [28, 29].
Клінічна картина. Значне збільшення маси тіла зазвичай відбувається протягом кількох тижнів після початку лікування антипсихотиками 2-го покоління та продовжується протягом тривалого часу, хоч і меншими темпами [27]. Вибір «нездорової» їжі та відсутність фізичної активності, на додачу до можливих специфічних для самого психічного захворювання механізмів, можуть спричиняти розвиток ожиріння в людей із серйозними проблемами психічного здоров’я. Утім, саме використання антипсихотичних засобів (особливо атипових) вважається найважливішим чинником, пов’язаним зі збільшенням маси тіла.
! Часто після початку застосування антипсихотиків 2-го покоління спостерігаються швидке підвищення рівня глюкози в крові та дебют ЦД.
Це може відбуватися навіть до збільшення маси тіла, що свідчить про пряму діабетогенну роль саме цих препаратів [30].
Патерн гіперглікемії нагадує той, що спостерігається при ЦД 2 типу, але прогресування відбувається швидше. При цьому повідомлення про розвиток ДКА після початку застосування антипсихотиків 2-го покоління свідчать про те, що вони чинять прямий шкідливий вплив на β-клітини підшлункової залози та секрецію інсуліну [31].
Патофізіологія/механізми. Антипсихотики спричиняють ожиріння, призводячи до підвищення маси тіла внаслідок посилення апетиту та збільшення прийому їжі [25, 32]. Прибавка маси тіла, спричинена застосуванням антипсихотиків 2-го покоління, може пояснюватися їхньою антагоністичною дією на рецептори 5-HT2C. Дійсно, серотонін діє через рецептори 5-HT2C, стимулюючи анорексигенні нейрони, які синтезують проопіомеланокортин, і знижуючи апетит; цей ефект блокується антипсихотиками 2-го покоління. Крім того, інгібування Н1-рецепторів гістаміну може зумовлювати збільшення споживання їжі [25]. Антипсихотики також можуть зменшувати витрати енергії через седативний ефект, який зменшує довільні рухи, або через змінену експресію роз’єднувального білка-1 (UCP-1) у бурій ЖТ [32].
! Антипсихотики (переважно препарати 2-го покоління) збільшують імовірність виникнення метаболічних порушень, у тому числі ЦД, ризик розвитку якого тісно пов’язаний зі ступенем збільшення маси тіла [33].
Проте точні механізми розвитку ЦД на тлі застосування цих препаратів іще потребують подальшого з’ясування. Згідно з даними нещодавнього огляду [30, 34], спричинені антипсихотиками порушення гомеостазу глюкози в усьому організмі можуть включати клітинну передачу сигналів інсуліну, ендогенну продукцію глюкози, захоплення глюкози та секрецію інсуліну, таким чином впливаючи на різні ключові органи-мішені (печінку, скелетні м’язи й ендокринний апарат підшлункової залози).
Оскільки ДKA розвивається лише в ситуаціях глибокого дефіциту інсуліну, вища частота розвитку цього ускладнення в осіб, які отримували лікування антипсихотиками 2-го покоління, означає, що ці препарати можуть різко знижувати секрецію інсуліну, принаймні в деяких осіб.
Це може відбуватися через порушення нормальної індукованої глюкозою секреції інсуліну або бути результатом прямого токсичного впливу на β-клітини підшлункової залози [25].
Медичне спостереження та лікування. Вкрай важливо вживати заходів для профілактики діабету, особливо в осіб із групи високого ризику, а також проводити скринінг діабету після початку лікування антипсихотичними засобами [31].
! Для осіб із групи ризику розвитку ЦД рекомендується вибрати антипсихотичний засіб із незначними несприятливими метаболічними ефектами чи без них. Препарати вибору в цьому разі включатимуть або такі сучасні антипсихотики, як арипіпразол і зипразидон, або навіть антипсихотики 1-го покоління (котрі здатні спричиняти менш тяжкі метаболічні порушення, проте можуть зумовити нейроендокринні порушення) [36].
Пацієнтам та їхнім опікунам обов’язково треба давати поради щодо способу життя, щоб мінімізувати ризик збільшення маси тіла й розвитку ЦД (тобто раннє звернення до дієтолога та поради щодо фізичних вправ).
! В осіб без ЦД рекомендується контролювати рівень глюкози в крові натщесерце протягом перших 12 тижнів після початку терапії антипсихотиками, а потім щорічно [33].
Можна також розглянути переведення пацієнта з відхиленнями рівня глюкози в крові від норми на прийом тих антипсихотиків 2-го покоління, котрі не пов’язані з розвитком ЦД (див. вище) [36]. Враховуючи високу поширеність ожиріння, крім призначення метформіну певні переваги може мати також використання цукрознижувальних препаратів, які сприяють зниженню маси тіла, як-от агоністи рецепторів ГПП-1 та інгібітори натрійзалежного котранспортера глюкози 2 типу, хоча в цьому напрямі потрібні подальші спеціальні дослідження [32, 36]. Показано, що агоністи рецепторів ГПП-1 нівелюють збільшення маси тіла, пов’язане із застосуванням антипсихотиків (особливо в пацієнтів, які приймали клозапін або оланзапін), і цей ефект супроводжується покращенням глікемії натще [37]. У разі вираженого дефіциту інсуліну, особливо при розвитку ДКА, безперечно потрібна інсулінотерапія.
Антиретровірусна терапія
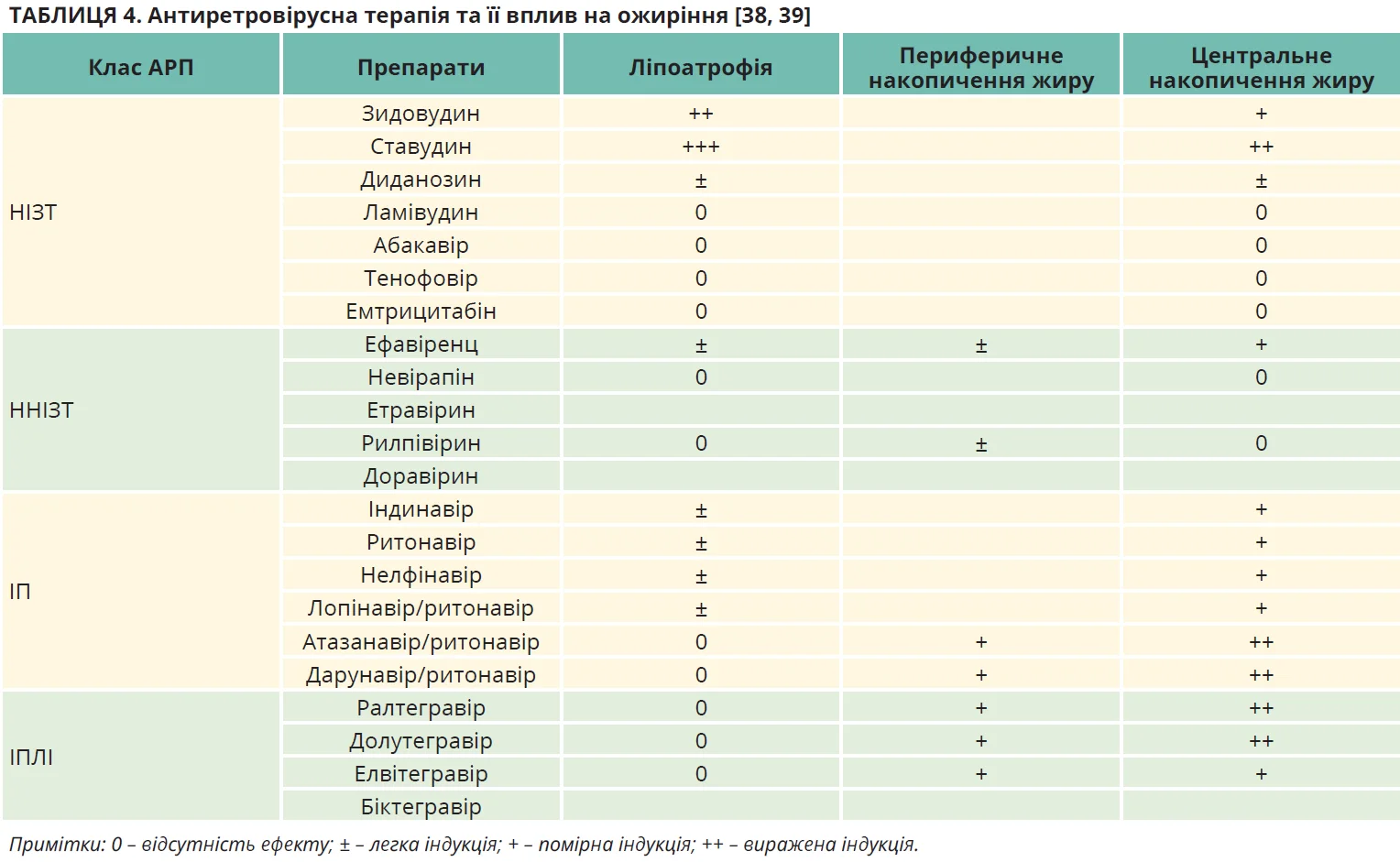
Для лікування ВІЛ-інфекції можуть застосовуватися чотири класи АРП у різних комбінаціях: нуклеозидні інгібітори зворотної транскриптази (НІЗТ), ненуклеозидні інгібітори зворотної транскриптази (ННІЗТ), інгібітори протеази (ІП) й інгібітори переносу ланцюга інтегрази (ІПЛІ) (табл. 4) [38, 39].
Поява нових класів АРП і нових препаратів у кожному класі не тільки покращила ефективність контролю ВІЛ-інфекції, але й зменшила метаболічні побічні ефекти антиретровірусної терапії (АРТ).
Поширеність. Частота діабету, спричиненого АРТ, помітно змінилася протягом останніх десятиліть, і переважно це пов’язано зі змінами у використанні АРП. Наприклад, у Франції [40] та Данії [41] спостерігалося явне зниження захворюваності на ЦД після 2005 р. – паралельно із заміною ставудину, диданозину й індинавіру на нові менш токсичні АРП. У нещодавньому метааналізі, виконаному Nansseu та співавт. [42], було описано помітні відмінності в захворюваності на діабет у Північній Америці (19,1/1000 людино-років подальшого спостереження – PYFU) та Європі (8,0/1000 PYFU). Глобальна сукупна захворюваність становила в середньому 4,9% у всьому світі; цей показник виявився вищим серед американців (6,1%), аніж серед європейців (3,8%), що відображає варіації в поширеності ожиріння.
Основними чинниками, які пов’язані з розвитком АРП-індукованого діабету, є літній вік, африканське та латиноамериканське походження, ЦД у сімейному анамнезі, надмірна маса тіла чи ожиріння, центральне ожиріння, дисліпідемія, метаболічний синдром, порушення розподілу жиру (ліпоатрофія та/або ліпогіпертрофія) й тип АРТ.
Клінічна картина. У ВІЛ-інфікованих осіб діабет зазвичай перебігає безсимптомно, тому після початку або модифікації АРТ варто проводити скринінг. Це особливо важливо для пацієнтів із групи ризику розвитку ЦД, зважаючи на їхнє походження, наявність ліподистрофії та склад обраного режиму АРТ (табл. 4) [38, 39].
Патофізіологія/механізми. Основними чинниками формування інсулінорезистентності у ВІЛ- інфікованих осіб є ліпоатрофія та порушення розподілу жиру [38, 39]. Основна роль, яку відіграють НІЗТ 1-го покоління ставудин і зидовудин у виникненні ліпоатрофії (й гіпертрофії жирової клітковини тулуба), була чітко задокументована та пов’язана з інфільтрацією ЖТ макрофагами й запаленням, мітохондріальною токсичністю та дисфункцією жирових клітин, включаючи резистентність адипоцитів до інсуліну [44]. Було припущено, що тимідинові НІЗТ зумовлюють незворотні мутації мітохондріальної ДНК, що призводить до мітохондріальної дисфункції та передчасного старіння ЖТ [45, 46].
Роль ІП у розвитку гіпертрофії ЖТ тулуба менш ясна [47]. Молекулярний аналіз підшкірної ЖТ, узятої в осіб, які отримували лікування ІП, показав знижену експресію мікроРНК-процесингового ферменту DICER, пов’язану з низхідною регуляцією специфічних для ЖТ генів, як-от UCP-1, разом зі зрушенням у бік прозапального та профібротичного станів [39, 48]. Дослідження in vitro показали, що деякі ІП інгібують фермент цинкову металопептидазу (ZMP)-STE24, який є обов’язковим для дозрівання білка нуклеарної матриці преламіну-А в ламін-А. Як наслідок, накопичення преламіну-А індукує змінену функцію адипоцитів і резистентність до інсуліну, а також сприяє центральному перерозподілу жиру [49].
Було показано in vitro, що ННІЗТ ефавіренц змінює розвиток і функціонування адипоцитів і посилює запалення, тоді як невірапін чинить сприятливі ефекти [50].
Механізми, за допомогою яких ІПЛІ зумовлюють посилене відкладання жиру, вивчені недостатньо.
У дослідженнях in vitro з використанням підшкірної та вісцеральної ЖТ від макак, які отримували ІПЛІ, було продемонстровано збільшення фіброзу, розміру адипоцитів та експресії адипогенного маркера (PPARG і CEBPA) порівняно з нелікованими тваринами [51].
Отже, деякі АРП (переважно НІЗТ та ІП 1-го покоління) спричиняють резистентність адипоцитів до інсуліну, що збільшує вивільнення неестерифікованих жирних кислот (NEFA), а це, своєю чергою, призводить до ліпотоксичності з подальшою інсулінорезистентністю та зміненою секрецією інсуліну.
Ба більше, крім значного впливу АРТ на чутливість до інсуліну, було показано, що ІП змінюють функцію β-клітин. АРП (включаючи лопінавір, атазанавір і ритонавір) здатні знижувати інсуліносекреторні властивості клітин інсуліноми й острівців підшлункової залози людини, а також можуть посилювати апоптоз β-клітин [52].
Медичне спостереження та лікування. Профілактика й діагностика діабету має вирішальне значення для ВІЛ-інфікованих осіб. У всіх пацієнтів, які отримують лікування з приводу ВІЛ-інфекції, рівень глюкози в плазмі натщесерце слід рутинно перевіряти що 6-12 місяців, а також що 1-3 місяці після початку АРТ [53]. Як модифікація способу життя (вправи та дієта), так і метформін полегшували прояви метаболічного синдрому в цих осіб [55]. Також виправданим є уникнення застосування старих АРП, пов’язаних із розвитком адипозопатії (ліпоатрофії та центральної ліпогіпертрофії).
У ВІЛ-інфікованих осіб із ЦД його лікування має відповідати класичним рекомендаціям [56]. Основою комплексного лікування залишається зміна способу життя. Метформін є препаратом першої лінії, а лікування другої лінії слід обирати після врахування відповідних переваг і недоліків [54], а також профілю пацієнта та його вподобань.
Інгібітори контрольних точок імунної відповіді
Антиген-4 цитотоксичних Т-лімфоцитів (CTLA-4) та білок запрограмованої смерті клітин-1 (PD-1) разом із його лігандом (PDL-1) являють собою ті білки контрольних точок імунної відповіді, які відповідають за негативну регуляцію імунних реакцій, а отже, за підтримання автотолерантності. На ці білки можна чинити цілеспрямований вплив за допомогою моноклональних антитіл (табл. 5).

При лікуванні раку застосування ІКТІВ забезпечує активацію імунної системи, яка покликана подолати імуносупресію, спричинену злоякісною пухлиною. Однак ІКТІВ можуть перешкоджати фізіологічній функції імунних контрольних точок, спрямованій на підтримання автотолерантності, й тим самим зумовлювати унікальний спектр імунозалежних несприятливих подій. Зокрема, на тлі застосування ІКТІВ повідомлялося про різні ендокринопатії, в тому числі про вперше діагностований ЦД, який може (принаймні частково) нагадувати за своїм перебігом автоімунний ЦД 1 типу [57-60].
Поширеність у клінічній практиці. Згідно з метааналізом даних 40 досліджень за участі загалом 24 596 осіб, випадки специфічного ІКТІВ-індукованого діабету трапляються рідко. Проте порівняно з плацебо й іншими терапевтичними стратегіями ІКТІВ достовірно підвищували ризик розвитку серйозної гіперглікемії (відносний ризик (ВР) 2,41; 95% довірчий інтервал (ДІ) 1,52-3,82), діабету (ВР 3,54; 95% ДІ 1,32-9,51), ЦД 1 типу (ВР 6,60; 95% ДІ 2,51-17,30) та ЦД 1 типу з тяжким перебігом (ВР 6,50; 95% ДІ 2,32-18,17) [61].
Ретроспективне дослідження даних Системи звітності про небажані явища Управління з контролю якості харчових продуктів і медикаментів США (FAERS) у період із 1 січня 2015 р. по 31 грудня 2019 р. виявило 735 випадків уперше виявленого діабету, пов’язаного із застосуванням ІКТІВ, із загальною розрахунковою частотою 1,27% [62].
Із цих 735 випадків у 183 (24,90%) пацієнтів було діагностовано фульмінантний ЦД 1 типу, в 338 (45,99%) – ДКА, в 183 (24,90%) – загрозливі для життя наслідки ЦД, а 41 (5,58%) пацієнт помер. Слід зазначити, що звітність про ЦД, пов’язаний із застосуванням IКТІВ, постійно зростала з початку 2015 до кінця 2019 р. [62].
Порівняно з терапією інгібіторами PD-1 або PD-L1 особи, які отримували лікування інгібіторами CTLA-4, мали достовірно меншу ймовірність розвитку ЦД [63]. Відповідно до бази даних Всесвітньої організації охорони здоров’я про індивідуальні звіти щодо безпеки, лише у 12 із 283 випадків (4,2%) уперше виявленого ЦД пацієнтів лікували тільки інгібіторами CTLA-4, тоді як монотерапія інгібіторами PD-1 реєструвалася в 76% усіх випадків [64].
Клінічна картина. IКТІВ-асоційований діабет за своєю патофізіологією та клінічними проявами часто нагадує ЦД 1 типу [58, 59]. Однак у деяких осіб може виникати ЦД 2 типу або відзначатися посилення гіперглікемії за вже наявної дисглікемії чи ЦД [65]. Середній вік пацієнтів у разі дебюту ІКТІВ-асоційованого діабету (60 років) є набагато вищим, аніж у разі типового ЦД 1 типу; серед хворих спостерігається незначне переважання чоловіків. Клінічні прояви є різноманітними – від безсимптомної гіперглікемії або класичних симптомів діабету (поліурія, полідипсія) до загрозливого для життя ДКА [66]. Час від початку терапії ІКТІВ до діагностування ЦД також варіює в широких межах: від кількох днів до кількох місяців [63]. Короткий період гіперглікемії до встановлення діагнозу (що підтверджується майже нормальним або лише помірно підвищеним рівнем HbA1c), свідчить про гостру деструкцію β-клітин, що підтверджується вираженим зниженням концентрації С-пептиду [60].
Візуалізація підшлункової залози демонструє неспецифічні результати; проте повідомлялося про дифузний панкреатит (частіше при застосуванні інгібіторів CTLA-4, ніж інгібіторів PD-1) [67].
Патофізіологія/механізми. Опосередкована ІКТІВ активація імунної системи не обмежується власне протипухлинною активністю; імунореактивність може бути спричинена й проти нормальних тканин, як-от β-клітини підшлункової залози, внаслідок чого «імітується» сценарій розвитку ЦД 1 типу.
Точний патогенез цього небажаного явища недостатньо вивчений. Раннє виявлення осіб, які можуть бути схильні до розвитку ІКТІВ-асоційованого діабету, є життєво важливим, але біомаркери досліджені недостатньо [66]. Було припущено, що наявність антитіл до острівцевих клітин (переважно антитіл до глутаматдекарбоксилази – GAD) або чутливих генотипів HLA (наприклад, DR4-DQ4) може свідчити про вищий ризик розвитку ІКТІВ-асоційованого діабету [63, 68]. Проте лише в приблизно половини осіб з ІКТІВ-асоційованим діабетом було отримано позитивний результат аналізу на наявність принаймні одного типу антитіл до острівцевих клітин, причому антитіла до GAD були найпоширенішими [58, 63].
Медичне спостереження та лікування. Перед початком терапії IКТІВ пацієнтів слід поінформувати про потенційний ризик розвитку діабету та навчити виявляти симптоми й ознаки гіперглікемії та ДКА, щоб вони могли терміново звернутися по медичну допомогу. Також перед початком лікування ІКТІВ варто проводити рутинний аналіз рівня глюкози в крові та HbA1c, а потім перевіряти ці показники через регулярні проміжки часу.
! Лікування діабету, асоційованого із застосуванням ІКТІВ, залежить від ступеня гіперглікемії та наявності ДКА [60, 62].
В осіб із легкою гіперглікемією терапію ІКТІВ можна продовжувати, але рекомендується ретельний лабораторний моніторинг. У пацієнтів із помірною гіперглікемією можливе продовження терапії IКТІВ, але слід розпочати лікування інсуліном. Для осіб із тяжкою гіперглікемією та, звісно, з ДКА, лікування ІКТІВ варто принаймні тимчасово перервати, а інсулінотерапія стає обов’язковою.
Після одужання можна розглянути можливість повторного застосування ІКТІВ, але потрібний ретельний моніторинг глікемії. ЦД, асоційований із застосуванням ІКТІВ, є незворотним і зазвичай потребує довічної інсулінотерапії. Отже, лікування ІКТІВ-асоційованого діабету має бути мультидисциплінарним і до його проведення мають бути залучені як ендокринологи, так і онкологи [63, 65].
Висновки
Зростає занепокоєння фахівців через медикаментозно-індуковану гіперглікемію. Точні механізми, за допомогою яких ті чи інші ЛЗ спричиняють гіперглікемію та діабет, іще потребують подальшого вивчення, але вони, ймовірно, є множинними та відрізняються для препаратів різних фармакологічних класів. У разі застосування препаратів деяких фармакологічних класів провідну роль у розвитку ЦД, безсумнівно, відіграють збільшення маси тіла та/або дисфункція ЖТ (адипозопатія).
Незважаючи на можливий дебют або погіршення перебігу вже наявного ЦД, переваги належним чином призначеного лікування чотирма розглянутими фармакологічними класами препаратів значною мірою переважають потенційні ризики припинення терапії (як і в разі зі статинами). Утім, клініцистам слід пам’ятати про ризик погіршення гомеостазу глюкози, особливо в осіб з уже наявними чинниками ризику, та, коли це можливо, обирати альтернативні препарати, котрі характеризуються меншим ризиком розвитку гіперглікемії. Рекомендується здійснювати ретельний моніторинг показників глікемії в осіб із групи високого ризику розвитку ЦД, які отримують препарати з відомою «діабетогенною» дією, з метою запобігання дебюту ЦД або раннього початку його лікування й уникнення ускладнень, пов’язаних із цим захворюванням.
Оптимізація способу життя залишається ключовим заходом для запобігання або лікування спричинених ЛЗ порушень гомеостазу глюкози; якщо цього недостатньо, препаратом першого вибору залишається метформін. Новітні цукрознижувальні препарати, які можуть сприяти зниженню маси тіла, становлять потенційний інтерес для лікування пацієнтів, у яких ЦД виникає в контексті збільшення маси тіла та формування інсулінорезистентності. При тяжкій гіперглікемії та, звичайно, розвитку ДКА, а також за наявності маркерів глибокої дисфункції β-клітин інсулінотерапія стає обов’язковою й має бути скорегована відповідно до даних ретельного моніторингу показників глікемії.
КЛЮЧОВІ МОМЕНТИ
- Клініцисти мають знати про ризик дебюту діабету або погіршення вже наявного ЦД у разі призначення деяких ЛЗ, особливо в осіб, які вже перебувають у групі ризику.
- Особливу увагу слід зосередити на ГК, АРТ, антипсихотиках нового покоління й ІКТІВ.
- Через різні механізми дії ЛЗ вищезазначених чотирьох фармакологічних груп як профілактика, так і лікування індукованого їх застосуванням діабету можуть відрізнятися.
- Медикаментозно-індуковане збільшення маси тіла (абдомінальне ожиріння й «адипозопатія») спричиняє порушення гомеостазу глюкози.
- Рекомендовані заходи щодо корекції способу життя (дієта та фізичні вправи) мають бути інтенсифіковані в тих осіб, які отримують ЛЗ, що можуть призвести до збільшення маси тіла та розвитку ЦД.
- Фармакотерапія медикаментозно-індукованого діабету загалом аналогічна такій при інших формах цього захворювання та передбачає ступеневий перехід від призначення метформіну до застосування інсуліну (якщо це потрібно).
Література
Fève B., Scheen A.J. When therapeutic drugs lead to diabetes. Diabetologia. 2022 May; 65 (5): 751-762. doi: 10.1007/s00125-022-05666-w. Epub 2022 Mar 4. PMID: 35244742.
