Клітинна терапія в ендокринології: новини в лікуванні цукрового діабету
Підготувала канд. мед. наук Тетяна Можина
Цукровий діабет (ЦД) визнано серйозним викликом для глобальної системи охорони здоров’я через стрімке зростання його поширеності, ЦД-асоційованої захворюваності, інвалідності та смертності [14]. Міжнародна діабетична федерація (IDF), зазначаючи, що у 2021 р. у світі на ЦД страждало 537 млн осіб, прогнозує подальше зростання його поширеності: вже у 2045 р. цей показник збільшиться на 12,2% та становитиме понад 783 млн осіб [13]. Протягом 2021-2045 рр. найбільше зростання поширеності ЦД очікується в країнах із середнім рівнем доходу (21,1%) порівняно з країнами з високим (12,2%) та низьким (11,9%) рівнями доходу [13].
Перебіг ЦД 1-го, а іноді й 2-го типу може потребувати проведення інсулінотерапії, яка спричиняє значну кількість побічних дій і несприятливих ефектів, особливо виникнення епізодів гострої неконтрольованої гіпоглікемії [15]. Спочатку як альтернативу звичайній інсулінотерапії намагалися виконувати трансплантацію підшлункової залози (ПЗ), але пересадження цілого органа супроводжується кількома проблемами, включаючи обмежену доступність, відторгнення трансплантата, судинні ускладнення, необхідність довічного застосування імуносупресивних препаратів, боротьбу з наслідками імуносупресії. Останнім часом на зміну трансплантації всієї ПЗ прийшла клітинна терапія, що передбачає введення хворим автологічного (власні клітини) або алогенного (донорські) клітинного матеріалу [1]. Саме ця галузь набуває стрімкого розвитку: обсяг світового ринку клітинної терапії у 2023 р. становив 14,52 млрд доларів США й, за прогнозами, протягом 2024-2033 рр. зросте на 20,9% та досягне 97 млрд доларів США вже у 2033 р. [1].
Клітинна терапія ЦД
Клітинну терапію ЦД можна умовно поділити на дві великі галузі: власне отримання клітинного матеріалу та його наступне введення із забезпеченням виживання й функціонування в організмі людини.
Отримання клітин для трансплантації: які найефективніші та найбезпечніші?
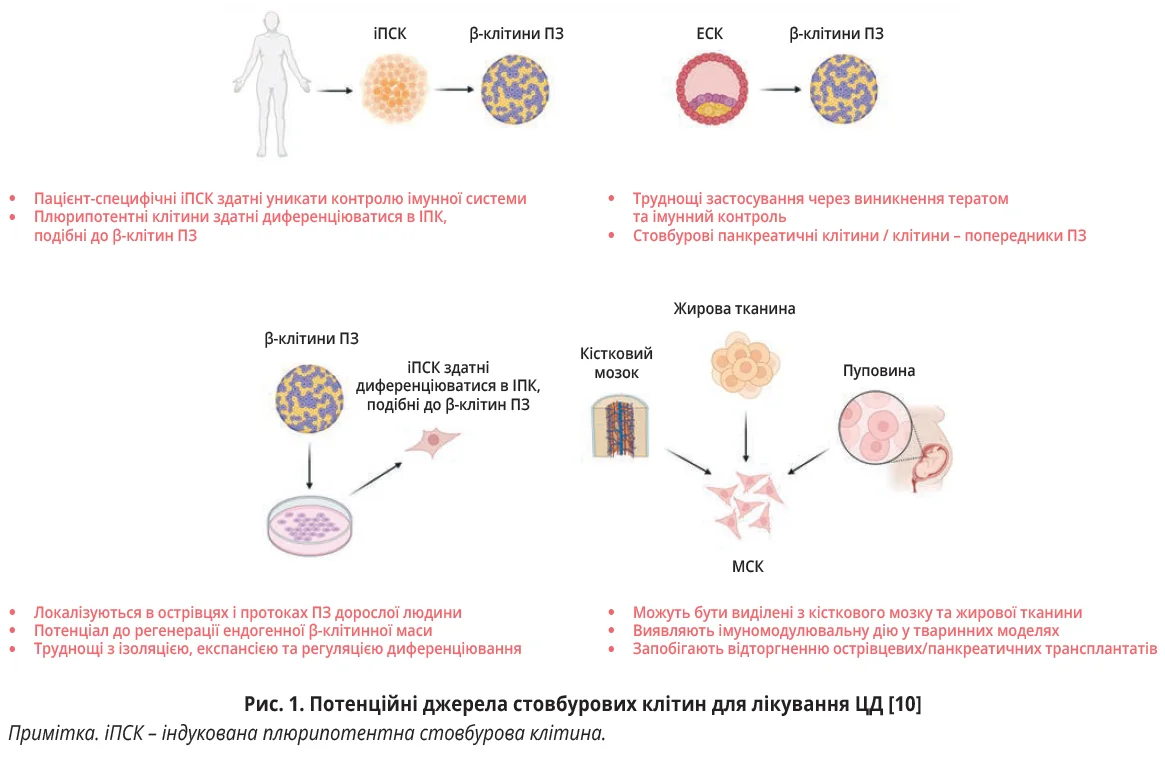
Клітинна терапія ЦД ґрунтується на використанні стовбурових (мезенхімальних, ембріональних) і нестовбурових (клітини кісткового мозку) клітин [3]. Ембріональні стовбурові клітини (ЕСК) одержують з ембріонів на дуже ранніх етапах розвитку. Ці клітини є плюрипотентними та здатні трансформуватися майже в будь-який тип клітин людського організму (рис. 1). Однак їх використання часто є предметом етичних спорів через однозначну загибель ембріона після забору ЕСК, а також унаслідок декількох властивостей плюрипотентних клітин: вони не здатні уникати впливу імунної системи, тобто є імуногенними, а також, імовірно, тератой онкогенними [5].
Мезенхімальні стовбурові клітини (МСК) цінують завдяки їхній здатності диференціюватися в різні типи клітин (кісткові, хрящові, м’язові, жирові, β-клітини ПЗ), можливості їх отримання з різноманітних тканин, включаючи кістковий мозок, жир, пуповину (рис. 1). МСК, на відміну від ЕСК, уникають імунологічних реакцій, а генні маніпуляції з ними не супроводжуються виникненням будь-яких непередбачуваних ускладнень, у тому числі пухлин унаслідок злоякісної трансформації трансплантованих клітин [6]. МСК здатні трансформуватися в клітини, подібні до β-клітин ПЗ: шляхом спрямованої диференціації отримують інсулінопродукувальні клітини (ІПК). Трансплантація ІПК, одержаних із МСК, асоціюється з приглушеною алогенною відповіддю, яка, з одного боку, не порушує їхньої функціональної активності, а з іншого – дає змогу трансплантованим клітинам вижити під наглядом імунної системи організму [5].
Доказова база
Вже накопичено достатню кількість клінічних досліджень, які дають змогу провести метааналізи ефективності клітинної терапії ЦД. Один з перших метааналізів, заснований на даних 21 клінічного дослідження (серед яких 10 випробувань (n=226) проведено в когорті хворих на ЦД 1-го типу, 11 (n=386) – за участю пацієнтів із ЦД 2-го типу), довів, що введення стовбурових клітин забезпечило покращення вмісту С-пептиду (середня різниця, СР 0,41; 95% довірчий інтервал, ДІ 0,06-0,76) та глікозильованого гемоглобіну – HbA1c (СР -3,46; 95% ДІ від -6,01 до -0,91) у хворих на ЦД 1-го типу [16]. Терапія стовбуровими клітинами ЦД 2-го типу також сприяла зростанню рівня С-пептиду (СР 0,33; 95% ДІ 0,07-0,59), зменшенню HbA1c (СР -0,87; 95% ДІ від -1,37 до -0,37) та потреби в інсуліні (СР -35,76; 95% ДІ від -40,47 до -31,04) [16]. Трансплантація хворим на ЦД 2-го типу МСК асоціювалася зі зниженням рівня HbA1c та потреби в інсуліні, тоді як уведення мононуклеарних клітин кісткового мозку забезпечило зменшення потреби в інсуліні та зростання рівня С-пептиду [16].
У нещодавно опублікованій роботі, заснованій на аналізі даних 13 клінічних випробувань (n=302), доведено, що трансплантація МСК асоційована з тенденцією до зниження середнього рівня глікемії натще (СР 1,78; 95% ДІ від -1,02 до 4,58; р=0,212), вірогідним зменшенням HbA1c порівняно з вихідним рівнем (СР 0,95; 95% ДІ 0,33-1,57; р=0,003), зниженням потреби в інсуліні (СР 0,19; 95% ДІ 0,07-0,31; р=0,002), певним зростанням рівня С-пептиду натще (СР -0,02; 95% ДІ від -0,07 до 0,02) у хворих на ЦД 1-го та 2-го типів без явних побічних ефектів [6].
Наступними важливими етапами клітинної терапії є доставка стовбурових клітин і забезпечення їх належного функціонування в організмі людини протягом якомога більшого часу, бажано без системної імуносупресії та розвитку ускладнень імуносупресивної терапії [15]. Перші спроби застосування клітинної терапії ЦД передбачали інфузію острівців ПЗ у ворітну вену печінки й обов’язкове призначення імуносупресивних препаратів з метою запобігання відторгненню клітинного трансплантата. Обмежений запас острівців ПЗ та побічні ефекти імуносупресантів (переважно підвищення ризику розвитку неоплазій і супутніх інфекцій) значно стримували застосування цього різновиду клітинної терапії. Подолати зазначені провідні недоліки вчені змогли за допомогою МСК, ЕСК, а також їх розміщення в спеціальних мікрокапсулах.
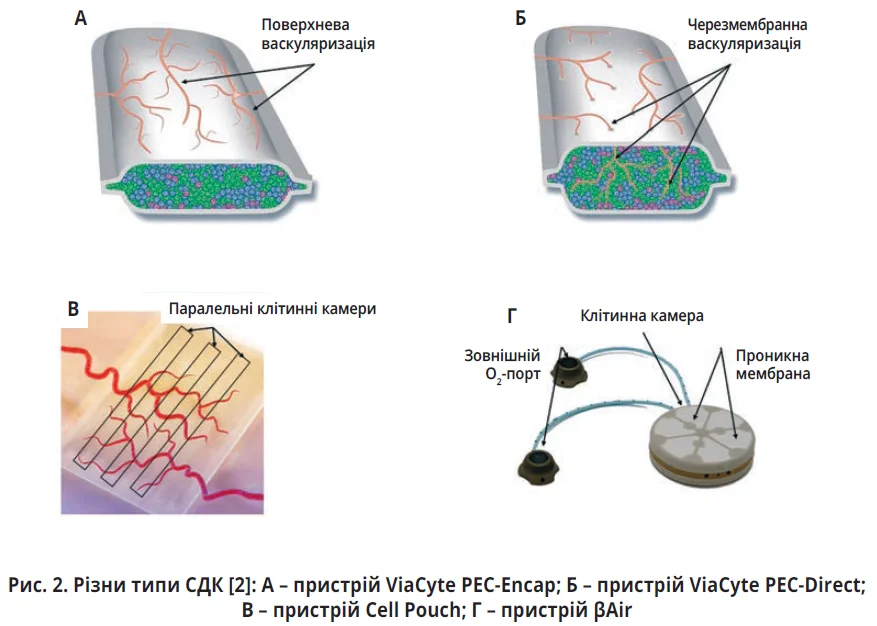
Зазначена стратегія дістала назву «система доставки клітин» (СДК) та використовується вже понад 40 років. Згодом виробництво СДК вдосконалювалося: мікрокапсули почали розміщати в каркасах різної форми, покривати різноманітними гелями. Таким чином були створені макро- та мікропристрої, які забезпечують васкуляризацію й захист інкапсульованих β-клітин від імунного нагляду (рис. 2).
Провідні СДК, які використовувалися в клінічних дослідженнях
Альгінатні мікрокапсули
Застосування альгінату, аніонного полісахариду з різних видів водоростей, сприяло створенню мікрокапсули з особливими фізико-хімічними властивостями, завдяки яким забезпечується захист трансплантованих β-клітин. Альгінатні мікрокапсули стали першими СДК: їх використання дало змогу трансплантувати 15 000 острівців ПЗ (еквівалент – панкреатичні острівці на кілограм) в очеревину пацієнтів, які раніше перенесли трансплантацію та приймали імуносупресанти. Трансплантовані людські острівці ПЗ виробляли інсулін, і реципієнти не залежали від уведення екзогенного інсуліну майже 9 місяців [12]. Однак у подальших клінічних випробуваннях не вдалося досягти таких самих результатів без супутньої імуносупресії. Недостатнє очищення альгінату та наявність у ньому білків, поліфенолів, ендотоксинів можуть погіршити виживання трансплантата.
Інший терапевтичний підхід передбачає інкапсуляцію панкреатичних острівців разом з МСК та безклітинним панкреатичним екстрацелюлярним матриксом, який підтримує ріст і функціонування острівців. Згідно з цією методикою введення альгінату натрію та гіалуронової кислоти сприяє синтезу колагену, тоді як оптимальне перенесення води й кисню досягається при використанні пористих 3D-мембран. Гідрогель прискорює реепітелізацію, зменшує запалення [6].
Пристрій Encaptra від компанії ViaCyte
На противагу мікрокапсулюванню було розроблено метод «напівпроникних мішечків», зокрема пристрій Encaptra, який імплантують підшкірно. Encaptra містить клітини – попередники ПЗ, отримані з ЕСК, які здатні диференціюватися в зрілі β-клітини та нормалізувати рівень глікемії [8].
У першому дослідженні, проведеному у 2014 р., пристрій VC-01, або PEC-Encap, імплантували хворим на ЦД 1-го типу без призначення імуносупресивних засобів. Дослідження підтвердило безпечність пристрою, але пізніше розвинувся індукований гіпоксією некроз клітин [9]. Наступна модифікація цього пристрою під назвою VC-02 має більший розмір пор, що, з одного боку, полегшує васкуляризацію, а з іншого – нівелює імуноізолювальний ефект. Зазначені зміни дали змогу знизити потребу в інсуліні в більшості учасників дослідження протягом 1 року [2]. З метою зниження імуногенності й усунення необхідності прийому імунодепресантів компанія ViaCyte вирішила використовувати спінений політетрафторетилен, якому притаманні одразу імуноізолювальні та проангіогенні властивості [2].
Пристрій Cell Pouch від компанії Sernova
Cell Pouch являє собою комбіновану методику, яка передбачає використання острівцевих клітин, вирощених поза організмом реципієнта, та «вбудованого» пристрою для їх зберігання й доставки – власне, того самого «мішечка» [11]. Імплантація Cell Pouch відбувається у два етапи з інтервалом у декілька тижнів: спочатку під загальною анестезією аксесуар уживлюється під шкіру в ділянці живота. Після досягнення максимальної спорідненості з організмом пацієнта виконують 2-й етап трансплантації: пересаджують in situ кілька тисяч острівцевих клітин. Зовнішня оболонка Cell Pouch містить тонкі пори, через які з часом проростають капіляри; всередині передбачені мікротрубки, що стають місцем для приживлення острівцевих клітин з ідеальними умовами.
Пристрій Cell Pouch, площа якого менша за таку візитівки, а товщина – всього декілька міліметрів, можна згорнути та помістити в підшкірно-жирову клітковину живота. Після імплантації пристрій розгортають і приблизно через 3 тижні заповнюють стовбуровими клітинами. «Навколо цих клітин продовжуватимуть рости тканини, їх живитимуть кровоносні судини, а ІПК перебуватимуть в органоподібному середовищі», – стверджують представники компанії Sernova. Отже, «клітинний мішечок» практично трансформується в орган, який генерує дефіцитний інсулін; безперечно, Cell Pouch не можна назвати повноцінною або автономною ПЗ, але цей пристрій не можна вважати повністю чужорідним тілом, який буде атакований імунною системою. Виробник вважає, що Cell Pouch зможе функціонувати необмежений час, оскільки пристрій виготовляють зі спеціального нейтрального стабільного полімеру, який не має деградувати.
У клінічному дослідженні доведено, що імплантація Cell Pouch сприяє стимуляції синтезу С-пептиду протягом 9 місяців, зниженню рівня HbA1c з 10,6 до 7,6%, зменшенню добової дози екзогенного інсуліну із 49 до 28 Од [11]. Нині компанія Sernova працює над можливістю позбавлення пацієнтів від пожиттєвого прийому імуносупресантів завдяки розміщенню β-клітин у гідрогелевих капсулах та їх «маскуванню» від імунної системи хазяїна.
Пристрій βAir від компанії Beta O2
βAir відрізняється від інших CДК тим, що не тільки містить клітини в імуноізолювальному режимі, але й забезпечує безперервне постачання екзогенного кисню для імплантованих β-клітин, задовольняючи їхні метаболічні потреби. Клітини, які розміщені в пласкій альгінатовмісній плиті з гіалуроновою кислотою, відокремлені від зовнішнього середовища напівпроникною гідрофільною мембраною з політетрафторетиленом, розмір пор якої становить 0,4 мкм [2]. Саме цей комплекс альгінату та мембрани забезпечує часткову імуноізоляцію імплантованих β-клітин. Противники методики βAir припускають, що постійна залежність від кисню асоційована з високим ризиком інфікування, незважаючи на досягнуте покращення виживаності інкапсульованих острівців [2].
Лантидра від компанії CellTrans Inc – лідер клітинної терапії ЦД
Попри велику кількість наявних і розроблення нових СДК найграндіозніше просування отримав препарат для клітинної терапії під торговою назвою Лантидра (доніслецел), який має вигляд «звичайного» інфузійного розчину. Саме Лантидра схвалений Управлінням США з контролю продовольства та медикаментів (FDA) для лікування ЦД 1-го типу й уже офіційно присутній на фармацевтичному ринку [4]. За своїм складом Лантидра є першим алогенним засобом клітинної терапії, який містить острівцеві клітини ПЗ, отримані від померлого донора. Лантидра може бути призначена дорослим хворим на ЦД 1-го типу, які не можуть досягти цільового рівня глікемії через повторювані епізоди тяжкої гіпоглікемії, незважаючи на оптимальну протидіабетичну фармакотерапію [4].
Лантидра складається із суспензії клітин ПЗ, вкритих біосумісною речовиною, яка пропускає поживні речовини й інсулін, водночас захищаючи їх від імунної системи пацієнта. Розчин доніслецелу вводять у ворітну печінкову вену за допомогою лапароскопічного або відкритого хірургічного доступу; черезшкірний або трансвенозний черезпечінковий доступ також можливий, але визнаний непрактичним [7].
Очікується, що трансплантація Лантидри допоможе ефективно відновити добрий контроль за глікемією, який зберігатиметься щонайменше кілька років, а також зменшить залежність від екзогенного інсуліну [7]. Два клінічні дослідження, проведені компанією-виробником, свідчать, що введення Лантидри покращує якість життя пацієнтів, даючи їм змогу виконувати різноманітні повсякденні активності, які не були можливими до трансплантації [7]. Трансплантація острівців у складі Лантидри сповільнює чимало виснажливих вторинних ускладнень і супутніх захворювань ЦД (атеросклероз, ретинопатію) або сприяє їх регресуванню [7].
Висновки
Сучасна клітинна терапія ЦД передбачає застосування МСК, ЕСК та нестовбурових клітин,які допомагають відновити функцію β-клітин ПЗ із забезпеченням часткової імунної толерантності. Метааналізи довели клінічну ефективність і безпечність трансплантації МСК у лікуванні ЦД. Інноваційна клітинна терапія ЦД вже стала реальністю сучасної медицини: препарат Лантидра, перший представник клітинної терапії, схвалений FDA, вже рятує життя хворих на ЦД 1-го типу.
Завдяки встановленню нових важливих рубежів клітинної терапії, спрямованих на оптимізацію способів інкапсуляції, доставки й імплантації клітин для гарантування безпечного й ефективного відновлення кількості острівців ПЗ без хронічної залежності від імуносупресивних засобів, можна очікувати на появу нових засобів, здатних частково відновити функцію ПЗ та нормалізувати стан хворих на ЦД.
Література
- Cell Therapy Market Size, Share, and Trends 2024 to 2034. Available at: https://www.precedenceresearch.com/cell-therapy-market.
- Dang H.P., Chen H., Dargaville T.R., Tuch B.E. Cell delivery systems: toward the next generation of cell therapies for type 1 diabetes. J. Cell. Mol. Med. 2022 Sep; 26 (18): 4756-4767. doi: 10.1111/jcmm.17499.
- El-Kadiry A.E., Rafei M., Shammaa R. Cell therapy: types, regulation, and clinical benefits. Front. Med. (Lausanne). 2021 Nov 22; 8: 756029. doi: 10.3389/fmed.2021.756029.
- FDA approves first cellular therapy to treat patients with type 1 diabetes. Available at: https://www.fda.gov/news-events/press-announcements/fda-approves-first-cellular-therapy-treat-patients-type-1-diabetes.
- Ghoneim M.A., Gabr M.M., El-Halawani S.M., et al. Current status of stem cell therapy for type 1 diabetes: a critique and a prospective consideration. Stem Cell Res. Ther. 2024; 15: 23. doi: 10.1186/s13287-024-03636-0.
- Habiba U.E., Khan N., Greene D.L., Ahmad K., Shamim S., Umer A. Meta-analysis shows that mesenchymal stem cell therapy can be a possible treatment for diabetes. Front. Endocrinol. (Lausanne). 2024 May 10; 15: 1380443. doi: 10.3389/fendo.2024.1380443.
- Lantidra™. First FDA-approved, cellular therapy to treat type 1 diabetes. Available at: https://www.lantidra.com.
- Kirk K., Hao E., Lahmy R., Itkin-Ansari P. Human embryonic stem cell derived islet progenitors mature inside an encapsulation device without evidence of increased biomass or cell escape. Stem Cell Res. 2014; 12 (3): 807-814.
- Pullen L.C. Stem cell–derived pancreatic progenitor cells have now been transplanted into patients: report from IPITA 2018. Wiley Online Library, 2018. P. 1581-1582.
- Raoufinia R., Rahimi H.R., Saburi E., Moghbeli M. Advances and challenges of the cell-based therapies among diabetic patients. J. Transl. Med. 2024 May 8; 22 (1): 435. doi: 10.1186/s12967-024-05226-3.
- Sernova Corp presents positive preliminary safety and efficacy data in its phase I/II clinical trial for type 1 diabetes. Biospace, 2019. Available at: https://www.biospace.com/article/sernova-corp-presents-positive-preliminary-safety-and-efficacy-data-in-its-phase-i-ii-clinicaltrial-for-type-1-diabetes.
- Soon-Shiong P., Heintz R.E., Merideth N., et al. Insulin independence in a type 1 diabetic patient after encapsulated islet transplantation. Lancet. 1994; 343 (8903): 950-951.
- Sun H., Saeedi P., Karuranga S. IDF Diabetes Atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan; 183: 109119. doi: 10.1016/j.diabres.2021.109119.
- Vos T., Lim S.S., Abbafati C., Abbas K.M., Abbasi M., Abbasifard M., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020; 396 (10258): 1204-1222.
- Wassmer C.H., Lebreton F., Bellofatto K., Bosco D., Berney T., Berishvili E. Generation of insulin-secreting organoids: a step toward engineering and transplanting the bioartificial pancreas. Transpl. Int. 2020 Dec; 33 (12): 1577-1588. doi: 10.1111/tri.13721.
- Zhang Y., Chen W., Feng B., Cao H. The clinical efficacy and safety of stem cell therapy for diabetes mellitus: a systematic review and meta-analysis. Aging Dis. 2020 Feb 1; 11 (1): 141-153. doi: 10.14336/AD.2019.0421.