Інозитоли – ключові вторинні медіатори інсуліну. Частина 1
Підготувала канд. мед. наук Ольга Королюк
Інозитоли – це група природних поліолів (цукрів), що належать до класу циклогексанолів, оскільки містять гідроксильні групи, приєднані до циклогексанового кільця.
Інозитоли входять до складу низки харчових продуктів, як-от зернові, бобові, горіхи, насіння олійних культур, цитрусові, за винятком лимонів, баштанні культури, особливо мускатна диня, й інші види овочів і фруктів.
Добова потреба інозитолу для дорослих становить 4-8 г/добу. З їжею надходить близько 25% цієї кількості. Решту організм синтезує самостійно в нирках, печінці та головному мозку. Основним регулятором метаболізму інозитолу є нирки. Кожна нирка виробляє близько 2 г інозитолу щодня. Катаболізм інозитолів відбувається виключно в нирках.
Завдяки одній аксіальній гідроксильній групі на другому атомі вуглецю міоінозитол (MI) є унікальним серед інших форм інозитолу. Саме МІ є найпоширенішим природним ізомером, що присутній у всіх еукаріотичних клітинах. Першим етапом біосинтезу MI є фосфорилювання глюкози до D-глюкозо-6-фосфату (Г6Ф) гексокіназою. Надалі Г6Ф за допомогою міоінозитолфосфатсинтази-1 перетворюється на міоінозитолфосфат, який дефосфорилюється до вільного MI ферментом інозитолмонофосфатазою. У тканинах під впливом інсуліну МІ перетворюється на D-хіроінозитол (DХІ) тканиноспецифічними епімеразами. Це незворотна реакція, котра дає змогу кожному органу або тканині мати специфічний належний баланс між умістом МІ та DХІ, що забезпечує фізіологічний статус метаболізму. Власне МІ та DХІ є найпоширенішими стереоізомерами інозитолу, що відіграють важливу роль у функціонуванні людського організму.
Біологічна роль інозитолу
В організмі людини інозитол є компонентом фосфоліпідів клітинних мембран, фосфатів ядра чи ліпопротеїнів плазми крові, завдяки чому задіяний у багатьох клітинних процесах: осморегуляції, регуляції іонних каналів, передачі сигналів гормонів – фолікулостимулювального гормону (ФСГ), тиреотропного гормону, інсуліну. Крім того, інозитол конче потрібний для функціонування репродуктивної системи, правильного розвитку плода та в ранньому післяпологовому періоді.
Роль інозитолу в метаболізмі глюкози
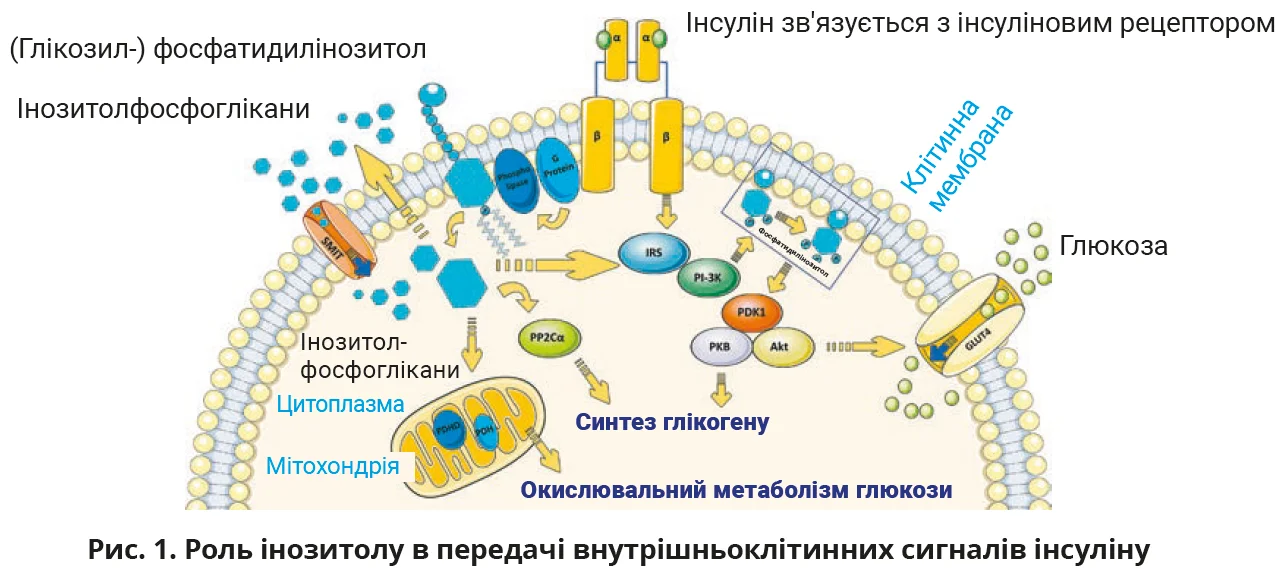
На клітинній мембрані інозитол присутній у вигляді фосфатидилінозитолу. Після зв’язування інсуліну з інсуліновим рецептором (IR) активується субстрат інсулінового рецептора-1 (IRS1), який, своєю чергою, активує фосфоінозитид-3-кіназу (PI3K). У результаті утворюється фосфатидилінозитол для активації фосфоінозитидозалежної кінази-1 (PDK1), а згодом протеїнкіназа B / Akt (PKB/Akt). Кінцевими ефектами вказаних процесів є транслокація транспортера глюкози 4-го типу (GLUT4) та синтез глікогену. Інший шлях активації IR пов’язаний з гетеротримерним G-білком, який активує фосфоліпазу, відповідальну за гідроліз глікозилфосфатидилінозитолу з утворенням розчинних інозитолфосфогліканів. Після активації IR інозитолфосфоглікани вивільняються за межі клітини та згодом реімпортуються транспортером натрію/МІ (SMIT). Інозитолфосфоглікани можуть діяти як другий передбачуваний месенджер інсуліну. У цитоплазмі інозитолфосфоглікан зв’язується з фосфопротеїнфосфатазою 2Cα (PP2Cα) та/або IRS і алостерично активує їх, що призводить до прямої стимуляції глікогенсинтази. У мітохондріях активована піруватдегідрогеназафосфатаза (PDHP) стимулює піруватдегідрогеназу (PDH), тобто окислювальний метаболізм глюкози (рис. 1).
Внутрішньоклітинні ефекти різних стереоізомерів інозитолу різняться. MI перетворюється на вторинний месенджер інсуліну міоінозитолфосфоглікан (MI-ІФГ), що сприяє транслокації GLUT4 до плазматичної мембрани й поглинанню глюкози клітиною, а також пригнічує аденілатциклазу та зменшує вивільнення вільних жирних кислот із жирової тканини. Це пояснює, чому тканини з високим рівнем споживання глюкози (головний мозок, серце, яєчники) містять велику кількість МІ порівняно з іншими тканинами. Натомість DХІ перетворюється на вторинний месенджер інсуліну DХІ-ІФГ та бере участь у синтезі глікогену, стимулюючи глікогенсинтазу, тому його рівні вищі в тканинах, що накопичують глікоген (печінка, скелетні м’язи). DХІ посилює експресію матричної РНК, білків IRS2, PI3K та протеїнкінази В, які є ключовими ферментами сигнальних шляхів різних гормонів. Як наслідок, підвищується рівень білка P-AKT та знижується рівень глікогенсинтази кінази-3β (GSK3β).
Отже, МІ та DХІ виявляють інсуліносенсибілізаційний ефект, знижуючи потребу в інсуліні, що зрештою зменшує гіперінсулінемію. Тому інозитоли вважаються вторинними (хімічними) медіаторами інсуліну.
Клінічна значущість інозитолу
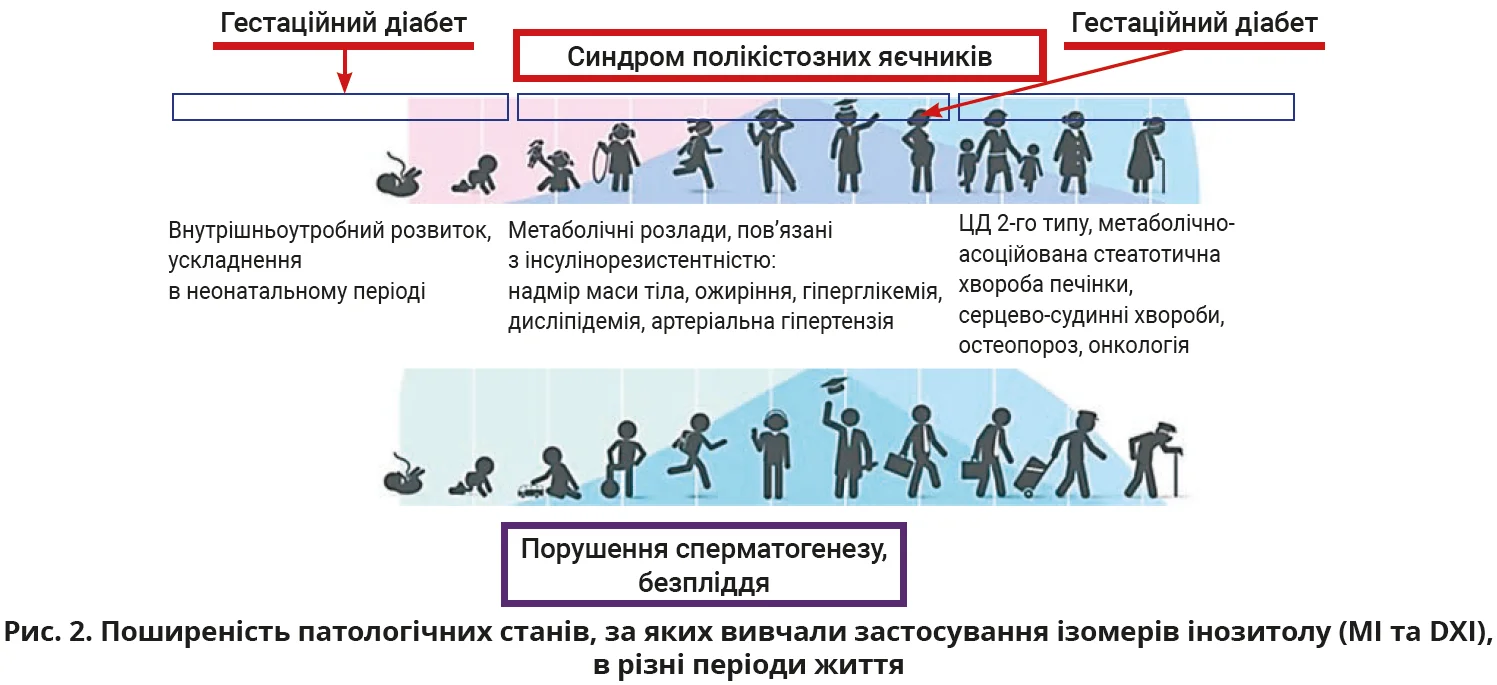
Природне походження, значна поширеність в організмі та вагома роль у життєво важливих процесах (метаболізм, передача гормональних сигналів, вироблення внутрішньоклітинної енергії, ріст і диференціація тощо) роблять інозитол привабливою терапевтичною опцією на всіх етапах життя людини – від ембріонального розвитку до глибокої старості. Цей огляд присвячено висвітленню можливих механізмів дії та сучасних доказів щодо ефективності інозитолу (МІ та DХІ) для лікування різних захворювань на різних етапах життя (рис. 2).
Застосування інозитолу в жінок і чоловіків репродуктивного віку
Більшість знайдених у літературі досліджень стосувалися застосування інозитолу (МІ та DХІ) в жінок репродуктивного віку для лікування синдрому полікістозних яєчників (СПКЯ), безпліддя (пов’язаного й не пов’язаного з СПКЯ) та гестаційного діабету (ГД). Зважаючи на ключову роль інсулінорезистентності в патогенезі вказаних станів, паралельно дослідження описували впливи інозитолу на асоційовані порушення: надмір маси тіла, гіперглікемію, дисліпідемію, запалення, артеріальну гіпертензію. Через спадковість і нездоровий спосіб життя поширеність асоційованих з інсулінорезистентністю метаболічних розладів неухильно зростає в цілому світі; описано тенденцію до їх «омолодження» з можливістю виникнення навіть у дітей. У чоловіків репродуктивного віку МІ та DХІ насамперед вивчалися в контексті чоловічого фактора безпліддя.
Визначення, класифікація, причини та патогенез СПКЯ
СПКЯ – це ендокринна хвороба, яка вражає 4-21% жінок репродуктивного віку. Зазвичай СПКЯ діагностують у віці 18-45 років, хоча хвороба може виникати в підлітків і дітей. Через гетерогенність і мінливість симптомів СПКЯ важко діагностувати. Запропоновано різні діагностичні критерії СПКЯ (табл.).
Діагноз СПКЯ встановлюється за наявності вказаного поєднання діагностичних критеріїв і після виключення інших розладів, які можуть проявлятися нерегулярними менструальними циклами та/або надлишком андрогенів, як-от синдром Кушинга, андрогенсекретувальні пухлини, підвищений пролактин або лютеїнізувальний гормон (ЛГ). Варто зазначити, що власне полікістозна морфологія яєчників як така не є обов’язковою умовою для встановлення діагнозу СПКЯ. Ба більше, розрізняють чотири фенотипи СПКЯ, котрі характеризуються різними клінічними особливостями та гормональними змінами.
Опубліковані 2022 року систематичний огляд і метааналіз указують, що загальна поширеність СПКЯ, згідно з Роттердамськими критеріями, в Європі та США становить 19,5% (95% довірчий інтервал 17,3-21,6) без помітної гетерогенності між географічними регіонами. Найчастіше траплявся фенотип А («повний СПКЯ») із середньою поширеністю 44,8%. На другому місці опинився фенотип D (19,5%), який називають «негіперандрогенним СПКЯ»; далі – фенотип C (16,2%), який називають «овуляторним СПКЯ», та фенотип B (14,9%), що проявляється як фенотип А без морфології полікістозних яєчників. Поширеність СПКЯ в європейських країнах і США загалом була подібною, але в США відзначено вищу частоту фенотипу А, проте нижчу – фенотипу С.
Наявність різних фенотипів СПКЯ (A-D) зумовлена багатофакторною природою хвороби з поєднаним впливом генетичних, епігенетичних, метаболічних і гормональних чинників. Установлено специфічні гени, пов’язані з синтезом андрогенів, чутливістю до інсуліну та рецепторами гіпоталамічного гонадотропін-рилізинг-гормону. В умовах надлишку глюкокортикоїдів може асоціюватися з СПКЯ та народженням дітей з малою масою для гестаційного віку, що підвищує ризик серцево-судинних захворювань у дорослому віці; в умовах надлишку андрогенів частіше призводить до ожиріння, цукрового діабету (ЦД) 2-го типу й інсулінорезистентності.
Ендокринний профіль жінок з СПКЯ характеризується підвищеною концентрацією андрогенів яєчників та/або наднирковиків у плазмі крові та вищим рівнем естрогенів, насамперед естрону. Такі зміни пояснюються змінами функції гіпоталамо-гіпофізарно-гонадної або гіпоталамо-гіпофізарно-наднирковозалозної осі. Гормональні порушення на будь-якому рівні можуть призвести до надлишку андрогенів та/або ановуляції.
Інсулінорезистентність і компенсаторна гіперінсулінемія відіграють центральну роль у патогенезі СПКЯ. Крім опосередкованої дії через пригнічення глобуліну, що зв’язує статеві гормони, інсулін безпосередньо стимулює тека-клітини яєчників виробляти більше андрогенів. Як наслідок, виникають передчасна атрезія фолікулів, хронічна ановуляція й дисбаланс гонадотропінів з підвищенням ЛГ, зниженням ФСГ та збільшенням співвідношення ЛГ/ФСГ >2,5. Посилений інсуліном синтез андрогенів яєчниками, ймовірно, посилює чутливість гранульозних клітин до ЛГ та збільшує експресію гена, що кодує андрогеноутворювальний фермент цитохрому P450c17α. Клінічно надмір андрогенів / гіперандрогенія проявляються гірсутизмом, акне й алопецією за жіночим типом. Існує нерозривний зв’язок між високим рівнем андрогенів, ановуляцією та метаболізмом інсуліну в жінок з СПКЯ (рис. 3).
Роль інозитолів у лікуванні СПКЯ
Отже, СПКЯ асоціюється з метаболічними, гормональними та репродуктивними розладами, які можуть виникати навіть у дітей і потребують належного лікування. Зважаючи на природне походження та низьку токсичність, інозитол є привабливою терапевтичною опцією в цій когорті.
Застосування МІ та DХІ в співвідношенні 40:1 забезпечувало найбільший ефект щодо всіх симптомів СПКЯ. Таку комбінацію слід використовувати як терапію першої лінії в пацієнток з СПКЯ та надмірною масою тіла для ефективного зниження метаболічних параметрів і досягнення клінічних результатів. Успіх комбінації зумовлений ефектами обох стереоізомерів: DХІ забезпечує зменшення периферичної гіперінсулінемії; МІ покращує овуляторну функцію. Комбінована терапія знижує ризик метаболічного синдрому, покращує ендокринний профіль і чутливість до інсуліну. Ефективність у поєднанні з доброю переносимістю, незначною кількістю побічних ефектів і низькою токсичністю дає змогу використовувати їх навіть у дітей і вагітних.
ГД: визначення, епідеміологія, механізми, клінічна значущість
Випадки діабету під час вагітності охоплюють ЦД 1-го типу, ЦД 2-го типу або ГД. Вагітність у жінок з діабетом асоціюється з підвищеним ризиком серйозних ускладнень з боку матері та дитини; зокрема, ризик уроджених аномалій, мертвонародження та неонатальної смерті у 2-5 разів вищий, аніж у загальній популяції вагітних. Будь-який тип діабету, діагностований до вагітності, не є ГД; такі випадки позначаються терміном «прегестаційний діабет».
Фактори ризику ГД охоплюють старший вік, етнічну приналежність, надмір маси тіла чи ожиріння (індекс маси тіла (ІМТ) >29 кг/м2), надмірний приріст маси тіла під час вагітності, сімейний анамнез діабету, переддіабет або ГД в анамнезі, СПКЯ, попередні пологи з народженням немовляти з масою тіла ≥4 кг або анамнез смерті чи аномалій плода, багатоплідна вагітність, нездоровий спосіб життя (західний тип дієти, низька фізична активність, куріння) та використання стероїдів. Попередні дослідження підтвердили, що ГД частіше виявляється у вагітних старшого віку, адже з віком знижуються секреторна активність β-клітин і чутливість до інсуліну. Найвагомішим модифікованим чинником ризику ГД є ожиріння: ризик ГД у жінок з морбідним ожирінням уп’ятеро вищий, аніж у жінок з нормальним ІМТ, що пояснюється впливом інсулінорезистентності та порушенням балансу адипокінів. Повідомлялося, що ГД значуще асоціюється з приростом маси тіла під час вагітності; проте вік матері й ІМТ на ранніх термінах вагітності є важливішими факторами ризику ГД, ніж приріст маси тіла під час вагітності.
Зважаючи на низку спільних патогенетичних механізмів між СПКЯ та ГД, не дивно, що жінки з СПКЯ належать до групи ризику незалежно від застосування допоміжних репродуктивних технологій (ДРТ); з іншого боку, ГД є найчастішою проблемою вагітності в жінок з СПКЯ. Крім того, СПКЯ в поєднанні з ГД підвищує ризик індукованої вагітністю гіпертензії у 2,4 раза, прееклампсії – вдвічі. Основними факторами ризику ГД у жінок, яким проводять ДРТ зі штучним заплідненням, є старший вік, ожиріння, багатоплідна вагітність і СПКЯ. Виявлено, що в жінок, які досягли вагітності за допомогою ДРТ, ризик ГД був вищим, аніж у жінок, які вагітніли природним шляхом. Цікаво, що ранній початок менархе (у віці 9-11 років) виявився незалежним фактором ризику виникнення ГД та ЦД 2-го типу. Виявлено кореляцію між віком менархе та рівнем глюкози в плазмі. Шкідливий вплив раннього менархе на подальший метаболічний статус підтверджують результати епідеміологічних досліджень. Значущий вплив на ризик виникнення ГД має нездоровий спосіб життя, включно з особливостями харчування, недостатньою фізичною активністю, шкідливими звичками, екологічними та психосоціальними чинниками. Основні чинники ризику ГД підсумовано на рисунку 4.
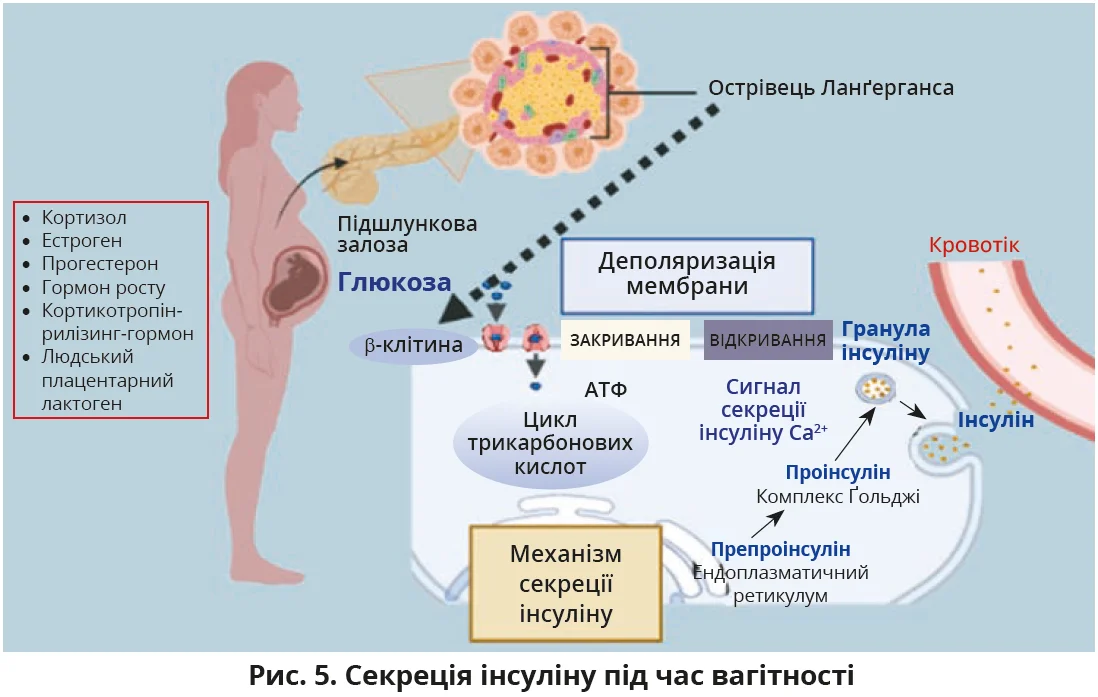
Основну роль у патогенезі ГД відіграє інсулінорезистентність. На ранніх термінах вагітності секреція інсуліну та чутливість до нього тканин посилюються, що дає матері змогу накопичувати жир і глікоген. Гормональні зміни під час вагітності та виділення плацентою речовин з контрінсулярним ефектом (гормон росту, кортикотропін-рилізинг-гормон, кортизол, естроген, прогестерон, людський плацентарний лактоген) знижують чутливість тканин до інсуліну та спричиняють інсулінорезистентність (рис. 5); їх значне посилення спостерігається на 24-28-му тижнях вагітності, досягаючи піку на 32-34-му тижнях вагітності.
До певної міри материнська інсулінорезистентність є фізіологічним явищем, необхідним для достатнього постачання енергії та поживних речовин плоду, що розвивається. Посилення інсулінорезистентності зазвичай компенсується секрецією інсуліну, особливо в третьому триместрі, коли підшлункова залоза виробляє значну кількість інсуліну, надто після їди, – явище, відоме як «гіперплазія β-клітин». Посилення синтезу інсуліну підтримує еуглікемію, але призводить до гіперінсулінемії. Коли функціональна активність β-клітин матері неспроможна подолати посилення інсулінорезистентності, виникає гіперглікемія.
Отже, ГД – це тимчасова форма непереносимості глюкози, спричинена інсулінорезистентністю та дисфункцією β-клітин. Тобто механізми ГД схожі з патогенезом ЦД 2-го типу. Варто вказати, що ГД не лише патогенетично подібний до ЦД 2-го типу, а й має схожі фактори ризику. Впродовж останніх десятиліть поширеність ГД у світі суттєво зросла, як і поширеність ЦД 2-го типу. У жінок з факторами ризику або попереднім ГД відповідь β-клітин недостатня, щоб подолати інсулінорезистентність, притаманну вагітності; метаболічний стрес може прискорити виснаження β-клітин і призвести до ГД.
Дослідження останніх років показують, що потенційними медіаторами інсулінорезистентності є адипокіни, які беруть безпосередню участь у регуляції секреції інсуліну та чутливості до нього печінки, м’язів і жирової тканини; впливають на запалення, накопичення жирової тканини, розподіл жиру, метаболізм глюкози й ліпідів. З’явилося багато доказів щодо дисбалансу адипокінів під час вагітності та їх потенційної ролі в патогенезі ГД.
Список літератури – в редакції.