Експертний висновок щодо скринінгу, діагностики та лікування діабетичної периферичної нейропатії: мультидисциплінарний підхід
Переклала й адаптувала канд. мед. наук Ольга Королюк
Експертний висновок розглядає сучасні знання про концептуальні, клінічні та терапевтичні аспекти діабетичної периферичної нейропатії (ДПН), надаючи практичні настанови для допомоги клініцистам у розпізнаванні, діагностуванні та лікуванні ДПН.
Діабет вважається глобальною пандемією XXI століття. Очікується подальше збільшення поширеності діабету – з 10,5% (536,6 млн) у 2021 р. до 12,2% (783,2 млн) у 2045 р., що неминуче призведе до зростання кількості діабетичних ускладнень. Діабетична нейропатія часто ускладнює діабет обох типів і може виникати на стадії переддіабету.
Нейропатії при діабеті становлять гетерогенну групу розладів, які різняться за патогенезом і клінічними проявами. Їх можна класифікувати як «дифузні або симетричні» нейропатії (дистальна симетрична полінейропатія, вегетативна нейропатія, гостра сенсорна нейропатія) та «фокальні або мультифокальні» нейропатії (полірадикулонейропатія, компресійні синдроми, черепні паралічі й інші мононейропатії). У пацієнтів з діабетом також можливі недіабетичні нейропатії: паралічі внаслідок тиску, гостра ятрогенна больова нейропатія малих волокон і хронічна запальна демієлінізувальна полінейропатія.
Найпоширенішою формою діабетичної нейропатії є дистальна симетрична полінейропатія (далі – ДПН), яка становить близько 75% усіх діабетичних нейропатій і вражає до 50% пацієнтів із цукровим діабетом (ЦД) обох типів і принаймні 10% осіб з переддіабетом. Основною характеристикою ДПН є пошкодження периферичних нервів зі втратою дистальної сенсорної чи моторної функції за типом «рукавичок» або «панчіх», що може супроводжуватися болем. За відсутності лікування ДПН істотно погіршує якість життя через втрату чутливості кінцівок, падіння, підвищений ризик виразок стопи й ампутацій нижніх кінцівок. Окрім того, пацієнти з діабетом і ДПН мають вищий ризик смерті від усіх причин і серцево-судинних захворювань порівняно з пацієнтами без ДПН. Отже, рання діагностика та профілактичні заходи є вкрай важливими.
Єдиного стандарту діагностики ДПН не існує особливо на ранніх стадіях. Лікування ДПН полягає в покращенні контролю глікемії, модифікації способу життя та корекції чинників ризику. Симптоматичне лікування болю при ДПН забезпечує достатнє полегшення лише в третини пацієнтів. Існує нагальна потреба в специфічних методах лікування, здатних модифікувати хворобу, а також стандартизованих інструментах для визначення груп ризику субклінічної нейропатії, механізмів хвороби та відповіді на лікування.
Визначення
ДПН вважається симетричною, залежною від довжини нервів сенсомоторною полінейропатією, спричиненою метаболічними й мікросудинними змінами внаслідок хронічної гіперглікемії та супутніх серцево-судинних чинників ризику. Простіше визначення для клінічної практики: «наявність симптомів та/або ознак нейропатії, яка виникає в осіб з переддіабетом або діабетом після виключення інших причин периферичної нейропатії».
Прогресування ДПН поступове та залежить від стану контролю глікемії. Поширеність ДПН доволі низька впродовж перших 5 років від початку ЦД 1-го типу. Натомість у разі ЦД 2-го типу уповільнення нервової провідності є однією з найбільш ранніх нейропатичних аномалій, що часто виявляється на момент діагностики діабету. Отже, ДПН слід підозрювати в усіх пацієнтів з переддіабетом і ЦД 2-го типу, а також в осіб із ЦД 1-го типу тривалістю понад 5 років.
Патофізіологія
Точна патофізіологія ДПН невідома. Запропоновано роль різних сигнальних каскадів: поліоловий і гексозаміновий шляхи, шляхи кінцевих продуктів глікації, поліаденозиндифосфатрибозополімерази (ПАРП) і протеїнкінази C. Глікозилювання, дисліпідемія, гіпергомоцистеїнемія, артеріальна гіпертензія, активація тромбоцитів, зниження оксиду азоту та надмірне утворення активних форм кисню (АФК) порушують здоров’я ендотелію. Проте основною причиною ДПН є хронічна гіперглікемія, котра призводить до пошкоджень на судинному рівні та вільного пасажу глюкози до нейронів і клітин Шванна, що порушує баланс між пошкодженням і відновленням нервових волокон. Усі запропоновані шляхи патогенезу ДПН активуються при гіперглікемії, прямо чи опосередковано погіршуючи окисно-відновну здатність клітин і збільшуючи утворення вільних кисневих радикалів (супероксидний аніон-радикал, гідроксильний радикал). Накопичення АФК зумовлює неспроможність ендогенної системи антиоксидантного захисту (супероксиддисмутаза, каталаза, глутатіон), що посилює окисний стрес, порушує функцію нервів, спричиняє апоптоз нейронів і гліальних клітин периферичної нервової системи.
Вважається, що причиною ДПН є багатофакторний метаболічний процес, що прогресивно пошкоджує тканини. Гіперглікемія, підвищення сорбітолу, протеїнкінази С та гомоцистеїну, зниження оксиду азоту й надлишок АФК пошкоджують ендотелій і спричиняють реологічні зміни, які збільшують судинний опір і зменшують приплив крові до нервів.
Чинники ризику
Найсильнішим чинником ризику ДПН є діабет, особливо тривалий або з незадовільним контролем глікемії. Симптоми та/або ознаки дистальної симетричної полінейропатії можуть виникати в осіб з переддіабетом; підтверджено зв’язок між переддіабетом і ранніми симптомами ураження малих волокон. Нейропатія сильніше пов’язана з порушенням толерантності до глюкози, ніж із рівнем глікемії натще; адже гіперглікемія після навантаження є ключовим механізмом індукції окисного стресу, дисфункції ендотелію й активації шляхів поліолу та протеїнкінази C, котрі порушують метаболізм нейронів і спричиняють пошкодження ДНК. Інші чинники ризику ДПН підсумовано в таблиці 1. Їх розпізнавання має вирішальне значення для виявлення субклінічної/ранньої ДПН, ефективного контролю хвороби та запобігання ускладненням (виразка, гангрена, ампутація).
Клінічні прояви
Початок ДПН зазвичай непомітний і поступовий, перебіг хронічний, за відсутності лікування – прогресивний. На момент діагностики пацієнти можуть мати «позитивні» (нейропатичний біль, печіння й гостре поколювання, парестезії, гіперестезії) та/або «негативні» симптоми (атактична хода та втрата чутливості (гіпестезія) в різних сенсорних сферах, пов’язаних із функціями різних типів нервових волокон).
Деякі пацієнти не мають симптомів, але детальне неврологічне обстеження виявляє ознаки хвороби. Можливі також рідкісні атипові діабетичні нейропатії з чіткими ознаками та механізмами, а також нейропатії, не пов’язані з діабетом.
Через більшу вразливість до пошкодження довгих аксонів нижніх кінцівок ДПН зазвичай спочатку виникає на стопах з подальшим проксимальним поширенням на верхні кінцівки; в пацієнтів спостерігається нейронна дисфункція у вигляді «панчіх-рукавичок».
Загалом близько 50% пацієнтів не повідомляють про симптоми; у чверті пацієнтів виникає больова форма ДПН, яка часто асоціюється з фізичними та психосоціальними порушеннями, інвалідністю й погіршенням якості життя.
Здебільшого спостерігається «змішана» нейропатія з ушкодженням великих і малих нервових волокон; усі пацієнти з ДПН мають вищий ризик нейропатичних ускладнень: виразки стопи, нейроартропатія Шарко, падіння, переломи.
Недостатня діагностика – погана інформованість лікарів
У клінічній практиці ДПН часто недооцінюють і недостатньо діагностують. Причинами пізньої діагностики ДПН є:
- прихований перебіг хвороби з неспецифічними симптомами й ознаками, що імітують іншу патологію;
- відсутність консенсусу щодо оптимальних процедур скринінгу та діагностики;
- відсутність добре налагодженого діагностичного обстеження;
- погане сприйняття рекомендацій і недостатня обізнаність лікарів.
Оскільки ДПН є діагнозом виключення, її розпізнавання ґрунтується на клінічній підозрі та зусиллях, докладених для її виявлення. Проте лікарі недостатньо обізнані в тому, як розпізнати ДПН, навіть за наявності симптомів. Зокрема, в осіб із ЦД 2-го типу больову й безбольову форми ДПН не діагностують у 60 та 80% випадків відповідно.
Сучасна практика лікування ДПН також не є адекватною, оскільки включає численні візити пацієнта до різних клініцистів, які не мають спеціальної підготовки для оцінювання ризику, консультування або правильного скерування для подальшого обстеження та відповідного втручання.
Отже, підозра хвороби клініцистами є ключовим моментом діагностики ДПН. Робоча група підкреслює важливість обізнаності лікарів первинної ланки, що зменшить кількість непотрібних скерувань до кількох різних спеціалістів для встановлення правильного діагнозу. Покращення обізнаності інших фахівців (терапевтів, неврологів, ендокринологів, реабілітологів) є ключовим аспектом розгляду ДПН у диференційній діагностиці в пацієнтів з підозрою на нейропатичні симптоми.
Обґрунтування скринінгу
Вважається, що ДПН виникає в кожного другого пацієнта з діабетом на певному етапі життя, що підкреслює користь скринінгу для ранньої діагностики. Дані опитувань MONICA/KORA Augsburg із Німеччини показали різну поширеність ДПН і больової ДПН у спектрі порушень регуляції обміну глюкози: 28 і 13% відповідно в осіб зі встановленим діабетом; 13 і 9% в осіб з порушенням толерантності глюкози; 11 і 4% в осіб з порушення глікемії натще; 7 і 1% в осіб з нормальною толерантністю глюкози.
За даними багатоцентрового дослідження, проведеного в Туреччині, поширеність ДПН на підставі лише клінічного обстеження становила 40,4%, сягаючи 62,2% за використання досліджень нервової провідності; поширеність болю становила 14,0%. В іншому дослідженні за участю 100 осіб з нещодавно виявленим переддіабетом мікросудинні ускладнення мали 12% учасників (4% – нейропатію, 8% – нефропатію), макросудинні – 19%.
Відповідно, ранній скринінг ДПН в осіб з діабетом і переддіабетом цілком виправданий. Важливим є також подальше спостереження, оскільки поява симптомів та/або ознак часто спостерігається на пізніх стадіях ДПН, нівелюючи користь від багатофакторного втручання на ранніх стадіях хвороби.
Нещодавно оновлений «Стандарт медичної допомоги при діабеті» Американської діабетичної асоціації (ADA, 2024) щодо скринінгу нейропатії стверджує, що пацієнтів із ЦД 2-го типу на момент установлення діагнозу та пацієнтів із ЦД 1-го типу через 5 років після встановлення діагнозу слід перевірити на ДПН шляхом ретельного збору анамнезу й об’єктивного обстеження (сенсорна оцінка й обстеження стопи) з подальшим щорічним оцінюванням. Зважаючи на те що різні ускладнення діабету взаємопов’язані, при виявленні в паціє та певного ускладнення варто провести скринінг інших ускладнень.
Запропонований алгоритм скринінгу та діагностики
Діагноз ДПН підтверджується, коли анамнез хвороби та базове неврологічне обстеження (прості напівкількісні інструменти біля ліжка й огляд стоп) виявляють відповідні нейропатичні симптоми та/або ознаки за відсутності інших потенційних причин дистальної симетричної периферичної нейропатії. Тож у більшості випадків діагноз ДПН установлюють шляхом виключення інших потенційних причин: алкоголь, дефіцит нутрієнтів (вітамінів В1, В6, В12, Е, фолату, міді, фосфату), гіпо- або гіпертиреоз, автоімунні хвороби, множинна мієлома, хронічні хвороби печінки або нирок, інфекції (ВІЛ/СНІД, хвороба Лайма), хіміотерапія та вплив токсинів. Для цього потрібні ретельний збір анамнезу та скринінгові лабораторні тести: загальний аналіз крові, повний метаболічний профіль, уміст глюкози в крові натще, рівні тиреотропного гормону та вітаміну В12, електрофорез сироваткових білків з імунофіксацією.
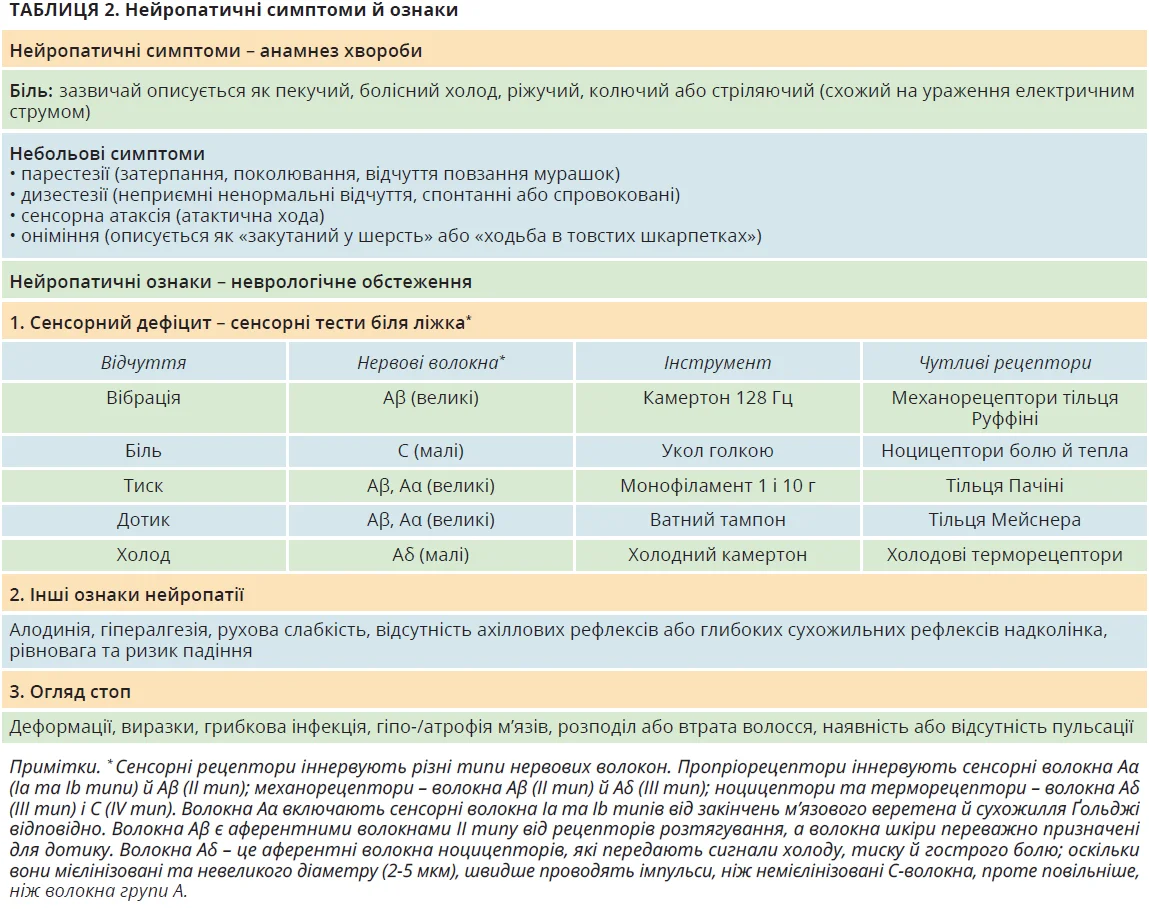
Нейропатичні симптоми включають біль і низку небольових симптомів (табл. 2; рис. 1). Нейропатичні ознаки виявляють під час неврологічного обстеження, котре включає сенсорні тести й огляд стопи: а) сенсорний дефіцит великих нервових волокон (тест із камертоном 128 Гц для відчуття вібрації, тест із монофіламентом 1 і 10 г для відчуття тиску, тест із ватою для відчуття легкого дотику); б) сенсорний дефіцит малих нервових волокон (оцінка відчуття болю й уколу шпилькою, оцінка відчуття холоду за допомогою холодного камертона); в) алодинія – біль, зумовлений зазвичай небольовими подразниками: контакт шкарпеток, взуття або постільної білизни; г) гіпералгезія – надмірна реакція на больові подразники; ґ) рухова слабкість (розгинання великого пальця стопи, тильне згинання стопи, ходьба на п’ятках); д) відсутність рефлексів (визначення сухожильних рефлексів); е) тести на рівновагу та ризик падіння (тест Ромберга, нормальна й тандемна хода); є) огляд стоп на наявність деформацій, виразок, грибкової інфекції, атрофії м’язів, розподілу або втрати волосся, оцінювання пульсації (табл. 2; рис. 1).
При ДПН пошкодження малих і великих нервових волокон найчастіше співіснують. Тому перевірка їхньої функції за допомогою відповідних напівкількісних тестів однаково важлива. При больовій формі ДПН інтенсивність болю оцінюється за допомогою числової рейтингової шкали (NRS) або візуальної аналогової шкали. Зазвичай біль посилюється вночі, перешкоджає повсякденній діяльності, погіршує сон та якість життя.
За визначенням ADA, для клінічної діагностики нейропатії не потрібні аномальні результати електродіагностичних тестів. Низка досліджень указує, що електродіагностичні тести рідко змінюють етіологію та/або лікування пацієнтів, які відповідають клінічному визначенню ДПН.
Однак, обстежуючи пацієнта з діабетом та ознаками/симптомами нейропатії, важливо пам’ятати, що причиною вказаних проявів може бути не лише ДПН, а й рідкісні діабетичні нейропатії або нейропатії іншої етіології. Отже, детальне неврологічне обстеження зазвичай не потрібне для клінічної діагностики, але використовується в клінічних дослідженнях і є корисним для діагностики в пацієнтів з атиповими проявами. Детальне дослідження включає тести на ушкодження великих і малих нервових волокон: електродіагностичні тести (тести нервової провідності, електроміографія) та визначення щільності внутрішньоепідермального нервового волокна відповідно (рис. 1).
Атипові прояви мають спонукати лікаря розглянути недіабетичні причини нейропатії та скерувати пацієнта на детальне неврологічне обстеження в таких випадках: 1) асиметрія та швидке прогресування симптомів; 2) переважання рухової слабкості над втратою чутливості; 3) мононейропатія або ураження черепних нервів; 4) прогресування нейропатії, незважаючи на оптимальний контроль глікемії; 5) симптоми з боку верхніх кінцівок; 6) сімейний анамнез недіабетичної нейропатії; 7) сильні больові симптоми в стопах за нормальних результатів клінічного обстеження; 8) неможливість установлення діагнозу ДПН після клінічного обстеження (рис. 1).
Експертна група припускає, що ДПН слід розглядати в пацієнта з переддіабетом або діабетом за наявності чинників ризику ДПН (табл. 1) і білатеральних, симетричних симптомів та/або ознак нейропатії (табл. 2), ретельно розглядаючи результати лабораторних досліджень для виключення інших причин дистальної симетричної периферичної нейропатії; в атипових випадках – скерувати пацієнта на детальне неврологічне обстеження для підтвердження дисфункції малих або великих нервових волокон. Алгоритм скринінгу та діагностики ілюструє рисунок 1.
Скринінгові тести та можливі труднощі в клінічній практиці
Наразі в клінічній практиці не існує єдиного золотого стандарту для об’єктивного оцінювання та раннього виявлення ДПН. Однак існують значні відмінності між лікарями в оцінюванні й інтерпретації симптомів/ознак нейропатії.
Сенсорні тести залежать від виконавця та зазвичай діагностують ДПН, але їх складно проводити лікарям загальної практики або в завантажених діабетичних клініках через часові обмеження. ADA рекомендує виконувати тести на укол і температуру для виявлення дисфункції малих волокон, визначати рефлекси нижніх кінцівок, оцінювати відчуття вібрації з камертоном 128 Гц для виявлення дисфункції великих волокон. Експертна група також заохочує використання вказаних тестів (рис. 1).
Оскільки ранній стадії ДПН притаманна клініко-електрофізіологічна дисоціація, часто трапляються пацієнти з діабетом і нормальними клінічними, але аномальними електрофізіологічними характеристиками (субклінічна нейропатія) або з аномальними клінічними, але нормальними електрофізіологічними ознаками (рання ДПН, клінічно встановлена ДПН).
Хоча визначення ADA не вимагає електродіагностичного тестування для клінічної діагностики нейропатії, дослідження нервової провідності часто потрібні для підтвердження діагнозу та встановлення тяжкості ДПН. Іншим вагомим клінічним моментом є те, що наявність діабету в пацієнта з нейропатією не доводить, що діабет є причиною полінейропатії, оскільки у 2% пацієнтів із ЦД 1-го типу та 6% пацієнтів із ЦД 2-го типу можлива інша етіологія нейропатії. Крім того, дослідження нервової провідності є предикторами виразок стопи та смертності.
ДПН є найсильнішим чинником ризику виразок стопи й ампутацій кінцівок, які призводять до втрати працездатності й асоціюються з дуже високими індивідуальними та соціальними витратами. Оскільки ДПН залежна від довжини нервів і виникає внаслідок дисфункції сенсорної системи, дослідження провідності дорзального литкового та медіального підошовного нервів є набагато чутливішими, ніж дослідження провідності литкових нервів, які зазвичай використовуються в електрофізіологічному обстеженні. Нещодавно показано, що аномалія інтервалу RR при електрофізіологічному дослідженні дає змогу діагностувати серцеву вегетативну нейропатію на ранній стадії.
Тести нервової провідності й електроміографія забезпечують вищу чутливість оцінювання периферичних симетричних поліневропатій та їх прогресування, ніж клінічні обстеження. Проте це трудомістке та дороге дослідження, що обмежує його застосування в клінічній практиці. Для діагностики периферичної нейропатії також використовується біопсія шкіри, яка дає змогу оцінити щільність інтраепідермальних нервових волокон; у клінічних умовах це дослідження непрактичне для моніторингу прогресування симптомів або оцінювання ефективності лікування.
Для діагностики субклінічної нейропатії розроблено швидкі неінвазивні тести – пристрої для пунктів догляду (point-of-care devices), які включають конфокальну мікроскопію рогівки для оцінювання нейропатії малих волокон і прогресування до нейропатії великих волокон; SUDOSCAN для оцінювання судомоторної функції; кількісне сенсорне тестування NeuroQuick і NeuroPAD.
Доступні на сьогодні дані свідчать, що такі пристрої відповідають критеріям ідеального скринінгового тесту (безпечний, швидкий і досить простий для об’єктивного оцінювання). Проте вартість для масового скринінгу пацієнтів з діабетом і зручність їх застосування в завантажених діабетичних клініках потребують ретельної оцінки.
Для скринінгу та градації тяжкості ДПН запропоновано також низку клінічних шкал, які поєднують оцінювання симптомів з оцінюванням клінічних ознак, зокрема Мічиганський інструмент скринінгу нейропатії (MNSI), Торонтська клінічна оцінка нейропатії (TCNS), скринінговий тест Сполученого Королівства (UKST), оцінка ранньої нейропатії штату Юта (UENS) та оцінка нейропатичних порушень для нижніх кінцівок (NIS-LL). Оцінювання за шкалами є доволі суб’єктивним, значною мірою залежить від інтерпретації, а їхня валідність сумнівна. Проте шкали вважаються корисними для епідеміологічних досліджень, які вивчають поширеність ДПН у популяції.
Для покращення клінічних результатів за ДПН існує нагальна потреба діагностувати ДПН на ранній стадії до появи явних клінічних ознак і точно оцінити прогресування хвороби, щоб ефективно знизити захворюваність та інформувати пацієнтів про ризик виразок стопи. Отже, потрібні швидкі чутливі та специфічні тести, які не потребуватимуть спеціальної підготовки, але забезпечуватимуть надійний, чутливий та економічно ефективний метод скринінгу ДПН.
Резюме щодо скринінгових тестів у разі ДПН
- У рутинній клінічній практиці не існує золотого стандарту або спеціальних простих маркерів для раннього виявлення ДПН.
- Сенсорні тести залежать від виконавця та зазвичай діагностують явні стадії ДПН; їх складно виконувати лікарям загальної практики та в завантажених діабетичних клініках через брак часу.
- Часто в пацієнтів з діабетом виявляють нормальні клінічні, але аномальні електрофізіологічні характеристики (субклінічна нейропатія) або аномальні клінічні, але нормальні електрофізіологічні ознаки (рання ДПН, клінічно встановлена ДПН).
- Тести нервової провідності й електроміографія є найменш варіабельними неінвазивними методами оцінювання нейропатії та її прогресування, але вони трудомісткі, тривалі, дорогі, непрактичні для застосування в клінічній практиці та непридатні для оцінки ураження малих волокон.
- Для діагностики периферичної нейропатії використовується біопсія шкіри, яка оцінює щільність інтраепідермальних нервових волокон; але цей метод непрактичний для моніторингу прогресування симптомів або оцінювання ефективності лікування в клінічних умовах.
- Швидкими неінвазивними тестами для діагностики субклінічної нейропатії є пристрої для пунктів догляду: конфокальна мікроскопія рогівки (оцінювання нейропатії малих волокон і прогресування до нейропатії великих волокон), SUDOSCAN (оцінювання судомоторної функції) та кількісне сенсорне тестування. Проте варто ретельно оцінити вартість масового скринінгу пацієнтів з діабетом і зручність їх використання в завантажених діабетичних клініках.
- Клінічні шкали є стандартизованими об’єктивними кількісними показниками для скринінгу й визначення тяжкості ДПН, але отримані результати доволі суб’єктивні та залежні від інтерпретації; валідність шкал сумнівна.
- Для ефективного зниження захворюваності існує нагальна потреба в простих, швидких, чутливих і специфічних тестах для ранньої діагностики ДПН до появи явних клінічних ознак і точної оцінки прогресування хвороби.
Лікування ДПН
Найкраще ведення ДПН може забезпечити мультидисциплінарна команда за участю ендокринолога, терапевта, невролога, офтальмолога, нефролога, дієтолога, медсестри, навченої догляду за пацієнтами з діабетом, фахівців із фізіотерапії, реабілітації, фізичних вправ, ортопеда та психолога.
Втручання І лінії для ДПН наразі включає оптимізацію контролю глікемії при ЦД 1-го типу та багатофакторне втручання при ЦД 2-го типу; оптимізацію способу життя й контроль маси тіла. Існує потреба в персоналізованому підході до ведення ДПН, який, окрім оптимального лікування діабету, має включати цілеспрямовані втручання залежно від супутніх захворювань і механізмів основного захворювання, що є специфічними для кожного пацієнта. Загалом ведення ДПН ґрунтується на трьох принципах:
1) оптимальне лікування діабету шляхом інтенсивного контролю глікемії, модифікації способу життя та впливу на чинники ризику;
2) патогенетично орієнтована фармакотерапія;
3) симптоматичне знеболення.
Оптимальне лікування діабету
Інтенсивний контроль глікемії
Гіперглікемія є основним патофізіологічним чинником ДПН. Тому контроль глікемії на ранніх стадіях хвороби вважається найефективнішим профілактичним заходом, здатним відтермінувати ДПН.
Результати масштабних досліджень (Steno-2, ADVANCE, ACCORD, VADT) і метааналізів продемонстрували, що суворий контроль глікемії уповільнює прогресування ДПН в осіб із ЦД 1-го типу (зниження відносного ризику (ВР) на 78%), але його вплив у разі ЦД 2-го типу незначний (зниження ВР на 5-9%), що можна пояснити незалежним впливом компонентів метаболічного синдрому. Проте більшість указаних досліджень спиралися на нечутливі методи оцінювання нейропатії, оскільки ДПН не була їхнім основним результатом. Дослідження з використанням чутливіших клінічних кінцевих точок (конфокальна мікроскопія рогівки) показали переваги суворого контролю глікемії (HbA1c <6,5%) в осіб із ЦД 2-го типу.
Дослідження BARI 2D продемонструвало значно нижчу кумулятивну захворюваність на ДПН у разі застосування інсулін-сенситайзерів (метформін, тіазолідиндіони), а не секретогенів (препарати сульфонілсечовини й інсуліну). Отже, хоча контроль глікемії є основним підходом до запобігання та лікування пов’язаних з діабетом ускладнень, ступінь запобігання або відтермінування ДПН унаслідок контролю глікемії залежить від вибору протидіабетичних засобів, типу діабету, тривалості хвороби, варіабельності рівня глюкози та коливань глікемії.
Модифікація способу життя та багатокомпонентний вплив на чинники ризику
Найкращим способом контролю чинників ризику, запобігання появі та прогресуванню ДПН є багатофакторні стратегії зниження ризику, які передбачають здоровий спосіб життя: збалансована дієта з обмеженням калорій і низьким умістом жиру або середземноморська дієта; регулярні аеробні фізичні навантаження для контролю маси тіла.
Рандомізоване контрольоване дослідження (РКД) у пацієнтів з ДПН показало, що 12-тижневий курс фізичних вправ і зміна способу життя асоціюються зі значним зниженням тяжкості ДПН. Інше РКД продемонструвало значне покращення маркерів ДПН (щільність внутрішньоепітеліальних нервових волокон і регенеративна здатність) під впливом дієти та фізичних впав на біговій доріжці впродовж 2,5 годин щотижня.
Імовірно, патогенез ДПН у разі ЦД 1-го та 2-го типів відрізняється. При ЦД 2-го типу ДПН слід лікувати в контексті метаболічного синдрому. Декілька великих інтервенційних досліджень, націлених на численні фактори ризику (UKPDS, Steno-2, ADDITION), не продемонстрували зниження ДПН, незважаючи на очевидні переваги щодо ускладнень з боку нирок і сітківки, що знову підкреслює важливість використання чутливих, надійних методів для діагностики та кількісної оцінки ДПН.
Два дослідження вказують, що інгібітори ангіотензинперетворювального ферменту здатні покращити клінічний перебіг ДПН і параметри нервової провідності. Дані щодо впливу лікування дисліпідемії на ДПН суперечливі. Деякі дослідження показали, що лікування статинами або фібратами асоціювалося зі зниженням ризику виникнення ДПН, тоді як інші вказують на відсутність зв’язку терапії статинами зі зниженням ризику ДПН або навіть на збільшення поширеності ДПН серед пацієнтів, котрі вживають статини, порівняно з тими, хто їх не використовує. Зв’язок терапії статинами із симптомами ДПН у хворих на діабет залишається суперечливим, зважаючи на те що їх призначають особам з дуже високим ризиком ДПН.
Патогенетично орієнтована фармакотерапія
В ідеалі втручання має бути спрямованим на усунення основних патогенетичних механізмів і зміну природної траєкторії хвороби. На основні патогенні шляхи ДПН впливає низка сполук. Зокрема, інгібітори альдозоредуктази (сорбініл, толрестат, поналрестат, фідарестат, епалрестат, зенарестат) діють на поліоловий шлях; інгібітори протеїнкінази С (рубоксиастаурин) і бенфотіамін впливають на гексозаміновий шлях; міноциклін, аміногуанідин діють на шлях кінцевих продуктів глікації; актовегін є інгібітором ПАРП; альфа-ліпоєва кислота (АЛК), коензим Q10, нікотинамід, ресвератрол і таурин пригнічують утворення АФК.
АЛК займає особливе місце в сучасній парадигмі лікування ДПН і ліцензована як препарат для лікування ДПН у багатьох країнах. Унікальні та широкі антиоксидантні ефекти АЛК добре досліджені в Німеччині, Східній Європі, на Далекому Сході.
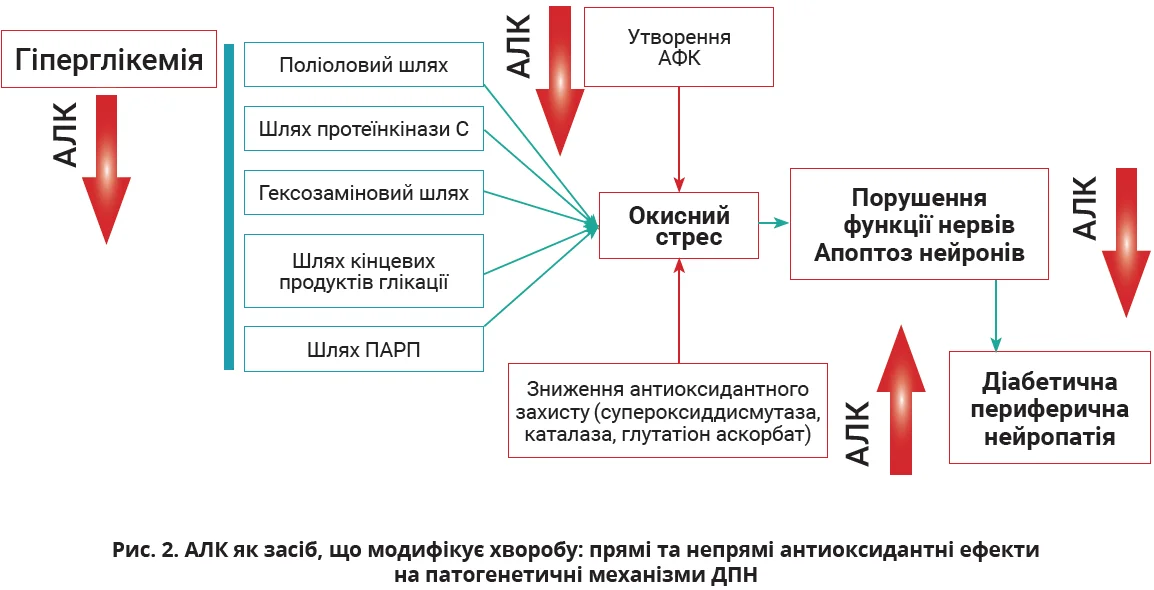
АЛК як патогенетичний засіб лікування ДПН, що модифікує хворобу
Кожен патогенетичний шлях ДПН здатний посилювати клітинний окисний стрес, зумовлений утворенням АФК та зниженням антиоксидантного захисту, що робить антиоксидантну дію важливою терапевтичною мішенню. Завдяки здатності запобігати виникненню та прогресуванню ДПН шляхом прямого й непрямого антиоксидантного впливів АЛК вважається перспективним засобом І лінії терапії ДПН, що модифікує хворобу, тобто сприяє помітному клінічному покращенню (рис. 2). Крім того, АЛК зменшує індукований гіпергомоцистеїнемією стрес ендоплазматичного ретикулуму й окислення в ендотеліальних клітинах аорти людини та здатна знижувати рівень гомоцистеїну.
У дослідженні ALADIN II застосування АЛК впродовж 2 років спочатку внутрішньовенно (в/в), потім перорально асоціювалося з покращенням швидкості рухової та сенсорної провідності й полегшенням симптомів ДПН.
У дослідженні SYDNEY 2 пероральне лікування AЛК у дозі 600 мг 1 раз на день протягом 5 тижнів покращувало симптоми (колючий або пекучий біль, парестезії й оніміння стоп уві сні), дефіцит за шкалами NSC і NIS, забезпечуючи оптимальне співвідношення ризику та користі.
У метааналізі трьох РКД за участю пацієнтів із симптоматичною ДПН показано, що 600 мг АЛК перорально або в/в значно зменшують симптоми нейропатії. Інший метааналіз чотирьох РКД (ALADIN I, ALADIN III, SYDNEY, NATHAN I; 1258 пацієнтів) продемонстрував, що лікування AЛК протягом 3 тижнів значно покращувало загальну оцінку симптомів за шкалами TSS (відносна різниця порівняно з плацебо (ВРПП) 24,1% зі значним впливом на біль, печіння й оніміння) та NIS-LL (ВРПП 16,0% зі значним впливом на гомілковостопні рефлекси, відчуття уколу шпилькою та дотику). У метааналізі 19 РКД за участю 1242 пацієнтів із ДПН ефективність пероральної АЛК (600, 1200 і 1800 мг на добу) оцінювали за шкалами TSS, NDS, NIS, NIS-LL, VPT і NCS. Лікування AЛК асоціювалося зі сприятливими результатами лише за шкалами TSS і NDS. У невеликій групі з 20 пацієнтів AЛК зменшила нічний біль, парестезію, атрофію м’язів і труднощі при ходьбі.
У дослідженні NATHAN 1 після 4 років лікування АЛК пацієнтів з легкою-помірною, переважно безсимптомною ДПН зменшився нейропатичний дефіцит. Аналіз post hoc цього дослідження показав, що лікування AЛК асоціювалося з кращим результатом за шкалою NIS-LL порівняно з плацебо.
Підтверджено ефективність АЛК у полегшенні симптомів у літніх пацієнтів із серцево-судинними хворобами в анамнезі, які отримували інсулін, мали добре контрольовану масу тіла й артеріальний тиск, а також у пацієнтів з рівнями HbA1c ≥7% і тяжчими стадіями нейропатії. Експерти робочої групи вважають, що поганий контроль глікемії призводить до вищої частоти та гіршого прогнозу макро-й мікросудинних ускладнень. Без досягнення глікемічного контролю неможливо запобігти ускладненням або сповільнити їх прогресування в будь-якого пацієнта. Доки зберігається глюколіпотоксичність, жоден із засобів, що використовуються для лікування нейропатії, не здатний запобігти ускладненням.
У метааналізі 9 досліджень ДПН пероральне лікування АЛК порівняно з плацебо сприяло зниженню NIS (слабкість м’язів, втрата рефлексів, тиск дотику, вібрація, положення й рухливість суглобів), NIS-LL (моторна функція нервів і рефлекси) та NDS (пошкодження черепних нервів, сила м’язів, втрата рефлексів і чутливості). Тож пероральне застосування АЛК вважається сприятливим варіантом лікування ДПН завдяки ефективності (полегшення болю, зменшення розладів моторики та пошкодження нервів) і відмінному профілю безпеки. У когорті 443 пацієнтів з діабетом і хронічною больовою нейропатією, які отримували АЛК у дозі 600 мг 1 раз на день перорально впродовж 5 років, довгострокова терапія виявилася безпечним та ефективним варіантом амбулаторного лікування ДПН. Важливо, що припинення прийому АЛК після 5 років лікування призводило до рецидиву симптомів через 2 тижні, а перехід на центральні аналгетики (габапентин) асоціювався зі значною кількістю побічних ефектів, збільшенням частоти амбулаторних візитів і вищими щоденними витратами на лікування.
Отже, лікування ДПН має бути тривалим, навіть у періоди відсутності симптомів, із застосуванням засобів, які впливають на патогенез, зокрема АЛК. Встановлено також, що пацієнти з діабетом мають знижений рівень циркулювальної АЛК; це додатково підкреслює сприятливий вплив АЛК.
Метааналіз 24 РКД за участю пацієнтів з метаболічними розладами виявив, що АЛК покращує гомеостаз глюкози (зниження глікемії натще, інсуліну, індексу HOMA-IR і HbA1c) та ліпідний профіль (зниження тригліцеридів, загального холестерину та холестерину ЛПНЩ). Потенційні механізми сприятливого впливу АЛК на гомеостаз глюкози включають посилення поглинання глюкози периферичними тканинами (м’язами), стимуляцію транслокації транспортерів глюкози до плазматичної мембрани та підвищення фосфорилювання тирозину субстрату-1 рецептора інсуліну.
У пацієнтів із ЦД 2-го типу та нейропатичним болем сприятливі впливи АЛК посилюються в разі поєднання з традиційною терапією діабету: гліклазид, інгібітор натрієзалежного котранспортера глюкози 2-го типу, метформін і аналоги глюкагоноподібного пептиду-1.
Резюме щодо АЛК як антиоксидантної патогенетичної терапії ДПН
- АЛК – терапія ДПН І лінії, що модифікує хворобу; пряма антиоксидантна дія спрямована безпосередньо на АФК; непрямий антиоксидантний ефект полягає в покращенні ендогенного антиоксидантного захисту.
- Ефективність АЛК при ДПН підтверджена багатьма клінічними випробуваннями, реальними дослідженнями та метааналізами. Спостерігалося покращення моторної та сенсорної провідності нервів і полегшення симптомів нейропатії (колючий і пекучий біль, парестезія, оніміння стоп уві сні).
- Лікування АЛК асоціювалося зі зниженням NIS (слабкість м’язів, втрата рефлексів, тиск, дотик, вібрація, положення й рухливість суглобів), NIS-LL (функція рухових нервів і рефлекси) та NDS (пошкодження черепних нервів, сила м’язів, втрата рефлексів і чутливості).
- Тривала терапія АЛК вважається безпечним та ефективним варіантом лікування пацієнтів з ДПН.
- Через 2 тижні після припинення лікування в пацієнтів, котрі приймали АЛК впродовж 5 років, спостерігався рецидив симптомів; у разі переходу від тривалого лікування АЛК до центральних аналгетиків (габапентин) відзначалися значно більше побічних ефектів, частіші амбулаторні відвідування та вищі щоденні витрати на лікування. Отже, лікування ДПН має бути тривалим, навіть за відсутності симптомів, із застосуванням засобів з патогенетичним впливом, зокрема АЛК.
- Імовірно, АЛК покращує гомеостаз глюкози та ліпідний профіль. У пацієнтів з нейропатичним болем вплив АЛК на ДПН кращий за умови поєднання АЛК із традиційним лікуванням ЦД 2-го типу.
Симптоматичне лікування больової форми діабетичної симетричної полінейропатії
Медикаментозне лікування
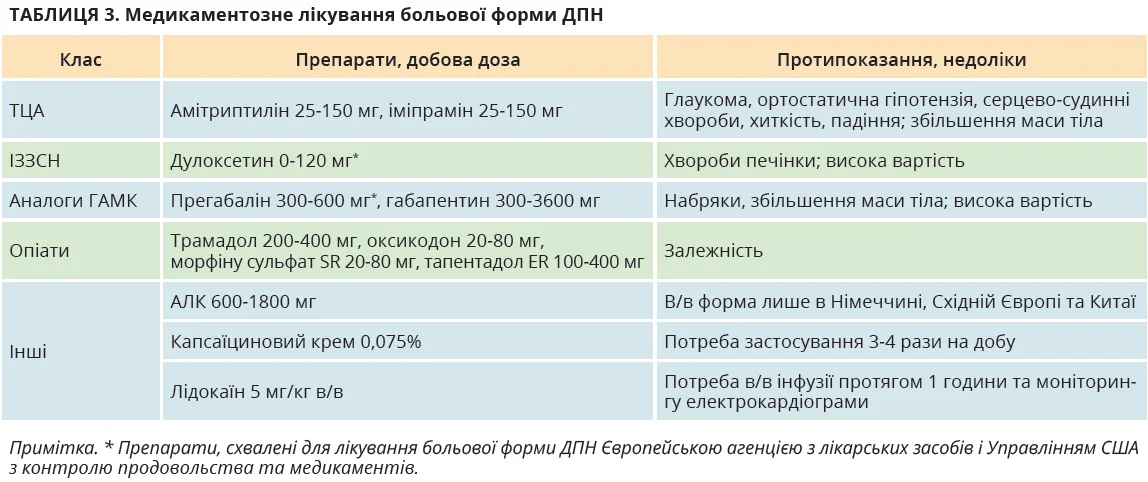
До препаратів І лінії фармакотерапії больової форми ДПН відносять інгібітори зворотного захоплення серотоніну-норадреналіну (ІЗЗСН) дулоксетин і венлафаксин; трициклічні антидепресанти (ТЦА) амітриптилін та іміпрамін; аналоги гамма-аміномасляної кислоти (ГАМК) габапентин і прегабалін. Як лікування ІІ-ІІІ лінії рекомендовано комбіновану терапію (антидепресант у поєднанні з габапентином), місцеві засоби й опіоїди. Нещодавно в Японії, Кореї, Тайвані та Китаї для лікування ДПН схвалено мірогабалін – третій член групи габапентиноїдів з чіткими характеристиками зв’язування з потенціалозалежними кальцієвими каналами.
Антиоксидант АЛК також ефективно полегшує нейропатичний біль і зменшує використання рятівних ліків (прегабаліну, дулоксетину, тапедантолу). У ретроспективному аналізі національної бази даних Угорщини порівняння когорт пацієнтів з ДПН, котрі отримували АЛК або симптоматичну знеболювальну фармакотерапію, виявило нижчу частоту серцево-судинних і цереброваскулярних захворювань (гострий інфаркт міокарда, інсульт і госпіталізація внаслідок серцевої недостатності), випадків раку та смертність від усіх причин у групі АЛК; істотних змін щодо ризику ампутації нижніх кінцівок не спостерігалося. Тривалість лікування була значно більшою в групі АЛК порівняно із симптоматичною фармакотерапією.
При виборі засобу для лікування больової форми ДПН окрім потенційної ефективності препарату варто враховувати низку інших чинників: супутні хвороби, потенційні побічні ефекти ліків, лікарські взаємодії та вартість. Препарати для лікування больової форми ДПН узагальнено в таблиці 3.
Відповідь на монотерапію досягається лише в 50% пацієнтів. За відсутності ефекту від терапії І лінії, незважаючи на ретельне титрування дози та достатню тривалість застосування, призначають другий препарат І лінії або комбіновану фармакотерапію.
Нефармакологічні підходи
Попри відносно низький рівень доказів, запропоновано низку нефармакологічних методів лікування ДПН: психологічна підтримка (зниження стресу, когнітивно-поведінкова терапія), акупунктура, черезшкірна електрична стимуляція нервів, лазерна терапія низької інтенсивності; в тяжких резистентних випадках – електрична стимуляція спинного мозку та високочастотна повторна транскраніальна магнітна стимуляція моторної кори.
Добавки вітамінів
Пацієнти з діабетом, які постійно приймають метформін або інгібітори протонної помпи, мають підвищений ризик дефіциту вітаміну В12, що потребує щорічного оцінювання статусу вітаміну В12.
За результатами масштабного дослідження DPPOS (Diabetes Prevention Program Outcomes Study) статус вітаміну B12 в осіб із ЦД 2-го типу включає такі категорії: низький <200 пг/мл; граничний – 200-300 пг/мл; нормальний >300 пг/мл.
Є повідомлення, що добавки вітаміну В12 здатні покращити якість життя, нейрофізіологічні параметри, судомоторні функції та зменшити інтенсивність болю в пацієнтів з ДПН і дефіцитом вітаміну В12. Проте надмірне вживання вітаміну B6 (піридоксину) в складі комбінованих таблеток вітамінів групи B (В1, В6, В12) може спричинити необоротну нейротоксичність.
Дефіцит вітаміну B12 залежить від дози та часу застосування метформіну. Проте, за даними метааналізу, використання метформіну не корелювало з високою частотою нейропатії. У дослідженні тривалістю 9 років оцінювали взаємодію між дефіцитом вітаміну В12, ДПН та експозицією метформіну в пацієнтів з діабетом; люди з дефіцитом вітаміну В12 мали вищий ризик ДПН, аніж особи без дефіциту, а люди з ДПН мали вищий ризик виникнення дефіциту вітаміну В12, аніж особи без ДПН. Метформін значно підвищував ризик розвитку ДПН у пацієнтів з дефіцитом вітаміну В12. Натомість лікування метформіном в осіб з попередньо встановленою ДПН не підвищувало, а радше знижувало ризик дефіциту вітаміну В12.
Отже, щоб з’ясувати складний зв’язок між терапією метформіном, дефіцитом вітаміну В12 і появою ДПН у пацієнтів із ЦД 2-го типу, потрібні подальші дослідження.
Резюме щодо варіантів лікування та майбутніх перспектив
- Втручання І лінії для ДПН наразі полягає в оптимізації контролю глікемії при ЦД 1-го типу та багатофакторному втручанні при ЦД 2-го типу в поєднанні з оптимізацією способу життя й контролем маси тіла.
- Окрім оптимального лікування діабету, існує потреба персоналізованого підходу до лікування, що ґрунтується на механізмах ДПН і включає цільові втручання залежно від супутніх чинників ризику та механізмів основної хвороби, специфічних для кожного пацієнта.
- AЛК – ефективна антиоксидантна терапія І лінії для тривалого лікування ДПН, що модифікує хворобу.
- Досі існує потреба в добре спланованих, надійних, багатоцентрових клінічних дослідженнях із чутливими кінцевими точками та стандартизованими протоколами для полегшення діагностики ДПН за допомогою простого ефективного алгоритму, відстеження перебігу хвороби й відповіді на лікування.
- Ідентифікація нових чинників ризику та прогностичних біомаркерів сприятиме індивідуалізації лікування з погляду потенційної модифікації хвороби, можливості розроблення нових ефективних методів лікування на ранніх стадіях ДПН, здатних змінити природний перебіг хвороби.
Висновки
Ключовим фактором діагностики ДПН є клінічна підозра, що потребує кращої обізнаності лікарів, насамперед фахівців первинної ланки. Запропонований скринінговий і діагностичний алгоритми включають: розгляд клінічної ДПН у пацієнтів з переддіабетом або діабетом, які мають чинники ризику ДПН, симптоми та/або ознаки нейропатії; ретельне лабораторне тестування для виключення інших причин дистальної симетричної периферичної нейропатії; скерування на детальне неврологічне обстеження в атипових випадках. Досліджень у галузі ДПН досі недостатньо. Наразі втручання І лінії передбачають оптимізацію глікемічного контролю при ЦД 1-го типу та багатофакторне втручання при ЦД 2-го типу, модифікацію способу життя й контроль маси тіла. Існує також потреба індивідуального підходу, спрямованого на патогенез і супутні хвороби. Із цього погляду АЛК є важливим засобом терапії І лінії, що модифікує хворобу та впливає на патогенез завдяки прямій і непрямій антиоксидантній дії. Ідентифікація біомаркерів / прогностичних чинників відкриє можливості пошуку нових методів лікування, що будуть ефективними на ранніх стадіях ДПН і змінять її природний перебіг.
Література
Atmaca A., Ketenci A., Sahin I., Sengun I.S., Oner R.I., Erdem Tilki H., Adas M., Soyleli H., Demir T. Expert opinion on screening, diagnosis and management of diabetic peripheral neuropathy: a multidisciplinary approach. Front. Endocrinol. (Lausanne). 2024 Jun 17; 15: 1380929. doi: 10.3389/fendo.2024.1380929.