Двоспрямований зв’язок синдрому обструктивного апное уві сні та серцево-судинних розладів у разі діабету
Переклала й адаптувала канд. біол. наук Олександра Демецька
Обструктивне апное уві сні (OАС) і цукровий діабет (ЦД) зазвичай співіснують у замкненому колі, що погіршує захворюваність і тяжкість обох станів. У поєднанні з діабетом ОАС чинить кумулятивний ефект на серцево-судинні результати. Також зв’язок OAС з декількома супутніми хворобами, включно із серцево-судинною патологією, є двоспрямованим, тобто вони можуть спричиняти розвиток OAС. Вочевидь у пацієнтів із ЦД лікування OAС має бути інтегровано в цілісну стратегію профілактики серцево-судинних і мікросудинних ускладнень.
ОАС як проблема громадського здоров’я
OАС є серйозною проблемою громадського здоров’я, оскільки його поширеність зростає через глобальне прогресування ожиріння та метаболічних розладів, а також підвищену обізнаність людей і лікарів про цей стан, що, своєю чергою, призводить до збільшення кількості діагнозів. Метааналіз 17 досліджень показав: 425 млн дорослих осіб у всьому світі страждають від помірного та тяжкого OAС, що становить приблизно 11,8% дорослого населення світу [1].
Цей розлад характеризується повторюваними епізодами періодичної часткової (гіпопное) або повної (апное) обструкції верхніх дихальних шляхів під час сну, яка вимірюється індексом апноегіпопное (ІАГ), що призводить до зниження насичення крові киснем, гіперкапнії, мікрозбуджень, змін частоти серцевих скорочень, артеріального (АТ) та внутрішньогрудного тиску, фрагментарного сну.
OАС проявляється такими симптомами, як денна сонливість, інтенсивне хропіння, відчуття задухи, головні болі після пробудження, денна втома й епізоди ніктурії (часті позиви до сечовипускання в нічний час).
Нині доступно кілька інструментів скринінгу OAС, тоді як діагностика спирається на полісомнографію, що є золотим стандартом, або на респіраторну поліграфію. Проте ОАС усе ще недостатньо виявляється, оскільки діагностика часто займає багато часу, є трудомісткою та досить дорогою.
Замкнене коло ОАС і ЦД
OAС і діабет зазвичай співіснують у замкненому колі, що погіршує тяжкість і частоту обох захворювань. OAС має багато наслідків, включно з кардіометаболічними розладами та погіршенням серцево-судинного прогнозу [3]. Оскільки ЦД також є потужним чинником ризику серцево-судинних захворювань (ССЗ), то ОАС у поєднанні з діабетом може чинити кумулятивний вплив на результати серцево-судинної патології.
Зв’язок OАС із декількома супутніми хворобами, включно з ССЗ, є двоспрямованим, тобто деякі з них можуть спричиняти розвиток OAС.
Розуміння складного зв’язку між OАС і ЦД є важливим, оскільки OAС може бути модифікованим чинником ризику виникнення ЦД 2-го типу й інших несприятливих наслідків.
Застосування нічного постійного позитивного тиску в дихальних шляхах (CPAP) є золотим стандартом лікування пацієнтів з OAС. Потрібні дослідження, щоб з’ясувати, чи може CPAP зменшити розвиток макро- та мікросудинних ускладнень у пацієнтів з діабетом.
Діабет, контроль глікемії та ОАС
Зв’язок між OAС і діабетом було встановлено в низці досліджень. Зокрема, європейське когортне дослідження апное уві сні засвідчило наявність ЦД 2-го типу в 14,1; 21,0 та 28,9% пацієнтів з легким, помірним і тяжким OАС відповідно. Ризик розвитку ЦД залишався суттєво пов’язаним з тяжкістю ОАС після корегування на ожиріння й інші чинники впливу [4].
В огляді, який охоплює 41 статтю, поширеність OАС серед пацієнтів із ЦД було оцінено в 60%, тоді як у загальній популяції його частота коливалася від 9 до 38% [5].
Деякі лонгітюдні дослідження продемонстрували взаємозв’язок між OAС і ризиком розвитку ЦД 2-го типу [8]. Нещодавній метааналіз, який охоплював 154 948 учасників 25 когортних або перехресних досліджень, повідомив про вищий у 1,5-3,6 раза ризик розвитку переддіабету або діабету в пацієнтів з ОАС порівняно з тими, хто не мав ОАС. Окрім того, в когортних дослідженнях ризик розвитку ЦД поступово збільшувався разом зі ступенем тяжкості ОАС [9].
Кілька досліджень повідомили про зв’язок між обома станами незалежно від індексу маси тіла (ІМТ) й інших чинників ризику [10-12].
Прикметно, що метааналіз 11 рандомізованих контрольованих досліджень за участю загалом 964 пацієнтів із ЦД 2-го типу й OAС показав: лікування CPAP сприяло значному зниженню глікованого гемоглобіну (HbA1c) порівняно з контрольними групами.
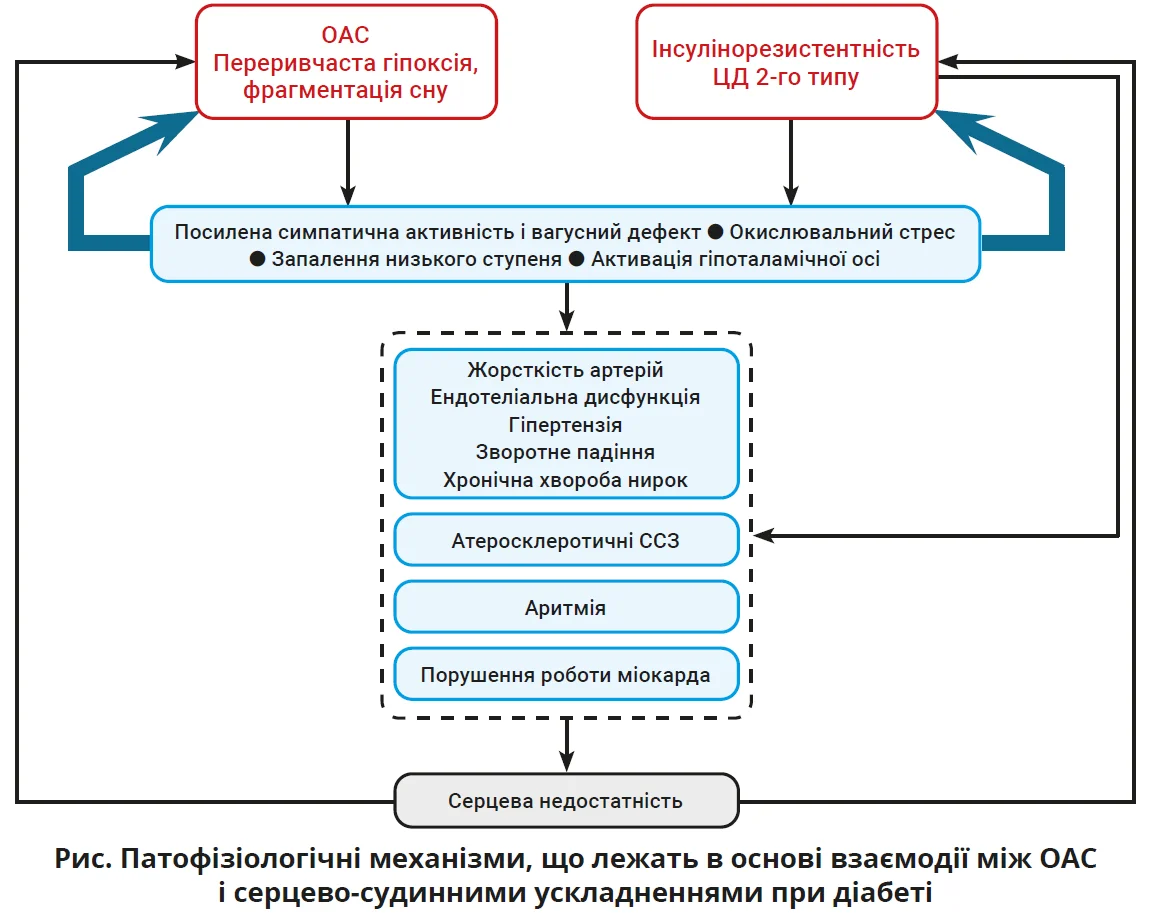
Отже, зв’язок між OAС і діабетом є двоспрямованим (рис.). З одного боку, OAС може спричиняти виникнення діабету шляхом посилення резистентності до інсуліну, що підтверджується підвищенням індексу HOMA-IR і порушенням глікемії в пацієнтів з OAС, які отримують лікування CPAP [16].
З іншого боку, переривчаста гіпоксія, фрагментація сну, окислювальний стрес, сприяння системному запаленню, посилена симпатична активність і активація гіпоталамо-наднирковозалозної осі з порушеннями циркадного ритму кортизолу є потенційними механізмами, що лежать в основі взаємозв’язку між OAС, інсулінорезистентністю та ЦД 2-го типу.
Переривчаста гіпоксемія також може порушити функцію або навіть спричинити часткове чи повне руйнування β-клітин, як було продемонстровано на тваринних моделях [18]. Натомість діабет може спричиняти виникнення OAС через різні механізми, включно з дисрегуляцією вегетативної нервової системи.
Вочевидь усебічне розуміння цього двоспрямованого зв’язку має сприяти покращенню профілактики та лікування обох захворювань. Пацієнти з ЦД можуть отримати користь від скринінгу й моніторингу апное уві сні, а лікування OAС можна розглядати як додатковий захід для профілактики ЦД 2-го типу та його ускладнень. Майбутні дослідження можуть виявити нові стратегії втручання.
OАС, гіпертензія та серцево-судинний ризик
Захворюваність на артеріальну гіпертензію може зростати разом зі ступенем тяжкості ОАС, тоді як застосування CPAP асоціюється з меншим ризиком її розвитку. Також установлено, що ОАС є найпоширенішим станом, пов’язаним з резистентною гіпертензією [34]. OАС асоціюється з аномальним 24-годинним профілем АТ, який підвищується після епізодів апное уві сні зі збільшенням симпатичної активності [36]. У пацієнтів з діабетом АТ без спаду пов’язаний з порушенням циркадних варіацій симпатовагальної активності [38]. Той самий механізм може бути залучений до підвищення АТ у нічний час у пацієнтів з ОАС.
Численні дослідження надали докази зв’язку між OAС і вищим серцево-судинним ризиком. Метааналіз, який охоплював 22 обсерваційні дослідження (42 099 учасників), показав, що апное уві сні було пов’язане з підвищеним ризиком серцево-судинної смерті та раптової смерті від усіх причин, причому ризик був значним за середнього й тяжкого OAС [40].
Своєю чергою, пацієнти з ЦД, у яких розвивається ОАС, належать до групи високого ризику серцево-судинних подій.
Когортне дослідження з бази даних первинної медичної допомоги Великої Британії показало, що учасники з ЦД 2-го типу, в яких розвинувся ОАС після діагностики діабету, мали підвищений ризик комбінованої серцево-судинної патології, фібриляції передсердь і смерті від усіх причин (54, 53 та 24% відповідно) порівняно з пацієнтами без ОАС [23].
У пацієнтів із ССЗ наявність ОАС і діабету також призводить до збільшення серцево-судинного ризику [46, 48, 49].
Нині є дані щодо внеску метаболічних біомаркерів, серцево-судинних маркерів і маркерів, пов’язаних з гіпоксією, в оцінку серцево-судинного ризику в пацієнтів із ЦД й ОАС [61-63, 65, 67, 69, 75-77].
Вплив терапії CPAP на серцево-судинні результати
Терапія CPAP є золотим стандартом лікування середнього та тяжкого ОАС. Однак її захисний ефект щодо серцево-судинних наслідків чітко не визначений. Обсерваційне дослідження, котре охоплювало велику популяцію чоловіків, повідомило, що після середньої тривалості спостереження 10,1 року частота летальних і нефатальних серцево-судинних подій у пацієнтів, які отримували CPAP, була значно нижчою, ніж у тих, хто не отримував лікування тяжкого ОАС [78].
Метааналіз 27 когортних досліджень (3 162 083 пацієнти) показав, що смертність від усіх причин і серцево-судинна смертність були значно нижчими в осіб, які отримували CPAP, аніж у пацієнтів, які не отримували лікування [79].
Щодо пацієнтів із ССЗ в анамнезі, то рандомізовані контрольовані дослідження, проведені за участю пацієнтів із серцевою недостатністю зі зниженою фракцією викиду, не змогли продемонструвати жодної користі CPAP або адаптивної сервовентиляції на результати ССЗ, тоді як ці методи лікування можуть покращити якість сну та нічну оксигенацію [81].
Водночас нещодавній метааналіз, який охоплював 4186 пацієнтів з OAС і ССЗ, повідомив про відсутність користі від терапії CPAP щодо ризику рецидиву серйозних несприятливих серцевих і цереброваскулярних подій, але розширив переваги використання CPAP протягом 4 годин на ніч у вторинній профілактиці [82].
Що стосується впливу на АТ, то CPAP не зменшує істотно частоти гіпертензії, але може зробити це, якщо дотримуватися режиму 4 години на ніч або довше [85]. Варто зазначити, що більше зниження АТ можна отримати в пацієнтів з резистентною гіпертензією [86].
Медичні підходи до пацієнтів з ОАС і ожирінням або ЦД
Медичні підходи до пацієнтів з OAС і ожирінням/ЦД передбачають стратегії схуднення (зміна способу життя та баріатрична хірургія), застосування цукрознижувальних і антигіпертензивних препаратів, а також терапевтичні підходи, спрямовані на вагосимпатичний баланс.
Зміна способу життя та баріатрична хірургія
Загалом результати рандомізованих досліджень демонструють переваги втрати ваги в пацієнтів з ОАС незалежно від того, чи було це досягнуто шляхом зміни способу життя, фармакотерапії або хірургічного втручання, тим самим підтверджуючи, що втрата ваги покращує параметри, пов’язані з ОАС.
У дослідженні INTERAPNEA 89 чоловіків з надмірною масою тіла чи ожирінням і помірним або тяжким OАС були рандомізовані для отримання терапії CPAP або 8-тижневого втручання щодо зниження ваги та способу життя в поєднанні з CPAP [87]. Було зафіксовано значніше зниження маси тіла (-7,1 проти -0,3 кг) і середніх значень АТ (-6,5 проти 2,2 мм рт. ст.) у групі комбінованої терапії (СРАР + заходи щодо зниження ваги). Через 6 місяців після втручання зниження ІАГ становило 57% у групі втручання із середньою різницею між групами -23,8 події/год, при цьому 61,8% учасників більше не потребували терапії CPAP, а 29,4% досягли повної ремісії OAС.
Так само дослідження Sleep AHEAD у пацієнтів з ожирінням і ЦД 2-го типу показало, що учасники, призначені для інтенсивного втручання в спосіб життя, втратили більше ваги за 1 рік, аніж ті, хто був рандомізований лише для лікування ЦД (10,8 проти 0,6 кг), а також досягли більш ніж утричі вищого рівня загальної ремісії OAС [88].
Щодо баріатричної хірургії, то нещодавній метааналіз, який охоплює 32 дослідження (2310 пацієнтів з OАС), повідомив про значне зниження ІМТ (середньозважена різниця -11,9 кг/м2) та ІАГ (-19,3/год), а також ремісію ОАС у 65% пацієнтів у групі втручання [89].
Агоністи рецепторів глюкагоноподібного пептиду-1
Терапія препаратами інкретину (включно з агоністами рецепторів глюкагоноподібного пептиду-1) як доповнення до модифікації способу життя може стати важливим терапевтичним компонентом для лікування OАС і бути корисною для пацієнтів, які вже проходять лікування за допомогою CPAP.
Застосування ліраглутиду в дозі 3 мг як доповнення до дієти та фізичних вправ у пацієнтів без ЦД з ожирінням і помірним або тяжким OАС, які не бажали / не могли використовувати CPAP, через 32 тижні порівняно з плацебо сприяло значно більшому зниженню ІАГ (-12,2 проти -6,1 подій/год у середньому), маси тіла (-5,7 проти -1,6%), систолічного АТ та HbA1c. Більша втрата ваги наприкінці випробування була суттєво пов’язана з більшим зниженням ІАГ і значнішим покращенням кінцевих точок, пов’язаних з насиченням киснем, архітектурою сну, денною сонливістю та якістю життя [90]. Так само в пацієнтів із ЦД 2-го типу та тяжким ОАС, які отримували CPAP, після 3-місячного лікування ліраглутидом (титрували до 1,8 мг на добу) ІМТ, ІАГ і середній систолічний АТ були значно нижчими, а мінімальна сатурація киснем вищою, ніж у контрольній групі [91].
Інгібітори натрієзалежного котранспортера глюкози-2
Вплив на зниження ваги, але головним чином на осмотичний діурез, що забезпечує скорочення об’єму плазми, зменшення попереднього навантаження, внутрішньогрудної затримки рідини та нічного рострального переміщення рідини з ніг з потенційною користю для дихальної функції, а також пригнічення симпатичної активності, може опосередковувати користь від інгібіторів натрієзалежного котранспортера глюкози-2 у хворих на ОАС.
Потенційна профілактика розвитку ОАС у пацієнтів із ССЗ та/або ЦД 2-го типу свідчить про те, що ці препарати можуть стати серйозними кандидатами на лікування ОАС. Однак такі ефекти та механізми, що лежать в їхній основі, мають бути з’ясовані в майбутніх дослідженнях [94, 95].
Антигіпертензивні препарати
Через серцево-судинний ризик, пов’язаний з OАС, використання блокаторів ренін-ангіотензинальдостеронової системи (РААС) видається цілком доречним.
Проте патофізіологія гіпертензії при ОАС передбачає використання препаратів, здатних знижувати симпатичну активність. Симпатолітичні препарати з центральною активністю є ефективними для зниження АТ, нейтрально впливають на масу тіла та нейтрально або сприятливо діють на чутливість до інсуліну. Також вони можуть знижувати частоту серцевих скорочень, як нещодавно показано в пацієнтів з надмірною вагою з дисглікемією та легкою або помірною гіпертензією [107]. Такі препарати можуть бути запропоновані як друга лінія терапії в поєднанні з блокатором РААС.
Висновки
- OАС і ЦД мають синергічний вплив на ризик розвитку серцево-судинних ускладнень.
- У разі діабету зв’язок OAС із ССЗ, зокрема із серцевою недостатністю, є двоспрямованим.
- Артеріальні маркери та показники гіпоксії варто враховувати при стратифікації серцево-судинного ризику.
- Цілеспрямована втрата ваги (наприклад, за допомогою терапії на основі інкретину) є надзвичайно важливою для пацієнтів з ожирінням та ОАС.
- Інгібітори натрієзалежного котранспортера глюкози-2 є доцільними кандидатами для профілактики та лікування OAС; їхня роль має бути визначена в пацієнтів з діабетом і ССЗ або без них.
Література
Valensi P., et al. Bidirectional interplay of sleep apnea syndrome and cardio-vascular disorders in diabetes. Diabetes Research and Clinical Practice. 2025;
220: 111984.