Деінтенсифікація цукрознижувальної терапії: як? кому? коли?
Переклала та адаптувала канд. мед. наук Тетяна Можина
Цукровий діабет (ЦД) є одним із найпоширеніших у світі хронічних захворювань, що призводить до виникнення серйозних порушень стану здоров’я та супроводжується значними економічними витратами. Поширеність ЦД 2 типу надзвичайно висока серед осіб літнього віку та, за прогнозами експертів, продовжуватиме зростати через збільшення тривалості життя (Ogurtsova K. et al., 2017). Етапність лікування ЦД 2 типу добре відома. У зв’язку з неухильним прогресуванням захворювання вона передбачає інтенсифікацію терапії, тобто призначення комбінації декількох пероральних цукрознижувальних препаратів (ЦЗП) та інсуліну, як правило, за базально-болюсною (ББ) схемою. Наступним кроком, який роблять за умови зниження інсулінорезистентності, є спрощення або пом’якшення цукрознижувальної терапії, тобто її деінтенсифікація. У яких випадках слід жорстко контролювати рівень глікемії за допомогою багаторазових ін’єкцій інсуліну, а коли можна почати деінтенсифікацію? У цьому огляді спробуємо дати відповіді на ці та інші запитання, ґрунтуючись на сучасних рекомендаціях Американської діабетологічної асоціації (ADA), Європейської асоціації з вивчення діабету (EASD) й Угорської діабетологічної асоціації.
У яких випадках необхідно призначати інсулін пацієнту з ЦД 2 типу?
— Згідно з останніми рекомендаціями ADA «Фармакологічні підходи до контролю глікемії» (2021), слід негайно призначити інсулін хворим на ЦД 2 типу за наявності симптомів/ознак катаболізму, що свідчать про дефіцит інсуліну: втрата маси тіла, поліурія, полідипсія. Експерти ADA (2021) наголошують, що інсулін має бути першим ін’єкційним препаратом у пацієнтів з дуже високим рівнем глікозильованого гемоглобіну (HbA1c; >10%) або значною гіперглікемією (>16,7 ммоль/л).
Яка основна мета лікування ЦД 2 типу?
— В останніх рекомендаціях ADA та EASD підкреслюється, що досягнення жорсткого контролю глікемії у вигляді підтримання цільового рівня HbA1c ≤7% в усіх хворих на ЦД 2 типу не є метою фармакотерапії. Доведено, що така тактика має декілька переваг щодо діабетичної ретинопатії, але не ефективна стосовно кінцевих серцево-судинних точок і здатна викликати несприятливі події унаслідок гіпоглікемічних станів, особливо у пацієнтів літнього віку (Davies M. et al., 2018). Лікування має бути спрямоване на зниження ризику розвитку ускладнень ЦД 2 типу за мінімізації шкоди, пов’язаної з терапією, і, таким чином, збільшення тривалості життя та його якості (ADA, 2021; EASD, 2019). Інколи досягнення цільового рівня HbA1c ≤7%, особливо в осіб літнього віку, асоціюється з мінімальною потенційною користю та підвищеним ризиком негативних наслідків на тлі можливої невеликої тривалості життя порівняно з періодом, необхідним для отримання клінічних переваг (McAlister F. et al., 2016).
Саме тому експерти ADA, EASD наголошують на доцільності індивідуального визначення цільового рівня HbA1c у межах від <7,0 до <8,5%, особливо в осіб літнього віку з урахуванням ризику розвитку гіпоглікемії, старечої астенії та соціальної дезадаптації (ADA, 2021; Davies M. et al., 2018). Зокрема, фахівці ADA (2021) рекомендують встановлювати цільовий рівень HbA1c для пацієнтів літнього віку з урахуванням загального стану та ступеня компенсації супутніх захворювань. Якщо пацієнт літнього віку практично здоровий, має невелику кількість хронічних видів патології та збережену когнітивну функцію, то рекомендований цільовий показник HbA1c може становити <7,0–7,5%. За наявності великої кількості супутніх хронічних хвороб, посереднього стану здоров’я та незначних/помірних когнітивних порушень, які дещо скорочують очікувану середню тривалість життя, збільшують імовірність гіпоглікемії та ризик падінь, експерти ADA (2021) пропонують підвищити цільовий рівень HbA1c до <8,0%. В осіб похилого віку з багатьма супутніми захворюваннями, незадовільним станом здоров’я, помірно тяжкими/тяжкими когнітивними порушеннями й короткою очікуваною тривалістю життя фахівці ADA (2021) не рекомендують брати за основу певний рівень HbA1c під час ухвалення рішення щодо контролю вмісту глюкози; лікування таких пацієнтів має бути спрямоване на уникнення епізодів гіпоглікемії та симптомної гіперглікемії. Слід зауважити, що експерти ADA (2021) підкреслюють потенційну шкоду зниження рівня HbA1c <6,5% у літніх пацієнтів із ЦД 2 типу.
Кожен лікар бажає бути впевненим, що призначене лікування діятиме тільки на користь. Коли ББ‑інсулінотерапія може бути розцінена як надмірне лікування?
— Протягом останніх років формується поняття надмірної цукрознижувальної терапії як варіанта неадекватного контролю ЦД 2 типу, при якому досягнення бажаних цільових значень не відповідає клінічній значущості, а потенційна шкода наслідків такого лікування перевищує можливу користь. За даними зарубіжних авторів, надмірна терапія є поширеним явищем у клінічній практиці: кожен десятий хворий літнього віку із ЦД 2 типу отримує надвисокі дози ЦЗП, а кожен четвертий пацієнт похилого віку потребує модифікації ББ‑інсулінотерапії (Sonmez А. et al., 2020). Водночас лікарі схильні інтенсифікувати призначення ЦЗП та ігнорувати потребу в деінтенсифікації лікування (Sonmez А. et al., 2020).
У чому причина надмірного лікування? Коли слід розглянути спрощення режиму ББ‑інсулінотерапії?
— Основними причинами надмірного лікування ЦД 2 типу є властивості інсуліну. Порівняно з іншими ЦЗП інсулін здатний знизити рівень глікемії в дуже широкому діапазоні залежно від обраного дозування (Jermendy G. et al., 2017; Sonmez А. et al., 2020). Поширеними побічними ефектами інсулінотерапії є епізоди гіпоглікемії та їх негативні наслідки. З часом на тлі ББ‑інсулінотерапії явища глюкозотоксичності зникають, що дає змогу спростити комплексну схему лікування, яку застосовували спочатку. Але рекомендації щодо деінтенсифікації чітко не сформульовані, і багато пацієнтів роками отримують надмірне лікування ЦД (Jermendy G. et al., 2017; Sonmez А. et al., 2020).
Надмірне лікування також можливе у разі досягнення хворими тривалого контролю глікемії в межах цільового діапазону за допомогою надмірно складної схеми інсулінотерапії. Це призводить до значних економічних витрат і погіршення якості життя порівняно із застосуванням простіших альтернативних схем, які забезпечують той самий контроль глікемії (Sonmez А. et al., 2020; Taybani Z. et al., 2019).
За якими показниками слід контролювати стан хворих на ЦД 2 типу, особливо тих, які приймають ББ‑інсулін?
— Основним показником, за яким визначають ступінь компенсації ЦД, є вміст HbA1c, непрямий показник середнього рівня глікемії протягом останніх 2–3 місяців. Незважаючи на деякі недоліки, саме вміст HbА1с є тим показником, за яким приймається рішення щодо корекції медикаментозної терапії ЦД (ADA, 2021; EASD, 2019).
Ще одним значущим маркером контролю глікемії при проведенні ББ‑інсулінотерапії є С‑пептид. Утворившись у β-клітинах підшлункової залози після перетворення проінсуліну в активний інсулін, С‑пептид надходить у кров разом з інсуліном в однаковій кількості з ним. Хоча С‑пептид позбавлений біологічної активності, за його сироватковою концентрацією можна дуже точно оцінити рівень секреції власного, ендогенного інсуліну. За даними Z. Taybani та співавт. (2019), вміст рандомно визначеного С‑пептиду в сироватці крові не натще становить ≥1,1 нг/мл у дорослих із ЦД 2 типу, які отримують низькі дози інсуліну (загальна доза інсуліну ≤0,6 МО/кг маси тіла або ≤70 МО/добу) та мають рівень HbA1c ≤7,5%, вказує на наявність певної ендогенної секреції інсуліну та може стати приводом для спрощення складних схем інсулінотерапії.
Якими рекомендаціями слід керуватися при деінтенсифікації терапії? Згідно з якими критеріями проводити спрощення?
— Нині погляди на деінтенсифікацію ББ‑інсулінотерапії тільки починають формуватися. Експерти вважають її наступним кроком у веденні пацієнтів з надмірною цукрознижувальною терапією, що дозволяє усунути поліпрагмазію, запобігти її негативним клінічним наслідкам і значно знизити прямі витрати на лікування (Farrell B. et al., 2017; Taybani Z. et al., 2019).
Канадські практичні рекомендації щодо деінтенсифікації терапії передбачають зниження доз ЦЗП, перехід на більш безпечні ліки чи припинення прийому лікарського засобу (Farrell B. et al., 2017). Згідно з зазначеними рекомендаціями, деінтенсифікацію слід проводити у пацієнтів віком від 65 років, які отримують ≥1 ЦЗП для лікування ЦД 2 типу та відповідають ≥1 з таких критеріїв:
- належність до групи ризику гіпоглікемії (внаслідок похилого віку, надмірно інтенсивного контролю глікемії, множинних супутніх захворювань, лікарських взаємодій, гіпоглікемії в анамнезі або відсутності розпізнавання гіпоглікемії, порушення функції нирок, прийому препаратів сульфонілсечовини/інсуліну);
- імовірність виникнення інших побічних ефектів ЦЗП;
- невизначеність переваг терапії внаслідок ослабленості, деменції або обмеженої тривалості життя (Farrell B. et al., 2017).
Яким чином слід проводити деінтенсифікацію ББ‑інсулінотерапії?
— Різні міжнародні фахові спільноти пропонують різні підходи до деінтенсифікації ББ‑інсулінотерапії. Так, у чинних рекомендаціях ADA (2021) міститься окремий розділ щодо лікування ЦД 2 типу у пацієнтів похилого віку та запропоновано спеціальний алгоритм спрощення ББ‑інсулінотерапії, що ґрунтується на покроковій корекції дози базального та прандіального інсуліну залежно від рівня глікемії.
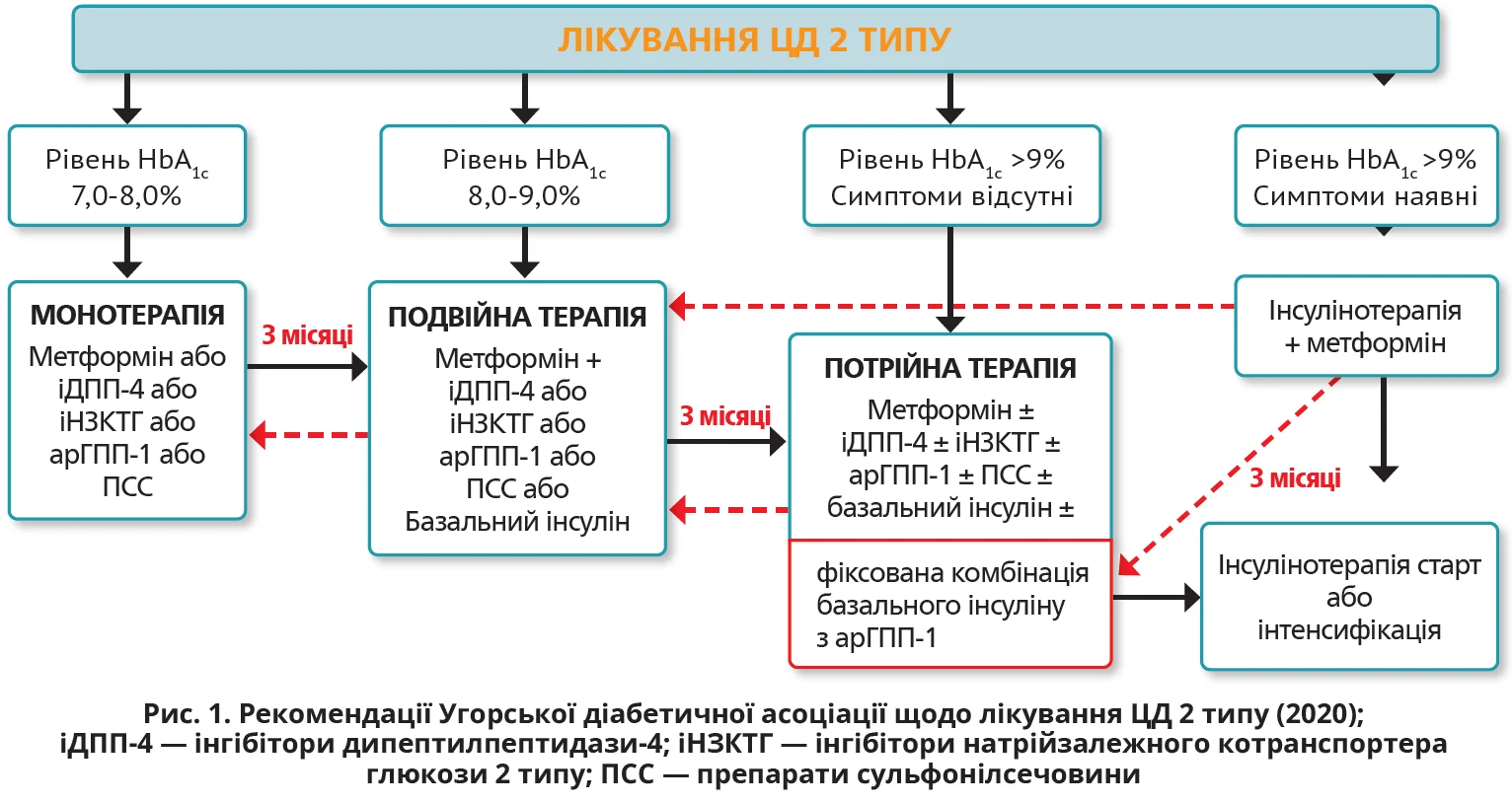
У настановах Угорської діабетичної асоціації (2020) також наголошується доцільність деінтенсифікації цукрознижувальної терапії із застосуванням простішого підходу (рис. 1). На думку угорських експертів, спрощення ББ‑інсулінотерапії можна досягти шляхом використання фіксованої комбінації базального інсуліну з агоністом рецепторів глюкагоноподібного пептиду‑1 (арГПП‑1).
Чи є практичні приклади деінтенсифікації?
— Яскравим прикладом успішного застосування деінтенсифікації є рандомізоване клінічне дослідження Z. Taybani та співавт. (2019), у якому пацієнтів, котрі отримували ББ‑інсулінотерапію ± метформін, переводили на фіксовану комбінацію базального інсуліну деглюдек та ліраглутиду (ІДегЛіра, Ксалтофай). Основними вимогами до проведення деінтенсифікації були рівень С‑пептиду натще ≥1,1 нг/мл (норма 1,1–4,1 нг/мл), задовільний контроль глікемії (концентрація HbA1c ≤7,5%) та порівняно низька добова доза інсуліну (≤70 ОД/добу, або ≤0,6 ОД/кг на добу). У дослідженні брали участь пацієнти, які приймали надмірно високі дози ЦЗП і мали тяжку/повторну симптомну гіпоглікемію протягом 1 місяця до початкового візиту при застосуванні добової дози інсуліну ≤70 ОД/добу й отримували інсулін у дозі 0,6–0,8 ОД/кг на добу.
Чи необхідно продовжувати введення базального інсуліну при призначенні ІДегЛіра? З якої дози ІДегЛіра слід починати деінтенсифікацію?
— На думку Z. Taybani та співавт. (2019), деінтенсифікацію слід починати з відміни базального інсуліну та введення ІДегЛіра (Ксалтофай) зі стартової дози у кількості 16 кроків дози з подальшим титруванням по 2 кроки дози через кожні 3 дні до досягнення цільового діапазону глікемії натще 5–6 ммоль/л. У цьому дослідженні ІДегЛіра (Ксалтофай) вводили підшкірно 1 раз на добу у будь-який час, а прийом метформіну починали/продовжували та титрували від 500 мг на тиждень до 3000 мг або до досягнення максимально допустимої дози. Під час проведення деінтенсифікації пацієнтів просили вимірювати рівень цукру в крові двічі на день у визначений час (натще і перед обідом/вечерею).
Яких клінічних результатів можна очікувати у пацієнтів після деінтенсифікації ББ‑інсулінотерапії з використанням Ксалтофай?
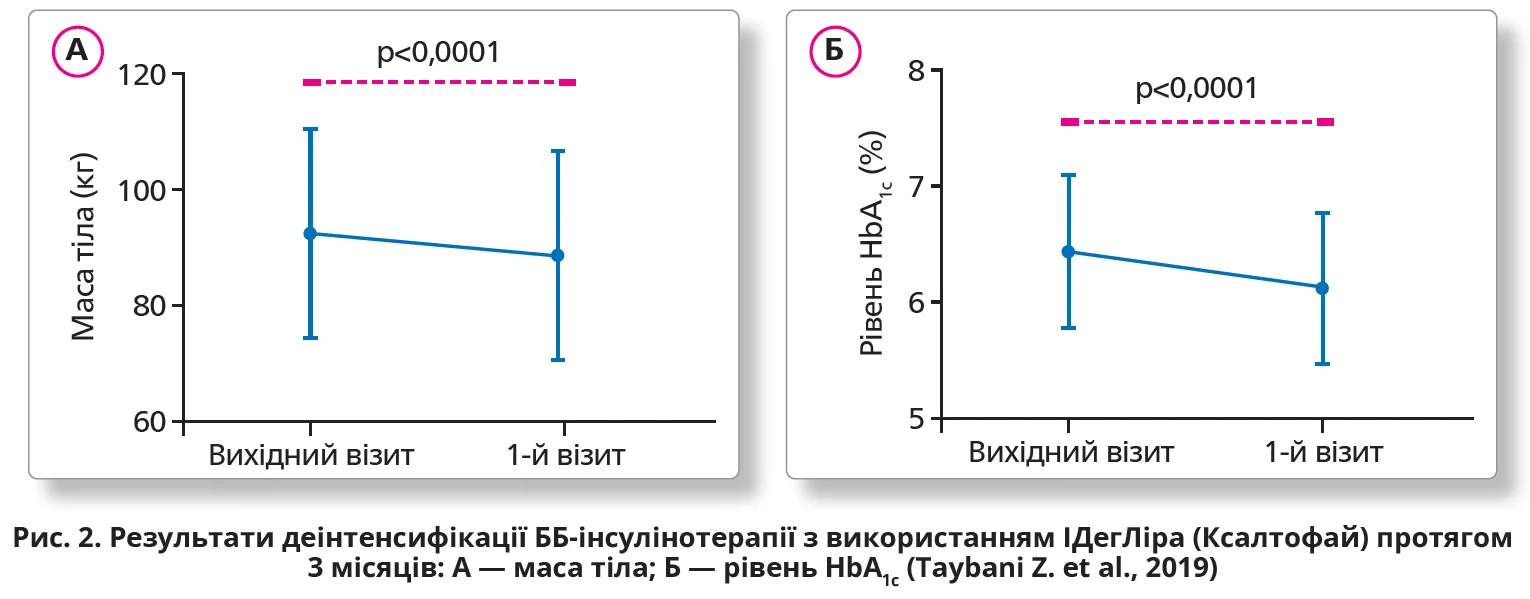
— Z. Taybani та співавт. (2019), які спостерігали за станом пацієнтів протягом у середньому 99,2 доби, відзначили вірогідне зниження вмісту HbA1c на 0,3% (середні значення після завершення дослідження 6,12±0,65%; р<0,0001), маси тіла на 3,11 кг (90,7±19,12 кг; р<0,0001), індексу маси тіла (32,39±6,71 кг/м2; р<0,0001) порівняно з показниками до початку деінтенсифікації з використанням ІДегЛіра (Ксалтофай; рис. 2).
Через 3 місяці лікування середня доза ІДегЛіра (Ксалтофай) становила лише 20,76±6,6 ОД, а середня потреба в інсуліні знизилася до 0,23±0,08 ОД/кг.
Чи супроводжувалося проведення деінтенсифікації з використанням ІДегЛіра (Ксалтофай) епізодами гіпоглікемії?
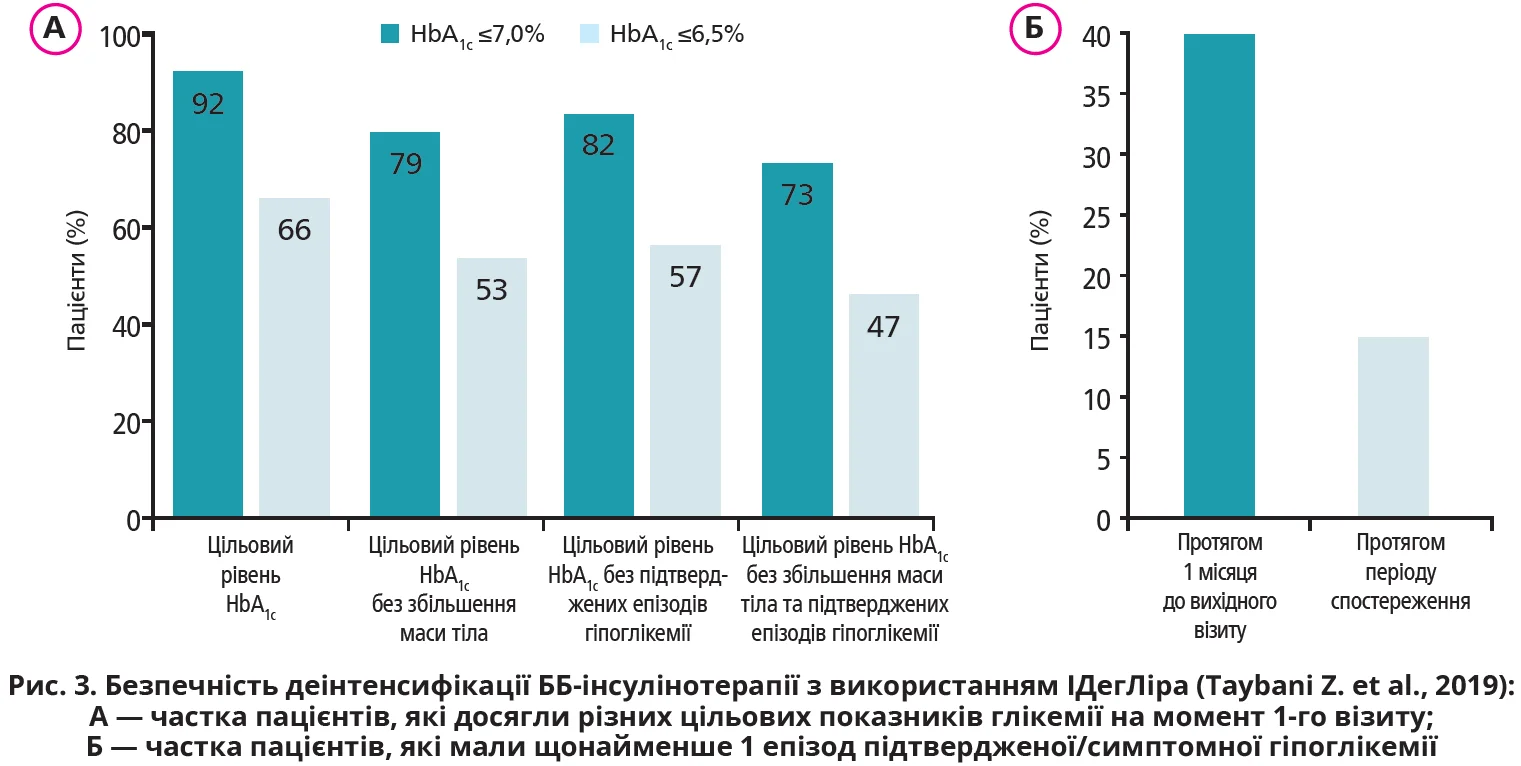
— Z. Taybani та співавт. (2019) відзначили хорошу переносимість і високу безпечність комбінованої терапії ІДегЛіра (Ксалтофай) ± метформін. Використання ББ‑інсулінотерапії протягом 1 місяця до включення в дослідження спровокувало виникнення принаймні одного епізоду підтвердженої/симптомної гіпоглікемії (<3,9 ммоль/л) у 28 (45,0%) пацієнтів, тоді як під час 3-місячного спостереження на тлі використання ІДегЛіра (Ксалтофай) ± метформін лише 6 (9,67%) хворих відзначили 13 підтверджених епізодів (рис. 3).
Таким чином, у повсякденній клінічній практиці деінтенсифікація ББ‑інсулінотерапії з використанням фіксованої комбінації ІДегЛіра (Ксалтофай) у пацієнтів із добре контрольованим ЦД 2 типу є безпечною. Застосування ІДегЛіра (Ксалтофай) сприяє порівнянному з ББ‑інсулінотерапією чи кращому контролю глікемії, а також істотно зменшує потребу в інсуліні. Використання ІДегЛіра (Ксалтофай) може супроводжуватися зменшенням маси тіла та індексу маси тіла. Зазначене спрощення схеми ББ‑інсулінотерапії у вигляді її деінтенсифікації зменшує вартість і дозволяє покращити прихильність до терапії завдяки введенню препарату лише один раз на добу.
Література
- Farrell B., Black C., Thompson W. et al. Deprescribing antihyperglycemic agents in older persons. Canadian Family Physician. 2017; 63(11): 832–843.
- Taybani Z., Bótyik B., Katkó M. et al. Simplifying Complex Insulin Regimens While Preserving Good Glycemic Control in Type 2 Diabetes. Diabetes Ther. 2019; 10: 1869–1878. https://doi.org/10.1007/s13300–019–0673–8.
- Jermendy G., Gaál Z., Gerő L., Hidvégi T. et al. Clinical practice guideline — diagnosis, antihyperglycaemic treatment and care of patients with diabetes in adulthood. Diabetol Hungar. 2017; 25(1): 3–77.
- Sonmez A., Tasci I., Demirci I. et al. A Cross-Sectional Study of Overtreatment and Deintensification of Antidiabetic and Antihypertensive Medications in Diabetes Mellitus: The TEMD Overtreatment Study. Diabetes Ther. 2020; 11: 1045–1059. https://doi.org/10.1007/s13300–020–00779–0.
- Boussageon R., Bejan-Angoulvant T., Saadatian-Elahi M. et al. Guidelines Abstracted from the American Geriatrics Society Guidelines for Improving the Care of Older Adults with Diabetes Mellitus: 2013 Update. J Am Geriatr Soc. 2013; 61(11): 2020–2026. https://doi.org/10.1111/jgs.12514.
- Davies M. J., D’Alessio D.A., Fradkin J. et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018; 61(12): 2461–2498. https://doi.org/10.1007/s00125–018–4729–5.
- McAlister F.A., Youngson E., Eurich D. T. Treated glycosylated hemoglobin levels in individuals with diabetes mellitus vary little by health status: a retrospective cohort study. Medicine (Baltimore). 2016; 95(24): e3894.
- Davies M. J., D’Alessio D.A., Fradkin J. et al. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018; 2018(61): 2461–2498.
- Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes‑2021. American Diabetes Association. Diabetes Care. 2021 Jan; 44(suppl. 1): S111-S124. https://doi.org/10.2337/dc21-S009.
- Hogan P., Dall T., Nikolov P. et al. Economic costs of diabetes in the US in 2002. Diabetes Care. 2003; 26: 917–932.
- Ogurtsova K., da Rocha Fernandes J. D., Huang Y. et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 2017; 128: 40–50. https://www.hbcs.hu/uploads/jogszabaly/3172/fajlok/2020_EuK_12_szam_EMMI_iranyelv_4.pdf.
- Buse J. B., Wexler D. J., Tsapas A. et al. 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2020; 63: 221–228. https://doi.org/10.1007/s00125–019–05039-w.