Дапагліфлозин знижує смертність пацієнтів із хронічною хворобою нирок: аналіз результатів дослідження DAPA-CKD
Огляд публікацій, переклала й адаптувала Олена Зотова
На хронічну хворобу нирок (ХХН) страждає близько 700 млн осіб у світі, й упродовж останніх десятиріч відзначається істотне зростання її поширеності. Згідно з даними дослідження з оцінки глобального тягаря хвороб (Global Burden of Disease Study), в період із 1990 по 2017 р. кількість смертей, які можуть бути пов’язані з ХХН, зросла на 41,5% [1]. У структурі причин смертності пацієнтів із ХХН домінує серцево-судинна патологія, істотна частка належить й іншим причинам, зокрема інфекціям і злоякісним новоутворенням [2-4].
Існує лінійна залежність між зниженням розрахункової швидкості клубочкової фільтрації (рШКФ) і частотою смерті від раку. Для кожних -10 мл/хв/1,73 м2 зниження рШКФ ризик загальної смерті від раку збільшувався на 18%, незалежно від віку, статусу куріння, статі, артеріального тиску та рівня глюкози натще. Цей ефект пояснюється не просто однією причиною й у людей зі зниженим ШКФ, у кого розвивається рак, загальний ризик смертності від раку також збільшується, наприклад у пацієнтів із рШКФ 45 мл/хв/1,73 м2 ризик смерті збільшується у 2,3 раза. Точне біологічне обґрунтування підвищеного ризику смерті від раку та зниження функції нирок не зрозуміле й, імовірно, є багатофакторним. Оксидативний стрес, своєю чергою, також може активувати шляхи запалення, що призводять до трансформації нормальних клітин у пухлинні клітини, проліферації пухлини й ангіогенезу. Можна припустити, що уремічні токсини в пацієнтів із ХХН здатні ще більше посилювати мітогенез і диференціацію клітин у злоякісні пухлини. Майбутні дослідження мають додатково вивчити біологічний механізм, що лежить в основі ефектів уремії, хронічного запалення та прогресування пухлини в пацієнтів зі зниженою функцією нирок [5].
Смертність, пов’язана з інфекцією, є вищою в осіб із високим рівнем альбумінурії та нижчими вихідними рівнями рШКФ. На сьогодні достеменно визначено, що через підвищену сприйнятливість чи порушення здатності реагувати на гостру інфекцію існує кореляція з підвищенням смертності від інфекційних причин у пацієнтів із термінальною стадією ниркової недостатності, які отримують гемодіалізну терапію [4].
У контексті пошуку методів лікування, що здатні покращити прогноз життя в пацієнтів із ХХН, велика увага науковців і клініцистів прикута до такого інноваційного класу лікарських засобів, як інгібітори натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2). Уже було доведено, що іНЗКТГ-2 знижують ризик розвитку серцевої недостатності (СН) і сповільнюють прогресування ХХН у пацієнтів із цукровим діабетом (ЦД) 2 типу – як на ранніх, так і на пізніх стадіях ХХН [6-8]. Наразі є всі підстави вважати, що деякі іНЗКТГ-2 можуть також зберігати функцію нирок і в тих пацієнтів із ХХН, які не мають ЦД 2 типу. Зокрема, в дослідженні DAPA-CKD (Dapagliflozin And Prevention of Adverse outcomes in Chronic Kidney Disease) було продемонстровано, що дапагліфлозин достовірно знижує ризик серйозних несприятливих подій із боку нирок, госпіталізації з приводу СН, серцево-судинної смерті та смерті від будь-яких причин, покращує виживаність у пацієнтів із ХХН незалежно від глікемічного статусу [9, 10]. Науковці продовжують ретельно аналізувати результати цього масштабного дослідження, і нещодавно було представлено висновки заздалегідь спланованого аналізу даних DAPA-CKD, присвяченого докладній оцінці впливу дапагліфлозину на смертність пацієнтів із ХХН від кардіоваскулярних та інших причин, зокрема інфекцій або онкологічних захворювань [11]. Пропонуємо до уваги читачів його реферативний огляд.
Дизайн дослідження й учасники
DAPA-CKD – багатоцентрове подвійне сліпе плацебо-контрольоване рандомізоване дослідження, що було проведено на базі 386 дослідних центрів у 21 країні. Воно було розроблене з метою оцінки впливу дапагліфлозину на ренальні та кардіоваскулярні кінцеві точки в пацієнтів із ХХН – як із ЦД 2 типу, так і без нього [9, 10]. У ході цього дослідження 4304 пацієнти з ХХН із рШКФ 25-75 мл/хв/1,73 м2 і співвідношенням альбуміну та креатиніну (САК) у сечі 200-5000 мг/г були рандомізовані (1:1) для прийому дапагліфлозину в дозі 10 мг 1 раз на добу (n=2152) або плацебо (n=2152) як доповнення до стандартного лікування. Усі учасники мали отримувати стабільну дозу інгібіторів ангіотензинперетворювального ферменту (іАПФ) або блокаторів рецепторів ангіотензину II (БРА) протягом щонайменше 4 тижнів до включення в дослідження (за винятком випадків наявності протипоказань для лікування препаратами цих класів).
Середній вік учасників дослідження – 62 роки (стандартне відхилення (СВ) 12,1), 1425 (33%) із них становили жінки, середнє значення рШКФ дорівнювало 43 мл/хв/1,73 м2 (СВ 12,4), а медіана САК – 949 мг/г (міжквартильний діапазон (МКД) 477-1885). Вихідні характеристики учасників, розподілених у групи дапагліфлозину та плацебо, були аналогічними (табл. 1). Медіана тривалості періоду подальшого спостереження за пацієнтами становила 2,4 року (МКД 2,0-2,7).

! Слід зазначити, що за рекомендацією незалежного моніторингового комітету дослідження DAPA-CKD було припинено достроково через 2,4 року – через очевидну ефективність досліджуваного лікування [10].
Що оцінювали саме в цьому аналізі?
Як первинну комбіновану кінцеву точку в дослідженні DAPA-CKD розглядали стійке зниження рШКФ щонайменше на 50%, настання термінальної стадії ХХН або смерть унаслідок ниркових чи серцево-судинних причин. Термінальна стадія ниркової недостатності визначалась як необхідність підтримувального діалізу протягом щонайменше 28 днів і трансплантації нирки або стійкого зниження рШКФ <15 мл/хв/1,73 м2. Ниркова смерть визначалась як смерть, що настала внаслідок термінальної стадії хвороби нирок, коли лікування методом діалізу було свідомо припинено (діаліз не починали або припинили) з будь-якої причини.
Вторинні кінцеві точки являли собою час до досягнення:
- специфічної ниркової комбінованої кінцевої точки, яка включала ті самі складові, що й первинна кінцева точка, проте за винятком серцево-судинної смерті;
- комбінованої серцево-судинної кінцевої точки, визначеної як госпіталізація з приводу СН або серцево-судинна смерть;
- смерть унаслідок будь-якої причини (смертність від усіх причин).
! У цьому заздалегідь спланованому аналізі результатів дослідження DAPA-CKD як вторинну кінцеву точку розглядали смертність.
Усі випадки смерті учасників дослідження було розглянуто незалежним комітетом з оцінки клінічних подій із використанням чітких визначень випадку. Всі причини смерті було надалі класифіковано на серцево-судинні, некардіоваскулярні та невизначені основні причини смерті. Термін «невизначена причина смерті» належить до такого випадку смерті, що не був визнаний як пов’язаний із певною серцево-судинною або несерцево-судинною причиною через відсутність або недостатність підтверджувальної інформації для встановлення конкретної причини смерті.
Результати аналізу
Причини смерті в учасників із ЦД 2 типу та без нього
Протягом періоду подальшого спостереження було зафіксовано настання такої події, як смерть, у 247 (5,7%) учасників дослідження: з них у 91 пацієнта (36,8%) зафіксовано смерть через серцево-судинні причини, у 102 пацієнтів (41,3%) – через несерцево-судинні причини; причина смерті 54 пацієнтів (21,9%) залишилася невизначеною (рис. 1A).
При аналізі результатів з огляду на глікемічний статус виявляється схожа залежність з огляду на причини смерті. При цьому двома найчастішими некардіоваскулярними причинами смерті в учасників із ЦД 2 типу й без нього були інфекції та злоякісні новоутворення (рис. 1Б). Серед учасників із ЦД 2 типу в 76 випадках (38,6% усіх смертей) смертність була пов’язана із серцево-судинними причинами, в 75 випадках (38,1%) – із несерцево-судинними причинами; в 46 учасників (23,4%) причина смерті була невизначеною (рис. 1Б). У когорті учасників без ЦД 2 типу протягом періоду спостереження загалом смертність була пов’язана з несерцево-судинними причинами: 15 випадків (30,0%) – смерть через серцево-судинні причини, 27 (54,0%) – через несерцево-судинні причини, а у 8 (16,0%) учасників причина смерті залишилася невстановленою (рис. 1Б).

Причини смерті на тлі діалізу та без нього
Під час періоду подальшого спостереження діаліз було розпочато у 167 учасників дослідження; кінцевою подією для 37 пацієнтів була смерть (частота події – 11,4 на 100 пацієнто-років). При цьому в групі, в якій отримували лікування з дапагліфлозином, учасники помирали вдвічі рідше порівняно з групою плацебо: 12 осіб у групі дапагліфлозину та 25 осіб у групі плацебо (табл. 2).
Настання вторинної кінцевої точки (загальна смертність) було констатовано у 210 учасників (2,2 випадку на 100 пацієнто-років), які не потребували діалізу: в групі плацебо таких подій було більше – 121 порівняно з 89 у групі дапагліфлозину (табл. 2). В учасників, яким проводили діаліз, частота настання смерті внаслідок несерцево-судинних причин загалом була вищою, ніж частота серцево-судинної смерті; в учасників, які не потребували діалізу під час періоду подальшого спостереження, розподіл показників частоти подій (несерцево-судинні порівняно із серцево-судинними) був аналогічним, і менша частота подій спостерігалася в групі дапагліфлозину (табл. 2).
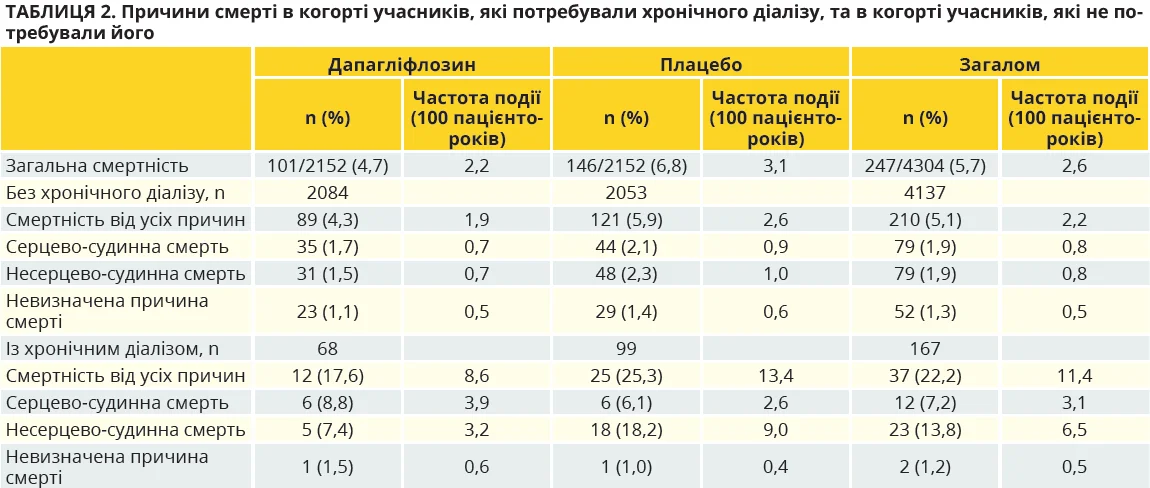
Як дапагліфлозин вплинув на показники смертності?
У групі дапагліфлозину частота настання подій смерті внаслідок будь-яких причин була меншою порівняно з такою в групі плацебо: 4,7 проти 6,8% відповідно (відношення ризику (ВР) 0,69; 95% довірчий інтервал (ДІ) 0,53-0,88; P=0,003).
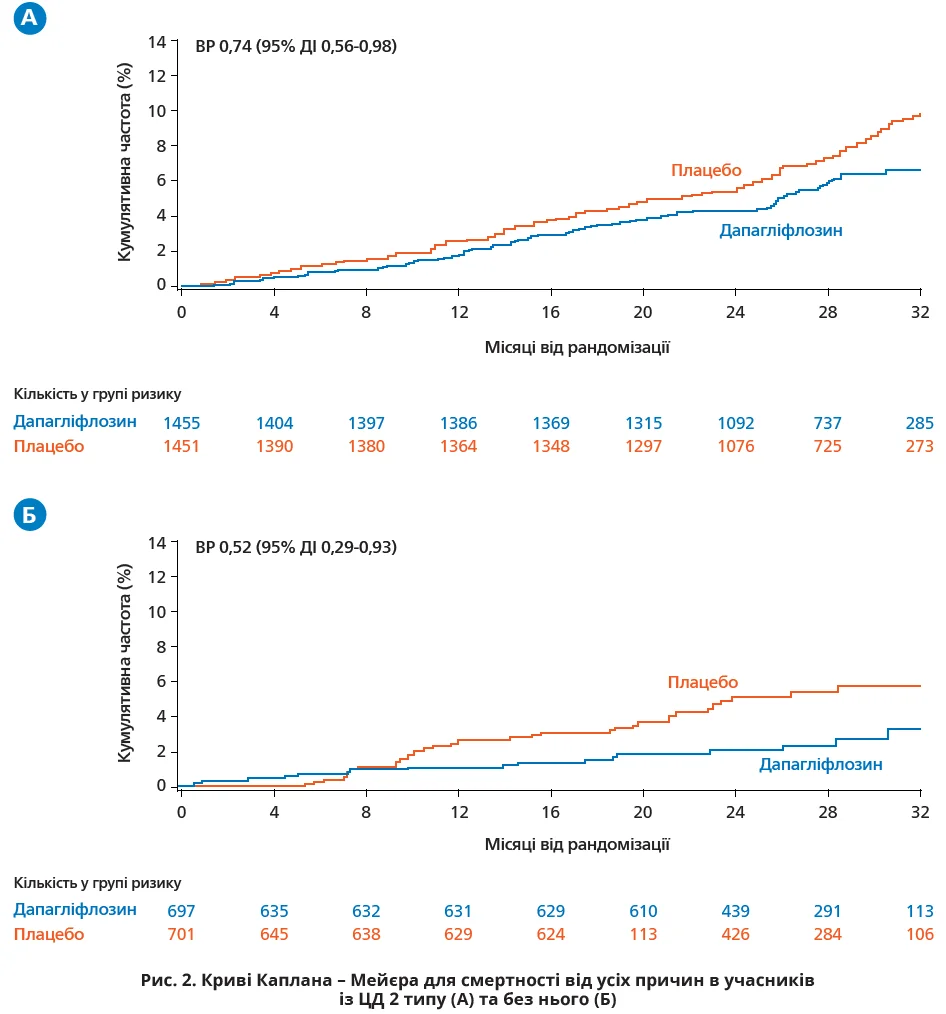
! В учасників із ЦД 2 типу з групи дапагліфлозину показник смертності виявився нижчим, аніж у групі плацебо: 2,6 проти 3,5 події на 100 пацієнто-років відповідно (ВР 0,74; 95% ДІ 0,56-0,98; рис. 2A).
! Серед учасників без діабету показники смертності також виявилися нижчими в групі дапагліфлозину (1,2 події на 100 пацієнто-років) порівняно з групою плацебо (2,3 події на 100 пацієнто-років; ВР 0,52; 95% ДІ 0,29-0,93; рис. 2Б).
У групі пацієнтів, які отримували плацебо, показники смертності виявилися вищими, особливо серед осіб похилого віку, в учасників із ЦД 2 типу та в осіб із нижчими значеннями рШКФ і вищими значеннями САК, а також із вищими рівнями систолічного артеріального тиску (рис. 3).
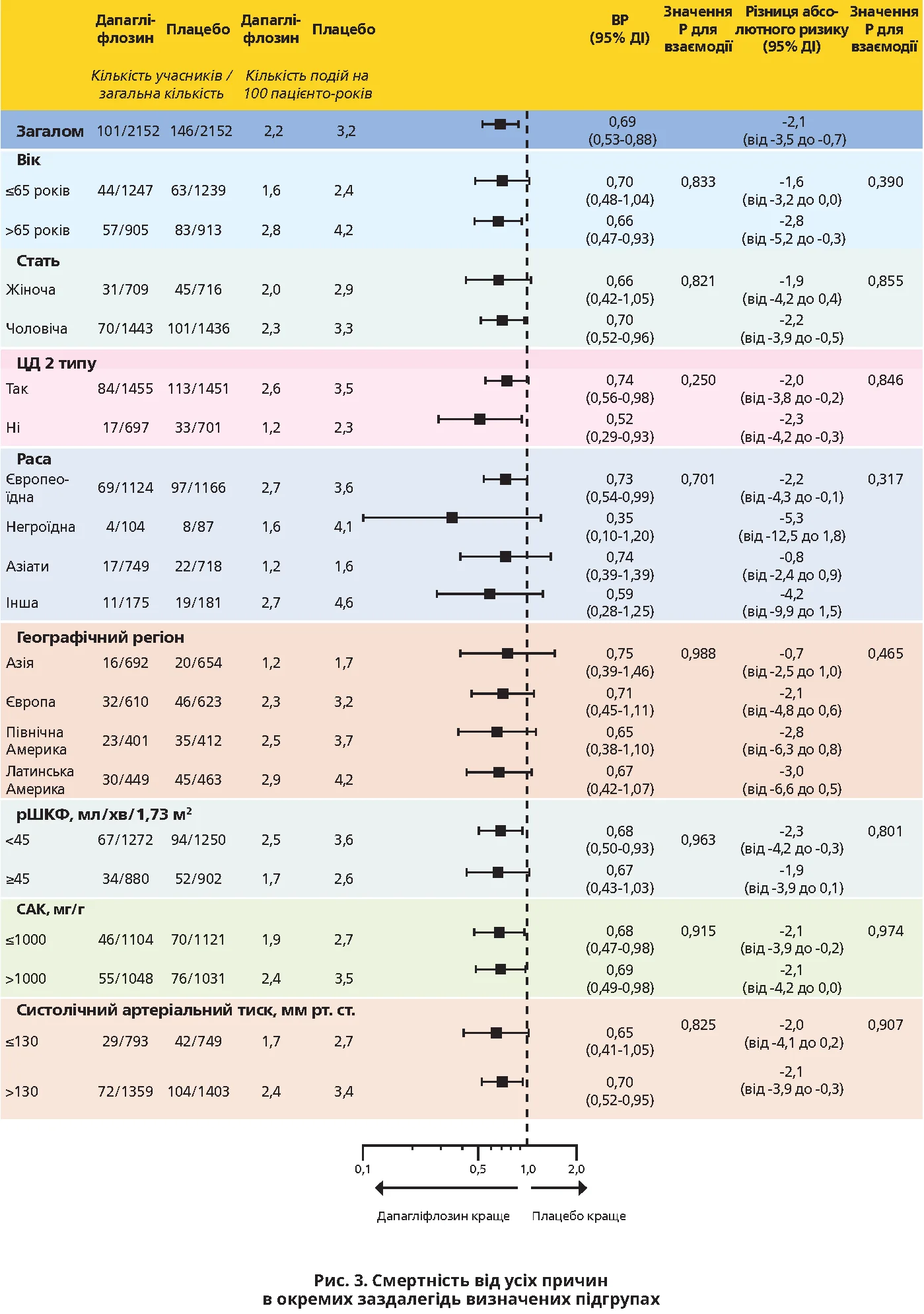
! Позитивний вплив дапагліфлозину щодо зниження відносного й абсолютного ризиків смерті від усіх причин був однаковим у всіх заздалегідь виділених підгрупах пацієнтів (рис. 3; всі значення Р для взаємодії >0,25).
Настання кінцевої точки «смерть унаслідок серцево-судинних причин» реєструвалося рідше в учасників групи дапагліфлозину: 41 подія (1,9%) проти 50 (2,3%) у групі плацебо (ВР 0,82; 95% ДІ 0,54-1,24; P=0,338). Найчастішою серцево-судинною причиною смерті виявилася раптова серцево-судинна смерть: вона була зафіксована у 24 (1,1%) учасників у групі дапагліфлозину й у 27 (1,3%) учасників у групі плацебо (ВР 0,89; 95% ДІ 0,52-1,55; рис. 4).
Смерть унаслідок СН виявилася другим за частотою типом серцево-судинної смерті: кількість подій була достовірно меншою в групі дапагліфлозину (3 події – 0,1%) порівняно з групою плацебо (11 подій – 0,5%) (ВР 0,27; 95% ДІ 0,08-0,98; рис. 4).
Смертність через несерцево-судинні причини достовірно рідше спостерігалася в групі дапагліфлозину (36 подій – 1,7%) порівняно з групою плацебо (66 подій – 3,1%) (ВР 0,54; 95% ДІ 0,36-0,82; P=0,003). Найчастішою причиною несерцево-судинної смерті виявилася смерть від інфекцій: вона була зареєстрована у 18 (0,8%) учасників у групі дапагліфлозину й у 28 (1,3%) учасників у групі плацебо (ВР 0,64; 95% ДІ 0,36-1,16; рис. 4).
Про смертність від злоякісних новоутворень повідомлялося у 27 пацієнтів у загальній популяції: у 8 (0,4%) осіб у групі дапагліфлозину й у 19 (0,9%) осіб у групі плацебо. Звертає на себе увагу, що цей показник був достовірно нижчим у групі дапагліфлозину, а зниження відносного ризику розвитку становило -58% (ВР 0,42; 95% ДІ 0,19-0,97; рис. 4).
Невизначеною причина смерті залишилася у 24 (1,1%) учасників у групі дапагліфлозину й у 30 (1,4%) учасників у групі плацебо (ВР 0,80; 95% ДІ 0,47-1,38; P=0,426; рис. 4).
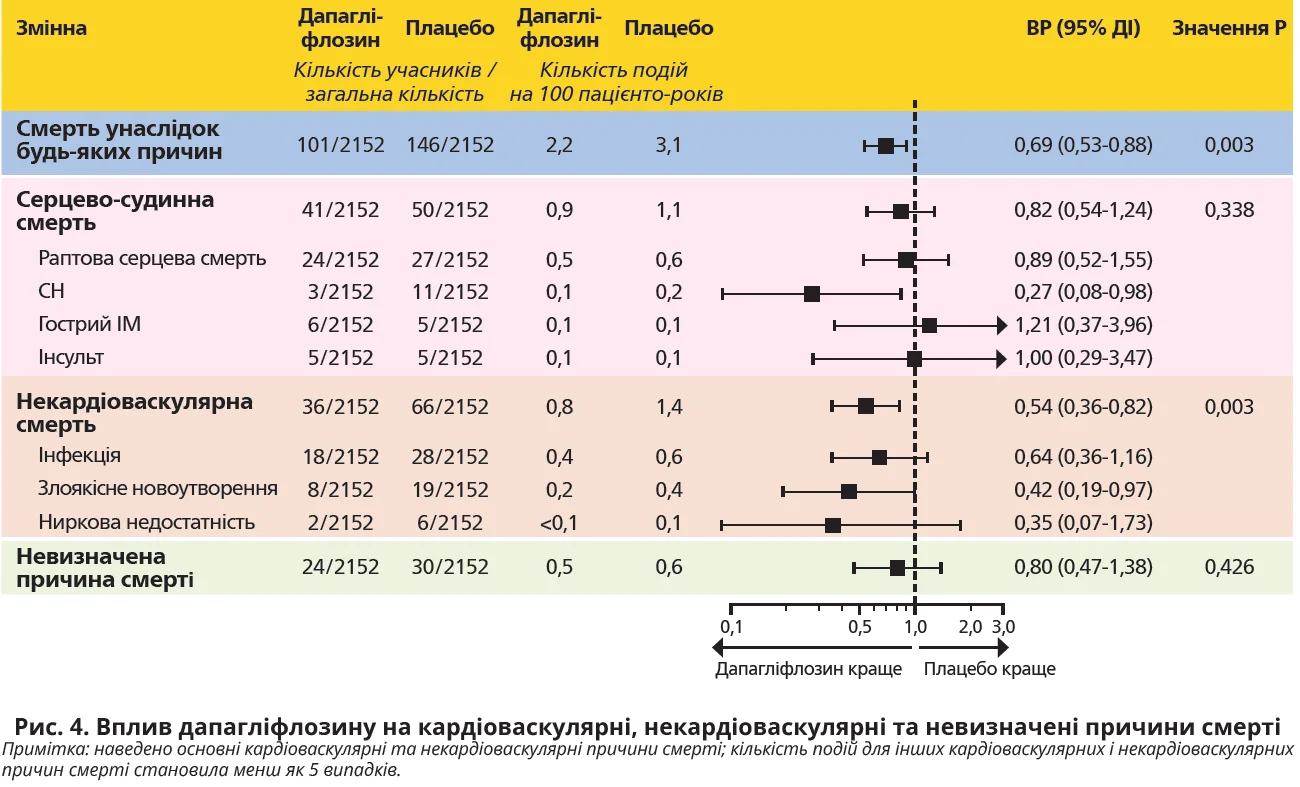
Смертність від інфекцій і злоякісних новоутворень
Під час періоду подальшого спостереження про серйозні небажані явища інфекційної етіології повідомлялося у 193 (9,0%) учасників у групі дапагліфлозину й у 207 (9,6%) учасників у групі плацебо (різниця в частоті – 0,4%; P=0,49). У ході апостеріорного (post hoc) аналізу було встановлено, що смертність із приводу інфекційних причин серед пацієнтів, які отримували лікування дапагліф-лозином, була достовірно меншою та становила 15 подій (7,8%) проти 31 події (15,0%) у групі плацебо (ВР 0,53; 95% ДІ 0,29-0,99). При апостеріорному (post hoc) аналізі даних пацієнтів із ХХН, у яких діагностували злоякісні новоутворення, було встановлено, що в групі дапагліфлозину пацієнти рідше помирали (9 подій – 15,3%), аніж у групі плацебо (17 подій – 23,9%) (ВР 0,69; 95% ДІ 0,30-1,56).
ВИСНОВКИ
Дослідження DAPA-CKD продемонструвало, що дапагліфлозин достовірно покращував виживаність пацієнтів із ХХН незалежно від глікемічного статусу. У цьому заздалегідь спланованому аналізі було показано, що переваги стосовно виживаності виявилися аналогічними в низці підгруп пацієнтів і переважно були зумовлені зменшенням смертності внаслідок несерцево-судинних причин, на частку яких припадало 41% усіх зареєстрованих випадків смерті.
Інфекції та злоякісні новоутворення були найчастішими причинами несерцево-судинної смерті, й обидві з них рідше виявлялися в учасників, які отримували лікування дапагліфлозином 10 мг порівняно з плацебо. Частка серцево-судинних смертей становила 37% від усіх випадків, при цьому найчастішими причинами в цій категорії були раптова серцева смерть і СН. Їхня кількість також була нижчою в групі дапагліфлозину 10 мг.
Можливо, встановлений у цьому аналізі позитивний вплив дапагліфлозину 10 мг на несерцево-судинну смертність може бути пов’язаний із його кардіо- та ренопротективними властивостями, які дають змогу зберегти функцію серця й нирок, забезпечуючи кращу стійкість в умовах тяжких та інтеркурентних захворювань, таким чином покращуючи виживаність. Ба більше, дапагліфлозин знижував ризики настання термінальної стадії хвороби нирок, яка асоціюється з вищими показниками серцево-судинної та несерцево-судинної смертності.
Що стосується ефектів дапагліфлозину в контексті інфекцій, то апостеріорний аналіз засвідчив зниження смертності серед пацієнтів із тяжкими інфекціями, які отримували дапагліфлозин.
Це підтверджує думку про те, що препарат може забезпечувати органопротекцію та знижувати ризик ускладнень і прогресування хвороби внаслідок інфекцій. Хоча через невелику абсолютну кількість подій ці результати слід інтерпретувати з обережністю, вони підтримуються експериментальними даними, котрі демонструють сприятливі ефекти інгібування НЗКТГ-2 у моделях інфекційного процесу у тварин [12, 13].
У дослідженні DAPA-CKD також було зафіксовано достовірну меншу кількість випадків смерті від злоякісних новоутворень у тих учасників, які були рандомізовані в групу дапагліфлозину, порівняно з групою плацебо. Деякі експериментальні дані свідчать про те, що інгібування НЗКТГ-2 сповільнює ріст пухлин і покращує виживаність піддослідних тварин [14, 15].
! Отже, в цьому заздалегідь спланованому аналізі результатів дослідження DAPA-CKD було чітко продемонстровано, що дапагліфлозин 10 мг достовірно покращує виживаність пацієнтів із ХХН. Переваги дапагліфлозину щодо зниження загальної смертності були переважно зумовлені зниженням смертності від несерцево-судинних причин, зокрема внаслідок інфекцій і злоякісних новоутворень [11].
Література
- GBD Chronic Kidney Disease Collaboration. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2020; 395: 709-733.
- Thompson S., James M., Wiebe N., Hemmelgarn B., Manns B., Klarenbach S., Tonelli M.; Alberta Kidney Disease Network. Cause of death in patients with reduced kidney function. J. Am. Soc. Nephrol. 2015; 26: 2504-2511.
- Mok Y., Matsushita K., Sang Y., Ballew S.H., Grams M., Shin S.Y., Jee S.H., Coresh J. Association of kidney disease measures with cause-specific mortality: the Korean heart study. PLoS One. 2016; 11: e0153429.
- Wang H.E., Gamboa C., Warnock D.G., Muntner P. Chronic kidney disease and risk of death from infection. Am. J. Nephrol. 2011; 34: 330-336.
- Iff S., Craig J.C., Turner R., Chapman J.R., Wang J.J., Mitchell P., et al. Reduced estimated GFR and cancer mortality. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation. 2014; 63 (1): 23-30. doi: 10.1053/j.ajkd.2013.07.008. PMID: 23993153.
- Mosenzon O., Wiviott S.D., Cahn A., Rozenberg A., Yanuv I., Goodrich E.L., Murphy S.A., Heerspink H.J.L., Zelniker T.A., Dwyer J.P., Bhatt D.L., Leiter L.A., McGuire D.K., Wilding J.P.H., Kato E.T., Gause-Nilsson I.A.M., Fredriksson M., Johansson P.A., Langkilde A.M., Sabatine M.S., Raz I. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE-TIMI 58 randomised trial. Lancet Diabetes Endocrinol. 2019; 7: 606-617.
- Wanner C., Heerspink H.J.L., Zinman B., Inzucchi S.E., Koitka-Weber A., Mattheus M., Hantel S., Woerle H.-J., Broedl U.C., von Eynatten M., Groop P.H.; EMPA-REG OUTCOME Investigators. Empagliflozin and kidney function decline in patients with type 2 diabetes: a slope analysis from the EMPA-REG OUTCOME trial. J. Am. Soc. Nephrol. 2018; 29: 2755-2769.
- Perkovic V., Jardine M.J., Neal B., Bompoint S., Heerspink H.J.L., Charytan D.M., Edwards R., Agarwal R., Bakris G., Bull S., Cannon C.P., Capuano G., Chu P.L., de Zeeuw D., Greene T., Levin A.,
Pollock C., Wheeler D.C., Yavin Y., Zhang H., Zinman B., Meininger G., Brenner B.M., Mahafey K.W.; CREDENCE Trial Investigators. Canagliflozin and renal outcomes in type 2 diabetes
and nephropathy. N. Engl. J. Med. 2019; 380: 2295-2306. - Heerspink H.J.L., Stefansson B.V., Chertow G.M., Correa-Rotter R., Greene T., Hou F.-F., Lindberg M., McMurray J., Rossing P., Toto R., Langkilde A.M., Wheeler D.C.; DAPA-CKD Investigators. Rationale and protocol of the Dapagliflozin And Prevention of Adverse outcomes in Chronic Kidney Disease (DAPA-CKD) randomized controlled trial. Nephrol. Dial. Transplant. 2020; 35: 274-282.
- Heerspink H.J.L., Stefansson B.V., Correa-Rotter R., Chertow G.M., Greene T., Hou F.F., Mann J.F.E., McMurray J.J.V., Lindberg M., Rossing P., Sjostrom C.D., Toto R.D., Langkilde A.M., Wheeler D.C.;
DAPA-CKD Trial Committees and Investigators. Dapagliflozin in patients with chronic kidney disease. N. Engl. J. Med. 2020; 383: 1436-1446. - Heerspink H.J.L., Sjöström C.D., Jongs N., Chertow G.M., Kosiborod M., Hou F.F., McMurray J.J.V., Rossing P., Correa-Rotter R., Kurlyandskaya R., Stefansson B.V., Toto R.D., Langkilde A.M., Wheeler D.C.; DAPA-CKD Trial Committees and Investigators. Effects of dapagliflozin on mortality in patients with chronic kidney disease: a pre-specified analysis from the DAPA-CKD randomized controlled trial. Eur. Heart J. 2021 Mar 31; 42 (13): 1216-1227.
- Astrand A., Wingren C., Benjamin A., Tregoning J.S., Garnett J.P., Groves H., Gill S., Orogo-Wenn M., Lundqvist A.J., Walters D., Smith D.M., Taylor J.D., Baker E.H., Baines D.L. Dapagliflozin-
lowered blood glucose reduces respiratory Pseudomonas aeruginosa infection in diabetic mice. Br. J. Pharmacol. 2017; 174: 836-847.
- Daniele G., Xiong J., Solis-Herrera C., Merovci A., Eldor R., Tripathy D., DeFronzo R.A., Norton L., Abdul-Ghani M. Dapagliflozin enhances fat oxidation and ketone production in patients with type 2 diabetes. Diabetes Care. 2016; 39: 2036-2041.
- Kuang H., Liao L., Chen H., Kang Q., Shu X., Wang Y. Therapeutic effect of sodium glucose co-transporter 2 inhibitor dapagliflozin on renal cell carcinoma. Med. Sci. Monit. 2017; 23: 3737-3745.
- Scafoglio C.R., Villegas B., Abdelhady G., Bailey S.T., Liu J., Shirali A.S., Wallace W.D., Magyar C.E., Grogan T.R., Elashoff D., Walser T., Yanagawa J., Aberle D.R., Barrio J.R., Dubinett S.M., Shackelford D.B. Sodium-glucose transporter 2 is a diagnostic and therapeutic target for early-stage lung adenocarcinoma. Sci. Transl. Med. 2018; 10: eaat5933.
