Case challenge «Два пацієнти, два сценарії: порушення ліпідного обміну при метаболічно-асоційованій стеатотичній хворобі печінки»
Підготувала канд. мед. наук Тетяна Можина
Вже доброю традицією стало проведення клінічних розглядів на навчальній платформі «Школа інноваційної медицини» за участю тріо провідних спеціалістів із трьох різних галузей медицини.
13 березня гастроентеролог Олена Бака, завідувачка гастроентерологічного відділення ДНУ «Центр інноваційних медичних технологій» НАН України, ендокринолог Любов Соколова, завідувачка відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка» НАМН України, та кардіолог Лариса Міщенко, завідувачка відділу артеріальної гіпертензії та коморбідної патології ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України», представили власні клінічні випадки двох пацієнтів з метаболічно-асоційованою стеатотичною хворобою печінки (МАСХП). Презентуючи на перший погляд однакові медичні кейси, в основі яких одна й та сама патологія – МАСХП, лекторки намагалися підкреслити цілком різні підходи до ведення хворих.
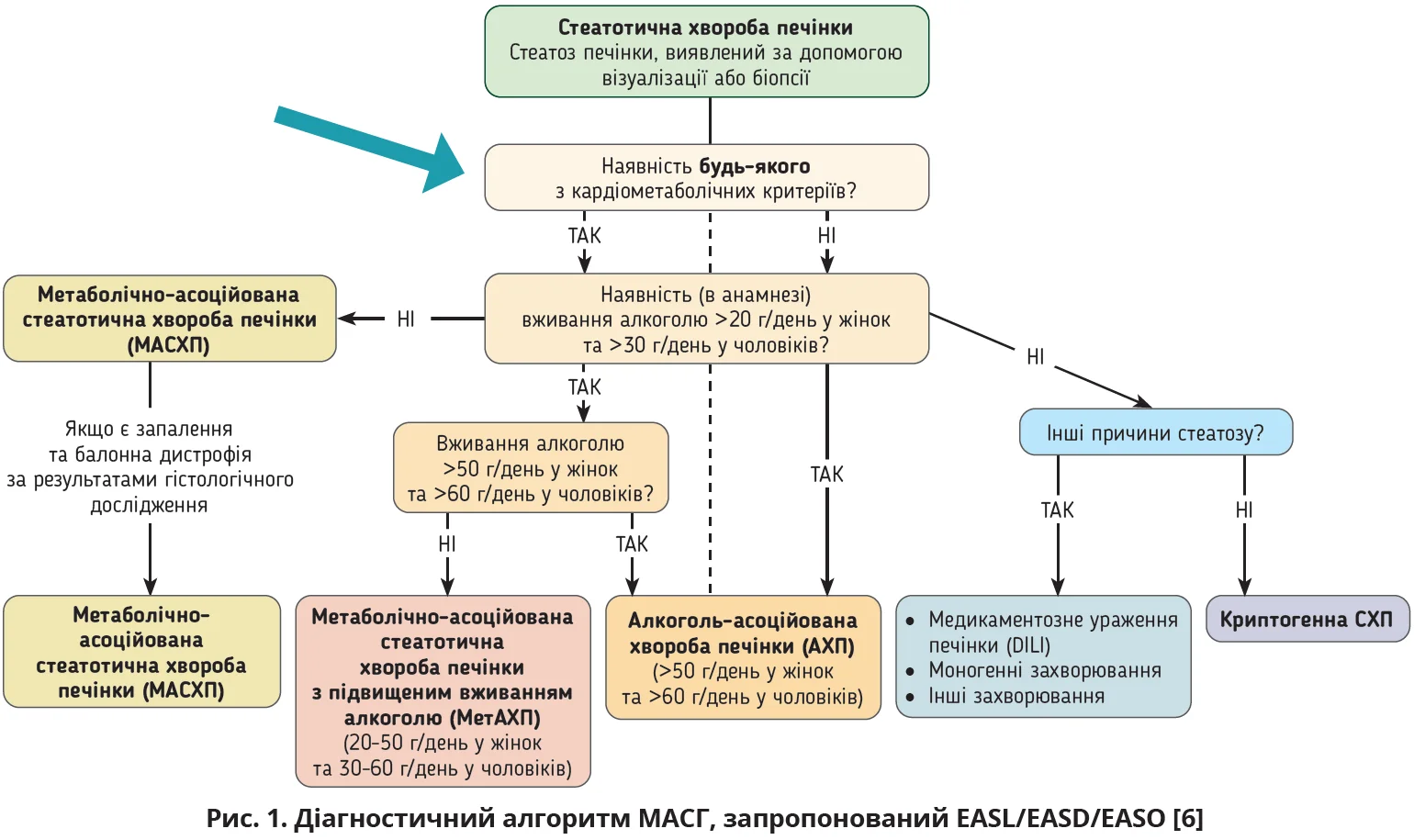
Відкрила семінар Олена Бака, яка навела сучасні дефініції стеатотичної хвороби печінки (СХП) та метаболічно-асоційованого стеатогепатиту (МАСГ) згідно з практичною настановою, підготовленою Європейською асоціацією з вивчення печінки (EASL), Європейською асоціацією з вивчення діабету (EASD) та Європейською асоціацією з вивчення ожиріння (EASO) [6]. Пильна увага до СХП пов’язана зі здатністю цієї патології прогресувати, починаючи від стеатозу до МАСГ, фіброзу та цирозу печінки (ЦП) та навіть МАСГ-асоційованої гепатоцелюлярної карциноми (ГЦК) [6]. Відповідно до положень спеціалізованої практичної настанови EASL/EASD/EASO з діагностики та лікування МАСГ одним з основних кроків на шляху діагностики цієї патології є виявлення будь-якого кардіометаболічного фактора ризику (рис. 1).
Перелік кардіометаболічних змін, які спричиняють розвиток МАСХП і МАСГ, залишився майже незмінним: надмірна вага чи ожиріння, явища дисглікемії на тлі цукрового діабету (ЦД), зростання рівня тригліцеридів (ТГ), зниження вмісту холестерину (ХС) ліпопротеїнів високої щільності (ЛПВЩ), підвищення артеріального тиску (табл.).
Сучасні дослідження переконливо доводять, що МАСХП має тісний зв’язок з інсулінорезистентністю, дисліпідемічними змінами, виникненням і швидким прогресуванням ожиріння, ЦД 2-го типу та серцево-судинних захворювань [6, 10]. Експерти EASL/EASD/EASO підкреслюють, що така метаболічна патологія, як ЦД 2-го типу, й ожиріння (особливо абдомінальне) чинять найпотужніший вплив на природний перебіг MAСХП, індукуючи швидке прогресування MAСХП/MAСГ-асоційованого фіброзу та ЦП, а також ГЦК (рівень доказів 2, сильний консенсус) [6].
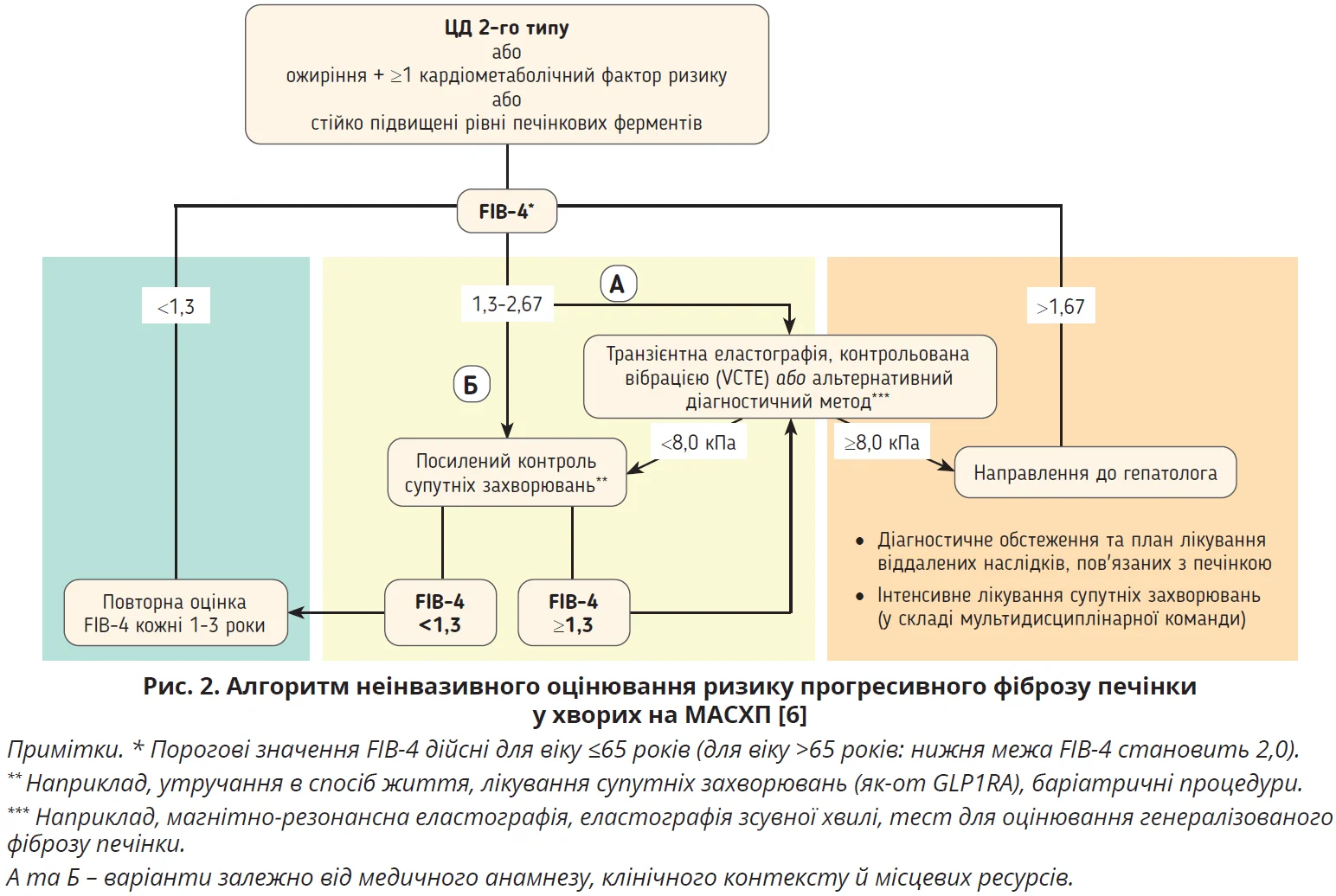
Окрім визначення факторів ризику, настанова EASL/EASD/EASO пропонує алгоритм неінвазивного оцінювання ризику прогресивного фіброзу печінки в пацієнтів з метаболічними факторами ризику або ознаками СХП (рис. 2), який заснований на розрахунку індексу фіброзу (FIB-4). Ризик розвитку ЦП вважають малоймовірним, якщо значення FIB-4 нижче 1,45; цей ризик стає високоймовірним за умови перевищення значення 3,25. У проміжних випадках, коли показники FIB-4 коливаються в межах 1,45-3,25, ризик наявності ЦП вважають сумнівним.
Значення FIB-4 >3,25 також розглядають як фактор, асоційований з високою ймовірністю розвитку ГЦК в осіб з МАСХП. Перелік факторів, що зумовлюють високий ризик розвитку ГЦК у пацієнтів з МАСХП, доповнюють наявність і тривалий перебіг ЦД 2-го типу, коморбідне ожиріння або одночасна наявність обидвох захворювань, похилий вік, одночасне вживання алкоголю та/або куріння, висока жорсткість печінки (>10 кПа) та зростання цього показника з плином часу [6].
Олена Бака акцентувала, що СХП слід запідозрити не тільки в осіб з надмірною вагою й ожирінням, а також в осіб з недостатнім ІМТ, адже представники Американської гастроентерологічної асоціації (AGA) підкреслюють високу ймовірність розвитку МАСХП у худих людей. Представники AGA сформулювали 15 практичних рекомендацій щодо діагностики, стратифікації ризику та лікування МАСХП у худих людей [7]. У цій настанові експерти AGA наголошують, що 7-20% осіб з МАСХП мають худорлявий габітус, і перелічують фактори ризику, які спричиняють виникнення первинного або вторинного стеатозу печінки:
- харчові звички з високим умістом фруктози або жиру в раціоні;
- зміни розподілу жирової тканини в тілі з виникненням вісцерального ожиріння;
- зміни складу тіла на тлі, наприклад, ліподистрофії у ВІЛ-інфікованих і не ВІЛ-інфікованих осіб;
- прийом певних ліків (метотрексат, аміодарон, тамоксифен, кортикостероїди);
- рідкісні вроджені аномалії (дефіцит лізосомальної кислотної ліпази, сімейна гіпо- й абеталіпопротеїнемія);
- вірусна інфекція (вірус гепатиту С, 3-й генотип);
- фактори, асоційовані з харчуванням і станом шлунково-кишкового тракту (повне парентеральне харчування) або наявної ендокринної патології (гіпотиреоз);
- вплив токсинів (вінілхлорид) [7].
Олена Бака представила першу історію хвороби заходу Case challenge: пацієнт Х., 1967 р. н., у якого у 2019 р. у ході комплексного обстеження з ультразвуковим дослідженням (УЗД), еластометрією та стеатометрією печінки виявлено гепатомегалію й жировий гепатоз (F1-F2 за шкалою METAVIR), незважаючи на абсолютно незмінені показники ІМТ (24,8 кг/м2). Згідно з рекомендаціями, які діяли на той час, проведено необхідне обстеження та встановлено діагноз неалкогольного стеатогепатиту з помірною активністю (АЛТ >2,5 норм) і мінімальним холестатичним синдромом (g-глутамілтранспептидаза – ГГТП >1,3 норм). На тлі рекомендованої нефармакологічної (корекція дієти, збільшення фізичної активності) та фармакологічної терапії (Гептрал® 1000 мг на добу внутрішньовенно крапельно протягом 14 днів з подальшим пероральним прийомом 500 мг 2 рази на добу протягом 2 місяців) відзначили нівелювання цитолітичного та холестатичного синдромів. Протягом наступних 2 років пацієнт почувався задовільно, але під час звернення в клініку з приводу іншої патології у 2024 р. знову відзначили активацію цитолізу (АЛТ >1,6 норм) і холестазу (ГГТП >1,15 норм) з одночасним зростанням рівня глікемії натще (7,72 ммоль/л), незміненим значенням HbA1c та вираженими дисліпідемічними змінами: зростання ТГ до 2,0 ммоль/л за норми 0,7-1,7 ммоль/л, зменшення ХС ЛПВЩ до 0,61 ммоль/л за норми 0,78-1,55 ммоль/л на тлі дещо зменшеного рівня загального ХС (2,0 ммоль/л за норми до 5,2 ммоль/л) і нормативних значень коефіцієнту атерогенності (2,28).
 Розбір клінічного випадку продовжила Любов Соколова, яка навела результати консультації ендокринолога (вересень 2024 р.) із приводу виявленої гіперглікемії. Вона підкреслила, що проведені додаткові обстеження дали змогу встановити проміжну гіперглікемію, переддіабет з порушенням толерантності до вуглеводів, синдром інсулінорезистентності (індекс НОМА – 15,43 за норми до 2,6) та наявність автоімунного тиреоїдиту з еутиреозом (тиреотропний гормон – норма, антитіла до тиреопероксидази збільшені у 2,7 рази, антитіла до тиреоглобуліну збільшені у 117,5 рази). Виявлене збільшення вмісту автоантитіл стало підґрунтям для пошуку прихованої автоімунної патології: проведено ANA Screen, але він дав негативні результати, антинуклеарні антитіла не виявлено, як і антитіла класу G до сахароміцетів (ASCA-G), антимітохондріальні (АМА-М2) антитіла й антитіла до печінки, нирок (LKM-1).
Розбір клінічного випадку продовжила Любов Соколова, яка навела результати консультації ендокринолога (вересень 2024 р.) із приводу виявленої гіперглікемії. Вона підкреслила, що проведені додаткові обстеження дали змогу встановити проміжну гіперглікемію, переддіабет з порушенням толерантності до вуглеводів, синдром інсулінорезистентності (індекс НОМА – 15,43 за норми до 2,6) та наявність автоімунного тиреоїдиту з еутиреозом (тиреотропний гормон – норма, антитіла до тиреопероксидази збільшені у 2,7 рази, антитіла до тиреоглобуліну збільшені у 117,5 рази). Виявлене збільшення вмісту автоантитіл стало підґрунтям для пошуку прихованої автоімунної патології: проведено ANA Screen, але він дав негативні результати, антинуклеарні антитіла не виявлено, як і антитіла класу G до сахароміцетів (ASCA-G), антимітохондріальні (АМА-М2) антитіла й антитіла до печінки, нирок (LKM-1).
Спікерка підкреслила, що в цьому випадку провідним фактором ризику дисглікемії є саме МАСХП, тоді як зміни вуглеводного обміну є вторинними, що дають змогу прогнозувати виникнення ЦД 2-го типу за умови погіршення функціонального стану печінки та прогресування МАСХП. Пацієнту було призначено метформін.
У продовження цього клінічного кейсу гастроентеролог Олена Бака зазначила, що контрольні аналізи, проведені в листопаді 2024 р., знову зафіксували підвищення АЛТ (106,7 Од/л за норми до 41,0 Од/л), АСТ (56,60 мкмоль/л за норми до 37,0 Од/л), ГГТП (65,2 Од/л за норми до 10,0-61,0 Од/л) і порушення вуглеводного обміну (глюкоза – 6,29 ммоль/л, HbA1c – 6,09% за норми 4,8-5,8%). Виявлені цитолітичний і легкий холестатичний синдроми не були пов’язані з інфікуванням вірусними гепатитами В та С (маркери вірусних гепатитів негативні). Значення FIB-4, розраховане для пацієнта, становило 6,91, що значно перевищувало порогову межу, відзначену в рекомендаціях EASL/EASD/EASO (2,67), та стало підґрунтям для скерування хворого до гепатолога з метою проведення діагностичного обстеження й визначення плану лікування. Під час проведення УЗД органів черевної порожнини виявлено ультразвукові ознаки стеатозу та дифузних змін печінки, гепатомегалії, хронічного холециститу, гіпотонії жовчного міхура, хронічного панкреатиту, ліпоматозу підшлункової залози. Додатково виконано стеатометрію й еластографію печінки, отримано висновок на користь тяжкого стеатозу (S3) та легкого фіброзу печінки (F1 за шкалою METAVIR).
Любов Соколова, ґрунтуючись на даних консультації ендокринолога, підтвердила діагноз переддіабету й автоімунного тиреоїдиту у фазі еутиреозу; але через 2,6-разове підвищення АЛТ прийом метформіну було скасовано та призначено дапагліфлозин (10 мг).
Провідна експертка в ендокринології підтвердила можливість призначення дапагліфлозину в цьому випадку, але зауважила, що препарат наразі відсутній у рекомендаціях EASL/EASD/EASO з лікування МАСГ і як представник групи інгібіторів натрієзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2) здатний провокувати розвиток баланопоститу, інфекцій сечовивідних шляхів.
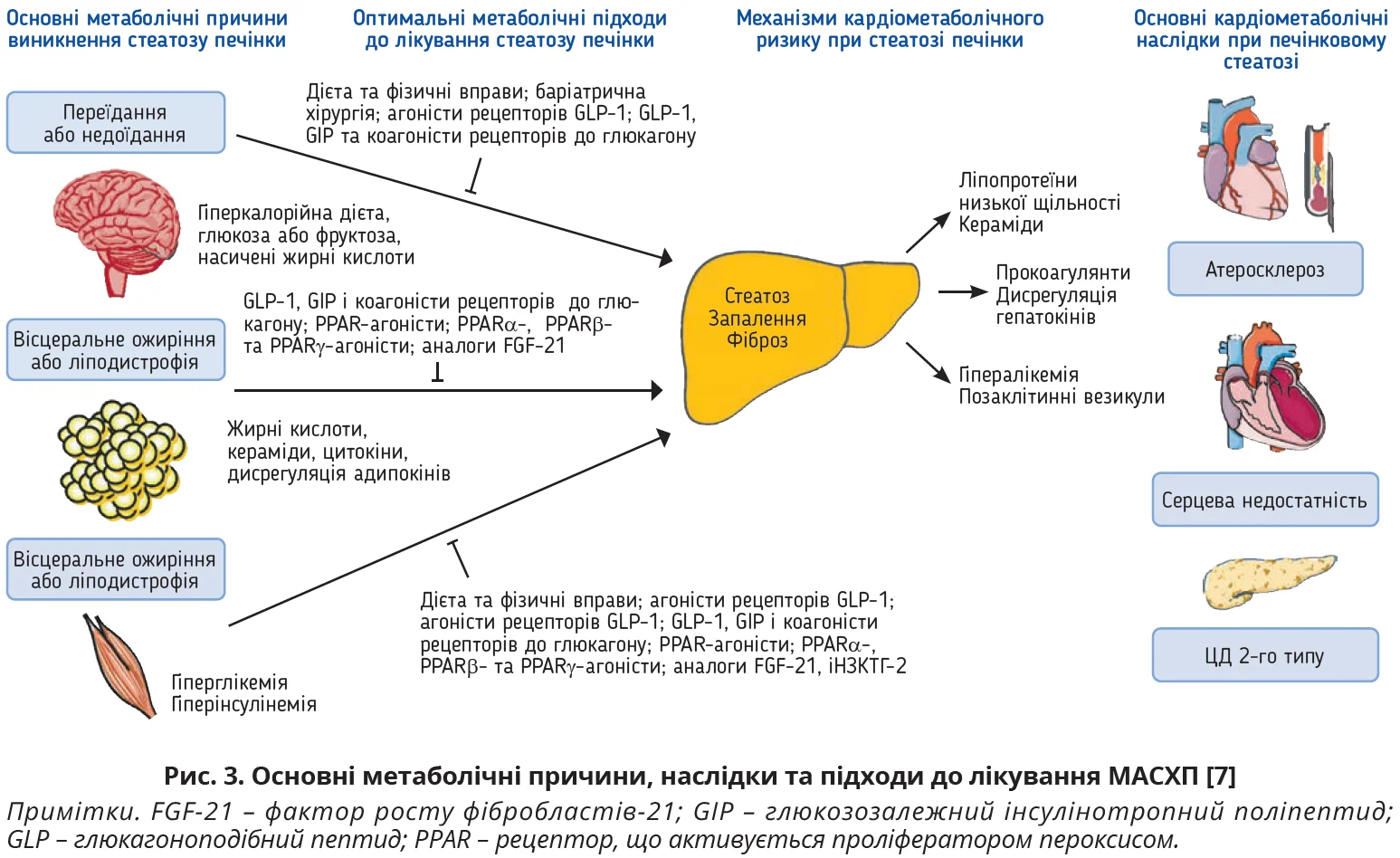
Відповідно до сучасних поглядів на патофізіологічні механізми розвитку МАСГ підходи до корекції цієї патології передбачають не тільки корекцію стеатозу печінки, але й захист серцево-судинної системи (рис. 3).
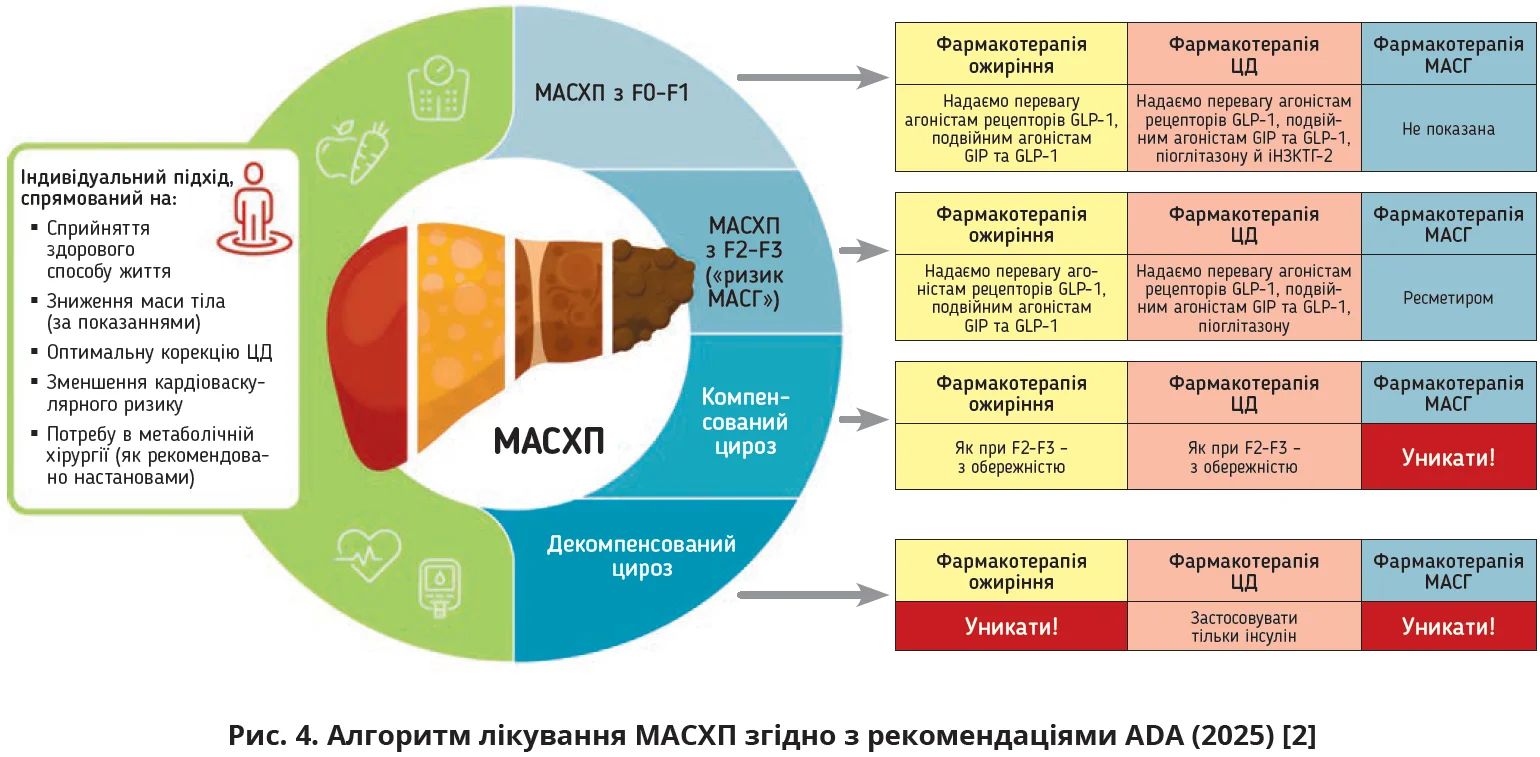
Оновлені погляди на лікування хворих на ЦД 2-го типу, представлені експертами Американської діабетологічної асоціації (ADA) цього року, наполягають на проведенні безперервного моніторингу глікемії в осіб із ЦД 2-го типу, включно з пацієнтами, які не отримують інсулін. Дослідження демонструють, що використання безперервного моніторингу глікемії здатне допомогти знизити ризик розвитку серйозних ускладнень, включно з діабетичним кетоацидозом, епізодами гіпоглікемії, а також госпіталізацією з приводу гіпоглікемії та гіперглікемії [2]. В оновленій настанові наводяться такі підходи до лікування МАСХП (рис. 4).
В оновлених рекомендаціях ADA з лікування ЦД у хворих на МАСХП (2025) з’явилося нове положення: «Якщо потрібне додаткове зниження серцево-судинного та ниркового ризиків, лікування інших метаболічно-асоційованих супутніх захворювань та/або зниження глікемії, слід додати препарати з потенційними перевагами щодо зниження ризику МАСХП або МАСГ» [2]. До таких препаратів експерти ADA відносять агоністи рецепторів GLP-1, подвійні агоністи GIP і GLP-1, піоглітазон, комбінацію агоніста рецепторів GLP-1 з піоглітазоном [2]. Зазначена рекомендація була зроблена з огляду на сприятливий метаболічний вплив перелічених ліків на стан печінки у хворих на МАСХП/МАСГ. Представники ADA підкреслюють, що лікування треба проводити з урахуванням маси тіла пацієнта: за потреби зниження маси тіла призначати ліраглутид і семаглутид, за потреби збільшення ІМТ рекомендувати піоглітазон і ланіфібранор, у пацієнтів зі збереженою вагою застосовувати ресметиром [2].
Зважаючи на перелічені рекомендації, пацієнт Х. отримав більше користі від призначення піоглітазону через його здатність запобігати прогресуванню інсулінорезистентності внаслідок зменшення ліпотоксичності, хронічного неспецифічного запалення, зниження ризику розвитку атерогенної дисліпідемії. На підставі наведених даних пацієнту Х. було скасовано дапагліфлозин і призначено піоглітазон (30 мг на добу перорально), рекомендовано корекцію функціонального стану печінки.
На жаль, іноді пацієнти мають низький рівень прихильності до призначеної терапії. Як зазначила Олена Бака, пацієнт відмовлявся від прийому гастроентерологічних препаратів, але регулярно навідувався в лабораторію для контролю рівнів печінкових проб. Зокрема, протягом січня-лютого 2025 р. було зафіксовано такі патологічні зміни: зберігалася активність цитолітичного синдрому (січень: АЛТ – 104,40 Од/л, АСТ – 49,5 Од/л; лютий: АЛТ – 96,30 Од/л, АСТ – 50,8 Од/л) на тлі нормалізації рівня ГГТП, покращення значень HbA1c (5,91%) і збереження високої сироваткової концентрації інсуліну (56,5 мкМО/мл за норми 2,2-25,0 мкМО/мл), підвищення індексу НОМА (18,13 за норми 1,0-2,6).
Естафету розгляду клінічного випадку підхопила кардіолог Лариса Міщенко, яка звернула увагу на зміни в клінічному аналізі крові (еритроцитоз – 5,65×1012/л за норми 4,0-5,5×1012/л), гіпергемоглобінемія – 176 г/л за норми 130-160 г/л), а також підкреслила деякі особливості в ліпідограмі. Зберігалося зростання ТГ до 2,26 ммоль/л (за норми 0,7-1,7 ммоль/л), ХС ліпопротеїнів дуже низької щільності (ЛПДНЩ) до 1,08 ммоль/л (за норми 0,26-1,04 ммоль/л), зменшення ХС ЛПВЩ до 0,61 ммоль/л (за норми 0,78-1,55 ммоль/л) на тлі досить невеликого вмісту загального ХС – 2,2 ммоль/л. Додаткове обстеження, проведене з цього приводу, виявило зниження рівня Апо-В до 0,50 г/л (за норми 0,55-1,30 г/л) і ліпопротеїну-α <2 мг/дл (за норми 5,6-33,8 мг/дл) на тлі незміненої концентрації Апо-А1 (1,0 г/л).
На підставі отриманих даних у пацієнта запідозрено сімейну гіпобеталіпопротеїнемію або абеталіпопротеїнемію, оскільки наведені результати відповідають критеріям діагностики зазначених патологій [12]. Відповідно до сучасних уявлень гетерозиготи та гомозиготи з низьким, але визначальним рівнем ХС ЛПНЩ не потребують спеціального лікування, тоді як гомозиготам за відсутності ЛПНЩ (як при абеталіпопротеїнемії) призначають вітамін Е, високожирову дієту та жиророзчинні вітаміни [12]. Прогноз для пацієнтів із сімейною гіпобеталіпопротеїнемією й абеталіпопротеїнемією є змінним, але рання діагностика та суворе дотримання лікування здатні затримати прогресування хвороби [12].
Спікерка процитувала декілька положень з рекомендацій AGA щодо лікування МАСХП у худих осіб, де допускається призначення високих доз вітаміну Е (100-300 мг/кг/добу) худорлявим пацієнтам з НАСГ, підтвердженим за допомогою біопсії, але без супутнього ЦД 2-го типу чи ЦП. У зазначених рекомендаціях також схвалюється застосування піоглітазону (30 мг на добу перорально) з метою покращення функціонального стану печінки та нормалізації рівня глікемії [7]. Лариса Міщенко підкреслила необхідність нормалізації роботи гепатоцитів для покращення ліпідного та вуглеводного обмінів.
Погане самопочуття та прояв гепатогенної втоми, що є одним із симптомів внутрішньопечінкового холестазу, нарешті привели пацієнта на консультацію до гастроентеролога. Як зазначила Олена Бака, з метою відновлення функціональної здатності гепатоцитів хворому було призначено оригінальний препарат адеметіоніну (S-adenosyl-L-methionine – SAMe), відомий під торговою назвою Гептрал® (Abbott, США). Доведено, що Гептрал® притаманний антиоксидантний ефект завдяки його здатності брати участь у синтезі глутатіону [1, 3, 8, 9, 13, 14]. Препарат відновлює структуру та функцію гепатоцитів завдяки посиленню синтезу фосфатидилхоліну [1, 3, 8, 9, 13, 14]; покращує ліпідний обмін унаслідок посилення елімінації ТГ та ХС ЛПДНЩ, знижуючи кількість жиру в печінці, та поліпшує регуляцію печінкового глюконеогенезу через опосередкований вплив на фарнезоїдний рецептор X (FRX) [1, 8, 9, 13]. На тлі тривалого прийому Гептрал® зменшується фіброзування [3] завдяки інгібуванню синтезу колагену. Адеметіонін має протизапальний та імуномодулювальний ефекти завдяки балансу про- та протизапальних цитокінів [1, 3, 9, 13].
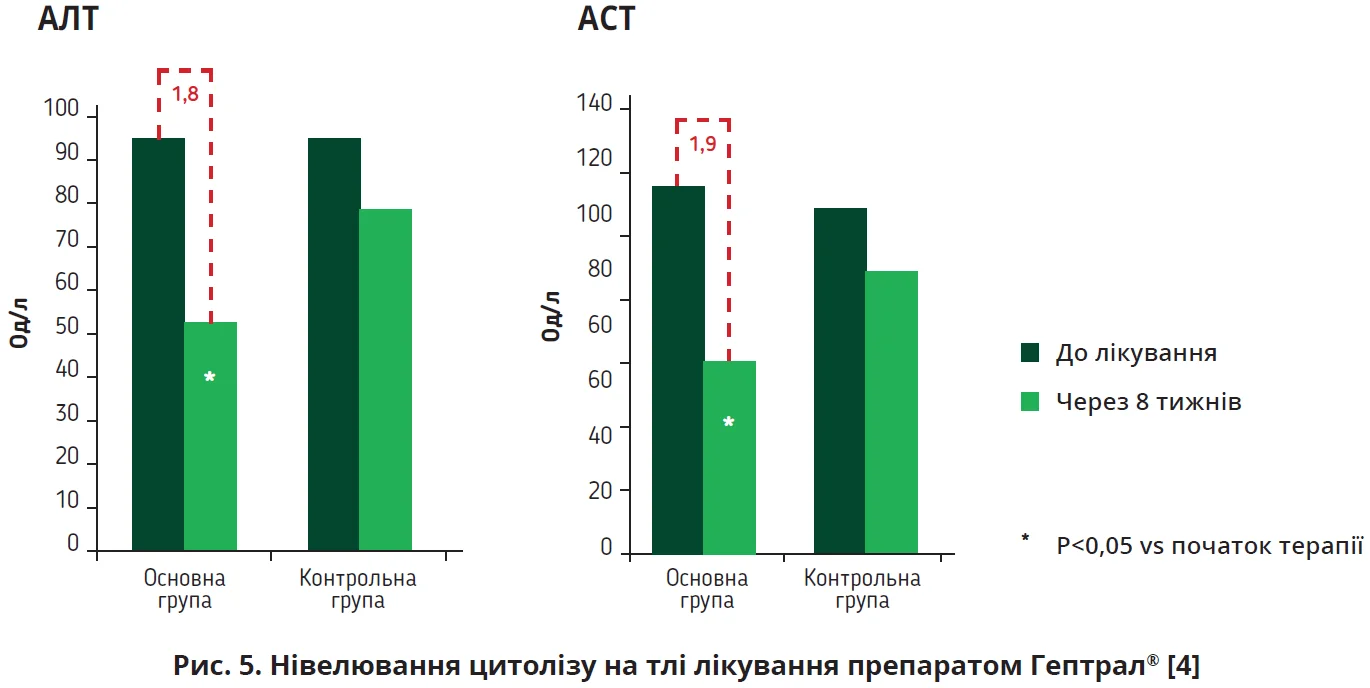
Клінічна ефективність препарату Гептрал® оцінювалася в різноманітних дослідженнях. В одному з них хворих на МАСХП (n=62) рандомізували для 8-тижневого перорального прийому Гептрал® (адеметіонін; n=31) або вітаміну Е (n=31) [4] (в оригінальному тексті згаданого дослідження використовується термін «неалкогольна жирова хвороба печінки» (НАЖХП). – Прим. ред.). Пацієнтам основної групи призначали адеметіонін у дозі 500 мг 2 рази на добу, хворі контрольної групи отримували вітамін Е 200 мг 3 рази на добу. Терапія препаратом Гептрал® (SAMe) сприяла вірогідному зниженню трансаміназ (рис. 5), нормалізації ліпідного профілю порівняно з групою контролю.
Згідно з інструкцією при призначенні Гептрал® (SAMe) слід дотримуватися послідовної покрокової схеми, яка передбачає 2-тижневу інтенсивну терапію із застосуванням парентеральної форми препарату (1-2 флакони вводять щоденно внутрішньом’язово або внутрішньовенно крапельно) з наступним переходом на пероральний прийом протягом 2 місяців (2-3 таблетки по 500 мг на добу) [14]. Передбачається також використання безін’єкційної схеми, коли прийом Гептрал® (SAMe) розпочинають із 3 таблеток на добу з метою швидкого зменшення дефіциту ендогенного SAMe, для чого потрібно щонайменше 2 тижні, а далі застосовують підтримувальну дозу 1000 мг на добу (2 таблетки) протягом наступних 2 місяців [14]. На тлі застосування Гептрал® (SAMe) вже на 7-му добу лікування зменшується активність маркерів цитолітичного та внутрішньопечінкового холестатичного синдромів і нівелюється гепатогенна втома [5]. Тривале застосування Гептрал® (SAMe) дає змогу покращити ліпідний профіль пацієнта й УЗД-картину, зберегти досягнутий терапевтичний ефект до 3 місяців після скасування препарату [15-17].
Також рекомендовано дообстеження з визначенням рівнів вітамінів Е, А та К, коагулограму та проведення молекулярно-генетичного тестування на наявність гена АРОВ.
Другий клінічний випадок
 Іншого пацієнта представила кардіолог Лариса Міщенко; головним героєм її розповіді став пацієнт К., 1983 р. н., який, на відміну від першого випадку, мав морбідне ожиріння: ІМТ становив 36,5 кг/м2.
Іншого пацієнта представила кардіолог Лариса Міщенко; головним героєм її розповіді став пацієнт К., 1983 р. н., який, на відміну від першого випадку, мав морбідне ожиріння: ІМТ становив 36,5 кг/м2.
З анамнезу хвороби відомо, що перші зміни рівня ГГТП (145,10 Од/л) з гіперглікемією (10 ммоль/л) зафіксовано в липні 2023 р. Під час розширеного лабораторного обстеження виявлено надзвичайно високий рівень загального ХС (14,33 ммоль/л), гіперглікемію (12,44 ммоль/л) і збільшення вмісту загального білка (121,7 г/л за норми 65-85 г/л) на тлі незміненої концентрації сечовини, креатиніну, АЛТ, АСТ й альбуміну; дослідити значення інших біохімічних показників не вдалося через значний хільоз сироватки.
Спікерка зауважила, що в цього пацієнта слід одразу запідозрити дисліпідемію, зумовлену генетичними мутаціями (сімейна гіперхолестеринемія, абеталіпопротеїнемія та гіпобеталіпопротеїнемія, хвороба утримання хіломікронів, гіпертригліцеридемія). Найімовірнішою патологією в цьому випадку є гомозиготна сімейна гіперхолестеринемія, котру діагностують на підставі високого базового рівня ХС ЛПНЩ (>10 ммоль/л) і наявності таких додаткових критеріїв, як ксантоми шкіри чи сухожиль до 10-річного віку та/або базове підвищення ХС ЛПНЩ [5]. Рекомендується також проводити генетичне тестування для підтвердження носійства біалельних патогенних / імовірно патогенних варіантів генів LDLR, APOB, PCSK9 або LDLRAP1 [5]. Високий рівень ХС ЛПНЩ (>10 ммоль/л) також є підґрунтям для виключення вторинного генезу його зростання та проведення диференційної діагностики з нефротичним синдромом, первинним біліарним ЦП, нелікованим гіпотиреозом, анорексією, прийомом певних медикаментів.
При повторному обстеженні спостерігали підвищення ГГТП (112,5 Од/л), гіперглікемію (16,67 ммоль/л) і зростання С-реактивного білка (87,7 мг/л за норми 50 мг/л), індексу НОМА (16,97) та HbA1c (9,46%) зі збереженням значного хільозу сироватки. Під час УЗД печінки також виявлено ознаки стеатозу, встановлено діагноз НАЖХП (який нині відповідає МАСХП), але він мав вторинний характер і розвинувся внаслідок первинного порушення ліпідного обміну. На тлі призначеного лікування (урсодезоксихолева кислота, Гептрал®, ацетилсаліцилова кислота, пантопразол, розувастатин 40 мг, езетиміб 10 мг, холестирамін) відзначили зниження рівнів ГГТП (99,3 Од/л), загального ХС (9,44 ммоль/л), С-реактивного білка (12,4 мг/л), але рівень ТГ залишався надзвичайно високим (14,5 ммоль/л), як і коефіцієнт атерогенності (9,49). Враховуючи зазначену динаміку, зробили висновок щодо можливої наявності в пацієнта сімейної комбінованої гіперліпідемії – спадкового метаболічного порушення, що характеризується підвищеними рівнями загального ХС, ТГ, ХС ЛПНЩ та зниженим рівнем ХС ЛПВЩ. Недостатня відповідь пацієнта на призначення гіполіпідемічних препаратів стала приводом для корекції терапії, яку провели згідно з рекомендаціями Європейського товариства кардіологів (ESC, 2021) [11]. Зазначена настанова припускає призначення статинів пацієнтам з гіпертригліцеридемією, а за умови їх недостатньої ефективності – додавання фенофібрату й ω3-поліненасичених жирних кислот [11].
Після консультації ендокринолога пацієнту було діагностовано інсулінозалежний ЦД 2-го типу середньої тяжкості в стані декомпенсації, з метою корекції якого було призначено інсулін, дапагліфлозин, α-ліпоєву кислоту, вітамін D. На думку гастроентеролога, основою ефективної корекції МАСХП у цьому випадку є нормалізація ліпідного обміну, а гематолог рекомендував гемоексфузії з метою компенсації явищ симптоматичного еритроцитозу. Отже, першим кроком на шляху розрішення явищ стеатозу печінки в пацієнта К. є нормалізація ліпідного й вуглеводного обмінів, чого можна досягти за допомогою комбінованої гіполіпідемічної
та гіпоглікемічної терапії. Поки що призначення гепатопротекторів цьому пацієнту є недоцільним, оскільки покращення ліпідного й вуглеводного обмінів сприятиме зменшенню навантаження на печінку та забезпечить покращення функціонування гепатоцитів, що має сприяти зменшенню явищ МАСХП. У наступному семінарі із серії Case challenge планується продовжити обговорення цього клінічного спостереження після отримання результатів контрольних біохімічних досліджень у ході динамічного спостереження.
Наведені клінічні випадки демонструють значущість корекції порушень ліпідного обміну при МАСХП і важливість розуміння патогенезу їх виникнення, що зумовить застосування різних підходів до терапії.
Переглянути запис вебінару Ви можете за посиланням https://www.youtube.com/live/fGJuk3KDX9o?si=BY9o-4OgXJ4A8SEn
Література
- Altamirano-Barrera А., Barranco-Fragoso В., Méndez-Sanchez N. Management strategies for liver fibrosis. Annals of Hepatology. 2017; 16 (1): 48-56.
- American Diabetes Association Professional Practice Committee; 4. Comprehensive medical evaluation and assessment of comorbidities: standards of care in diabetes – 2025. Diabetes Care. 2025; 48 (1): S59-S85. doi: 10.2337/dc25-S004.
- Anstee Q., et al. S-adenosylmethionine (SAMe) therapy in liver disease: a review of current evidence and clinical utility. J. Hepatology. 2012; 57: 1097-1109.
- Aнохіна Г.A., Харченко B.B., Динник O.Б. Роль запалення та метаболічних порушень у прогресуванні хронічних захворювань печінки: профілактика та лікування. Здоров’я України. 2018; 15-16 (436-437): 60-62.
- Boming L. Observation of efficacy of ademetionine for treating non-alcoholic fatty liver disease. Chinese Hepatol. 2011; 16 (4): 350-351.
- Cuchel M., Raal F.J., Hegele R.A., et al. 2023 Update on European Atherosclerosis Society Consensus Statement on Homozygous Familial Hypercholesterolaemia: new treatments and clinical guidance. Eur. Heart J. 2023 Jul 1; 44 (25): 2277-2291. doi: 10.1093/eurheartj/ehad197.
- European Association for the Study of the Liver; European Association for the Study of Diabetes; European Association for the Study of Obesity. EASL-EASD-EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD): executive summary. Diabetologia. 2024; 67 (11): 2375-2392. doi: 10.1007/s00125-024-06196-3.
- Long M.T., Noureddin M., Lim J.K. AGA clinical practice update: diagnosis and management of nonalcoholic fatty liver disease in lean individuals: expert review. Gastroenterology. 2022; 163 (3): 764-774.e1. doi: 10.1053/j.gastro.2022.06.023.
- Mao H., et al. Hepatoprotective effect of S-ademetionine in the treatment of intrahepatic cholestasis through farnesoid X receptor mechanism in rats. J. Biomol. Res. Ther. 2019; 8: 176. doi: 10.35248/2167-7956.19.8.176.
- Mato J.M., Martinez-Chantar M.L., Shelly C.Lu. S-adenosylmethionine metabolism and liver disease. Ann. Hepatol. 2013; 12 (2): 183-189.
- Stefan N., Yki-Järvinen H., Neuschwander-Tetri B.A. Metabolic dysfunction-associated steatotic liver disease: heterogeneous pathomechanisms and effectiveness of metabolism-based treatment. Lancet Diabetes Endocrinol. 2025; 13 (2): 134-148. doi: 10.1016/S2213-8587(24)00318-8.
- Visseren F.L.J., Mach F., Smulders Y.M., et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur. Heart J. 2021; 42 (34): 3227-3337. doi: 10.1093/eurheartj/ehab484.
- Welty F.K. Hypobetalipoproteinemia and abetalipoproteinemia: liver disease and cardiovascular disease. Curr. Opin. Lipidol. 2020; 31: 49-55.
- Інструкція для медичного застосування лікарського засобу Гептрал®.
- Барановский А.Ю., Райхельсон К.Л., Марченко Н.В. Применение Ѕ-аденозилметионина (Гептрал®) в терапии больных неалкогольным стеатогепатитом. Клинические перспективы гастроэнтерологии, гепатологии. 2010; 1: 3-10.
- Подымова С.Д. Адеметионин: фармакологические эффекты и клиническое применение препарата. РМЖ. 2010; 13.
- Харченко Н.В. Адеметионин в лечении внутрипеченочного холестаза в рутинной клинической практике в Украине: проспективное постмаркетинговое обсервационное исследование. Современная гастроэнтерология. 2013; 5: 60-69.