Безпека та доцільність застосування високих доз вітаміну D
Підготувала д-р мед. наук Лариса Стрільчук
Підраховано, що дефіцит вітаміну D відзначається приблизно в ½ населення світу незалежно від віку й етнічної приналежності [1]. Нестача вітаміну D призводить до несприятливих скелетних (остеопенія, остеопороз, переломи) та позаскелетних (підвищення ризику розвитку серцево-судинних, автоімунних, інфекційних, респіраторних і ендокринних хвороб; збільшення ймовірності новоутворень; зростання смертності; погіршення якості життя) наслідків. У загальній популяції практично здорових осіб рівень вітаміну D <30 нмоль/л вважається дефіцитом, 30-50 нмоль/л – нестачею, 50-125 нмоль/л – оптимальним його вмістом. У груп ризику авітамінозу оптимальний показник становить 75-125 нмоль/л, а рівень 30-75 нмоль/л вважається нестачею цього вітаміну [2, 3].
Яких хімічних перетворень зазнає вітамін D в організмі?
Термін «вітамін D» охоплює групу жиророзчинних сполук, основним хімічним елементом яких є холестеринове кільце. Хоча історично закріпилося поняття «вітамін D», насправді він є прогормоном, оскільки бере участь у нейробіологічних і сигнальних біохімічних реакціях, а для реалізації своїх біологічних ефектів потребує кількаетапних перетворень в організмі [4].
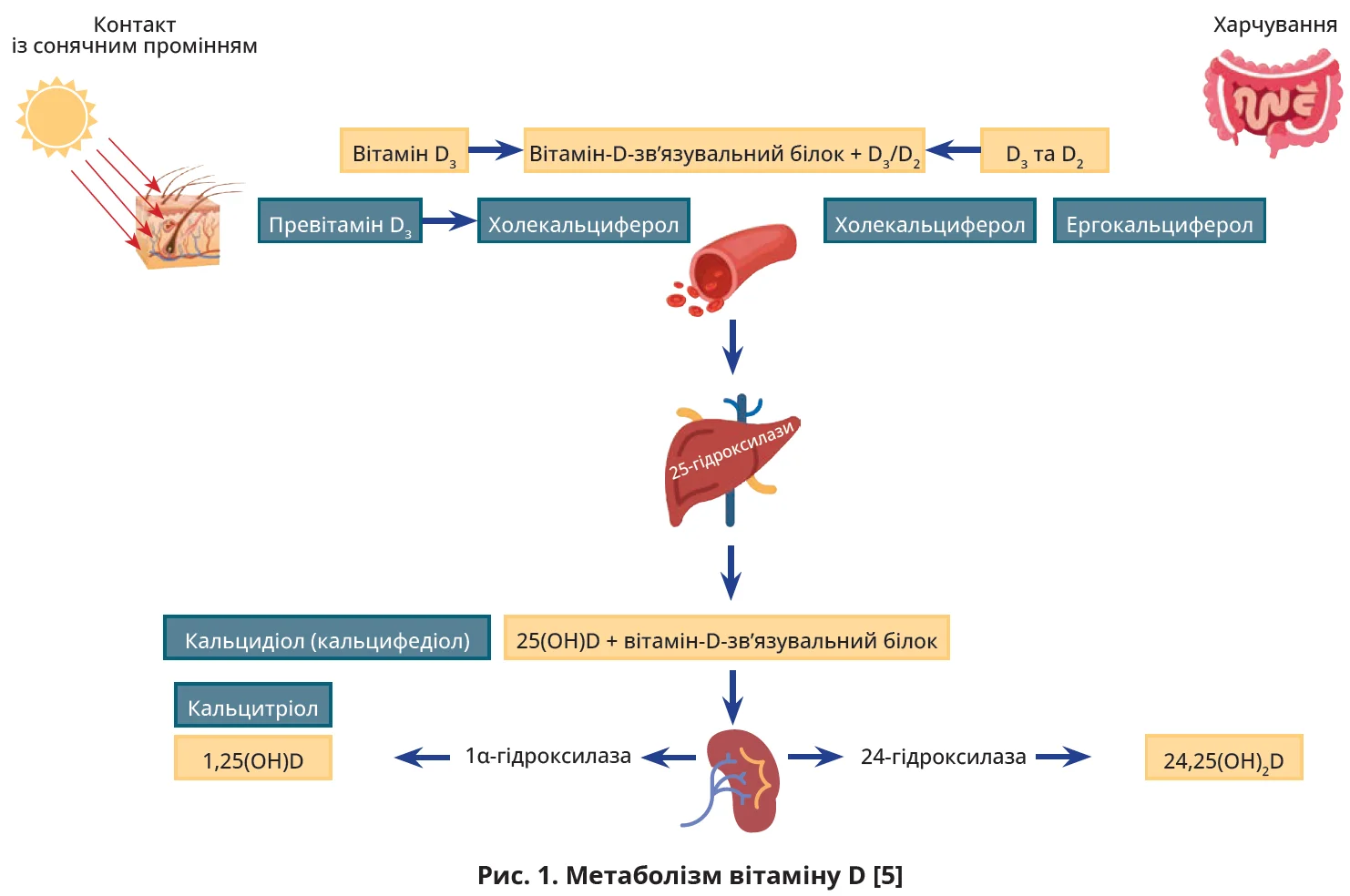
Основним джерелом вітаміну D в організмі людини є його синтез у шкірі, оскільки продукти, що містять цей вітамін, а саме жир печінки тріски, форель, лосось, сардини, не входять у більшість патернів харчування в достатній кількості [5].
Превітамін D3 синтезується в шкірі з 7-дегідрохолестерину (провітаміну D) під впливом ультрафіолетового випромінювання. На ефективність синтезу вітаміну в шкірі впливають вік, колір шкіри (вміст у ній меланіну), пора року, погода, широта та довгота місцевості, час доби, особливості одягу, застосування сонцезахисних засобів, тип шкіри. Наприклад, у осіб похилого віку шкірний синтез вітаміну D може знижуватися на 75%, особливо взимку й у північних широтах [5].
Превітамін D3 є термічно нестабільним та ізомеризується у вітамін D3 у базальному шарі епідермісу. Крім синтезу, джерелами вітаміну D виступають усмоктування вітамінів D2 і D3 з їжі та препаратів. Вітамін D зв’язується з вітамін-D-зв’язувальним білком і накопичується в жировій тканині, звідки згодом транспортується до печінки, де форми D2 та D3 ідроксилюються печінковими 25-гідроксилазами з утворенням 25-гідроксихолекальциферолу (кальцидіолу, 25(OH)D).
Останній повторно гідроксилюється в нирках з утворенням активного секостероїду кальцитріолу – 1,25(OH)2D, який взаємодіє з рецепторами вітаміну D та чинить активну дію на тканини-мішені (рис. 1). Основною циркулювальною формою вітаміну D є кальцидіол, період напіврозпаду якого становить 2-3 тижні. Натомість для кальцитріолу – активної форми – цей показник становить лише 4-8 годин.
Отже, для утворення біоактивної речовини вітамін D проходить дворазове гідроксилювання. Такі біохімічні перетворення, що являють собою процес активації, не притаманні жодному іншому вітаміну [5].
Кому та в яких дозах треба призначати вітамін D?
Відповідно до положень міжнародної настанови «Вітамін D у профілактиці хвороб» (2024) вагітним, особам віком 1-18 та ≥75 років, пацієнтам з переддіабетом показаний емпіричний прийом вітаміну D, тобто без попереднього визначення вмісту цього вітаміну в сироватці крові (табл. 1) [6].
Згідно з польськими рекомендаціями щодо лікування та профілактики дефіциту вітаміну D (2023) засобом вибору є холекальциферол. Застосування холекальциферолу має бути індивідуалізованим і залежати від віку, маси тіла, контакту із сонячним промінням, особливостей харчування та способу життя. Пристосування режиму вживання вітаміну D до вподобань пацієнта та застосування його раз на тиждень або раз на місяць можуть сприятливо впливати на прихильність.
Із профілактичною метою в немовлят віком 0-6 місяців доцільно застосовувати холекальциферол у дозі 400 МО на добу з перших днів життя незалежно від способу вигодовування, віком 6-12 місяців – 400-600 МО на добу залежно від умісту вітаміну D у продуктах харчування. Здорові діти віком 1-3 роки мають отримувати 600 МО холекальциферолу впродовж усього року. Якщо дитина віком 4-10 років підлягає сонячному випромінюванню з відкритими руками та ногами протягом 15-20 хвилин у проміжку часу з 10:00 до 15:00 без сонцезахисту з травня до кінця вересня, добавки вітаміну D є необов’язковими, однак рекомендованими й безпечними. Якщо ж дитина не отримує належного сонячного опромінення, застосовують 600-1000 МО вітаміну D на добу протягом цілого року. Аналогічно для підлітків віком 11-18 років і дорослих віком 19-65 років, якщо сонячне опромінення є достатнім (перебування з відкритими руками та ногами протягом 30-45 хвилин у проміжку часу з 10:00 до 15:00 без сонцезахисту з травня до кінця вересня), вітамін D є необов’язковим, але рекомендованим, а якщо ні, слід уживати добавки цього вітаміну в дозі 1000-2000 МО на добу протягом усього року.
В осіб похилого віку ефективність синтезу вітаміну D у шкірі знижується, тому у віковій групі 66-75 років доцільно вживати 1000-2000 МО на добу, а в групі ≥76 років – 2000-4000 МО на добу протягом усього року. Під час вагітності та лактації доцільно вживати холекальциферол у дозі 2000 МО на добу.
Що стосується лікування дефіциту вітаміну D, то потрібно досягти та підтримувати в організмі пацієнта оптимальну концентрацію 25(OH)D за допомогою щоденних або кумулятивних (1 раз на тиждень, на 2 тижні або на місяць) доз вітаміну. Щоденне та кумулятивне дозування є однаково ефективним і безпечним, однак адаптація режиму лікування до побажань пацієнта та вживання вітаміну D раз на тиждень чи раз на місяць може покращувати прихильність до лікування. Лікування має тривати 1-3 місяці або до досягнення сироваткової концентрації 25(OH)D ≥30-50 нг/мл, після чого слід перейти на відповідну до віку підтримувальну (профілактичну) дозу.
Лікувальні дози для немовлят віком 0-12 місяців становлять 2000 МО на добу, для дітей віком 1-10 років – 4000 МО на добу, для підлітків віком 11-18 років і всіх дорослих– 4000 МО на добу, або 7000-10 000 МО на тиждень, або 20 000-30 000 МО на 2 тижні, або 30 000 МО на місяць [7].
Хоча національні та міжнародні наукові товариства однозначно погоджуються, що вміст вітаміну D потрібно підтримувати в оптимальних межах, найкращий метод досягнення цього дотепер обговорюється.
Доза, необхідна для ефективного лікування дефіциту вітаміну D, є варіабельною й залежить передусім від немодифікованих індивідуальних чинників (здатність до всмоктування вітаміну, активність печінкового гідроксилювання, невідомі генетичні причини тощо). Цікаво, що відповідь на вітамін D залежить також від вихідного рівня 25(OH)D. Підраховано, що за умови повноцінного всмоктування на кожні 100 МО холекальциферолу, що надходить в організм, сироватковий рівень 25(OH)D зростає на 0,7-1,0 нг/мл, причому найвираженіше збільшення відзначається в осіб з найнижчим вихідним рівнем 25(OH)D [5]. Після перорального приймання вітамін D швидко всмоктується, досягаючи максимального рівня приблизно через 24 години. Рівні 25(OH)D поступово підвищуються до піку на 7-14-й день залежно від дози [8].
Слід зауважити, що в пацієнтів з ожирінням і дефіцитом вітаміну D, осіб з мальабсорбцією та хворих, які отримують препарати, здатні порушувати метаболізм вітаміну D, треба корегувати дозу, призначаючи у 2-3 рази вищу кількість, аніж зазвичай. Провідною метою застосування вітаміну D є поповнення його запасу, після чого пацієнти мають отримувати підтримувальну дозу [2, 5].
Чи є застосування високих доз вітаміну D доцільним і безпечним?
Завдання навантажувальної дози вітаміну D полягає у швидкій нормалізації вмісту 25(OH)D у сироватці крові. З цією метою нерідко застосовуються високі дози препарату, інтермітивне (не щоденне) застосування котрих дає змогу оптимізувати прихильність пацієнтів до лікування. В умовах реальної клінічної практики застосування кумулятивних доз (1 раз на тиждень, 2 тижні або місяць) забезпечує високу ефективність, оскільки після приймання болюсної дози ліпофільний холекальциферол накопичується в жировій тканині та протягом тривалого часу залишається біодоступним для організму [2].
Рандомізоване подвійне сліпе дослідження Calgary Vitamin D Study виявило, що профіль безпеки вітаміну D у дозах 400, 4000 та 10 000 МО на добу є однаковим. Гіперкальціурія та гіперкальціємія частіше виникали на тлі високих доз, однак остання траплялася рідко й була незначною та минущою, що свідчить про здатність організму людини виводити надлишкову кількість кальцію при вживанні високих доз вітаміну D [9].
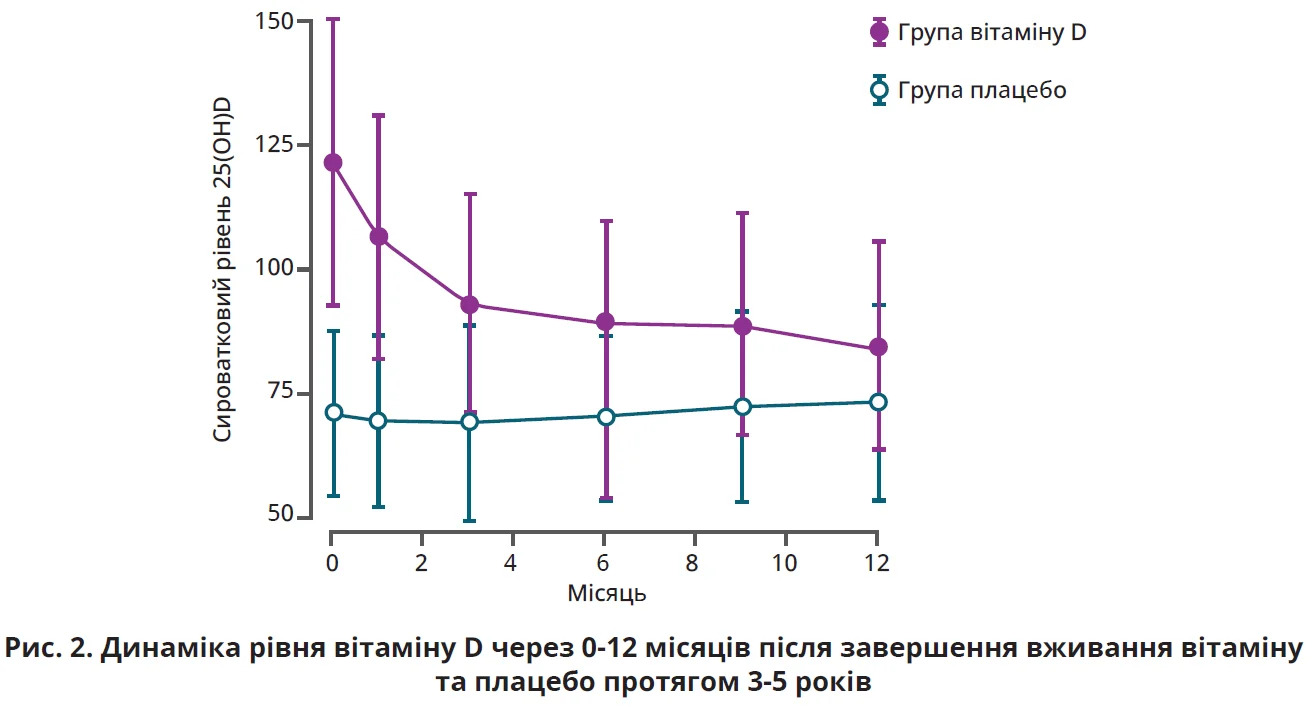
Безпеку й довготривалий ефект високих доз вітаміну D було доведено також у дослідженні I. Martinaityte та співавт. (2017) [10]. У цьому дослідженні взяли участь особи, які отримували вітамін D у дозі 20 000 МО або плацебо 1 раз на тиждень протягом 3-5 років. Аналіз зразків крові та жирової тканини виявив, що через рік після завершення вживання вітаміну D його вміст у сироватці крові осіб, які отримували вітамін, був достовірно вищим за показник групи плацебо (84,5 проти 73,1 нмоль/л; рис. 2).
Автори дійшли висновку, що вітамін D накопичується в жировій тканині, звідки поступово вивільняється в кровообіг, що забезпечує довготривалий сприятливий вплив на сироватковий уміст 25(OH)D.
У рандомізованому контрольованому дослідженні призначення 30 000 МО вітаміну D 1 раз на тиждень протягом 12 тижнів не спричиняло побічних явищ, натомість забезпечувало ефективну нормалізацію показника 25(OH)D. Через 8 тижнів лікування рівня 25(OH)D ≥25 нг/мл змогли досягти 95% пацієнтів, які отримували 30 000 МО на тиждень, і лише 33% пацієнтів, які отримували 1000 МО на добу. Наприкінці дослідження перевага інтермітивного застосування високих доз була ще разючішою: показника 25(OH)D >30 нг/мл досягли 95% пацієнтів групи 30 000 МО на тиждень і 24% пацієнтів групи 1000 МО на добу [11]. Подібні результати отримали й інші автори, які запропонували призначати особам з дефіцитом вітаміну D 30 000 МО холекальциферолу 1 або 2 рази на тиждень протягом 5 тижнів [12].
У дослідженні за участю пацієнтів із хронічною хворобою нирок II-IV стадії застосування вітаміну D у дозі 5000 і 20 000 МО на тиждень через 12 місяців забезпечувало підвищення вмісту 25(OH)D в обох групах, однак у групі високих доз підвищення було вираженішим. Паралельно відбувалося зниження сироваткового паратгормону, яке теж було вираженішим у групі високих доз [13].
Причиною застережень до призначення високих доз вітаміну D є зосередження на можливих явищах інтоксикації, а не на терапевтичному ефекті. Проте слід зауважити, що інтоксикація зазвичай спостерігається в осіб, які самовільно, без призначення лікаря, вживали дуже високі дози цього вітаміну (50 000-100 000 МО на добу!) протягом кількох місяців або навіть років [14, 15].
Чи є в Україні вітчизняні високодозові препарати вітаміну D?
Відеїн 20 000 (АТ «Київський вітамінний завод») містить 500 мкг холекальциферолу (20 000 МО вітаміну D3) – тижневий курс профілактики/лікування – в одній капсулі. Цей препарат показаний для лікування клінічно підтвердженого дефіциту вітаміну D у дорослих, профілактики дефіциту вітаміну D у пацієнтів з високим ризиком і як доповнення до специфічної терапії остеопорозу в пацієнтів з дефіцитом або високим ризиком нестачі вітаміну D. Важливо, що допоміжними речовинами Відеїну 20 000 є a-токоферолу ацетат і тригліцериди середнього ланцюга. α-токоферол (вітамін Е) – відомий антиоксидант, різнобічні переваги якого для організму докладно описано в науковій літературі. На відміну від низки інших препаратів вітаміну D Відеїн 20 000 не містить таких потенційних алергенів, як арахісова, сафлорова, соняшникова та соєва олії.
Відеїн 20 000 виготовляє відомий вітчизняний виробник вітамінів – АТ «Київський вітамінний завод», який дотримується вимог Належної виробничої практики (GMP). Відеїн 20 000 дає змогу забезпечити ефективну профілактику та лікування дефіциту вітаміну D, а продуманий склад допоміжних речовин, зручна форма випуску й дозування (м’які желатинові капсули)
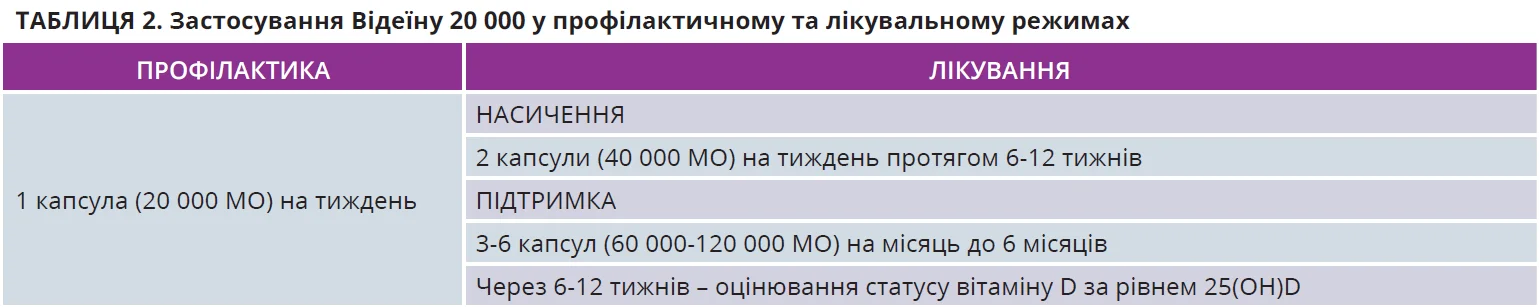
та доступна ціна забезпечують цьому препарату додаткові переваги. Рекомендований режим уживання Відеїну 20 000 у режимі лікування передбачає фази насичення та підтримки (табл. 2).
Завдяки тривалому періоду напіввиведення вітаміну D (близько 2 місяців) щотижневе або щомісячне споживання великих доз холекальциферолу дає змогу досягти тих самих значень у сироватці крові, як і за щоденного споживання, проте скорочення кількості капсул, які потрібно прийняти, забезпечує підвищення прихильності пацієнтів унаслідок спрощення режиму застосування.
Література
- Mavar M., Sorić T., Bagarić E., Sarić A., Matek Sarić M. The power of vitamin D: is the future in precision nutrition through personalized supplementation plans? Nutrients. 2024; 16 (8): 1176. doi: 10.3390/nu16081176.
- Giustina A., Bilezikian J.P., Adler R.A., Banfi G., Bikle D.D., et al. Consensus statement on vitamin D status assessment and supplementation: whys, whens, and hows. Endocr. Rev. 2024 Sep 12; 45 (5): 625-654. doi: 10.1210/endrev/bnae009.
- Bertoldo F., et al. Proposal for the reporting of vitamin D determination. Biochimica Clinica. 2024. Available at: https://biochimicaclinica.it/wp-content/uploads/2024/07/BC047-24-Lombardi_dp.pdf.
- Ellison D.L., Moran H.R. Vitamin D: vitamin or hormone? Nurs. Clin. North Am. 2021 Mar; 56 (1): 47-57. doi: 10.1016/j.cnur.2020.10.004. Epub 2020.
- Dominguez L.J., Farruggia M., Veronese N., Barbagallo M. Vitamin D sources, metabolism, and deficiency: available compounds and guidelines for its treatment. Metabolites. 2021 Apr 20; 11 (4): 255. doi: 10.3390/metabo11040255.
- Demay M.B., Pittas A.G., Bikle D.D., Diab D.L., Kiely M.E., et al. Vitamin D for the prevention of disease: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2024 Jul 12; 109 (8): 1907-1947. doi: 10.1210/clinem/dgae290. PMID: 38828931.
- Płudowski P., Kos-Kudła B., Walczak M., Fal A., Zozulińska-Ziółkiewicz D., et al. Guidelines for preventing and treating vitamin D deficiency: a 2023 update in Poland. Nutrients. 2023 Jan 30; 15 (3): 695. doi: 10.3390/nu15030695.
- Silva M.C., Furlanetto T.W. Intestinal absorption of vitamin D: a systematic review. Nutr. Rev. 2018 Jan 1; 76 (1): 60-76. doi: 10.1093/nutrit/nux034.
- Billington E.O., Burt L.A., Rose M.S., et al. Safety of high-dose vitamin D supplementation: secondary analysis of a randomized controlled trial. J. Clin. Endocrinol. Metab. 2020 Apr 1; 105 (4): dgz212. doi: 10.1210/clinem/dgz212. Erratum in: J. Clin. Endocrinol. Metab. 2021 Mar 25; 106 (4): e1932. doi: 10.1210/clinem/dgaa886.
- Martinaityte I., Kamycheva E., Didriksen A., Jakobsen J., Jorde R. Vitamin D stored in fat tissue during a 5-year intervention affects serum 25-hydroxyvitamin D levels the following year. J. Clin. Endocrinol. Metab. 2017 Oct 1; 102 (10): 3731-3738. doi: 10.1210/jc.2017-01187.
- Tóth B.E., Takács I., Szekeres L., et al. Safety and efficacy of weekly 30,000 IU vitamin D supplementation as a slower loading dose administration compared to a daily maintenance schedule in deficient patients: a randomized, controlled clinical trial. Journal of Pharmacovigilance. 2017 Jan. doi: 10.4172/2329-6887.1000233.
- Takács I., et al. Randomized clinical trial to comparing efficacy of daily, weekly and monthly administration of vitamin D3. Endocrine. 2017 Jan; 55 (1): 60-65. doi: 10.1007/s12020-016-1137-9. Epub 2016 Oct 7.
- Oksa A., Spustová V., Krivosíková Z., Gazdíková K., Fedelesová V., et al. Effects of long-term cholecalciferol supplementation on mineral metabolism and calciotropic hormones in chronic kidney disease. Kidney Blood Press. Res. 2008; 31 (5): 322-329. doi: 10.1159/000157177.
- Holick M.F. Vitamin D is not as toxic as was once thought: a historical and an up-to-date perspective. Mayo Clin. Proc. 2015 May; 90 (5): 561-564. doi: 10.1016/j.mayocp.2015.03.015.
- Marcinowska-Suchowierska E., Kupisz-Urbańska M., Łukaszkiewicz J., Płudowski P., Jones G. Vitamin D toxicity – a clinical perspective. Front. Endocrinol. (Lausanne). 2018 Sep 20; 9: 550. doi: 10.3389/fendo.2018.00550.