Ад’ювантні засоби при діабетичній нейропатії: варто чи ні?
Підготувала канд. мед. наук Ольга Королюк
Цукровий діабет (ЦД) вважається найбільшою глобальною епідемією XXI ст. через значну поширеність, що швидко й неухильно зростає. За оцінками Міжнародної федерації діабету (IDF), у 2021 р. кількість людей із діабетом у світі досягла 537 млн; за прогнозами, до 2030 р. ця цифра сягне 643 млн, до 2045 р. – 783 млн; на лікування діабету та його ускладнень спрямовано близько 1 трлн доларів США [1].
Приблизно в половини людей із діабетом виникає ураження периферичної або вегетативної нервової системи – діабетична нейропатія (ДНП) [2].
Це ускладнення є найвагомішим ініціювальним чинником ризику утворення виразок стопи й ампутацій [3]; асоціюється з високим ризиком падінь, появою хронічного болю, депресії, розладів сну, порушенням повсякденного функціонування та зниженням якості життя [4]. Важливими проблемами є недостатня діагностика та неадекватне лікування ДНП [5, 6].
Це особливо актуально в Україні в умовах великої війни, коли люди позбавлені можливості вчасно звернутися до фахівців, пройти потрібні обстеження чи отримати кваліфіковану медичну допомогу, не мають доступу до ліків або фінансової спроможності їх придбати. Вказані обставини неминуче призведуть до збільшення кількості пацієнтів із задавненою ДНП. Проте навіть за умови своєчасної діагностики лікування ДНП пов’язане з низкою викликів: невідповідність рекомендацій у різних міжнародних настановах, недостатність якісних доказів щодо всіх видів терапії, відсутність лікування, котре впливало би на всі патогенетичні механізми ДНП, небажані ефекти або резистентність до антинейропатичної терапії [7]. Цей огляд розглядає сучасні підходи до лікування ДНП та висвітлює світовий досвід використання ад’ювантних засобів терапії – вітамінів і нуклеотидів.
Визначення та класифікація ДНП
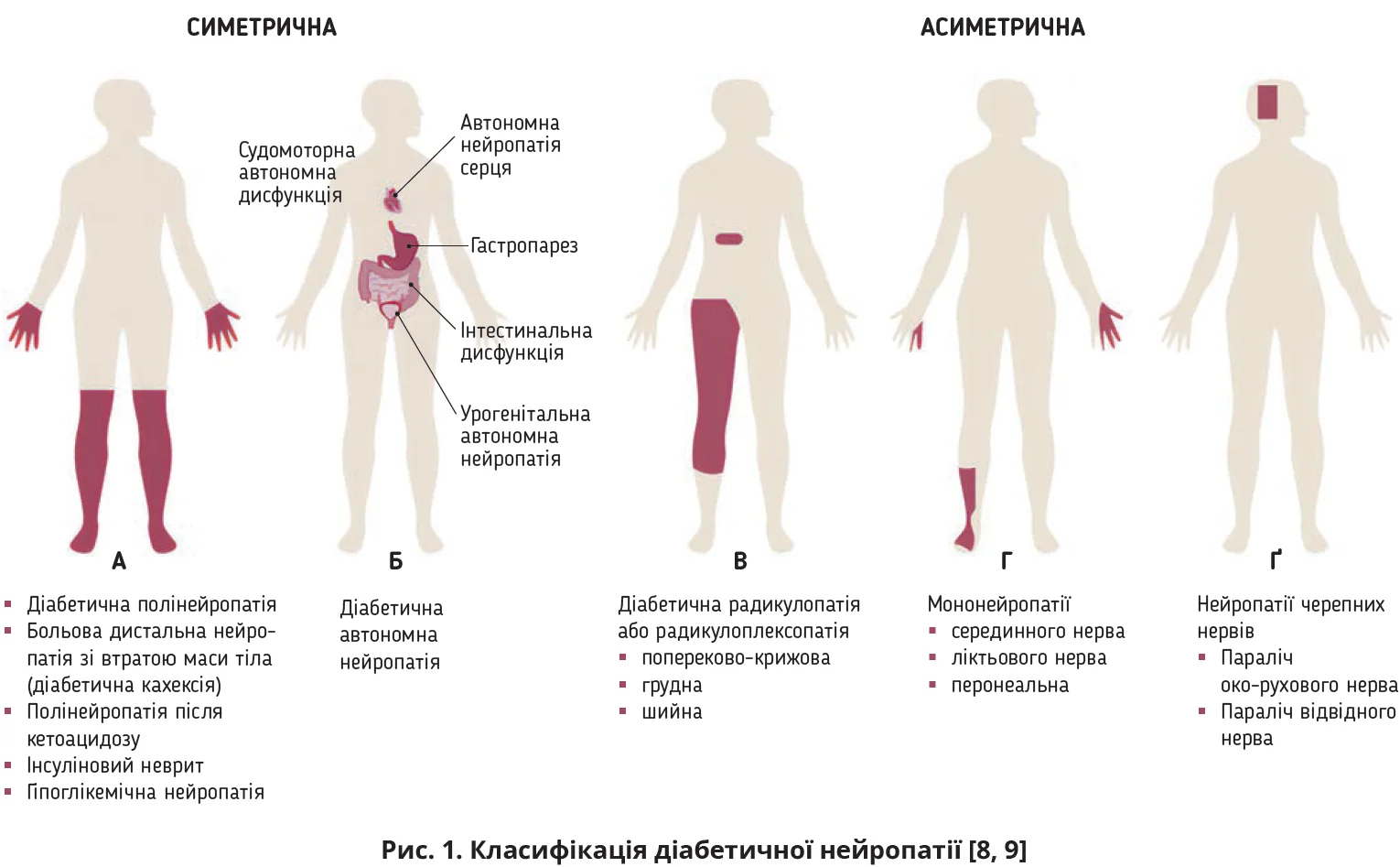
ДНП – одне з найпоширеніших ускладнень діабету, зумовлене дифузним або вогнищевим ураженням периферичної та вегетативної нервових систем [8]. Найпоширенішою формою ДНП є дистальна симетрична полінейропатія, котра зазвичай уражає кінцівки з класичним розподілом за типом «панчіх і рукавичок» (рис. 1А). Можливі також вегетативні нейропатії, як-от автономна нейропатія серця, порушення моторики шлунково-кишкового тракту, діабетична цистопатія й імпотенція (рис. 1Б). Менш поширеними формами ДНП є вогнищеві (асиметричні) нейропатії, які включають дисфункцію нервових корінців або окремих периферичних нервів, що призводить до радикулоплексопатії, полірадикулопатії (рис. 1В), ізольованої мононейропатії (рис. 1Г), зрідка до ураження черепних нервів (рис. 1Ґ). Певні форми ДНП, зазвичай дистальна симетрична та вегетативна нейропатії, можуть бути спричинені лікуванням діабету. Нейропатію, зумовлену лікуванням, часто складно діагностувати [8, 9].
У 30-50% пацієнтів із ДНП виникає нейропатичний біль, який найчастіше проявляється як спонтанний пекучий біль у стопах, що може супроводжуватися поколюванням і відчуттям, схожим на електричний удар [7, 10]. Окрім того, в пацієнтів із ДНП можуть виникати позитивні та негативні сенсорні симптоми. До позитивних симптомів належать алодинія (виникнення болю після зазвичай безболісної стимуляції, наприклад щіточкою) та гіпералгезія (аномально підвищена чутливість до болю). Негативними сенсорними симптомами є парестезії й оніміння (втрата чутливості). Отже, больовій ДНП притаманний своєрідний парадокс: пацієнт повідомляє, що ноги постійно болять, але не відчуває дотику. Чому в частини пацієнтів виникає біль, а в інших – ні, поки що не з’ясовано. Імовірно, це зумовлено складною взаємодією генетичних чинників, соматосенсорних схем і психологічних реакцій у відповідь на дію стресорів [11].
Епідеміологія та чинники ризику ДНП
Захворюваність на ДНП вища в пацієнтів із ЦД 2-го типу порівняно з ЦД 1-го типу (6100 проти 2800 на 100 тис. людино-років відповідно) [4, 12, 13]. Проте поширеність ДНП за обох типів діабету істотно не відрізняється: 11-50% у разі ЦД 1-го типу та 8-51% у разі ЦД 2-го типу [14-18]. З урахуванням безсимптомних випадків поширеність ДНП сягає 54% в осіб із ЦД 1-го типу та 45% в осіб із ЦД 2-го типу [18].
Поширеність ДНП істотно збільшується при тривалому, ускладненому та погано контрольованому діабеті. Зокрема, впродовж 10-річного спостереження за пацієнтами з ЦД 2-го типу поширеність ДНП зросла з 8 до 42% [17]. У великій когорті пацієнтів із тяжчим ЦД 2-го типу та підтвердженою ішемічною хворобою серця частка осіб із ДНП становила 50%, а 4-річна кумулятивна частота ДНП – 66-72% [13]. Дослідження, проведене в Данії, вказує, що за умови доброго глікемічного контролю ЦД 2-го типу частота ДНП зменшилася від 13% на початку дослідження до 10% упродовж 13 років спостереження [19].
Основними чинниками ризику ДНП вважаються тривалість діабету та рівень глікованого гемоглобіну (HbA1c) [15]. Інші незалежні чинники ризику ДНП включають вік, високий зріст, куріння, зловживання алкоголем [22]. У пацієнтів із ЦД 2-го типу додаються артеріальна гіпертензія, абдомінальне ожиріння, інсулінорезистентність, низькі рівні холестерину ліпопротеїнів високої щільності та гіпертригліцеридемія [20, 21]. Ризик больової ДНП вищий у жінок, пацієнтів із тяжкою ДНП, втратою чутливості, поганим контролем глікемії, порушенням функції нирок і високим індексом маси тіла [23-25].
Патофізіологічні механізми ДНП
Фактично ДНП є нейродегенеративною хворобою периферичної нервової системи з переважним ураженням сенсорних і вегетативних аксонів.
Моторні аксони страждають значно пізніше та меншою мірою. Іншою особливістю ДНП є найтяжче ураження периферії довгих сенсорних аксонів із відносним збереженням клітинних тіл [8].
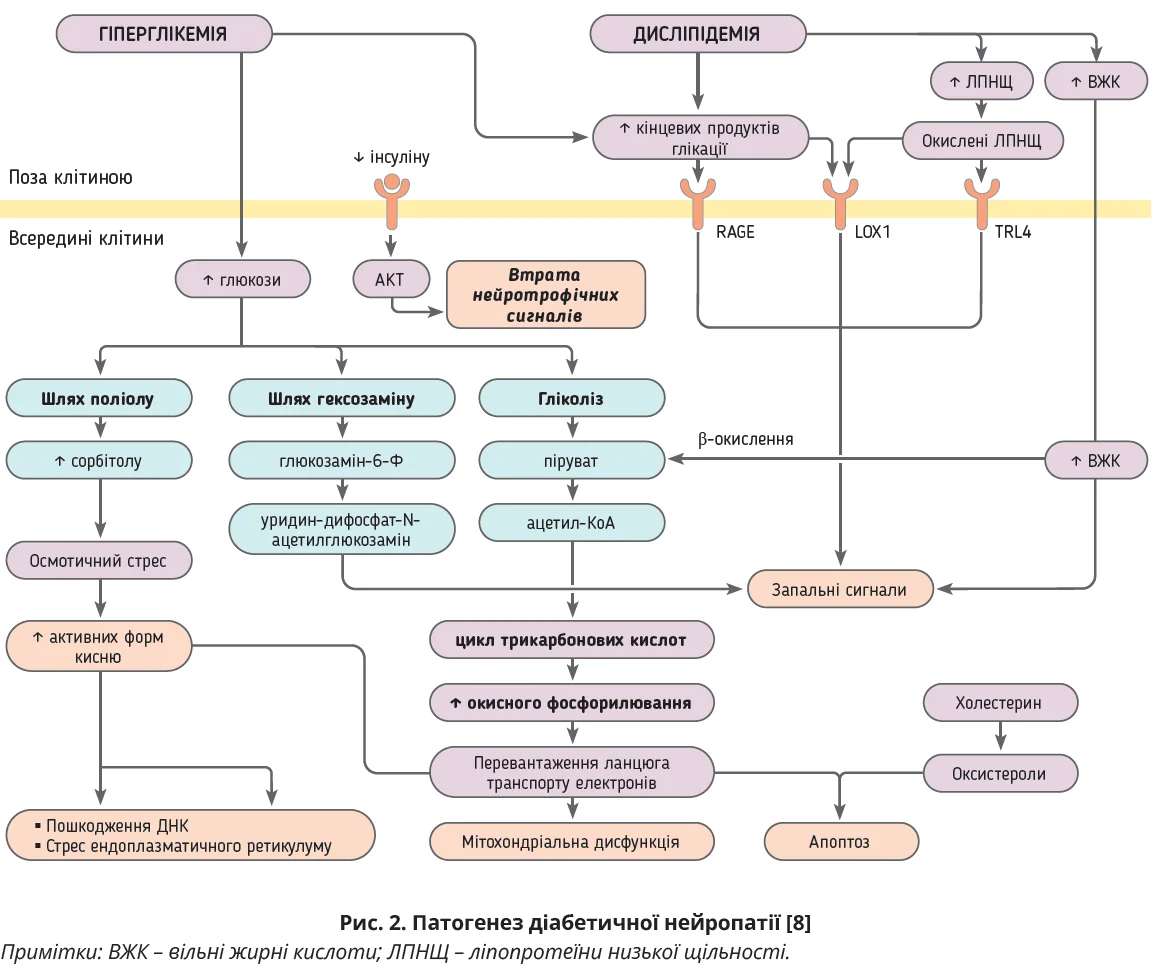
Для розуміння патогенезу ДНП важливо розуміти використання енергетичних субстратів периферичною нервовою системою та їх порушення при діабеті (рис. 2).
У клітинах Шванна, нейронах і аксонах дорзальних корінцевих гангліїв утворення NADH і FADH2 відбувається з глюкози через гліколіз і цикл трикарбонових кислот або із жирних кислот через β-окислення. Кожен цикл β-окислення утворює одну молекулу ацетил-КоА, яка транспортується до циклу трикарбонових кислот. Діабет призводить до перевантаження субстратом, і молекули ацетил-КоА перетворюються на токсичні для клітин Шванна та нейронів ацилкарнітини. Вивільнення ацилкарнітинів із клітин Шванна може індукувати дегенерацію аксонів через мітохондріальну дисфункцію та дезадаптивну відповідь на стрес [26].
У мітохондріях із NADH і FADH2 утворюється аденозинтрифосфат (АТФ) шляхом окисного фосфорилювання. Побічним продуктом окисного фосфорилювання є утворення активних форм кисню (АФК), які легко нейтралізують клітинні антиоксиданти – супероксиддисмутазу, глутатіон, каталазу [27-30]. Порушення фосфорилювання при діабеті зменшує утворення АТФ, але підвищує утворення АФК, що згодом призводить до мітохондріальної дисфункції, метаболічного й окисного пошкодження клітин Шванна та сенсорних нейронів [31, 32]. Брак енергії внаслідок мітохондріальної дисфункції ще більше посилює пошкодження [33]. В умовах гіперглікемії метаболізм глюкози відбувається через шляхи поліолу та гексозаміну, що призводить до активації запалення й також посилює дисфункцію нервової системи.
Гіперглікемія призводить до глікації численних структурних і функціональних білків з утворенням кінцевих продуктів глікації (AGE), які порушують структуру та функції білків. Взаємодіючи зі специфічними рецепторами, AGE модифікують експресію генів і внутрішньоклітинну передачу сигналів, спричиняють вивільнення прозапальних молекул і вільних радикалів [34]. Паралельно надлишок ВЖК, які катаболізуються β-окисленням, можуть пошкоджувати клітини Шванна через генерацію АФК, запалення з активацією макрофагів з утворенням цитокінів і хемокінів [35, 36].
Сучасні принципи лікування ДНП
Сучасна терапія ДНП включає вплив на чинники ризику, фармакотерапію (монотерапія, комбінована терапія), ад’ювантну терапію (немедикаментозне лікування й харчові добавки), а також додаткове та спеціалізоване лікування рефрактерного болю. Алгоритм лікування больової ДНП підсумовано на рисунку 3.
Вплив на чинники ризику
Адекватний глікемічний контроль уповільнює прогресування ДНП та відтерміновує початок нейропатії в пацієнтів із ЦД 1-го типу [12, 37, 38].
При ЦД 2-го типу показано багатофакторну модифікацію чинників ризику, запропоновану Американською діабетичною асоціацією (ADA) [4]. Проте немає надійних доказів, що покращення глікемічного контролю змінює інтенсивність болю при больовій ДНП [39]. Значення ліпідознижувальної терапії неоднозначне, оскільки продемонстровано як зв’язок із ризиком виникнення ДНП [15, 40-42], так і сповільнення прогресування ДНП [43, 44]. Регулярні аеробні та зміцнювальні вправи здатні зменшити нейропатичний біль, знижувати потребу в знеболенні й покращувати стан дрібних нервових волокон [45, 46].
Фармакотерапія
Лікування больової ДНП
Існує декілька міжнародних настанов щодо фармакотерапії больової ДНП, які пропонують певну черговість застосування препаратів (табл. 1).
Як препарати першої лінії більшість настанов рекомендують габапентиноїди (габапентин, прегабалін), ТЦА (амітриптилін) та ІЗЗСН (дулоксетин, венлафаксин). Настанови DC радять застосування прегабаліну перед іншими препаратами.
AAN рекомендує блокатори натрієвих каналів (карбамазепін, окскарбазепін, ламотриджин і лакозамід) як додаткові препарати першої лінії, але інші настанови цей клас не розглядають. Вальпроат рекомендований як препарат другої лінії в настановах DC та як препарат третьої лінії – в настановах AAN; однак обидві настанови не радять його призначення пацієнтам дітородного віку. Декілька настанов пропонують опіоїди та засоби з подвійним механізмом дії (трамадол, тапентадол) як препарати другої чи третьої лінії. Проте останні настанови AAN і AACE категорично не рекомендують використовувати ані засоби з подвійним механізмом дії, ані опіоїди для лікування больової ДНП. Пластир із капсаїцином 8% рекомендований як терапія першої лінії настановами DDG, AACE, AAN та як терапія третьої лінії – настановами IDF. Інфузія 5% лідокаїну, яка зазвичай використовується для лікування резистентної больової ДНП, не розглядається жодною з настанов, а настанови IDF не рекомендують застосувати пластир із 5% лідокаїном. Лише настанови DDG радять α-ліпоєву кислоту як терапію першої лінії; інші настанови не розглядають або не рекомендують її використання [7]. Особливості застосування найуживаніших засобів фармакотерапії ДНП підсумовано в таблиці 2.
α-ліпоєва кислота. Багатоцентрове рандомізоване подвійно сліпе плацебо-контрольоване дослідження ALADIN III продемонструвало значне покращення показника невропатії (NIS) після лікування за відсутності значущого покращення загального показника симптомів (TSS) [51]. У дослідженні SYDNEY2 оцінювали різні дозування α-ліпоєвої кислоти перорально 1 р/добу в 181 пацієнта з ДНП: 600, 1200 або 1800 мг проти плацебо впродовж 5 тижнів. Порівняно з початковим рівнем показники TSS у вказаних групах зменшилися на 51, 48, 52 та 32% відповідно (всі р<0,05 порівняно з плацебо). Зважаючи на ці результати, доза 600 мг 1 р/добу забезпечує найкраще співвідношення користь/ризик [52]. Тривале багатоцентрове рандомізоване подвійно сліпе дослідження з паралельними групами оцінювало ефективність і безпеку 600 мг α-ліпоєвої кислоти протягом 4 років у пацієнтів із легкою-помірною ДНП. Дослідження не виявили суттєвої різниці між лікуванням α-ліпоєвою кислотою та плацебо щодо впливу на первинну кінцеву точку – складений бал (NIS – нижні кінцівки (NIS-LL) та 7 нейрофізіологічних тестів). Однак у групі втручання спостерігалося певне покращення окремих клінічних показників оцінки компонентів ДНП порівняно з початковим рівнем: дистальна м’язова слабкість; комбінація слабкості, рефлексів і сенсорних змін у руках і ногах або лише в ногах.
У більшості пацієнтів групи втручання спостерігалося клінічне покращення, проте в меншої кількості пацієнтів відзначено прогресування NIS (p=0,013) і NIS-LL (p=0,025) порівняно з плацебо. Загальна оцінка переносимості лікування не відрізнялася між групами [53]. Управління з контролю медикаментів і продовольства США (FDA) не підтримує використання цього препарату для лікування ДНП, як і більшість міжнародних настанов (табл. 1).
Отже, препарати, які пропонуються для фармакотерапії ДНП, переважно блокують передачу больових імпульсів, але не модифікують хворобу, оскільки не впливають на важливі патогенетичні ланки цього ускладнення. Більшість препаратів мають низку несприятливих проявів побічної дії та не забезпечують гарантованого покращення в усіх пацієнтів.
Ад’ювантна терапія
Для лікування больової ДНП запропоновано такі немедикаментозні методи лікування: психологічну терапію, акупунктуру, черезшкірну електричну стимуляцію нервів, частотно-ритмічну електричну модульовану систему та стимуляцію спинного мозку [54]. Поки що докази стосовно їхньої ефективності недостатньо сильні, проте застосування цих методів
у комплексному лікуванні дає змогу полегшити симптоми та покращує функціонування пацієнтів із ДНП [7].
Роль харчових добавок у лікуванні ДНП
Вітамін D – секостероїд, який синтезується в організмі шкірою, нирками та печінкою в невеликих кількостях, є необхідним для життя. Крім відомого впливу на метаболізм кальцію, існують докази плейотропних ефектів вітаміну D на серцево-судинні, автоімунні та нейродегенеративні хвороби, діабет і пухлини [44].
Позитивні ефекти вітаміну D при діабеті
зумовлені впливом на секрецію інсуліну β-клітинами шляхом підвищення внутрішньоклітинної концентрації кальцію через вольтажозалежні кальцієві канали, які полегшують перетворення проінсуліну на інсулін [56]. Вітамін D посилює секрецію інсуліну та чутливість до інсуліну, а також покращує функцію β-клітин [57]. Окрім того, вітамін D сприяє виживанню β-клітин, безпосередньо контролюючи утворення та впливи цитокінів [58].
Точні механізми дії вітаміну D при ДНП докладно не вивчені. Найімовірніше, вплив опосередковується через рецептори вітаміну D (VDR) – ліганд-активовані фактори транскрипції, які регулюють експресію низки генів і присутні в ядрах і цитоплазмі більшості клітин нервової системи. У діабетичних щурів із низьким рівнем вітаміну D спостерігалася висока експресія VDR у дорсальних гангліях, що особливо впливає на дрібні С-волокна, які відповідають на ноцицепцію. Дослідники вважають, що цей механізм може відігравати роль у патогенезі больової ДНП [59]. В експерименті доведено нейропротекторний ефект вітаміну D [60]. Імовірно, він пов’язаний із регуляцією рівня нейротрофіну та гомеостазу кальцію в нейронах [61]. Вітамін D стимулює продукцію фактора росту нервів (NGF); лікування вітаміном D щурів із дефіцитом NGF посилювало його утворення [62]. Результати досліджень взаємозв’язку між вітаміном D, NGF і когнітивними функціями вказують на прямий вплив вітаміну D на функцію нервів [60, 62, 63]. Потенційні впливи вітаміну D3 на нервову систему підсумовано на рисунку 4.
Дефіцит і недостатність вітаміну D у пацієнтів із ДНП
Автономна нейропатія серця
У дослідженні за участю 113 пацієнтів із ЦД обох типів визначено сироваткові рівні 25-гідроксивітаміну D (25-OH-D) та проведено три тести серцево-судинного рефлексу: 1) частота серцевих скорочень (ЧСС) у відповідь на глибоке дихання (співвідношення E/1), стояння (співвідношення 30/15) і проба Вальсальви; 2) оцінка 5-хвилинної ЧСС у спокої; 3) три індекси частоти/варіабельності серцевих скорочень. Виявлено обернений U-подібний зв’язок між сироватковим рівнем вітаміну D та досліджуваними показниками серцево-судинного рефлексу. Моделі лінійної регресії показали, що підвищення рівня вітаміну D від 25 до 50 нмоль/л асоціюється зі збільшенням реакції ЧСС на глибоке дихання та співвідношення 30/15. Підвищення рівня вітаміну D від 125 до 150 нмоль/л асоціювалося зі зниженням реакції ЧСС на глибоке дихання та співвідношення 30/15. Отже, як дуже високі, так і низькі рівні вітаміну D у пацієнтів із діабетом пов’язані з автономною нейропатією серця [66]. В іншому дослідженні за участю 163 пацієнтів із ЦД 2-го типу проведено п’ять серцево-судинних рефлекторних тестів за протоколом Юінга й оцінено часові та частотні параметри варіабельності серцевого ритму. Пацієнтів класифікували за рівнем 25-OH-D: достатній (≥20 нг/мл), недостатній (від 10 до <20 нг/мл), дефіцит (<10 нг/мл). Дефіцит вітаміну D значно корелював із параметрами варіабельності серцевого ритму. Зв’язок між концентрацією вітаміну D й автономною нейропатією серця мав граничне значення [67].
Діабетична нейропатія
У дослідженні типу «випадок – контроль» спостерігався нелінійний зв’язок між сироватковим рівнем 25-OH-D та симптоматичною периферичною ДНП. Ризик симптоматичної ДНП виявився вищим як у пацієнтів із дефіцитом вітаміну D <20 нг/мл, так і в пацієнтів із рівнем 25-OH-D >40 нг/мл.
Це зумовлює потребу ретельної оцінки та контролю рівня вітаміну D упродовж терапії [68]. У дослідженні за участю 96 пацієнтів із ЦД 1-го типу оцінювали зв’язки між ДНП, вітаміном D, NGF і маркерами окисного стресу. У групі пацієнтів із ДНП виявлено значно нижчий середній рівень 25-OH-D за відсутності відмінностей у рівнях NGF і маркерів окисного стресу. Із рівнем 25-OH-D негативно корелювала тривалість діабету та позитивно корелював NGF [69]. Дослідження за участю 60 пацієнтів із ЦД 2-го типу виявило значно нижчий середній рівень 25-OH-D у групі з ДНП порівняно з групою без ДНП (21,09±8,38 проти 31,12±14,85 нг/мл; p=0,001) і в підгрупі з безбольовою ДНП порівняно з підгрупою з больовою ДНП (10,05±8,12 проти 18,14±3,85 нг/мл; p<0,05). Результати регресійного аналізу вказують, що дефіцит вітаміну D є незалежним чинником ризику ДНП (відношення шансів 0,914; p=0,007) [70]. Роль дефіциту вітаміну D як незалежного предиктора ДНП підтверджено іншим дослідженням за участю 136 пацієнтів із ЦД 2-го типу після корегування HbA1c, віку, куріння, індексу маси тіла та тривалості діабету в моделі логістичної регресії [71]. Метааналіз даних 6 досліджень за участю 1484 пацієнтів із ЦД 2-го типу продемонстрував значуще зниження 25-OH-D у сироватці крові в пацієнтів із ДНП (зважена середня різниця -6,36 нг/мл; 95% довірчий інтервал (ДІ) від -8,57 до -4,14; p<0,00001). Дефіцит вітаміну D асоціювався з підвищеним ризиком ДНП (відносний ризик 2,88; 95% ДІ 1,84-4,50; p<0,00001) [72].
Діабетичні виразки стопи
У дослідженні за участю 324 пацієнтів (по 162 у групах із виразками та без) медіана сироваткових рівнів 25-OH-D була суттєво нижчою в групі з виразками (6,3 [4,2; 11,1] проти 28,0 [21,4; 37,0] нг/мл; p<0,005) [73]. Аналогічні дані отримано після метааналізу результатів 7 досліджень за участю 1115 пацієнтів: середня різниця сироваткових рівнів 25-OH-D між групами з виразками та без становила -13,47 нмоль/л (95% ДІ від -16,84 до -10,10) [74].
Нещодавній метааналіз (10 досліджень, 1644 пацієнти з діабетом) указує, що тяжкий дефіцит вітаміну D (<10 нг/мл) істотно переважає серед пацієнтів із виразками (52,5 проти 23%) [75]. Ретроспективне дослідження виявило значно нижчі сироваткові рівні вітаміну D у пацієнтів із діабетом і захворюванням периферичних артерій, інфекцією діабетичної стопи та діабетичною виразкою стопи порівняно з пацієнтами без ускладнень (p=0,03; p=0,0006 та p=0,04 відповідно) [76].
Часте виявлення дефіциту вітаміну D у пацієнтів із ДНП може пояснюватися декількома чинниками: 1) менший вплив сонячного світла через обмеження рухливості; 2) недостатнє споживання вітаміну D з харчовими продуктами; 3) супутнє порушення функції нирок, поширеність і тяжкість якого значно вищі в пацієнтів з ускладненим діабетом; 4) підвищена потреба вітаміну D для загоєння ран, синтезу колагену, забезпечення імунітету тощо [77-81].
Ці дані підвищують імовірність того, що добавки вітаміну D можуть бути корисними для запобігання або полегшення ускладнень діабетичної стопи завдяки ранозагоювальній дії вітаміну D.
Результати інтервенційних досліджень із застосуванням вітаміну D у пацієнтів із ДНП
У літературі є повідомлення про випадок тяжкої ДНП у пацієнта 38 років із 27-річним анамнезом ЦД 1-го типу. Симптоми нейропатії тривали 10 років, спричиняли непрацездатність і потребували застосування серйозних анальгетиків для контролю болю. Сироватковий рівень 25-OH-D становив 16,5 нг/дл. Усунення дефіциту вітаміну D шляхом саплементації сприяло регресу симптомів ДНП та значущому зменшенню потреби в анальгетиках [82]. Дослідження за участю 51 пацієнта з ЦД 2-го типу, больовою ДНП та низьким рівнем 25-OH-D у сироватці крові продемонструвало зниження показника оцінки нейропатичного болю на 50% після 3 місяців прийому вітаміну D [83]. Нещодавнє дослідження за участю 66 пацієнтів із ЦД 2-го типу вивчало ефективність і переносимість добавок вітаміну D при больовій ДНП. Пацієнти отримували 50 000 МО вітаміну D3 щотижня протягом 12 тижнів. Застосування добавок вітаміну D асоціювалося з підвищенням сироваткових рівнів 25-OH-D та зменшенням симптомів і ознак ДНП (обидва p<0,001) [84]. Інше дослідження оцінювало вплив добавок вітаміну D на мікроциркуляцію, симптоми ДНП та маркери запалення. Терапія високими дозами вітаміну D асоціювалася зі зниженням прозапального інтерлейкіну-6 і підвищенням концентрації протизапального інтерлейкіну-10 у сироватці крові, зменшенням тяжкості симптомів ДНП та покращенням мікроциркуляції шкіри [85].
У двох дослідженнях оцінювали вплив парентерального введення високих доз вітаміну D. В одному з них брали участь 143 пацієнти (переважно з ЦД 2-го типу; середній бал за шкалою DN4 – 3,0±1,8; загальна оцінка болю за шкалою McGill – 21,2±14,9; середній початковий рівень 25-OH-D – 31,7±23,3 нг/мл; дефіцит вітаміну D у 58 пацієнтів, або 40,5%). Одноразова внутрішньом’язова доза вітаміну D3 600 000 МО забезпечила значне покращення симптомів больової ДНП [86]. Інше проспективне дослідження за участю 143 пацієнтів із больовою ДНП вивчало влив одноразової внутрішньом’язової ін’єкції вітаміну D3 у дозі 600 000 МО на якість життя за допомогою опитувальника NeuroQoL. Після лікування значно покращилася оцінка якості життя, особливо в пацієнтів із дефіцитом вітаміну D. Частка пацієнтів, які повідомили про «відмінну» якість життя, збільшилася з 1,5 до 7,4% (p<0,0001) [87].
Отже, низка досліджень підтвердила, що дефіцит вітаміну D поширений у пацієнтів із діабетом і відіграє значну роль у виникненні ДНП, нейропатичного болю, ураження судин, діабетичних виразок стопи й автономної нейропатії серця. Результати інтервенційних досліджень продемонстрували ефективність застосування добавок вітаміну D для контролю нейропатичного болю та зменшення потреби у використанні анальгетиків. Тривале лікування вітаміном D сприяє зменшенню запальної відповіді й загоєнню виразок; полегшує симптоми та покращує якість життя пацієнтів із ДНП. Маючи антиоксидантну, протизапальну та ранозагоювальну дії, вітамін D уповільнює руйнування нейронів і позитивно впливає на діабет загалом. Тому прийом добавок вітаміну D слід розглядати в комплексному лікуванні пацієнтів із ДНП, особливо за наявності його дефіциту. Варто віддавати перевагу якісним харчовим добавкам, які містять активніший вітамін D3 (холекальциферол), що добре засвоюється. Зважаючи на потребу індивідуального підбору дози та її корекції під час лікування, доцільно обирати добавки, які мають різний спектр дозування. Зазвичай тривалість прийому становить декілька місяців, отож вагомим чинником в умовах сьогодення є доступна ціна. Нарешті, багато добавок вітаміну D випускаються у великих капсулах, які важко проковтнути, що може зменшити прихильність пацієнтів до саплементації. Серед засобів, доступних на вітчизняному ринку, можна рекомендувати Детрімакс® («Юніфарм Лабораторіз Лімітед»), який виготовляють у Польщі за високими та суворими стандартами якості ЄС. Маленькі капсули, котрі зручно ковтати, містять вітамін D3, розчинений у сафлоровій олії, що сприяє кращому засвоєнню вітаміну. Лінійка Детрімакс® має дозування 1000, 2000 та 4000 МО, які можна комбінувати.
Доступна ціна на Детрімакс® дає змогу не жертвувати тривалістю й ефективністю прийому задля економії.
Вітаміни групи В
У людей із діабетом часто виникає дефіцит вітамінів групи В або підвищується потреба в них.
Вітамін B12 бере участь у синтезі ДНК та білка. Дефіцит цього вітаміну дуже поширений у людей, які приймають метформін, через зниження всмоктування в шлунково-кишковому тракті [88]. Наслідками дефіциту вітаміну В12 є порушення структури та трофіки нервових клітин, зниження синтезу мієліну й надмірне утворення гомоцистеїну. Недостатній рівень вітаміну B12 асоціюється з кількома неврологічними патологіями, включаючи делірій, деменцію та нейропатію. Тому моніторинг рівня вітаміну B12 у людей із діабетом є дуже важливим [89]. Ефект нормалізації рівня вітаміну B12 у разі ЦД 2-го типу вивчали в нещодавньому рандомізованому контрольованому дослідженні. Прийом добавок упродовж 12 місяців нормалізував рівень B12 і покращив як суб’єктивні, так і об’єктивні показники ДНП [90]. Подібні результати отримано в клінічних дослідженнях [91]. Оцінка статусу вітаміну B12 включена до стандартного обстеження пацієнтів із діабетом [92].
Фолієва кислота (вітамін В9) потрібна для синтезу піримідинів і пуринів, а отже, й для реплікації ДНК та мітозу [93]. Завдяки сильному впливу на ріст нейронів під час розвитку дефіцит фолату при ранньому ембріогенезі значно підвищує ризик дефектів нервової трубки. Показано здатність фолієвої кислоти індукувати відновлення нервової системи дорослої людини [94]. Фолієву кислоту потрібно вводити з дієтою або харчовими добавками, оскільки організм людини не здатний її синтезувати [95]. У щурів із стрептозотоцин-індукованим діабетом щоденне вживання фолієвої кислоти захищало від розвитку ДНП та супроводжувалося значним підвищенням рівня NGF у сідничному нерві. Крім нейротрофічних ефектів, фолат має антиоксидантні властивості [96]. Нещодавній метааналіз указує на зв’язок між низьким рівнем фолату в сироватці крові та частотою ДНП при ЦД 2-го типу [93].
У рандомізованому контрольованому дослідженні 16-тижневий прийом фолієвої кислоти (1 мг/день) значно покращив декілька об’єктивних компонентів нервової провідності, зокрема швидкість, сенсорну та рухову амплітуди [97].
Дефіцит вітаміну В1 (бері-бері) проявляється неврологічними та серцево-судинними симптомами. Нестача тіаміну також є причиною синдрому Верніке – Корсакова (церебрального бері-бері) – нервово-психіатричного захворювання, що характеризується розладом психічних функцій, паралічем окорухових нервів, порушенням постави та ходи. Обидва синдроми легко усуваються введенням тіаміну. Ще в 1954 р. висунуто гіпотезу, що тіамін може бути корисним для лікування ДНП. Проте лише наприкінці 1990-х рр. застосування тіаміну та його ліпофільного похідного бенфотіаміну досягло певного консенсусу [98]. Встановлено, що введення бенфотіаміну підвищує рівень внутрішньоклітинного тіаміну та знижує AGE, які індукують ДНП [99, 100].
У 6-тижневому подвійно сліпому плацебо-контрольованому дослідженні III фази спостерігалася гранична різниця в шкалі симптомів нейропатії між групами бенфотіаміну та плацебо (р=0,055) [101].
Вітамін B6 – важливий антиоксидант і кофактор багатьох ферментативних реакцій. У деяких дослідженнях низький рівень B6 асоціювався з діабетичними ускладненнями в пацієнтів із ЦД обох типів [102]. Активна форма вітаміну – піридоксаль-5-фосфат є важливим допоміжним фактором у перетворенні триптофану на нікотинову кислоту; порушення цього шляху сприяє утворенню проміжних метаболітів, які взаємодіють із біологічним інсуліном, що підвищує резистентність до інсуліну [103]. Нещодавнє дослідження виявило значну поширеність дефіциту піридоксину серед пацієнтів із ДНП (51,8%) та встановило прямий значущий зв’язок між піридоксином і швидкістю нервової провідності [104]. В організмі людини піридоксин не синтезується, що потребує стабільного надходження з їжею або застосування добавок [105].
Холін (вітамін В4) – важливий мікроелемент, необхідний для нормального розвитку мозку та когнітивних функцій протягом усього життя. Через епігенетичні механізми холін модулює експресію ключових генів, пов’язаних із пам’яттю, навчанням і когнітивними функціями. Холін є лімітувальним попередником нейромедіатора ацетилхоліну, а також одним із ключових субстратів метаболічних шляхів Кеннеді та фосфатидилетаноламін-N-метилтрансферази, залучених у синтез фосфатидилхоліну, що входить до складу мембран нейронів. Процес синтезу фосфатидилхоліну потребує наявності вітамінів В1, В6, В12 і фолієвої кислоти [106].
Піримідинові нуклеотиди
Уридин входить до складу ДНК та РНК і відіграє значну роль в енергетичному обміні та клітинному метаболізмі [107]. Це основна форма піримідинового нуклеотиду, яка поглинається мозком, де використовується для синтезу нуклеїнових кислот і компонентів мембран. Окрім того, уридин є біологічно активною молекулою, що відіграє роль у кількох функціях центральної нервової системи, включаючи пластичність нейронів і больові відчуття. Очевидно, ці впливи реалізуються через утворення нейрональних мембран і взаємодію зі специфічними уридино-нуклеотидними рецепторами (P2Y2), які контролюють диференціацію нейронів. Активація рецепторів P2Y2 уридинтрифосфатом (UTP), що виділяється як нейромедіатор із пресинаптичних терміналів, може мати нейропротекторний ефект за нейродегенеративних захворювань. Окрім того, UTP може перетворюватися на цитидинтрифосфат, який є ключовим проміжним продуктом у циклі Кеннеді для утворення фосфатидилхоліну [106]. Отже, уридин є природним будівельним матеріалом, що сприяє регенерації нервових клітин. Метаболізм уридину залежить від гомеостазу глюкози, обміну ліпідів і амінокислот [107]. В організмі людини він присутній у вигляді стабільних форм моно- або дифосфату, які руйнуються в печінці та шлунково-кишковому тракті [108].
Завдяки взаємодії з P2Y2-рецепторами й активації фактора росту нервових волокон уридин сприяє росту аксонів, їхній мієлінізації та збільшенню швидкості проведення нервового імпульсу. Крім того, уридин може бути транспортною молекулою, яка дає змогу певним сполукам проникати в мозок в обхід гематоенцефалічного бар’єра [109].
Низка досліджень продемонструвала ефективність уридину в лікуванні больової нейропатії. Подвійно сліпе контрольоване нейрофізіологічне дослідження вивчало застосування уридину в 40 пацієнтів із діабетом і проявами ДНП (середній вік – 48,5±3,4 року, тривалість хвороби >5 років). Усі пацієнти мали знижену швидкість моторної та сенсорної відповідей щонайменше на одному з периферичних нервів, постійний біль у нижніх кінцівках і порушення вібраційної чутливості. Пацієнтів порівну розподілено на дві групи, одна з яких приймала уридин у дозі 300 мг 3 р/добу, інша – плацебо. Хворим виконували електроміографію, фіксуючи швидкості й амплітуди моторних і сенсорних відповідей на серединному, променевому, загальному малогомілковому, задньому великогомілковому та литковому нервах. Оцінка проводилася на початку дослідження, на 60-й, 120-й і 180-й день терапії та на 90-й день після закінчення терапії. У групі плацебо не було жодних статистично значущих змін; в основній групі суттєво покращилися нейрофізіологічні показники починаючи зі 120-го дня терапії аж до 90-го дня після закінчення терапії. Отже, застосування високих доз уридину істотно покращує функцію периферичних нервів. У жодного пацієнта не було будь-яких побічних ефектів [110].
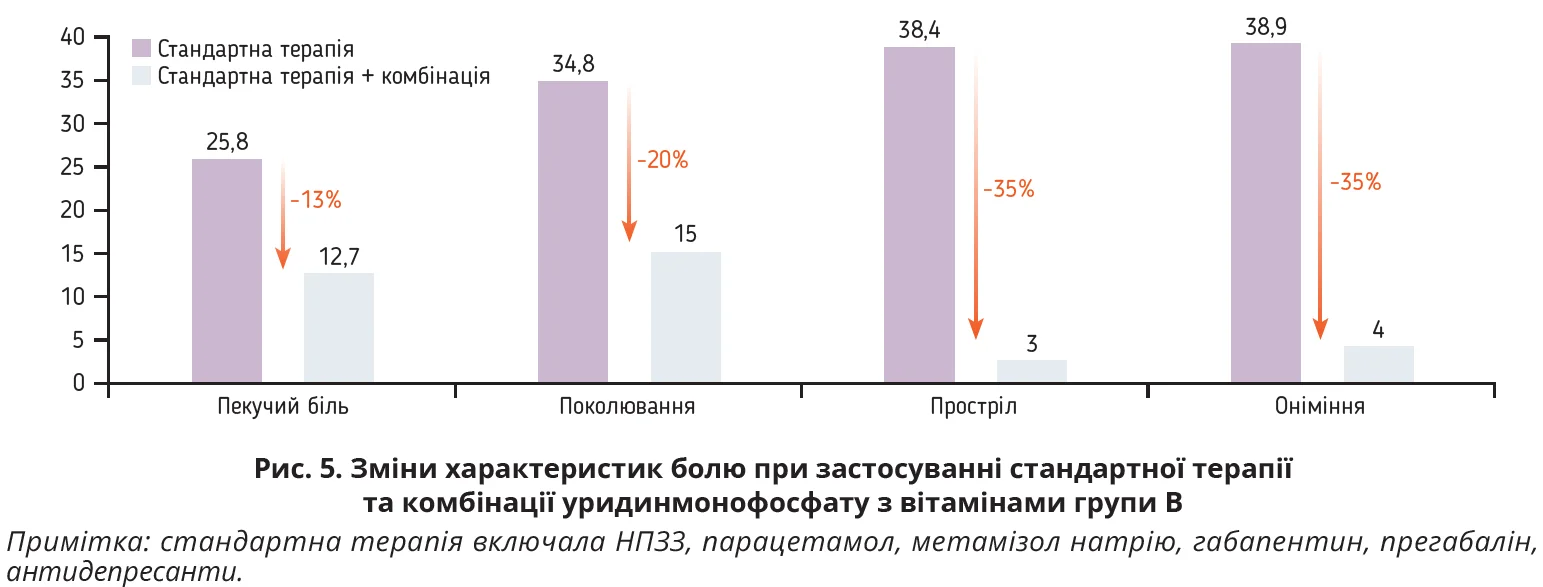
У відкритому проспективному багатоцентровому дослідженні вивчали вплив комбінації уридинмонофосфату, фолієвої кислоти та вітамінів групи В на больовий синдром у 212 пацієнтів (середній вік – 59,0±14,4 року) з периферичною нейропатією різного ґенезу. Для оцінки інтенсивності та характеристик болю використовували опитувальник painDETECT. Під час дослідження разом зі вказаною комбінацією застосовували стандартну терапію. Загальний бал за опитувальником painDETECT становив 17,5±5,7 на початку дослідження та 8,8±5,2 на 60-й день (p<0,001). Статистично значне покращання спостерігалося в пацієнтів із поперековим болем, ішіасом і шийною радикулопатією. На початку дослідження пацієнти приймали нестероїдні протизапальні засоби – НПЗЗ (77,8%), парацетамол (51,4%), трамадол (25,5%); на 60-й день дослідження в 75,6% пацієнтів відзначено зменшення прийому засобів стандартної терапії. Під час дослідження спостерігалося достовірне зниження пекучого болю, поколювання, прострілів та оніміння (рис. 5). Побічних ефектів не спостерігалося [111].
У відкритому проспективному багатоцентровому дослідженні, проведеному в 34 клінічних центрах Португалії, 48 пацієнтів із синдромом зап’ястного каналу приймали комбінацію уридинмонофосфату, фолієвої кислоти та вітаміну В12 в одній капсулі 1 р/добу протягом 60 днів. Загальний бал за опитувальником painDETECT на початку дослідження становив 17,3±5,9; на 60-й день знизився до 10,3±6,1 (p<0,001). У 77,4% пацієнтів вдалося зменшити або повністю скасувати прийом базового анальгетика (на початку дослідження 39 пацієнтів (81,3%) приймали НПЗЗ; по 9 пацієнтів (18,8%) використовували трамадол або прегабалін).
Відзначено також достовірне зниження пекучого білю, прострілів, оніміння, поколювання й алодинії. Побічних явищ не зафіксовано [112].
Отже, додавання комбінації уридину, холіну, вітамінів групи В та фолієвої кислоти до основної терапії больових форм ДНП сприяє нейрорегенерації, посиленню клітинного метаболізму та забезпечує опосередкований протибольовий ефект. Оскільки всі компоненти є ендогенними природними речовинами, в дослідженнях, які використовували вказану комбінацію, не відзначалося серйозних побічних явищ. На фармацевтичному ринку України комплексним продуктом, який містить вказану комбінацію, є Юнігамма® («Юніфарм Лабораторіз Лімітед»). До складу дієтичної добавки входить 150 мг уридину, 82,5 мг холіну, 2,5 мг вітаміну В1, 4 мг вітаміну В6, 3 мкг вітаміну В12 і 400 мкг фолієвої кислоти. Оскільки дослідження вказують на дозозалежність позитивних впливів уридину, Юнігамма® має переваги перед іншими уридиновмісними засобами, які містять значно менші дози уридину. Іншою перевагою є біодоступність, оскільки Юнігамма® містить уридину монофосфат. Синергічний вплив додаткових компонентів комбінації забезпечує добру ефективність дієтичної добавки в комплексному лікуванні нейропатичного болю та ДНП.
Список літератури – в редакції.