Лікування артеріальної гіпертензії в пацієнтів із цукровим діабетом: сучасний підхід
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
За останнє десятиліття рекомендації щодо лікування артеріальної гіпертензії (АГ) у пацієнтів із цукровим діабетом (ЦД) істотно змінилися. У 2014 р. Восьмий об’єднаний національний комітет (JNC 8) рекомендував встановити цільовий рівень артеріального тиску (АТ) у пацієнтів із ЦД <140/90 мм рт. ст. [1]. Однак після того рекомендації інших товариств повернулися до агресивніших цілей, а саме <130/80 мм рт. ст. [3-6].
Хоча дослідження ACCORD-BP (Action to Control Cardiovascular Risk in Diabetes — Blood Pressure) не змогло показати переваги нижчих цілей АТ щодо зниження кардіоваскулярного ризику (КВР), низка якісних метааналізів підтримує доцільність агресивного підходу [7–10]. На користь цієї позиції свідчать також результати дослідження SPRINT (Systolic Blood Pressure Intervention Trial) й аналіз узагальнених даних дослідження ACCORD-BP та його тривалого обсерваційного періоду ACCORDION [11–15].
Поширеність і патогенез
АГ є багатофакторним захворюванням, яке спостерігається приблизно в 46% населення США віком ≥20 років, причому більшість із цих людей не досягають контролю АТ [16]. Близько 39% осіб, яким уперше встановлюється діагноз ЦД 2 типу, мають АГ [17]. Наявність АГ та ЦД підвищує кардіоваскулярну захворюваність і смертність [18, 19].
Співіснування ЦД й АГ є наслідком чотирьох основних патофізіологічних чинників: діабетичної нефропатії з хронічною хворобою нирок, гіперволемії, гіперінсулінемії та збільшення жорсткості артерій.
Доказова база лікування АГ при ЦД
Серцево-судинні та ниркові переваги лікування АГ у пацієнтів із ЦД продемонстровані в кількох клінічних дослідженнях, основними з яких є UKPDS (UK Prospective Diabetes Study), HOT (Hypertension Optimal Treatment), ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation), ACCORD-BP та SPRINT [7, 14, 26–28].
Першим дослідженням, яке виявило переваги нижчих рівнів АТ щодо макроваскулярних ускладнень і показника смертності в осіб із ЦД 2 типу, стало дослідження UKPDS, опубліковане в 1998 р. Загалом 1148 учасників були рандомізовані в групи цільових показників АТ <150/85 та <180/105 мм рт. ст. Через 8,4 року спостереження в групі агресивнішого контролю АТ було досягнуто середнього показника 144/82 мм рт. ст., а в другій групі — 154/87 мм рт. ст. У групі агресивного контролю досягнення всіх асоційованих із ЦД кінцевих точок зменшилося на 24%, пов’язана з ЦД смертність — на 32%, а кількість інсультів — на 44% [26].
У дослідженні ADVANCE антигіпертензивна терапія (периндоприл/індапамід) у осіб із ЦД 2 типу порівнювалася з плацебо [28]. У групі лікування було досягнуто середнього АТ 135/74 мм рт. ст., а в групі плацебо — 140/76 мм рт. ст. Групі антигіпертензивної терапії були притаманні нижчі показники кардіоваскулярної смертності та смертності від усіх причин.
Хоча наведені дослідження продемонстрували однозначні переваги лікування АГ в осіб із ЦД, оптимальні цільові значення АТ залишилися нез’ясованими. У дослідженні ABCD (Appropriate Blood Pressure Control) учасників із діастолічним АТ (ДАТ) у межах 80–89 мм рт. ст. було розподілено в групи плацебо чи антигіпертензивного лікування (еналаприл або нізолдипін). У групі фармакотерапії АГ було досягнуто зменшення кількості інсультів і сповільнення прогресування уражень нирок (за вмістом альбуміну в сечі) [30]. Дослідження HOT також фокусувалося на показниках ДАТ.
За умови досягнення ДАТ <80 мм рт. ст. в учасників із ЦД спостерігалося зниження ймовірності великих кардіоваскулярних подій на 51% [27].
На противагу переліченим вище дослідженням, у дослідженні SANDS (Stop Atherosclerosis in Native Diabetics Study) групи учасників, що досягли середнього систолічного АТ (САТ) 129 та 117 мм рт. ст., не відрізнялися за частотою серцево-судинних подій, але в групі суворіших цільових показників спостерігалася достовірно більша кількість побічних ефектів лікування [31].
Цільові значення САТ посіли ключову позицію й у дослідженні ACCORD, у якому 4733 учасники з ЦД 2 типу та вихідним АТ 139/76 мм рт. ст. були рандомізовані до групи інтенсивного лікування (цільовий САТ <120 мм рт. ст.) чи стандартного лікування (цільовий САТ <140 мм рт. ст.). Дизайн дослідження також передбачав поділ на групи інтенсивного чи стандартного глікемічного контролю. Через 4,7 року спостереження (середній термін) показники досягнення комплексної кінцевої точки (нефатальний інфаркт міокарда, нефатальний інсульт, смерть від кардіоваскулярних причин) у двох групах за цільовим АТ достовірно не відрізнялася. Групі інтенсивного контролю САТ були притаманні нижчі показники інсультів (усіх та окремо підрахованих нефатальних), але достовірно більша кількість побічних явищ унаслідок лікування [7]. Як було сказано вище, висновки цього дослідження призвели до встановлення м’якших цільових показників АТ у 2014 р.
Чому рекомендації знову змінилися на <130/80 мм рт. ст.?
Через 5 років після виходу результатів дослідження ACCORD-BP були опубліковані результати дослідження SPRINT [14], у якому взяли участь 9361 пацієнт без діабету із САТ 130 мм рт. ст. або високим КВР, яких було рандомізовано до групи інтенсивного контролю САТ до рівня <120 мм рт. ст. або групи стандартного лікування з цільовим показником САТ у межах 135–140 мм рт. ст. Пацієнти групи інтенсивного лікування досягли середнього САТ на рівні 121,4 мм рт. ст., а учасники групи стандартної терапії — 136,2 мм рт. ст. Дослідження було завершено передчасно у зв’язку з достовірно нижчою частотою досягнення комплексної кінцевої точки та меншою смертністю від усіх причин у групі інтенсивного лікування.
Щоби краще зрозуміти відмінність між результатами досліджень ACCORD-BP та SPRINT, ми розглянемо їх докладніше. Дослідження SPRINT відрізнялося тим, що включало майже вдвічі більше пацієнтів, аніж ACCORD-BP, і зафіксувало набагато більше кардіоваскулярних подій. Включення серцевої недостатності (СН) до складу комплексної первинної точки дало авторам дослідження SPRINT змогу взяти до уваги саме той несприятливий наслідок кардіоваскулярних хвороб, який є дуже чутливим до зниження АТ (у дослідженні ACCORD-BP частота розвитку СН вважалася лише вторинною кінцевою точкою). СН становила 29% усіх кардіоваскулярних подій, що відзначалися в ході дослідження SPRINT, і відмінність у кількості випадків СН між групами інтенсивного та стандартного лікування забезпечила відмінність у кінцевій точці [32]. Крім того, в дослідженні ACCORD вивчалися різні інтенсивності не лише антигіпертензивної терапії, а й контролю глюкози, що вплинуло на дизайн дослідження й особливості аналізу його результатів [11].
Узагальнений аналіз даних досліджень ACCORD і його продовження ACCORDION з’ясував, що серед учасників високого ризику інтенсивний контроль АТ забезпечував зменшення досягнення комплексної кінцевої точки (смерть від серцево-судинних захворювань, нефатальний інфаркт міокарда, нефатальний інсульт) на 25% [13].
Перевагу нижчих цільових показників АТ в осіб із ЦД продемонстрували й опубліковані пізніше метааналізи. Зокрема, метааналіз Xie та співавт. (2016), який включав 19 досліджень, у тому числі 5 досліджень за участю пацієнтів із ЦД, виявив, що інтенсивніший контроль АТ зменшував ризик великих серцево-судинних подій на 14% і статистично достовірно знижував імовірність інфар-
кту міокарда, інсульту та прогресування альбумінурії [8]. У метааналізі, присвяченому виключно зниженню АТ в осіб із ЦД 2 типу, який охопив 40 досліджень, було з’ясовано, що в більшості з них зв’язки АТ із прогнозом виявилися найтіснішими при САТ ≥140 мм рт. ст., але подальше зниження САТ до показників <130 мм рт. ст. асоціювалося зі зменшенням ризику інсульту, ретинопатії й альбумінурії [10]. Метааналізи та дослідження post hoc мають певні обмеження: наприклад, у них не враховується застосування аспірину чи прихильність до статинів, але саме дані цих метааналізів забезпечили підґрунтя для зміни менш агресивних цільових показників АТ в осіб із ЦД до поточних 130/80 мм рт. ст.
ЦД 1 типу
Якісні дані щодо лікування АГ у дорослих із ЦД 1 типу відсутні. Оскільки на момент встановлення діагнозу АГ ці пацієнти зазвичай є молодими, приймаючи рішення, варто звертати увагу на ДАТ, який виступає предиктором кардіоваскулярних наслідків у цій віковій групі [37]. Отже, молоді пацієнти з ЦД 1 типу можуть отримати максимальні переваги від суворого контролю АГ, хоча це потребує підтвердження в рандомізованому контрольованому дослідженні [37].
Вибір антигіпертензивної терапії
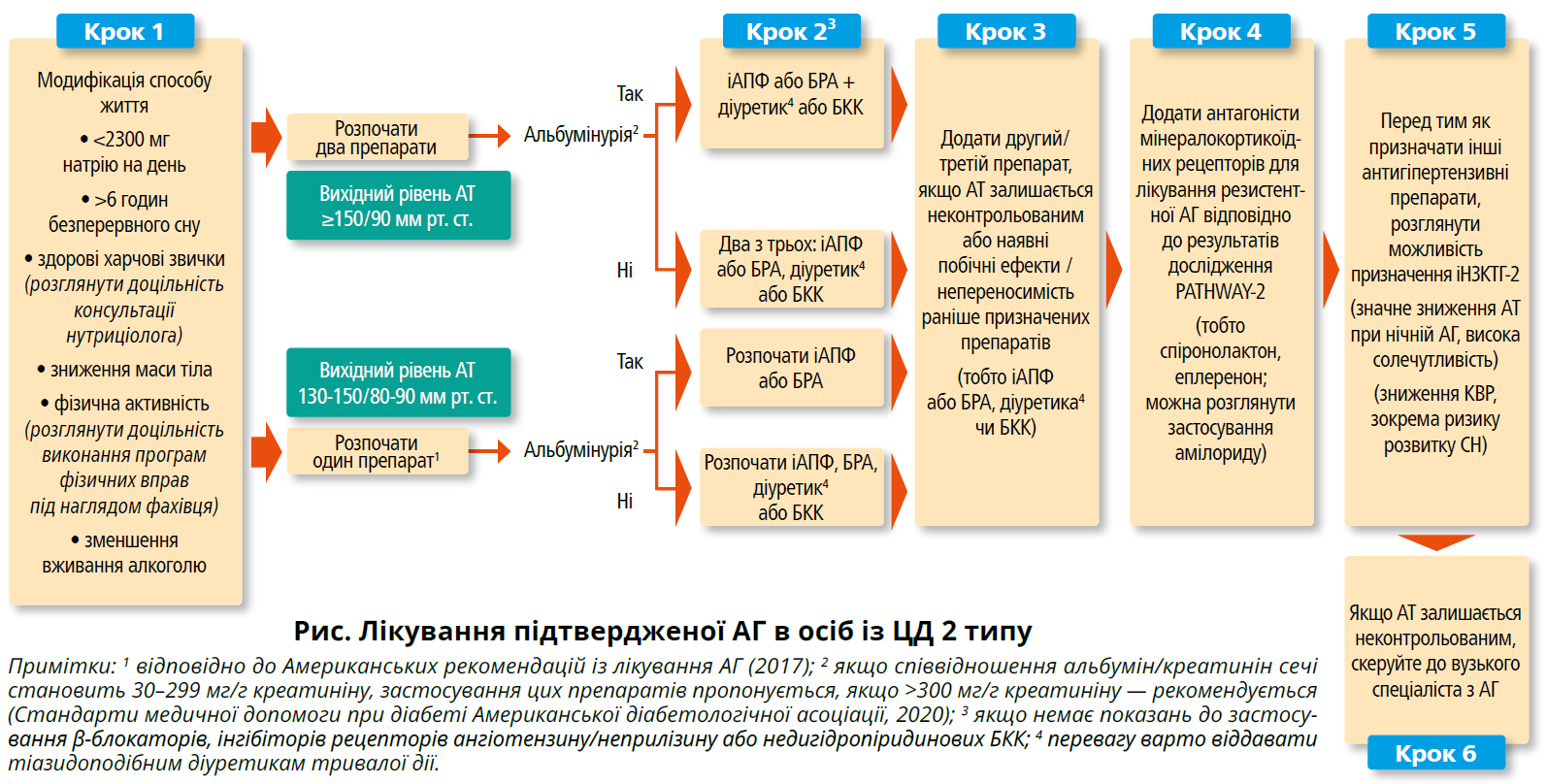
Усі рекомендації радять застосовувати модифікацію способу життя для лікування АГ до початку фармакотерапії або одночасно з нею (залежно від рівня АТ і загального КВР пацієнта). Основні заходи модифікації способу життя включають поміркованість у споживанні алкоголю, зменшення вживання натрію, зниження маси тіла та регулярну фізичну активність [3, 5, 6, 36, 38]. Рекомендації відрізняються за межовим значенням АТ, з якого потрібно починати застосування антигіпертензивних препаратів (>130/80 або >140/90 мм рт. ст.), але існує консенсус щодо значного підвищення АТ: при показниках >160/100 мм рт. ст. потрібно розпочати фармакотерапію щонайменше двома препаратами [3, 5]. На рисунку представлено алгоритм для лікування підтвердженої АГ у пацієнтів із ЦД 2 типу.
Для контролю АТ можна застосовувати будь-який препарат із таких класів, як інгібітори ангіотензинперетворювального ферменту (іАПФ), блокатори рецепторів ангіотензину (БРА), тіазидоподібні діуретики та дигідропіридинові блокатори кальцієвих каналів (БКК) [39]. БРА й іАПФ рекомендовані як препарати першої лінії в пацієнтів зі значною альбумінурією (відношення альбумін/креатинін у сечі >300 мг/г креатиніну), оскільки вони дають змогу знизити ризик прогресування захворювання нирок [36]. Застосування цих класів слід також розглянути при помірній альбумінурії (відношення альбумін/креатинін у сечі — 30–299 мг/г креатиніну). Вибір другого та третього засобу має враховувати такі чинники, як набряки, зменшення швидкості клубочкової фільтрації, наявність СН зі зниженою фракцією викиду й аритмій. Якщо відсутні чинники, які можуть впливати на вибір препарату, варто спиратися на дані дослідження ACCOMPLISH (Avoiding Cardiovascular Events through Combination Therapy in Patients Living with Systolic Hypertension), які стверджують, що комбінація іАПФ + дигідропіридиновий БКК має перевагу над комбінацією іАПФ + діуретик у зменшенні ризику несприятливих серцево-судинних подій у пацієнтів із ЦД та без нього [40, 41]. На початку застосування тіазидоподібних діуретиків на кшталт хлорталідону слід бути обережним, оскільки їм притаманні такі побічні ефекти, як гіперглікемія. Своєю чергою, деякі β-блокатори, як-от метопрололу тартрат, демонструють несприятливі кардіометаболічні наслідки порівняно з карведилолом. Кардіометаболічна нейтральність останнього та його здатність покращувати певні компоненти метаболічного синдрому, включаючи чутливість до інсуліну, в пацієнтів з АГ та ЦД була доведена в дослідженні GEMINI (Glycemic Effects in Diabetes Mellitus: Carvedilol-Metoprolol Comparison in Hypertensives) [42].
Що стосується пацієнтів із резистентною АГ, то дослідження PATHWAY‑2 чітко продемонструвало перевагу спіронолактону над бісопрололом і доксазозином [43]. У 14% учасників цього дослідження відзначався ЦД. Оскільки рандомізовані контрольовані дослідження щодо лікування резистентної АГ у пацієнтів із ЦД відсутні, після додавання спіронолактону вибір наступного кроку терапії ґрунтується виключно на експертній думці [38].
Наразі тривають дослідження в пацієнтів із хронічною хворобою нирок і ЦД 2 типу фінеренону — нового антагоніста мінералокортикоїдних рецепторів, який in vitro діє вибірковіше за спіронолактон та еплеренон [44].
Нещодавно до арсеналу засобів для модифікації АТ у пацієнтів із ЦД 2 типу увійшли інгібітор натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2). Доведені переваги цього класу препаратів включають сповільнення прогресування ураження нирок, а також зменшення кількості кардіоваскулярних подій і смертності осіб із ЦД 2 типу [45, 46]. Крім того, продемонстровано їхню здатність знижувати АТ. Хоча точний механізм дії іНЗКТГ-2 не встановлений, імовірно, він полягає в сполученні осмотичного діурезу та натрійурезу, яке забезпечує середнє зниження АТ на 3,6/1,7 мм рт. ст., що зіставне з ефективністю низьких доз тіазидоподібних діуретиків [47, 48]. Численні клінічні дослідження продемонстрували також здатність цього класу препаратів запобігати СН незалежно від анамнезу серцево-судинних захворювань [49]. Застосування іНЗКТГ-2 емпагліфлозину сприяло зменшенню нічної АГ у пацієнтів із ЦД похилого віку [50]. Хоча цей клас препаратів не входить до рекомендацій
із лікування АГ, слід розглянути застосування іНЗКТГ-2 у ролі п’ятого антигіпертензивного препарату за неефективності перших чотирьох.
Висновки
Останні рекомендації щодо лікування АГ у пацієнтів із ЦД радять прагнути до цільових показників ≤130/80 мм рт. ст. Хоча немає рандомізованого дослідження, котре чітко підтримує такі цільові значення, а не встановлені раніше 140/90 мм рт. ст., дані довготривалого спостереження за учасниками ACCORD-BP, нові дані SPRINT і численні метааналізи підтримують агресивніші цілі АТ у цього контингенту пацієнтів.
Література
Alencherry B., Laffin L. J. Treatment of hypertension in patients with diabetes mellitus: a contemporary approach. Current Cardiology Reports. 2021; 23: 14.
Коментар фахівця
 Лариса Анатоліївна МІЩЕНКО науковий керівник відділення артеріальної гіпертензії та коморбідних патологій ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України» (м. Київ), доктор медичних наук Лікування АГ у пацієнтів із ЦД є предметом активного вивчення й обговорення на межі діабетології та кардіології. Значення ефективного контролю рівня АТ для прогнозу пацієнта з цією коморбідністю є безсумнівним.
Лариса Анатоліївна МІЩЕНКО науковий керівник відділення артеріальної гіпертензії та коморбідних патологій ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України» (м. Київ), доктор медичних наук Лікування АГ у пацієнтів із ЦД є предметом активного вивчення й обговорення на межі діабетології та кардіології. Значення ефективного контролю рівня АТ для прогнозу пацієнта з цією коморбідністю є безсумнівним.
Останні настанови як кардіологічних, так і ендокринологічних міжнародних товариств висловлюють консолідовану позицію щодо цільового рівня АТ у пацієнтів із ЦД: кінцевою метою є АТ <130/80 мм рт. ст. за умови хорошої переносимості. Проте існують і певні нюанси.
Європейські рекомендації з профілактики серцево-судинних захворювань 2021 р. пропонують покроковий підхід до лікування АГ у пацієнтів із ЦД: досягнення АТ <140/90 мм рт. ст. як первинної мети з подальшим зниженням <130/80 мм рт. ст. у всіх пацієнтів віком менш як 70 років.
Задекларовані цілі є надзвичайно амбітними для реалій української клінічної практики. Результати останнього українського епідеміологічного дослідження STEPS свідчать про вкрай низький рівень контролю АТ в українській популяції пацієнтів з АГ — 14% із-поміж тих, які лікуються. Ще нижчим цей показник є у пацієнтів із ЦД і АГ. За наявності АГ і ЦД досягнення контролю АТ є складнішим завданням, а резистентність до антигіпертензивної терапії трапляється набагато частіше, ніж у разі АГ без ЦД. Резистентність до антигіпертензивної терапії при ЦД зумовлена цілим переліком чинників: ожиріння, обструктивне апное сну, хронічна хвороба нирок.
Негативний внесок у погіршення контролю АТ може робити також незадовільний контроль глікемії.
Принципи лікування АГ при ЦД не відрізняються від підходів у загальній популяції пацієнтів з АГ. Стартова антигіпертензивна терапія з комбінації блокатора ренін-ангіотензин-альдостеронової системи (РААС) із діуретиком або БКК в одній таблетці є пріоритетною для пацієнтів із ЦД.
У разі неефективності — інтенсифікація лікування шляхом використання потрійної фіксованої комбінації блокатора РААС із діуретиком і БКК з подальшим додаванням інших класів антигіпертензивних препаратів.
Вибір комбінацій для лікування АГ має враховувати й особливі характеристики гіпертензії в пацієнтів із діабетом. Насамперед це стосується порушень добового ритму АТ за типом non-dipper (недостатнє зниження АТ вночі) та night-peaker (середній нічний АТ є вищим за денний).
Саме це зумовлює потребу в застосуванні препаратів із тривалим антигіпертензивним ефектом упродовж 24 годин при одноразовому прийомі, який є бажаним із погляду зменшення кількості таблеток на добу.
Це принципово важливо для пацієнтів із ЦД, в яких поліпрагмазія — радше правило, ніж виняток, а використання фіксованих комбінацій із препаратами тривалої дії забезпечує контроль АТ удень та вночі, мінімізуючи загальну кількість таблеток на добу.
Лікування пацієнтів з АГ і ЦД потребує усвідомленого підходу до вибору антигіпертензивних препаратів. З огляду на доказову базу щодо покращення прогнозу пацієнтів і доведені органопротекторні, особливо нефропротекторні, властивості блокатори РААС є неодмінною складовою терапії. Традиційно дискусія точиться навколо особливостей застосування β-адреноблокаторів і тіазидних діуретиків.
Що стосується останніх, то сьогодні у фіксованих комбінаціях застосовуються низькі дози гідрохлоротіазиду, які є метаболічно нейтральними.
Хоча перевага все-таки віддається тіазидоподібним діуретикам, які мають більше доказів на користь покращення прогнозу, в тому числі в пацієнтів із ЦД. У сучасній концепції лікування АГβ-блокатори призначаються хворим на АГ за наявності таких показань: перенесений інфаркт міокарда, стенокардія, СН, планування вагітності, а також гіперсимпатикотонія. У пацієнтів із ЦД рекомендовано високоселективні β1-адреноблокатори (як-от бісопролол) і препарати з додатковими вазодилятаторними властивостями (як-от небіволол, карведилол). Окрім того, призначаючи антигіпертензивну терапію хворим на ЦД, потрібно враховувати антигіпертензивний ефект іНЗКТГ-2, який у середньому становить 3-5 мм рт. ст. Водночас варто зважати: що вищим є вихідний АТ, то більше його зниження можна очікувати при застосуванні препаратів.
Ефективний контроль АТ є невід’ємною умовою лікування пацієнтів з АГ і ЦД. Поряд з адекватною статинотерапією та застосуванням іНЗКТГ-2 / агоністів рецепторів глюкагоноподібного пептиду-1 досягнення й утримання цільового рівня АТ є запорукою зниження ризику розвитку серцево-судинних і ниркових ускладнень.
Ірбесартан у разі ЦД: нефропротекція + сприятливий метаболічний вплив
Обираючи оптимальний БРА для лікування пацієнта з ЦД, варто звернути увагу на ірбесартан. Передусім ірбесартану притаманна виражена нефропротекція, доведена в програмі досліджень PRIME. Ця програма включала дослідження IRMA-2 (пацієнти з ЦД 2 типу та мікроальбумінурією) та IDNT (пацієнти з ЦД 2 типу на пізніх стадіях захворювання нирок; Parving H.H. et al., 2001; Lewis E.J. et al., 2001).
За даними дослідження IRMA-2 (n=590), застосування ірбесартану в дозі 150 мг знижує рівень екскреції альбуміну на 24%, а в дозі 300 мг — на 38%. Відносний ризик розвитку протеїнурії
на тлі прийому доз 150 і 300 мг знижується на 39 і 70% відповідно (Parving H.H. et al., 2001). Своєю чергою, дослідження IDNT (n=1715) продемонструвало, що ірбесартан достовірно сповільнює зниження розрахункової швидкості клубочкової фільтрації. Ризик подвоєння концентрації сироваткового креатиніну у хворих, які отримували ірбесартан, був на 37% нижчим, ніж у групі хворих, які отримували амлодипін. Відносний ризик розвитку термінальної стадії ниркової недостатності в групі ірбесартану був на 23% нижчим порівняно з двома іншими групами (амлодипін і плацебо; Lewis E.J. et al., 2001). Ці результати застосування ірбесартану є дуже важливими, оскільки ураження нирок і мікроальбумінурія є вагомими прогностичними чинниками коронарних подій у пацієнтів із ЦД (Rutter M.K. et al., 2002).
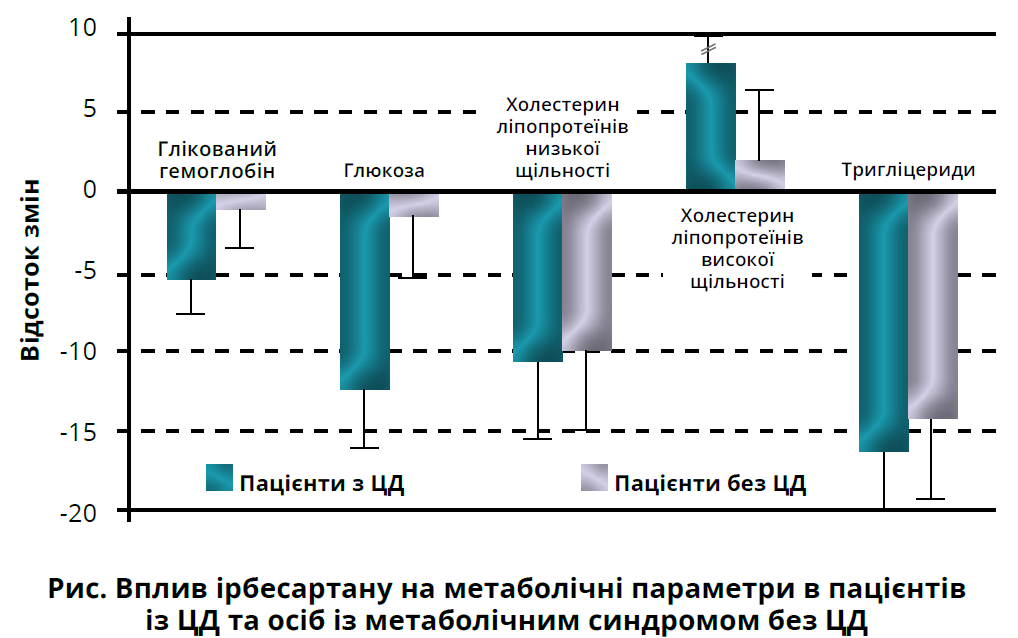
Крім потужної нефропротекторної дії, ірбесартан має сприятливий вплив на метаболічні параметри. У проспективному обсерваційному дослідженні DO-IT через 6 місяців терапії ірбесартаном середній САТ учасників знизився на 14% (зі 157,4±14,7 до 135,0±10,7 мм рт. ст.), а середній ДАТ — на 13% (із 92,9±9,2 до 80,8±6,8 мм рт. ст.). Зниження АТ супроводжувалося зниженням маси тіла на 2,3%, вмісту глюкози натще — на 9,5%, глікованого гемоглобіну — на 4,6%, холестерину ліпопротеїнів низької щільності — на 11%, тригліцеридів — на 16% і підвищенням холестерину ліпопротеїнів високої щільності на 5% (рис.). Цікаво, що сприятливі зміни були вираженішими в осіб з ожирінням порівняно з учасниками з нормальною масою тіла й у пацієнтів із ЦД порівняно з особами з нормальним гомеостазом глюкози. Вплив ірбесартану на метаболізм є дозозалежним: на тлі прийому 300 мг/добу ефект є вираженішим, аніж за умови вживання 150 мг/добу. Додавання гідрохлортіазиду дає змогу досягти ще кращого результату.
Слід зауважити, що відзначається висока прихильність пацієнтів до лікування ірбесартаном. У дослідженні Irbesartan Compliance Evaluation (ICE), яке проводилося в різних країнах Європи (Німеччина, Франція та Велика Британія), було з’ясовано, що через 12 місяців спостереження на стартовій монотерапії ірбесартаном залишилися 60,8% пацієнтів, іншими БРА — 51,3%, β-блокаторами — 49,7%, БКК — 43,6%, іАПФ — 42%, діуретиками — 34,4% (Forni V. et al., 2011).
Освітньо-практичний журнал Ендо Practise №1 2022