Особливості харчування та роль балансу кишкової мікрофлори у веденні цукрового діабету 2-го типу. Частина 1
Підготувала канд. мед. наук Ірина Жакун
Всесвітнє дослідження цукрового діабету (ЦД), опубліковане науковцями міжнародної організації NCD-RisC (Non-Communicable Disease Risk Factor Collaboration)*, виявило, що станом на 2022 рік кількість дорослих хворих на ЦД у світі становила близько 828 мільйонів [2]. Зокрема, ЦД 2-го типу виявлено приблизно в 6% населення. За оцінками експертів, близько 530 мільйонів людей у всьому світі страждають на ЦД 2-го типу та його ускладнення. Тому вивчення нових факторів і механізмів, які впливають на вуглеводний обмін, має вирішальне значення для профілактики й ефективного лікування пацієнтів із ЦД.
Одним з таких досліджень стала спільна праця науковців медичних коледжів США та Румунії. З метою кращого розуміння механізмів розвитку ЦД 2-го типу й інсулінорезистентності (ІР) учені проаналізували результати та висновки наукових робіт, які були опубліковані в 363 медичних інформаційних джерелах, визначили роль поживних речовин у підтриманні нормального складу мікрофлори кишківника (МК), описали особливості мікробіому кишківника осіб із ЦД 2-го типу та виявили механізми, за допомогою яких МК в одних випадках спричиняє виникнення й розвиток ЦД 2-го типу, а в інших – сприяє ремісії хвороби [1].
МК є одним з важливих регуляторів гомеостазу організму людини. Шлунково-кишковий тракт заселений трильйонами мікроорганізмів, 90% яких становлять Bacteroidetes і Firmicutes. Дисбаланс МК асоціюється з низкою хвороб, зокрема з розвитком ЦД 2-го типу. Вплив бактерій кишківника на розвиток ЦД 2-го типу відбувається шляхом змін співвідношення різних видів бактерій та утворення метаболітів, як-от коротколанцюгові жирні кислоти (КЖК), жовчні кислоти (ЖК) й амінокислоти (АК). Усі ці метаболіти утворюються в кишківнику внаслідок переробки бактеріями поживних речовин, які потрапили в кишківник з їжею: КЖК утворюються мікроорганізмами з клітковини, ЖК – з холестерину, АК – з білків.
Ці сполуки можуть як посилювати гіперглікемію й ІР, так і сприяти нормоглікемії. Зокрема, бактерії родів Bifidobacterium і Lactobacillus продукують КЖК, що асоціюється зі зниженням рівня глікованого гемоглобіну (HbA1c). Водночас у пацієнтів із ЦД 2-го типу, в яких розвинувся дисбактеріоз, змінюються рівні КЖК та ЖК через підвищену проникність кишкового бар’єра.
Таксономічні зміни у хворих на ЦД 2-го типу характеризуються зменшенням кількості бактерій, що виробляють бутират (Roseburia intestinalis, Bifidobacterium spp., Akkermansia spp., Faecalibacterium prausnitzii), та збільшенням патогенних видів (Clostridium spp., Escherichia coli, Eggerthella spp., Fusobacterium, Ruminococcus). Надлишок грамнегативних бактерій спричиняє підвищення рівнів ліпополісахаридів (ЛПС), які активують каскад біохімічних реакцій у тканинах, наслідками чого є послаблення бар’єрної функції кишківника, ендотоксемія та запалення.
МК та її метаболіти, зокрема КЖК і ЖК, відіграють важливу роль у підтриманні глікемічного гомеостазу та профілактиці ІР. Доведено, що КЖК мають протизапальний ефект, який реалізується шляхом впливу на метаболічну активність Т-лімфоцитів. Бутират, пропіонат і ацетат знижують рівні HbA1c, ЛПС і прозапальних цитокінів у сироватці крові, що запобігає ураженню стінки кишківника. Пропіонат посилює експресію Т-хелперів, які зменшують запалення жирової тканини й ІР, а також інтерлейкіну-10 (ІЛ-10), нормальний рівень якого необхідний для підтримання еубіозу кишківника. Дефіцит ІЛ-10 спричиняє дисбактеріоз. Окрім протизапальної дії, КЖК стимулюють виділення глюкагоноподібного пептиду-1 (ГПП-1) ентероендокринними клітинами кишківника. ГПП-1 стимулює секрецію інсуліну, знижує секрецію глюкагону, уповільнює випорожнення шлунка та сприяє зниженню апетиту.
У разі дефіциту енергії клітин, КЖК, ЖК гормони кишківника та певні ліки впливають на аденозинмонофосфат-активовану протеїнкіназу кишківника (AMPK). Це стимулює енергетичний обмін і пригнічує запалення. Дослідження показали, що МК бере участь у ферментативному перетворенні ЖК. Зв’язування ЖК з фарнезоїдним X-рецептором і рецептором-5, пов’язаним з G-білком Takeda (TGR5), реструктуризує МК та впливає на ланки патогенезу ЦД 2-го типу.
Активація TGR5 покращує функцію підшлункової залози та печінки, що сприяє вивільненню ГПП-1 і зменшенню ІР. Окрім того, ЖК підвищують чутливість фактора росту фібробластів до інсуліну та знижують активацію mTORC1**. Деякі медикаменти (метформін) і дієтичні чинники (поліфеноли) також стимулюють цей шлях активації AMPK у кишківнику.
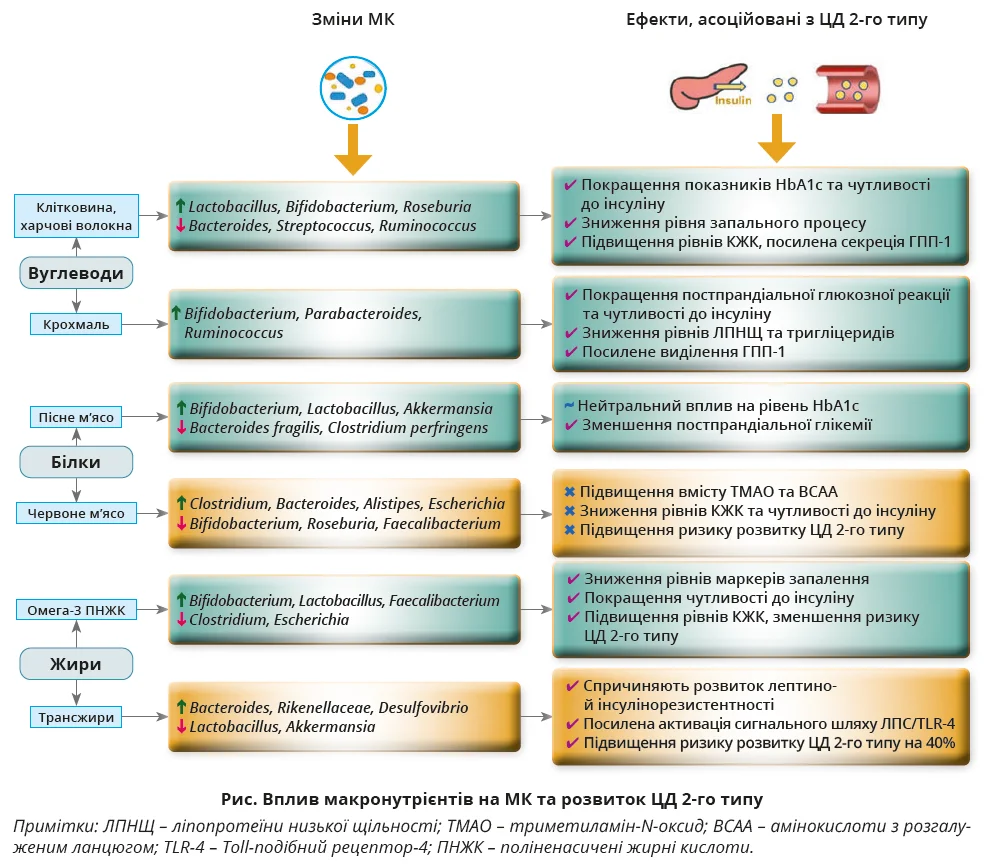
Раціон харчування впливає на склад і кількість МК. Макронутрієнти (вуглеводи, білки та жири) впливають як на мікрофлору кишківника, так і на розвиток ЦД 2-го типу (рис.).
Дієти з високим умістом вуглеводів асоціюються з переважанням роду Prevotella, тоді як дієти з високим умістом м’яса сприяють збільшенню Bacteroides. Їжа, багата на жири та тваринні білки, спричиняє дисбактеріоз, зростання кількості E. coli й Ruminococcus, підвищення проникливості стінки кишківника та метаболічну ендотоксемію, що призводить до ІР. Такий раціон зменшує кількість бактерій, які виробляють КЖК. Продукти харчування з високим умістом клітковини, горіхів і омега-3 жирних кислот підвищують кількість бактерій-продуцентів КЖК (Lactobacillus, Bifidobacterium, Eubacterium, Faecalibacterium), зменшують кількість Bacteroides і Prevotella, що забезпечує кращий контроль глікемії. Дотримання такої дієти сприяє зниженню рівнів ІЛ-6, С-реактивного білка, внутрішньоклітинної молекули адгезії-1 (ICAM-1), а також збільшенню секреції ГПП-1, що запобігає розвитку ЦД 2-го типу.
Раціони з низьким глікемічним індексом нормалізують показники HbA1c, рівні ліпідів крові та показників запалення, тоді як дієти з високим умістом білків і жирів асоціюються з дисбактеріозом, підвищеною проникністю стінки кишківника, виробленням ЛПС і гіперактивацією mTOR*** , що посилює ІР. Складові продуктів харчування впливають на метаболічні шляхи, пов’язані з ІР (активація mTORC1), спричиняючи дисфункцію мітохондрій і апоптоз β-клітин. Сукупно це підтверджує, що дієтичні втручання через модифікацію МК істотно визначають ризик і перебіг ЦД 2-го типу.
Отже, повноцінні дієти можна вважати основним немедикаментозним чинником лікування ЦД. Баланс макро- та мікронутрієнтів харчового раціону впливає на чутливість клітин до інсуліну, контроль глікемії й інші показники метаболізму. До макронутрієнтів належать основні компоненти їжі: білки, жири та вуглеводи, як-от глюкоза, фруктоза, сахароза й лактоза. Вони є основним джерелом енергії для всіх тканин організму. Дієти з низьким умістом вуглеводів (ДНВ) знижують HbA1c, підвищують чутливість до інсуліну, покращують ліпідний профіль і зменшують ризик розвитку ЦД 2-го типу, тоді як дієти з високим умістом вуглеводів підвищують цей ризик. Окрім прямого впливу на рівень глюкози крові, ДНВ модулюють гормони кишківника, зокрема ГПП-1, і сприяють корисним змінам МК. Дотримання ДНВ впродовж 3 місяців забезпечує підвищення секреції ГПП-1, зниження HbA1c і збільшення видів МК, що виробляють КЖК, роль яких у запобіганні розвитку ЦД 2-го типу було описано вище.
Споживання продуктів з надлишком глюкози та фруктози асоціюється з дисбактеріозом і зростанням кількості патогенних бактерій кишківника. Зростання співвідношення Firmicutes/Bacteroidetes, а також надлишок прозапальних мікроорганізмів Desulfovibrio супроводжувалися гіперглікемією натще, підвищенням ІР, зростанням проникності стінки кишківника та вищим ризиком розвитку ЦД 2-го типу. Надмірна кількість мікроорганізмів родів Akkermansia та Bacteroides руйнувала шар муцину кишківника, спричиняла запалення й секрецію цитокінів, тоді як Desulfovibrio, що продукує сірководень, посилює системне запалення та корелює з підвищенням рівня інсуліну натще. Сукупно ці зміни зумовлюють ІР, гіперглікемію й метаболічну ендотоксемію.
Клітковина є пребіотичним фактором, який змінює склад МК та сприяє профілактиці й контролю ЦД 2-го типу. Харчові волокна, стійкі до травлення в тонкій кишці, ферментуються мікробіотою товстої кишки та сприяють утворенню КЖК. Уживання клітковини сприяє глікемічному контролю, знижує ризик серцево-судинних ускладнень і метаболічного синдрому.
Розчинні волокна, зокрема псиліум й інулін, позитивно впливають на МК та ліпідний профіль, а волокна зернових культур найефективніше знижують ризик розвитку ЦД 2-го типу.
Зростання кількості мікроорганізмів родів Bifidobacterium, Roseburia, Lachnospira та Prevotella під впливом дієти, багатої на клітковину, асоціюється з підвищеним виробленням КЖК, нормалізацією вмісту HbA1c і зменшенням рівнів прозапальних метаболітів. Дефіцит клітковини призводить до зниження різноманіття МК, зменшення вироблення бутирату та прогресування ІР.
Білки є основним джерелом усіх клітинних структур та одним із чинників регуляції енергетичного обміну. Як для здорових осіб, так і для хворих на ЦД 2-го типу рекомендована доза становить 0,8 г/кг маси тіла на день. Водночас у разі діабетичної нефропатії необхідне обмеження білкового навантаження. Хоча роль білка в контролі складу та кількості МК у хворих на ЦД 2-го типу вивчена не достеменно, на сьогодні відомо, що його підвищене споживання покращує чутливість тканин до інсуліну завдяки підтриманню м’язової маси. Високобілкові дієти асоціюються з покращенням кардіометаболічних показників, але вплив на показники глікемії залишається суперечливим. Установлено, що білки сироватки крові стимулюють секрецію інсуліну й інкретинів (ГПП-1, глюкозозалежний інсулінотропний поліпептид§), знижують рівень глюкози й уповільнюють перистальтику шлунка. Однак низка досліджень не виявила прямого зв’язку між високим споживанням білка та зниженням ризику ЦД 2-го типу.
Вид білка в раціоні людини та його походження мають принципове значення: тваринні білки асоціюються з ІР і підвищеним ризиком ЦД, тоді як рослинні протеїни сприяють зростанню чутливості до інсуліну та кращому глікемічному контролю. Збільшення споживання рослинного білка знижує ймовірність розвитку та тяжкого перебігу діабету. Білки метаболізуються мікробіотою кишківника до АК й інших метаболітів, які впливають на механізм дії інсуліну. Особливе значення мають ті АК (лейцин, ізолейцин, валін), надмірна кількість яких спричиняє ІР. Оскільки тваринні білки містять їх більше, це частково пояснює різницю в метаболічній різниці з рослинними білками. Високобілкові дієти також спричиняють зниження вироблення бутирату та зростання триметиламіну-N-оксиду, пов’язаного з атерогенним і діабетогенним ефектами. Склад МК при цьому змінюється: зменшується кількість продуцентів бутирату (Faecalibacterium, Roseburia) та збільшується чисельність Bacteroides, Clostridia й умовно-патогенних видів МК. Натомість рослинні білки стимулюють розмноження корисних родів (Bifidobacterium, Lactobacillus, Akkermansia), що супроводжується позитивним впливом на параметри метаболізму. Отже, вплив білка на перебіг ЦД 2-го типу визначається не лише його кількістю, а й походженням, що опосередковується складними взаємодіями з МК.
Наступним класом макронутрієнтів, які входять до складу їжі та виконують в організмі роль головного джерела енергії, є жири. Високожирова дієта підвищує ризик розвитку ЦД 2-го типу шляхом погіршення толерантності до глюкози та накопичення тригліцеридів у м’язах. У патогенезі ЦД 2-го типу тип жирів у раціоні харчування має не менше значення, ніж їхня кількість. Дієтичні рекомендації наголошують на обмеженні насичених жирів і трансжирів і рекомендують збільшити споживання моно- та поліненасичених жирних кислот (ПНЖК).
Рослинні жири, зокрема α-ліноленова кислота та ПНЖК, асоціюються зі зниженням ризику ЦД 2-го типу. Заміна насичених жирів на ПНЖК зменшує ймовірність розвитку ЦД 2-го типу на третину, а трансжирів – майже наполовину. Омега-3 й омега-6 ПНЖК покращують чутливість тканин до інсуліну, знижують рівні запальних маркерів і сприяють нормалізації метаболізму. Такий позитивний ефект реалізується через вплив на МК: збільшення кількості Bifidobacterium і Akkermansia, а також підвищення вироблення КЖК.
Натомість трансжири та насичені жири змінюють мікробний баланс, зумовлюють зменшення різноманіття МК і збільшення співвідношення Firmicutes до Bacteroidetes, а також збільшення чисельності F. prausnitzii, Firmicutes, Proteobacteria, Desulfovibrionaceae, Rikenellaceae, Bacteroides та інших анаеробних мікроорганізмів, що спричиняє запалення й ІР. Наслідками цього є збільшення резистентності до лептину, розвиток ожиріння, дисбактеріозу та системного запалення. Водночас відсутність цих жирів у раціоні забезпечує відносне збільшення кількості корисних бактерій, як-от Bifidobacterium, а також нормалізацію рівнів глюкози крові та загального холестерину крові.
Отже, вплив ліпідів на ЦД 2-го типу залежить від якості та походження жирів їжі, а модуляція МК є одним із ключових механізмів цього ефекту. Відповідно, індивідуальний підбір страв з оптимальним співвідношенням поживних речовин сприяє нормалізації рівнів глюкози крові, HbA1c, а також стабільному перебігу та тривалим періодам компенсації ЦД 2-го типу.
Література
- Hamamah S., Iatcu O.C., Covasa M. Nutrition at the intersection between gut microbiota eubiosis and effective management of type 2 diabetes. Nutrients. 2024; 16 (2): 269. doi: 10.3390/nu16020269.
- NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in diabetes prevalence and treatment from 1990 to 2022: a pooled analysis of 1108 population-
representative studies with 141 million participants. Lancet. 2024 Nov 23; 404 (10467): 2077-2093. doi: 10.1016/S0140-6736(24)02317-1.
* Всесвітня мережа науковців, яка збирає, аналізує й оприлюднює нові або оновлені дані про хвороби неінфекційного походження по всьому світу.
** mTORC1 – mechanistic target of rapamycin – перший варіант білкового комплексу клітин, який регулює ріст, обмін речовин і старіння.
*** Загальна назва двох білкових комплексів з різними функціями, пов’язана з тим, що сполука була винайдена як «мішень» для дії імунодепресанту рапаміцину, який гальмує його активність.
• Гормон шлунково-кишкового тракту, що стимулює секрецію інсуліну та накопичення жиру в жировій тканині, разом з ГПП-1 створює «інкретиновий ефект», завдяки якому після їди зростає секреція інсуліну.