Інозитоли – ключові вторинні медіатори інсуліну. Частина 2
Підготувала канд. мед. наук Ольга Королюк
Зазвичай прояви гестаційного діабету (ГД) виникають у другому-третьому триместрах вагітності.
За даними Міжнародної дослідницької групи з проспективного вивчення гіперглікемії та несприятливих наслідків вагітності, материнська гіперглікемія призводить до численних короткострокових і довгострокових ускладнень для матері та дитини. Найпоширеніші ускладнення ілюструє рисунок 6.
У жінок з ГД ризик гестаційної гіпертензії (рівень тиску ≥140/90 мм рт. ст. після 20 тижнів вагітності) втричі вищий, аніж у вагітних без ГД. Як відомо, гестаційна гіпертензія може спричинити пошкодження печінки та нирок, прееклампсію й інші ускладнення вагітності, які потребують кесаревого розтину. Крім того, жінки з ГД більш схильні до прееклампсії, що виникає після 20 тижнів вагітності, характеризується появою гіпертензії, протеїнурії, набряків і асоціюється з порушенням функції плаценти.
Серед жінок, у яких ГД ускладнював декілька вагітностей, виявлено вищу захворюваність на рак молочної залози. Зв’язок між діабетом і онкогенезом складний: ракові клітини демонструють вище споживання глюкози та надмірну експресію рецепторів інсуліну й інсуліноподібного фактора росту-1, що може посилити проліферацію, мітогенез і метастазування; гіперінсулінемія підвищує рівень інсуліноподібного фактора росту-1, що спричиняє канцерогенез; інсулінорезистентність (ІР) і гіперінсулінемія знижують рівень глобуліну, який зв’язує статеві гормони, що підвищує біодоступність ендогенних естрогенів і андрогенів, пов’язаних з вищим ризиком раку молочної залози в постменопаузі. Крім раку молочної залози, ГД асоціюється з вищим ризиком раку яєчників, шийки матки, матки, щитоподібної та підшлункової залоз.
Що стосується впливу на плід, то ГД призводить до вісцеромегалії, макросомії або великого для гестаційного віку розміру плода, а також підвищує ризики гіперінсулінемії та гіпоксії плода, затримки росту легень і респіраторного дистрес-синдрому, пологової травми плода, неонатальної гіпоглікемії та жовтяниці. Епідеміологічні дані й дослідження показують, що ГД може впливати на внутрішньоутробний розвиток мозку та змінювати поведінку дитини в майбутньому житті. Оскільки макросомія плода найбільше пов’язана з патогенезом ГД та є причиною багатьох указаних вище ускладнень, запропоновано ретельний моніторинг макросомії плода як маркера ГД.
Довгострокові негативні наслідки ГД для дітей від матерів з ГД охоплюють підвищений ризик ожиріння, цукрового діабету (ЦД) 2-го типу й інших метаболічних розладів. Установлено зв’язок між ризиком лейкемії в дитини та ГД у матері. Доведено, що навіть короткочасний вплив материнського діабету на ранніх стадіях розвитку достатній для індукування незворотних змін метилювання ДНК й експресії генів, які контролюють секрецію інсуліну; це свідчить про опосередкований метилюванням епігенетичний механізм непереносимості глюкози між поколіннями, індукований ГД.
Несприятливі наслідки ГД для матері та дитини зумовлюють важливість скринінгу, ранньої діагностики й лікування цього стану. На жаль, на сьогодні не існує єдиних рекомендацій щодо точного скринінгу ГД, як і єдиних діагностичних критеріїв. Золотим стандартом діагностики ГД залишається пероральний тест на толерантність глюкози (ПТТГ).
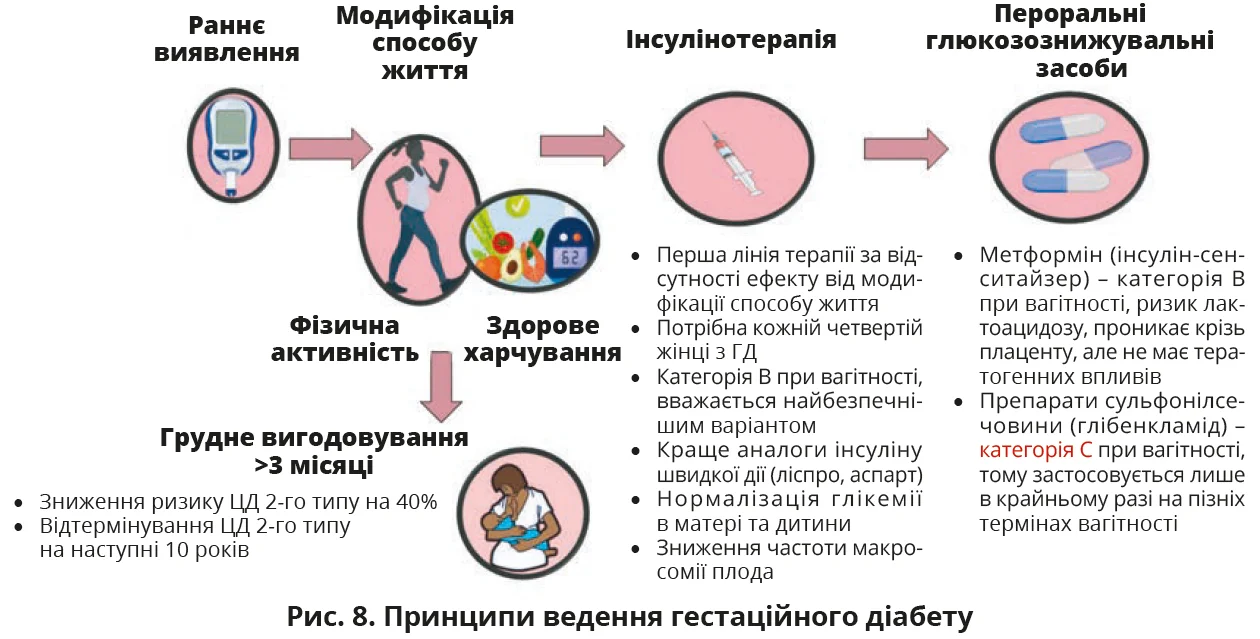
Щодо термінів скринінгу, то більшість настанов рекомендують його проведення в період 24-28 тижнів вагітності (рис. 7). Американський коледж акушерів-гінекологів рекомендує проводити пренатальне тестування ГД на 32-34-му тижні вагітності за допомогою нестресових тестів двічі на тиждень або щотижневих модифікованих біофізичних профілів. Наразі критерії IADPSG видаються найефективнішими для скринінгу та діагностики ГД. Раннє виявлення та належне лікування ГД, включно з моніторингом глікемії, корекцією способу життя, консультаціями з питань харчування, фізичними вправами та введенням інсуліну (рис. 8), дають змогу зменшити ризик ускладнень у матері та дитини. Зважаючи на ризик віддалених наслідків, жінки з ГД в анамнезі мають проходити подальший скринінг на наявність діабету що 3 роки.
Застосування інозитолу для профілактики ГД та його ускладнень
Патогенетичним обґрунтуванням доцільності призначення інозитолу при ГД є результати експериментального дослідження, проведеного на 24 плацентах жінок з метою оцінювання впливу глюкози на експресію ферментів і транспортерів інозитолу в плаценті. У плацентах вагітних з ГД виявлено зниження концентрації інозитолу приблизно на 17%, а також нижчі рівні білка ферменту синтезу міоінозитолу (МІ) та його транспортерів; ці показники обернено корелювали з глікемією натще. Імовірно, відновлення зниженого ендогенного запасу інозитолу шляхом призначення добавок MI та/або D-хіроінозитолу (DХI) може позитивно вплинути на вагітних з високим ризиком ГД.
Терапевтичні впливи інозитолу при ГД
Більшість висновків щодо ефективності інозитолу отримано з досліджень, проведених для профілактики ГД. Лише декілька досліджень оцінювали МІ як засіб для лікування ГД.
Невелике пілотне дослідження оцінювало здатність МІ бути препаратом першої лінії для лікування ГД. Протягом 12 місяців жінки з ГД, які не досягли глікемічного контролю під впливом дієти (n=32), отримували МІ в дозі 1200 мг і фолієву кислоту в дозі 400 мкг/день; групу контролю становили жінки з ГД, які отримували інсулін і лікувалися в центрі протягом попереднього року (n=28). Початкові характеристики та догляд були подібними в обох групах. Автори дійшли висновку, що МІ може бути безпечним препаратом першої лінії для лікування неконтрольованого ГД.
Нещодавно опубліковано результати іншого нерандомізованого дослідження, котре оцінювало вплив приймання високих доз МІ (4 г) у жінок з ГД на глікемічний контроль, потребу подальшого фармакологічного втручання та наслідків для матері (гестаційна гіпертензія, прееклампсія, рецидивна кетонурія, глюкозурія, спонтанний викидень (втрата вагітності до 24-го тижня), кесарів розтин і передчасні пологи до 37-го тижня) та плода (маса тіла та зріст при народженні, великий або малий розмір плода щодо гестаційного віку при народженні, випадки гіпоглікемії, гіпокальціємії, гіпербілірубінемії, респіраторний дистрес-синдром або госпіталізація новонароджених у відділення інтенсивної терапії). У дослідження включено 330 жінок з ГД, серед яких 150 отримували МІ в дозі 4000 мг і 180 жінок не отримували МІ (група контролю). Кількість жінок, які розпочали терапію інсуліном, не відрізнялася в обох групах (52 [34,6%] та 57 [31,6%] у групах МІ та контролю відповідно; Р=0,723); у групі МІ частіше використовували інсулін тривалої дії, у групі контролю – базально-болюсний режим уведення інсуліну (обидва P<0,001). Порівняно з групою контролю в жінок із групи МІ виявлено значно нижчі рівні глікемії натще (P=0,032) та після їди (P=0,014) у третьому триместрі, а також потребу в інсуліні в другому та третьому триместрах.
Щодо впливу на ускладнення матері та плода, то автори дійшли висновку, що призначення МІ жінкам з ГД покращує глікемічний контроль і зменшує потребу в інсуліні, особливо в третьому триместрі, а також зменшує ризик макросомії плода та гіпоглікемії новонароджених.
Декілька досліджень вивчали інозитол порівняно з іншими засобами (крім фолієвої кислоти). Крім того, проводилося порівняння чотирьох різних схем лікування жінок з ГД: 1) 400 мкг фолієвої кислоти;
2) 4000 мг МІ в поєднанні з 400 мкг фолієвої кислоти; 3) 500 мг DХІ в поєднанні з 400 мкг фолієвої кислоти; 4) 1100/27,6 мг МІ/DХІ + 400 мкг фолієвої кислоти. Загалом дослідження залучило 80 жінок, яких рандомізовано в одну з чотирьох груп лікування (n=20 у кожній групі). У жінок, які отримували МІ без інсулінотерапії, спостерігалося значне зниження індексу HOMA порівняно з групою контролю (Р<0,001). У групі МІ виявлено меншу варіацію середнього збільшення маси тіла (під час пологів порівняно з періодом до вагітності та в період ПТТГ) порівняно з групою контролю (P=0,001 та P=0,019 відповідно). Жінки, котрі приймали МІ та МІ + DХІ, мали значно меншу потребу в посиленні інсулінотерапії. У жінок групи контролю новонароджені мали більші показники маси тіла при народженні, ніж у жінок, які отримували інозитоли (P=0,032).
Впливи інозитолу на плід
Що стосується впливу на плід, то наявні дані свідчать про пряму потребу в інозитолі на етапі закриття нервової трубки.
Як указувалося вище, ГД характеризується гіперглікемією й ІР, що негативно впливають на плід, підвищуючи ризик передчасного народження, вроджених аномалій, макросомії, великої маси тіла при народженні відносно гестаційного віку, неонатальної гіпоглікемії, респіраторного дистрес-синдрому, жовтяниці та потреби інтенсивної терапії після народження. Крім того, немовлята, народжені жінками з ГД, демонструють підвищений ризик порушення регуляції глюкози в подальшому житті, що в майбутньому подовжує цикл поколінь з ожирінням і діабетом. Висока потреба в МІ під час внутрішньоутробного розвитку, профілактичний ефект МІ щодо дефекту нервової трубки, виникнення ГД, гестаційної гіпертензії, ризику передчасних пологів, великої маси тіла при народженні відносно гестаційного віку вказують на значну користь від його застосування для плода. Крім того, МІ покращував гестаційну глікемію, ліпідний профіль і параметри ІР, зменшував потребу в інсулінотерапії в разі виникнення ГД.
Вплив інозитолу на захворюваність у старших вікових групах
ІР – це дисметаболічний стан, що призводить до зниженої реакції на інсулін периферичних тканин-мішеней, яким потрібні вищі концентрації інсуліну для досягнення фізіологічної відповіді.
Це спричиняє компенсаторну гіперінсулінемію, яку вважають типовою ознакою ІР. У літературі з’являється дедалі більше повідомлень про асоційовану з ІР коморбідність, що може вражати практично будь-яку систему людського організму (рис. 9). Прямі метаболічні наслідки ІР охоплюють ожиріння, запалення, гіпертензію, ендотеліальну дисфункцію, гіперглікемію, ЦД 2-го типу, метаболічний синдром, серцево-судинні хвороби, метаболічно-асоційовану стеатотичну хворобу печінки (МАСХП), цереброваскулярні захворювання, хронічну хворобу нирок і вищу захворюваність на деякі види раку. Оскільки будь-яка хронічна хвороба проходить певний континуум упродовж життя (функціональні порушення ® безсимптомні структурні зміни ® маніфестна хвороба ® ускладнення), природно, що поширеність указаних станів і виникнення пов’язаних з ними ускладнень переважають у старших вікових групах.
Зміни інозитолу в умовах гіперглікемії та ІР
Було продемонстровано, що в людей з діабетом спостерігається дисбаланс між MI та DХI зі зниженим виведенням DХI з сечею та підвищеним виведенням MI з сечею. Експериментальні дослідження показали, що при гіперглікемічних станах пригнічення поглинання MI, індуковане глюкозою, є результатом конкуренції між MI та глюкозою за транспортери, які демонструють структурну подібність. Виснаження внутрішньоклітинного МІ та зниження утворення DХI знижують доступність обох речовин, обмежуючи їх включення до інозитолфосфогліканів (ІФГ), впливаючи на передавання інсулінових сигналів на пострецепторному рівні.
Встановлено, що МІ покращує поглинання глюкози м’язами, натомість глюкоза погіршує поглинання МІ клітинами. Транспорт інозитолу всередину клітини відбувається за допомогою транспортерів, пов’язаних з іонами натрію. Глюкоза здатна конкурентно пригнічувати поглинання інозитолу цим шляхом. Імовірно, саме тому виснажується запас інозитолу в нервах за діабетичної нейропатії. Крім того, глюкоза може виснажувати запаси МІ шляхом активації глюкозо-сорбітольного шляху, де альдозоредуктаза перетворює глюкозу на сорбіт з подальшим утворенням фруктози, рівень якої збільшується в умовах гіперглікемії. Надмір сорбітолу підвищує внутрішньоклітинну осмолярність, що пригнічує поглинання МІ шляхом зниження експресії носіїв. Пригнічення альдозоредуктази відновлює рівень МІ шляхом зниження рівня сорбітолу. Отже, гіперглікемічні стани збільшують потребу в інозитолі.
В умовах ІР і гіперглікемії знижується поглинання інозитолу тканинами та погіршується перетворення МІ на DХI в м’язах, жировій тканині та печінці, оскільки тканиноспецифічні епімерази, які регулюють цей процес, є інсулінозалежними.
Крім того, підвищений рівень глюкози знижує абсорбцію та біосинтез МІ, посилює його деградацію й екскрецію із сечею. У людей з діабетом обох типів виявляють підвищені втрати МІ з сечею. Збільшення втрат МІ з сечею зумовлене глюкозоопосередкованим пригніченням реабсорбції МІ нирками. Зниження рівня МІ ще більше посилює дефіцит DХI. Оскільки МІ та DХІ у складі ІФГ діють як вторинні месенджери інсуліну на пострецепторному рівні, їх дефіцит не тільки підвищує гіперглікемію, а й погіршує антиоксидантний захист, збільшує оксидативний глікувальний стрес, адже DХІ регулює секрецію інсуліну, мітохондріальний дихальний ланцюг і накопичення глікогену.
Порушення нормального співвідношення МІ/DХI в плазмі та сечі можуть бути раннім маркером ІР і ЦД 2-го типу. Із практичного погляду важливим є правильне дозування стереоізомерів інозитолу. Як указувалося вище, в разі комбінованого застосування обох стереоізомерів найкращі результати забезпечувало фізіологічне співвідношення МІ/DХI 40:1. Поєднання МІ (для фіксації низького рівня МІ в яєчнику) та DХI (для фіксації низького рівня DХI в печінці, скелетних м’язах і жирі) має синергетичну користь.
Вплив інозитолу в пацієнтів із ЦД 2-го типу, іншими видами діабету та діабетичними ускладненнями
Зважаючи на поширеність ЦД 2-го типу та його патофізіологічний зв’язок з ІР, інозитол може розглядатися як потенційний терапевтичний засіб. Проте на сьогодні знайдено лише одне клінічне дослідження, котре оцінювало ефективність застосування комбінації MI/DХI 40:1 при ЦД 2-го типу. Результати показали покращення глікемічних показників після 3-місячного курсу лікування: істотне зниження рівня глюкози в крові натще (зі 192,6 до 160,9 мг/дл) і зменшення рівня глікованого гемоглобіну – HbA1c (з 8,6 до 7,7%). Змін показників індексу маси тіла (ІМТ), артеріального тиску та ліпідного профілю не зафіксовано. Під час лікування не спостерігалося жодних побічних ефектів, що свідчить про безпечність терапії інозитолами в пацієнтів із ЦД 2-го типу.
В іншому рандомізованому перехресному дослідженні вивчали вплив інозитолгексафосфату (INSP6) – фосфорильованої форми MI в пацієнтів із ЦД 2-го типу. Виявлено зниження рівня HbA1c та підвищення рівня адипонектину – адипокіну, що покращує чутливість до інсуліну. Високий рівень адипонектину також асоціюється з меншим ризиком виникнення ЦД 2-го типу, а його дія реалізується через стимуляцію окислення ліпідів і зниження запалення. INSP6 і MI не є ідентичними, але мають подібні ефекти, хоча INSP6 не спричиняє помітного зниження індексу HOMA, притаманного для MI. Ожиріння, котре часто супроводжує ЦД 2-го типу, пов’язане з ІР і порушенням функції β-клітин.
Жирова тканина має три типи: WAT (біла), BAT (бура) та brite (гібридна). Дослідження показали, що MI та DХI сприяють диференціації WAT ® BAT з підвищенням кількості мітохондрій і споживання кисню. Вказані ефекти є потенційно корисними для боротьби з ожирінням у пацієнтів із ЦД 2-го типу.
На сьогодні описано випадки так званого подвійного діабету, коли в пацієнтів із ЦД 1-го типу з’являються ознаки ІР. Проведено пілотне дослідження з метою оцінювання гіпотези, що комбінація DХI та фолієвої кислоти може покращити контроль глюкози, зменшуючи ІР у пацієнтів з надмірною масою тіла чи ожирінням і ЦД 1-го типу. Рандомізоване контрольоване дослідження (РКД) тривало 24 тижні. Залучено 26 пацієнтів з надмірною масою тіла чи ожирінням і ЦД 1-го типу, який потребував інтенсивної інсулінотерапії. Пацієнти були рандомізовані для отримання DХI в дозі 1 г + фолієва кислота в дозі 400 мкг 1 раз на день (група лікування) або лише фолієвої кислоти в дозі 400 мкг 1 раз на день (група контролю). Первинною кінцевою точкою була оцінка ефективності DХI щодо метаболічного контролю за HbA1c. Як вторинні кінцеві точки оцінювалися ІМТ та потреба в інсуліні.
У групі лікування спостерігалося значне зниження рівня HbA1c порівняно з контрольною групою (7,5±0,9% проти 7,9±1,7% відповідно, P<0,05) за відсутності значного зниження ІМТ й ІР (ІМТ – 25,7±2,8 проти 26,7±1,0 кг/м2 відповідно, P>0,05; показник ІР – 0,52±0,26 проти 0,52±0,19 відповідно, P>0,05).
Це дослідження вперше продемонструвало, що пероральне приймання DХІ в поєднанні з фолієвою кислотою може покращити метаболічний контроль у пацієнтів з надмірною масою тіла та ЦД 1-го типу.
Участь MI в метаболізмі забезпечується ферментом міоінозитолоксигеназою (MIOX). Надмірна активність ферменту при гіперглікемії спричиняє дефіцит MI й оксидативний стрес, що може зумовлювати прогресування діабетичної нефропатії. Встановлено, що добавки МІ послаблюють пошкодження, спричинені цисплатином, у культивованих клітинах проксимальних канальців мишей Бостонського університету (BUMPT) та ниркових канальцях in vivo. У клітинах проксимальних канальців, оброблених цисплатином, були порушені метаболічні параметри фероптозу – унікальної форми регульованої клітинної загибелі, що спостерігається при різних типах уражень нирок. Дослідники вважають: МІ позитивно впливає на цей процес, оскільки визначено, що лікування цисплатином сприяло підвищенню регуляції ключового ферменту фероптозу NOX4, яке нормалізувалося під впливом МІ. Отже, в дослідженні in vitro MI знижував запрограмовану загибель клітин, фероптоз, оксидативний стрес, що свідчить про нефрозахисну дію та потребує подальших досліджень щодо потенціалу MI в лікуванні хронічних ускладнень діабету.
Дослідження терапевтичного потенціалу інозитолу при діабеті та його ускладненнях усе ще на ранній стадії. На сьогодні є лише одне клінічне дослідження, що вивчало застосування MI/DХІ в співвідношенні 40:1; подвійна терапія показала потенціал для боротьби з ІР і метаболічними порушеннями. Через брак великих РКД це питання потребує подальшого вивчення.
Вплив інозитолу в пацієнтів з іншою патологією, асоційованою з ІР
МАСХП
Опублікований 2020 року систематичний огляд аналізував наявні доклінічні та клінічні дані щодо користі ізомерів інозитолу МІ та DХІ в лікуванні МАСХП (відомої раніше як неалкогольна жирова хвороба печінки – НАЖХП) завдяки впливу на ІР, оксидативний стрес і накопичення жиру в печінці. Доклінічні дані, отримані з тваринних моделей, указують, що недостатність МІ в раціоні тварин спричиняє накопичення тригліцеридів і холестерину в печінці. Дефіцит фосфатидилінозитолу знижував стійкість ендоплазматичного ретикулуму та призводив до стеатозу печінки. Додавання інозитолу до дієти тварин значно знижувало накопичення ліпідів у печінці, нормалізувало антиоксидантну активність (глутатіонпероксидазу, каталазу тощо) та покращувало мікроструктуру тканини печінки.
У 2023 році опубліковано результати подвійно сліпого плацебо-контрольованого рандомізованого клінічного дослідження, в якому вивчали вплив добавок МІ на кардіометаболічні фактори, антропометричні показники та функцію печінки в пацієнтів з ожирінням і НАЖХП. Дослідження залучило 48 пацієнтів з ожирінням і НАЖХП, яких рандомізували на дві групи: лікування (МІ 4 г/день) або плацебо (мальтодекстрин 4 г/день) разом з дієтичними рекомендаціями протягом 8 тижнів. До та після втручання визначали глікемічні індекси, ліпідний профіль, антропометричні показники печінкових ферментів і артеріальний тиск.
Антропометричні показники значно зменшилися в обох групах, але зниження маси тіла (Р=0,049) та систолічного артеріального тиску (Р=0,006) у групі МІ було значно більшим, аніж у групі плацебо, після корегування на вихідні значення та споживання енергії. Добавки МІ сприяли значному зниженню рівня інсуліну в сироватці крові натще (Р=0,008) й індексу HOMA (Р=0,046). Спостерігалися значущі покращення ліпідного профілю, печінкових ферментів, співвідношення аспартатамінотрансфераза/аланінамінотрансфераза та рівня феритину
в сироватці крові в групі МІ порівняно з групою плацебо. Завдяки прийманню МІ протягом 8 тижнів у 1 з 3 пацієнтів тяжкість НАЖХП зменшилася на один ступінь. Автори дійшли висновку, що добавки МІ можуть значно покращити ІР, ліпідний профіль і функцію печінки в пацієнтів з НАЖХП.
Наступного року та сама група дослідників опублікувала результати подвійно сліпого РКД за участю дорослих пацієнтів віком до 55 років з ожирінням і НАЖХП з метою оцінювання впливу МІ в дозі 4 г/день упродовж 8 тижнів на експресію генів шляху SIRT1 – деацетилази, яка регулює ліпідний обмін, атерогенні індекси, гематологічні параметри та запальні маркери. Вивчення генів шляху SIRT1 показало значне зростання рівня експресії LDLR (рецептор ліпопротеїнів низької щільності – ЛПНЩ) лише в групі, що отримувала МІ. Експресія гена eNOS (синтази оксиду азоту) зросла в обох групах, але сильніше в групі, що отримувала МІ. Спостерігалося значне зниження експресії гена LOX1 (рецептор окисненого ЛПНЩ) у групі МІ, але збільшення його експресії в групі плацебо. У групі, яка отримувала МІ, зафіксовано зниження атерогенних індексів, що вказує на покращення ліпідного профілю. Після втручання спостерігалося зниження кількості лейкоцитів і гемоглобіну, маркера системного запалення співвідношення моноцити / холестерин ліпопротеїнів високої щільності. Дослідники дійшли висновку, що застосування МІ в дозі 4 г/день протягом 8 тижнів слабо активує шлях SIRT1, покращує експресію генів, які захищають судини (eNOS, LDLR), знижує атерогенні ризики та запальні маркери й позитивно впливає на гематологічний статус у пацієнтів з НАЖХП. Проте ці ефекти є помірними, для підтвердження їх клінічної значущості потрібні масштабніші дослідження.
Перспективи використання при інших станах
Низка досліджень підтвердила роль інозитолу в терапії психічних розладів, як-от біполярний розлад, депресія, панічні атаки, обсесивно-компульсивні розлади та розлади харчової поведінки.
Крім того, МІ може діяти як важливий фактор росту для клітин людини. Завдяки антиоксидантним, протизапальним і протираковим властивостям обидва стереоізомери є потенційними терапевтичними варіантами для лікування таких метаболічних розладів, як діабет, артеріальна гіпертензія, атеросклероз або онкологічні хвороби.
Неопластичні тканини експресують високі рівні ферменту ароматази порівняно зі здоровими тканинами. Є повідомлення про значуще підвищення експресії ароматази в клітинах міоми матки порівняно із сусіднім нормальним міометрієм, що призводить до високого рівня естрогенів in situ та може спричиняти розвиток міоми матки через інтракринний/автокринний механізм. Оскільки DХІ впливає на експресію ароматази, він може бути потенційним клінічним варіантом для лікування міоми матки. Припускається потенційно висока ефективність застосування комбінації епігалокатехін галат + вітамін D + DХІ для зменшенні об’єму міоми та менструальної кровотечі з метою уникнення операції. Дія DХІ на модуляцію активності ароматази може допомогти пояснити важливе зменшення об’єму міоми матки, про яке повідомлялося в кількох дослідженнях. Можливо, що вітамін D й епігалокатехін галат виявляють свої антипроліферативні та проапоптотичні ефекти, які посилюються завдяки активності DХІ. Звичайно, ці результати потребують додаткового підтвердження на великих вибірках. До речі, вважається, що значна частина переваг дієт з високим умістом клітковини щодо зниження ризику раку та покращення метаболізму глюкози, яка виявилася ефективною при лікуванні СПКЯ, серцево-судинних захворювань, ожиріння та деяких пухлин у жінок, зумовлена вмістом інозитолу.
Висновки
Огляд літератури дав змогу систематизувати сучасні знання про біологічні властивості інозитолів МІ та DХІ як перспективних метаболічних регуляторів з вираженим мультисистемним ефектом. Інозитоли виступають ключовими вторинними месенджерами інсуліну, модулюючи внутрішньоклітинні сигнальні шляхи – транслокацію транспортерів глюкози (GLUT4), синтез глікогену, активність PI3K та протеїнкінази B. DХІ демонструє додаткові ефекти стимуляції піруватдегідрогенази й енергетичного метаболізму в мітохондріях. Тканинна специфічність співвідношення МІ:DХІ регулює фізіологічну відповідь тканин-мішеней на інсулін; порушення цього балансу асоціюється з гіперглікемією, компенсаторною гіперінсулінемією та розвитком ІР.
Незважаючи на позитивні результати, низка клінічних досліджень має обмеження: варіативність доз, невеликі вибірки, короткий термін спостереження, географічна обмеженість. Подальші дослідження мають бути спрямовані на стандартизацію дозування, визначення маркерів відповіді, довготривалі ефекти терапії, а також розроблення алгоритмів застосування інозитолів у різних клінічних нозологіях, зокрема в педіатричних і геріатричних пацієнтів.
Список літератури – в редакції.