Демінералізація кісткових структур як прояв неонатального тяжкого первинного гіперпаратиреозу
Підготувала канд. біол. наук Олександра Демецька
Неонатальний тяжкий первинний гіперпаратиреоз (НТПГПТ) – це надзвичайно рідкісне автосомно-рецесивне захворювання, що потребує високого рівня підозри. Немовлята з цією патологією мають тяжку гіперкальціємію, яка загрожує життю, що потребує адекватного медикаментозного лікування з подальшим хірургічним утручанням.
Об’єднана команда фахівців медичних університетів США на підставі ретроспективного огляду медичної картки новонародженої дівчинки з НТПГПТ деталізувала клінічну картину хвороби, діагностичні проблеми та тактику ведення таких пацієнтів [1].
НТПГПТ – рідкісна генетична хвороба з високим рівнем смертності
Первинний гіперпаратиреоз – поширене ендокринне захворювання, що характеризується гіперкальціємією та підвищеним або невідповідно нормальним рівнем паратиреоїдного гормону (ПТГ). Він спорадично трапляється в дорослих пацієнтів і вважається рідкісним у дітей із частотою 2-5:100 000 і вищим рівнем ускладнень. Менша частка цих випадків має генетичний зв’язок, включно із сімейною гіпокальціуричною гіперкальціємією та НТПГПТ.
НТПГПТ проявляється протягом перших 6 місяців життя та характеризується аномально високими рівнями ПТГ і кальцію в новонароджених. Характерні прояви охоплюють млявість, погане харчування, блювання, зневоднення, закреп, затримку росту, гіпотонію, респіраторний дистрес, демінералізацію скелета та судоми [1].
НТПГПТ характеризується інактивувальними мутаціями в гені кальцієчутливого рецептора (CaSR), що призводить до значної гіперкальціємії й асоційованих з нею ускладнень [2].
Ген CaSR розташований на хромосомі 3q13.3-q21.1, експресується в паращитоподібній залозі та ниркових канальцях і допомагає регулювати гомеостаз кальцію в поєднанні зі зв’язуванням з рецептором. Окрім того, CaSR залучений у контроль синтезу та секрецію ПТГ у відповідь на зміни рівня кальцію в сироватці крові й реабсорбцію/виділення із сечею в нирках.
У літературі описано понад 200 випадків НТПГПТ з різними проявами та тяжкістю хвороби. У більшості пацієнтів діагностовано гомозиготні або складні гетерозиготні патогенні варіанти CaSR, і чимало з таких осіб мають сімейний анамнез гіпокальціуричної гіперкальціємії. Смертність становить 87,5% у пацієнтів, які отримують медикаментозне лікування, та 24% у пацієнтів, які отримують хірургічне лікування [1, 2].
Презентація випадку
Дівчинка народилася на 37-му тижні гестації шляхом планового кесаревого розтину через пренатальні проблеми, включно з материнським гестаційним діабетом, затримкою внутрішньоутробного розвитку, багатоводдям і гіпоплазією лівого передсердя з незначним розширенням правого передсердя (за даними фетальної ехокардіографії) [1].
Перед народженням було організовано госпіталізацію матері до відділення інтенсивної терапії новонароджених для оцінювання стану серця та подальшого обстеження.
Після огляду показники Апгар новонародженої становили 8 і 9 на першій і п’ятій хвилинах відповідно. Новонароджена демонструвала помірний дихальний дистрес із субкостальними западинами, краніотабесом і дзвоноподібною формою грудної клітки. Після початкового обстеження дитину було підключено до неінвазивної вентиляції легень з позитивним тиском для нормалізації дихання. Життєво важливі показники: температура тіла – 36,9 °C, частота дихання – 57/хв, частота серцевих скорочень – 139/хв, сатурація кисню – 99-100% за фракції вдихуваного кисню (FiO2) 30%.
Кардіологічне обстеження виявило безперервний шум, схожий на шум роботи апарату. Пульс був легко пальпованим, симетричним і синхронним. Обстеження черевної порожнини було без примітних ознак. Неврологічне обстеження виявило витягнуту поставу та незначно знижений м’язовий тонус. Обстеження опорно-рухового апарату дало змогу виявити легке викривлення двобічних стегнових кісток, нормальну м’язову масу та відсутність розбіжностей у довжині кінцівок. Ретельне оцінювання шкіри не виявило еритеми, вузликів або ознак некрозу підшкірного жиру.
Подальша ехокардіографія виявила велику відкриту артеріальну протоку, підвищений систолічний тиск у правому шлуночку, незначно розширене праве передсердя, але загалом структурно нормальне серце.
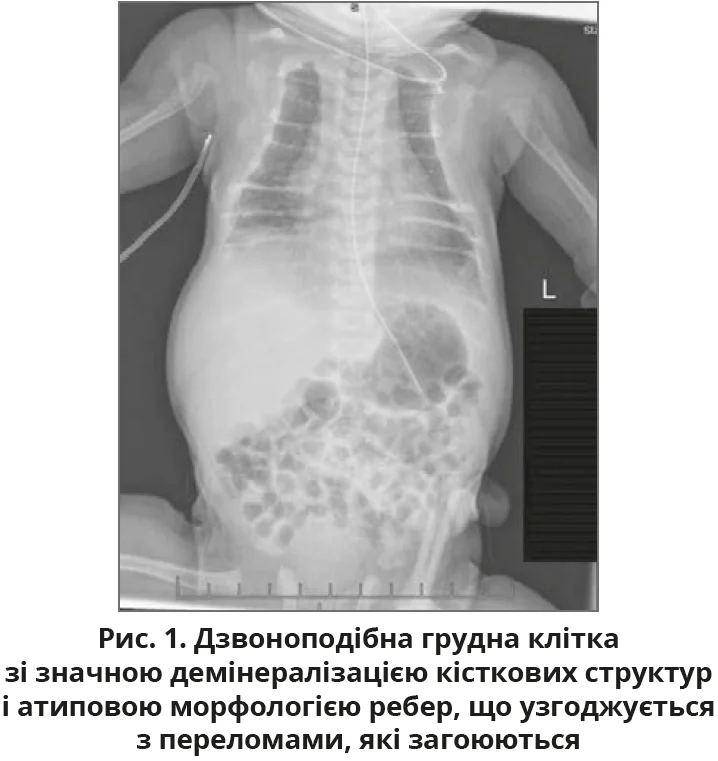
Рентгенографія грудної клітки продемонструвала значну демінералізацію кісткових структур і атипову морфологію ребер із дзвоноподібним виглядом грудної клітки (рис. 1).
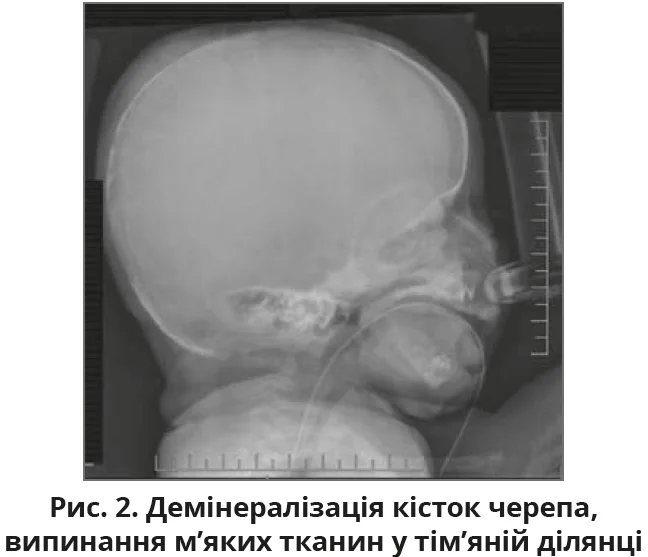
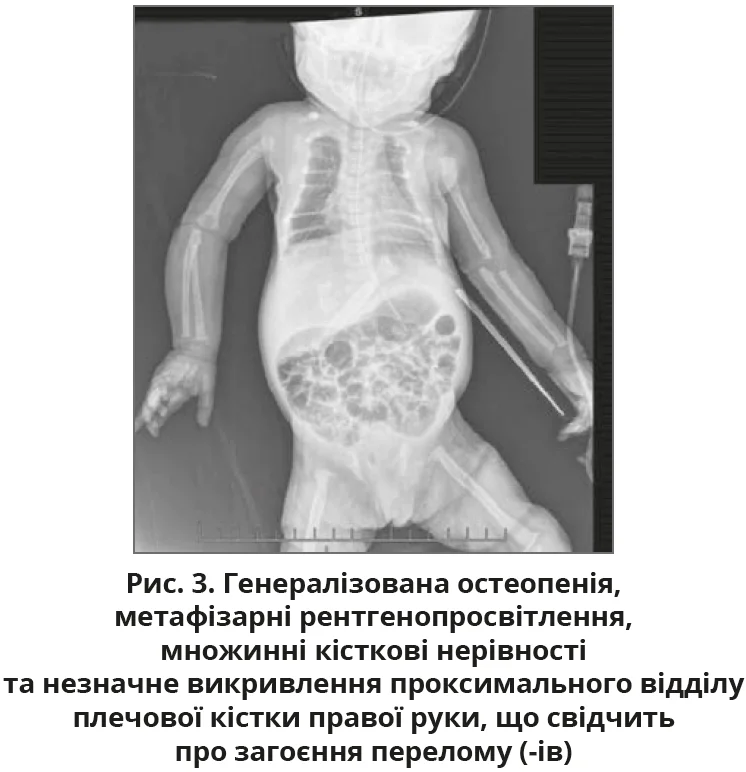
Наступним кроком стало обстеження скелета, яке виявило генералізовану остеопенію з вираженістю м’яких тканин у тім’яній ділянці волосистої частини голови, а також метафізарними просвітленнями та незначним викривленням правого проксимального відділу плечової кістки, що свідчить про загоєння перелому (-ів) (рис. 2, 3).
Лабораторні результати через 24 години життя: рівень кальцію в сироватці крові – 14,3 мг/дл (нормальний діапазон – 8,4-10,6 мг/дл), іонізований кальцій (iCal) – 2,32 ммоль/л (нормальний діапазон – 1-1,5 ммоль/л), рівень 25-гідроксивітаміну D – 54,2 нг/мл (нормальний діапазон – 31-80 нг/мл), рівень ПТГ – 2116 пг/мл (нормальний діапазон – 15-65 пг/мл).
Дівчинку було переведено до третинного медичного центру, де комплексне діагностичне обстеження дало змогу виявити основне захворювання – НТПГПТ.
♦ Фактичний діагноз
Лабораторні дослідження пацієнтки відповідали діагнозу НТПГПТ. Подальше ультразвукове дослідження шиї не виявило жодних ознак аденоми паращитоподібної залози. Молекулярне тестування підтвердило підозрюваний діагноз, виявивши гомозиготний варіант у гені CaSR (c.1744T >A; p.Cys582Ser). Цей місенс-варіант зазначений як імовірно патогенний у базі даних ClinVar (містить інформацію про геномну варіацію та її зв’язок зі здоров’ям людини). Представлений клінічний випадок додатково підтверджує те, що зазначений варіант CaSR є патогенним.
Розкриття діагнозу родині дало змогу зібрати відповідний сімейний анамнез. Батьки добровільно заявили, що їхній союз є кровним. Батько пацієнтки також розповів про сімейну схильність до паратиреоїдектомії та сімейної гіпокальціуричної гіперкальціємії серед родичів по батьківській лінії, включно з ним самим. Подальший генетичний аналіз продемонстрував, що батько є гетерозиготним за сімейним варіантом CaSR; це проливає світло на спадкову природу стану новонародженої дитини. Наразі очікується генетичне тестування матері пацієнтки, що підкреслює важливість сімейного скринінгу та генетичного консультування щодо успадкування й ризику рецидиву НТПГПТ у майбутнього потомства.
♦ Перебіг хвороби та лікування
Зважаючи на вік дитини й дихальну недостатність, початковий план полягав у медикаментозному лікуванні гіперкальціємії новонародженої. Лікування розпочалося з гіпергідратації за допомогою внутрішньовенних уведень рідин і введення фуросеміду для покращення кліренсу кальцію нирками. Добовий баланс рідини пацієнтки ретельно контролювався у відділенні інтенсивної терапії, щоб переконатися, що в неї немає ятрогенної дегідратації. Крім того, немовляті призначили кальцитонін і цинакальцет.
У віці приблизно 6 тижнів дівчинці було проведено процедуру паратиреоїдектомії, під час якої половина залози була реімплантована на грудинно-ключично-соскоподібний м’яз. Під час госпіталізації з приводу переломів не проводилося жодних гострих ортопедичних хірургічних утручань. Протягом усієї госпіталізації електролітний баланс ретельно контролювався.
Деформація ребер і демінералізація немовляти спричинили респіраторний дистрес, що вимагало початку неінвазивної вентиляції легень після народження. Залежність від апарату штучної вентиляції легень зберігалася приблизно до 5-місячного віку, коли пацієнтка досягла стабільності при використанні низькопотокової назальної канюлі зі швидкістю 0,03 л O2. Вона продовжувала отримувати додатковий кисень, а згодом у неї розвинулася легенева гіпертензія, для лікування котрої було призначено силденафіл.
Протягом усієї госпіталізації було проведено кілька ехокардіографічних досліджень для ретельного контролю підвищеного легеневого тиску. Внаслідок тривалої інтубації в немовляти розвинулася ротова аверсія (оральна відраза), що потребувало встановлення гастростомічної трубки (їй почали давати суміш з низьким умістом кальцію).
Виписка з відділення інтенсивної терапії новонароджених відбулася у віці 7 місяців із призначенням силденафілу та кальцитріолу. Батькам було надано докладні інструкції щодо амбулаторного спостереження.
Обговорення
У разі неонатальної кісткової демінералізації та деформацій кісток діагностика основної причини підозри на дисплазію скелета потребує ретельного клінічного, візуалізаційного, біохімічного й молекулярного оцінювання, що допомагає визначити відповідне неонатальне лікування та сімейне консультування.
Початкові диференційні діагнози, засновані на результатах рентгенографії грудної клітки й обстеження скелета, охоплювали: недосконалий остеогенез, скелетні циліопатії (наприклад, синдром Жене) й інші скелетні дисплазії, які проявляються характерною кістковою демінералізацією, що помітна на візуалізації.
Вроджений сифіліс, хоча й рідше пов’язаний з таким тяжким ураженням кісток, залишається важливим фактором через респіраторний дистрес новонародженого та потенційну можливість системного ураження, що впливає на розвиток кісток. Окрім того, рідкісні метаболічні хвороби кісток, як-от гіпофосфатемія й захворювання, опосередковані паратиреоїдними залозами (спорадичні та спадкові причини первинного гіперпаратиреоїдизму або дисфункції кальцієчутливого рецептора CaSR), заслуговують на увагу, особливо коли вони супроводжуються значно підвищеними рівнями кальцію та ПТГ, як це спостерігалося в представленому клінічному випадку. Хоча аліментарний рахіт, що виникає внаслідок дефіциту вітаміну D у матері, є важливим фактором, його ймовірність зменшується в розвинених країнах, де дефіцит поживних речовин менш поширений, особливо за відсутності суттєвих занепокоєнь щодо недоїдання матері перед пологами.
Після госпіталізації до відділення інтенсивної терапії новонароджених було проведено комплексні лабораторні дослідження, котрі виявили значно підвищений рівень ПТГ, який становив 2116 пг/мл, що значно перевищує нормальний діапазон (12-88 пг/мл). Рентгенологічні дані скелетного дослідження генералізованої остеопенії, що супроводжується характерними аномаліями скелета, включно з короткими ребрами та нерегулярною мінералізацією, а також ознаки загоєння переломів, які зачіпають кілька кінцівок з обох боків, додатково підтвердили діагноз (рис. 1-3).
Саме диференційна діагностика та результати комплексного лабораторно-інструментального обстеження стали поштовхом для проведення генетичного тестування, що дало змогу встановити фактичний діагноз немовляти.
Лікування НТПГПТ полягає в тотальній або субтотальній паратиреоїдектомії, але більшості пацієнтів потрібне початкове медичне втручання для стабілізації рівня кальцію. Початкове лікування охоплює гіпергідратацію для стимуляції сольового діурезу з використанням петльових діуретиків або без них для запобігання перевантаженню рідиною й оптимізації кліренсу кальцію нирками. Бісфосфати та нові препарати, як-от цинакальцет, пропонують альтернативні методи переходу до паратиреоїдектомії, коли стан пацієнта є стабільнішим. Цинакальцет, що є кальциміметичним засобом, завдяки цільовому впливу на паращитоподібну залозу може ефективно знижувати рівень ПТГ і таким чином нормалізувати концентрацію кальцію в сироватці крові.
Представлений клінічний випадок підкреслює важливість ранньої діагностики та втручання при НТПГПТ і висвітлює критичну роль довгострокового спостереження в оптимізації результатів лікування пацієнтів.
Подальші дослідження є важливими для кращого розуміння та розроблення стратегій лікування НТПГПТ [1, 2].
Наука для клініцистів
- Сімейна гіпокальціурична гіперкальціємія підвищує ризик розвитку НТПГПТ.
- НТПГПТ пов’язаний як з гомозиготними, так і з композитними гетерозиготними варіантами CaSR.
- Своєчасне виявлення НТПГПТ є вкрай важливим для покращення прогнозу пацієнта.
- Неонатальний гіперпаратиреоїдизм варто враховувати в немовлят з остеопенією, дзвоноподібною грудною кліткою та гіпомінералізацією.
- У немовлят з ознаками гіпомінералізації кісток доцільно провести аналізи на кальцій, фосфор, ПТГ, лужну фосфатазу та вітамін D.
- Варіанти лікування можуть охоплювати гіпергідратацію з петльовими діуретиками або без них, цинакальцет і хірургічну паратиреоїдектомію. Зважаючи на потенційний вплив тяжкої гіперкальціємії на деполяризацію міокарда, моніторинг серцевої функції є критично важливим [1].
Література
- Afrah A., et al. Demineralization of osseous structures as presentation of a rare genetic disorder that is associated with a high rate of mortality. Case Rep. Endocrinol. 2024 Dec 12; 2024: 6063059. doi: 10.1155/crie/6063059.
- Donbaloglu Z. Neonatal severe hyperparathyroidism with inactivating calcium sensing receptor (CaSR) mutation (p.I81K). Journal of Pediatric Endocrinology and Metabolism. 2025. doi: 10.1515/jpem-2024-0569.