Кістковий метаболізм у разі Цукрового діабету: посібник для лікаря-клініциста. Частина 2
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Патофізіологія підвищеної ламкості кісток за наявності діабету
Патофізіологія підвищеної ламкості кісток за наявності цукрового діабету (ЦД) охоплює множинні, подекуди протилежні чинники. ЦД 1-го та 2-го типів властиві спільні риси, зокрема гіперглікемія та судинні ускладнення, котрі безпосередньо й опосередковано негативно впливають на мікроархітектуру кісткової тканини. Водночас ключовими відмінностями між цими двома типами діабету виступають рівень ендогенного інсуліну та відносна тривалість дозрівання скелета до початку захворювання (ЦД 1-го типу часто виникає в молодому віці, до досягнення пікової кісткової маси).
Гіперглікемія
Безпосередній вплив гіперглікемії на клітини охоплює пригнічення дозрівання та диференціації остеобластів, що призводить до демінералізації трабекулярної кісткової тканини, а також до передчасного старіння та прискореного апоптозу остеоцитів, що порушує механочутливість і адаптаційні реакції кістки на стрес.
Кінцеві продукти глікування (КПГ)
КПГ, утворені внаслідок хронічної гіперглікемії, пригнічують розвиток, функції та виживання остеобластів, що призводить до зниження утворення й ремоделювання кісткової тканини. Крім того, КПГ порушують мінералізацію кістки, а також змінюють білковий склад і перехресні зв’язки колагену, що погіршує мікроархітектуру кісткової тканини та знижує її здатність витримувати механічне навантаження.
Ожиріння й інсулінорезистентність (ІР)
Ендогенний інсулін стимулює експресію гормону росту в печінці, що, своєю чергою, спричиняє вироблення інсуліноподібного фактора росту-1.
У зв’язку з цим дефіцит інсуліну в осіб із ЦД 1-го типу асоціюється зі зниженою стимуляцією остеобластів і недостатнім формуванням кісткової тканини. Натомість гіперінсулінемічні стани (ІР, ранні етапи ЦД 2-го типу, вроджена ліподистрофія) пов’язані з підвищеною кісткоутворювальною активністю, що зумовлює високу або нормальну мінеральну щільність кісткової тканини (МЩКТ). Механічне навантаження, пов’язане зі збільшенням маси тіла при ожирінні, також асоціюється з підвищеною МЩКТ.
Гормони жирової тканини лептин і адипонектин вважаються анаболічними факторами для кістки, проте адипонектин може набувати катаболічного впливу в процесі старіння та при запальних станах. Вісцеральна жирова тканина (ВЖТ) є метаболічно активною й характеризується підвищеним рівнем лептину та прозапальних цитокінів, а також зниженим рівнем адипонектину. Дані щодо впливу ВЖТ на скелет є суперечливими: хоча вміст ВЖТ прямо корелює з МЩКТ, цей зв’язок стає оберненим після врахування маси тіла чи індексу маси тіла (ІМТ).
Попри збережену або підвищену МЩКТ і знижену швидкість кісткового ремоделювання, й високий уміст ВЖТ, й ІР асоціюються з порушеною геометрією нижніх ділянок стегнової кістки та зниженням її здатності витримувати навантаження. Отже, неадекватне навантаження на кістку, навіть за умови збереженої МЩКТ, може бути ключовим механізмом розвитку підвищеної ламкості кісток у разі прогресування ЦД 2-го типу.
Судинні ускладнення
У міру прогресування ЦД судинні ускладнення відіграють дедалі більшу роль у патогенезі підвищеної ламкості кісток. Хронічна гіперглікемія та гострі коливання рівня глюкози спричиняють накопичення активних форм кисню й підвищення окисного стресу, що активує механізми ушкодження ДНК і білків. Ці процеси пригнічують диференціацію остеобластів і підвищують апоптоз.
Секреторна функція кісткової тканини
Гормони, які виробляються кістковою тканиною, можуть впливати на гомеостаз глюкози. Наприклад, остеокальцин, який секретується остеобластами під впливом вітаміну D, регулює активність остеобластів та остеокластів, а також мінералізацію кісткової тканини. Виявлено зв’язок між рівнями остеокальцину та регуляцією обміну глюкози, проте напрямок цього зв’язку залишається нез’ясованим. Зокрема, в серії експериментів на мишах дефіцит остеокальцину асоціювався зі зниженою проліферацією β-клітин підшлункової залози, погіршенням толерантності до глюкози та розвитком ІР. Натомість у літніх чоловіків із ЦД 2-го типу та без нього було виявлено позитивний зв’язок між остеокальцином і чутливістю до інсуліну.
Остеогліцин являє собою протеоглікан, який експресується в кістковій і м’язовій тканинах. Дані щодо його впливу на кістковий метаболізм є суперечливими: в доклінічних дослідженнях продемонстровано як пригнічення, так і стимуляцію остеобластичної активності при надмірній експресії остеогліцину. У дослідженні за участю пацієнтів з ожирінням, які проходили програми зниження ваги, рівень циркулювального остеогліцину після втручання зростав і позитивно корелював зі зниженням ваги й ІМТ, а також негативно корелював з рівнем глюкози натще. Загалом отримані результати свідчать про те, що остеогліцин сприяє адаптації скелета до змін енергетичного балансу та маси тіла.
Оцінювання стану кісток у разі діабету
Оптимальні методи виявлення осіб із ЦД та підвищеним ризиком переломів дотепер залишаються невизначеними. За даними двохенергетичної рентгенівської абсорбціометрії (ДРА), обидва типи діабету асоціюються зі змінами МЩКТ. В осіб із ЦД 1-го типу МЩКТ є зниженою, ймовірно, через недостатнє накопичення пікової кісткової маси, спричинене гіпоінсулінемією та низьким рівнем інсуліноподібного фактора росту-1. Натомість у разі ЦД 2-го типу МЩКТ збережена чи навіть підвищена, що корелює з більшою масою тіла. Однак за обох типів діабету ризик переломів вищий, аніж можна було б очікувати, виходячи лише з рівня МЩКТ. Імовірно, підвищена ламкість кісток у разі діабету зумовлена не так зниженням МЩКТ, як порушенням мікроархітектури, зокрема збільшенням кортикальної пористості та зниженим кістковим ремоделюванням.
Метод високороздільної периферичної кількісної комп’ютерної томографії (ВР-пККТ) дає змогу in vivo оцінювати об’ємну МЩКТ і характеристики трабекулярного й кортикального шарів кісткової тканини в ділянці дистального відділу променевої та великогомілкової кісток. Показано, що ЦД 1-го типу асоціюється з погіршеними трабекулярними параметрами (зниження об’ємної МЩКТ, зменшена кількість і підвищена гетерогенність трабекул) у променевій кістці, але не у великогомілковій, а також зі збереженими кортикальними характеристиками. Натомість ЦД 2-го типу пов’язаний зі збереженими трабекулярними параметрами та збільшеною товщиною кортикального шару, проте водночас і зі зростанням кортикальної пористості.
Метаболізм кісткової тканини найкраще оцінюється за допомогою біопсії клубової кістки з тетрацикліновими мітками, але через інвазивність цей метод застосовується рідко. Неінвазивно оцінити кістковий метаболізм можна за допомогою сироваткових маркерів кісткового обміну (СМКО). Ці маркери, які відображають формування та резорбцію кістки, знижуються при обох типах діабету, проте дослідження дають неоднозначні результати щодо їхнього зв’язку з рівнем глікованого гемоглобіну, ожирінням і мікросудинними ускладненнями.
Додаткові методи оцінювання кісткової структури при діабеті
Оскільки застосування ДРА в осіб із ЦД має певні обмеження, досліджуються альтернативні методи: показник якості трабекулярної кісткової тканини (ПЯТКК) та розширений аналіз стану стегнової кістки (РАССК).
ПЯТКК є непрямим показником мікроархітектури трабекулярної кісткової тканини поперекового відділу хребта, який визначається шляхом аналізу варіацій рівня сірого кольору на зображенні, отриманому при ДРА. Вважається, що ЦД 1-го типу пов’язаний з нижчим ПЯТКК порівняно з особами без діабету, однак у молодих людей (19-50 років) без діабетичних ускладнень відмінностей за цим показником може й не бути. ЦД 2-го типу також асоціюється зі зниженим ПЯТКК, який прямо корелює з підвищеним ІМТ та збільшеною масою жирової тканини. Це свідчить про те, що саме абдомінальне ожиріння, а не ЦД, може виступати основним чинником зниження якості трабекулярної кістки.
РАССК використовує геометрію та структурні параметри стегнової кістки, отримані за допомогою ДРА, для оцінювання її міцності. Параметри РАССК при ЦД 2-го типу, ймовірно, залежать від ІМТ, а не від самого діабету, хоча вміст ВЖТ обернено асоціюється з деякими показниками міцності скелета.
Калькулятори ризику переломів
Наявні калькулятори ризику переломів неточно оцінюють ризик у пацієнтів із ЦД. Порівняно із загальною популяцією ані показник МЩКТ, ані інструмент оцінювання ризику переломів FRAX не дають повної картини ризику переломів у разі ЦД 2-го типу. Було встановлено, що ризик переломів за FRAX для пацієнтів із ЦД 2-го типу еквівалентний показнику їхніх однолітків без діабету, але з нижчим на 0,4-0,6 T-критерієм.
Корегування вхідних даних FRAX покращує прогнозування переломів у пацієнтів із ЦД 2-го типу, однак усе ще не дає змоги повністю пояснити цей ризик. Застосовуються такі методи корегування: зниження T-критерію на 0,5; збільшення віку на 10 років; включення ревматоїдного артриту як супутнього захворювання замість ЦД 2-го типу або додавання корекції за ПЯТКК. Для ЦД 1-го типу корекцію можна здійснити, обравши у FRAX опцію «вторинний остеопороз». Нещодавно ЦД 2-го типу був доданий як опція в платну бета-версію FRAXplus, але наразі невідомо, чи дає це змогу краще ідентифікувати пацієнтів з підвищеним ризиком переломів.
У дослідженні Fremantle Diabetes Study було визначено п’ять клінічних характеристик, які є значущими предикторами 10-річного ризику перелому стегна: літній вік, жіноча стать, низький ІМТ, периферична сенсорна нейропатія та порушена функція нирок. Для оцінювання ризику переломів в інших ділянках скелета, а також у разі ЦД 1-го типу потрібні подальші дослідження.
Доцільним є рутинний рентгенологічний скринінг грудного та поперекового відділів хребта, особливо для пацієнтів з високим ризиком виникнення переломів (як пов’язаним із ЦД, так і за загальними клінічними чинниками ризику).
Оптимізація контролю стану кісток у разі ЦД 2-го типу
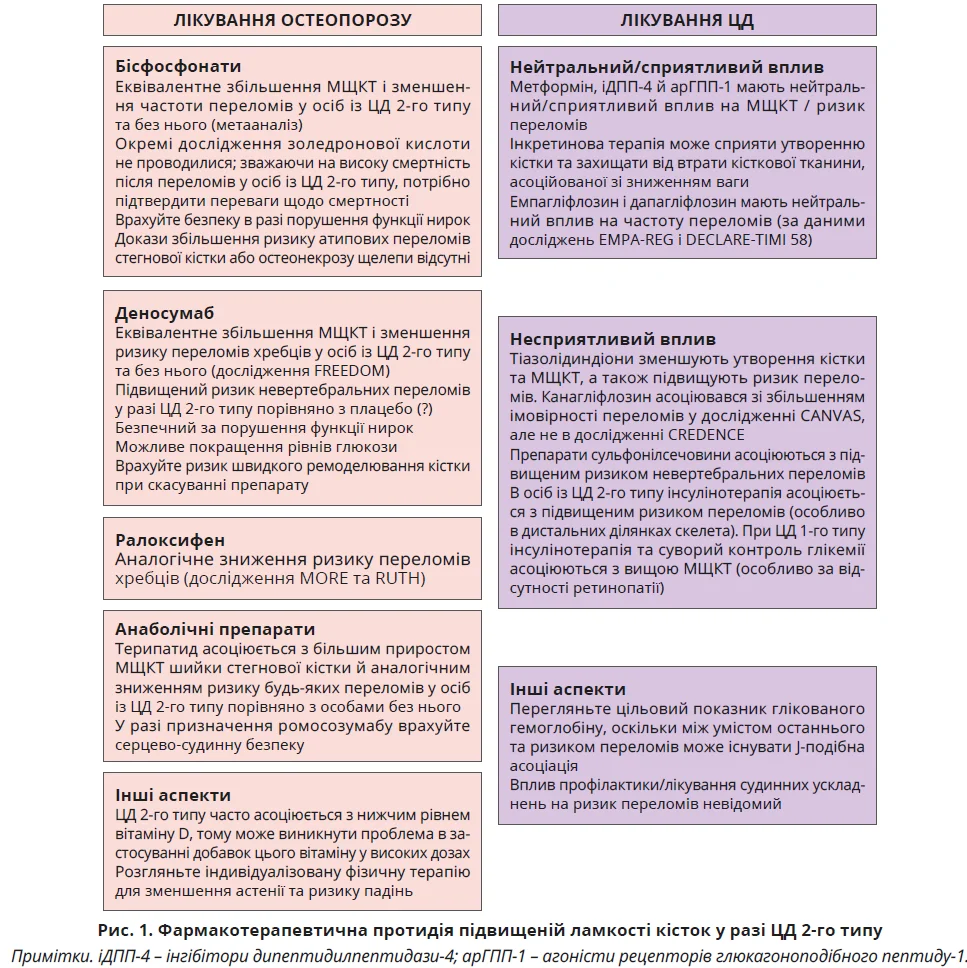
Унікальний скелетний фенотип у разі ЦД викликає питання щодо оптимального підходу до лікування діабетичної остеопатії (рис. 1). Дотепер не було проведено проспективних рандомізованих контрольованих досліджень (РКД), які оцінювали б ефективність і безпеку лікування остеопорозу в пацієнтів з діабетом, а post hoc-аналізи даних клінічних досліджень обмежуються ЦД 2-го типу через малу кількість учасників із ЦД 1-го типу.
У плацебо-контрольованому дослідженні Fracture Intervention Trial лікування алендронатом забезпечувало подібне підвищення МЩКТ у пацієнтів із ЦД 2-го типу та без нього, а в когортному дослідженні за базою даних рецептів – аналогічне зниження ризику переломів. Три дослідження ризедронату також показали однакове зниження СМКО та покращення МЩКТ у пацієнтів із ЦД 2-го типу та без нього. У метааналізі 15 РКД з використанням антирезорбтивних препаратів бісфосфонати продемонстрували ефективність у підвищенні МЩКТ і зниженні ризику переломів. Важливим аспектом є потенційна користь золедронової кислоти для зниження смертності після перелому шийки стегнової кістки. В осіб із ЦД 2-го типу бісфосфонати слід застосовувати обережно, оскільки ці препарати протипоказані при порушенні функції нирок.
У РКД MORE та RUTH ралоксифен продемонстрував аналогічне зниження ризику переломів у жінок із ЦД 2-го типу та без нього. У дослідженні FREEDOM, присвяченому деносумабу, приріст МЩКТ і зниження ризику переломів хребців у пацієнтів із ЦД 2-го типу та без нього були подібними, проте ризик невертебральних переломів у разі лікування деносумабом у пацієнтів із ЦД 2-го типу виявився підвищеним порівняно з плацебо. Ця тенденція спостерігалася лише протягом перших 3 років дослідження й могла бути пов’язана з нижчою, ніж очікувалося, частотою переломів у групі плацебо серед учасників із ЦД. Важливо, що деносумаб є безпечним для пацієнтів з порушенням функції нирок і може мати додаткові переваги при ЦД 2-го типу завдяки покращенню глікемічних показників.
Оскільки ЦД 2-го типу характеризується повільним кістковим ремоделюванням, перевагу можуть мати анаболічні препарати. В обсерваційному дослідженні DANCE терипаратид сприяв значнішому підвищенню МЩКТ у ділянці шийки стегнової кістки, аналогічному підвищенню МЩКТ хребта та всієї стегнової кістки, а також подібному зниженню ризику невертебральних переломів у пацієнтів із ЦД 2-го типу порівняно з особами без нього.
У подальших обсерваційних дослідженнях застосування терипаратиду було пов’язане з вираженішим зниженням частоти всіх переломів у пацієнтів із ЦД 2-го типу порівняно з особами без діабету.
У дослідженні ACTIVE у пацієнтів із ЦД 2-го типу спостерігалося аналогічне покращення МЩКТ і ПЯТКК при застосуванні абалопаратиду. Доклінічні дослідження свідчать, що терапія терипаратидом, абалопаратидом і ромосозумабом сприяє посиленню утворення кістки, зменшенню кортикальної пористості та покращенню механічних властивостей кісткової тканини в моделі мишей з діабетом. Водночас призначення ромосозумабу пацієнтам із ЦД 2-го типу потребує обережності через підвищений ризик серцево-судинних ускладнень.
Вплив протидіабетичних препаратів на стан кісткової тканини
Існує потреба й у встановленні впливу протидіабетичних препаратів і засобів для лікування ожиріння на кісткову тканину (рис. 1). З огляду на істотне зростання використання інгібіторів натрієзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2) й інкретинових препаратів у пацієнтів із ЦД 2-го типу та без нього, варто враховувати можливий безпосередній і опосередкований вплив цих ліків на кісткову тканину.
Що стосується ЦД 1-го типу, то одне дослідження показало, що 7-річна інтенсивна інсулінотерапія сприяла підвищенню МЩКТ і зниженню маркерів кісткової резорбції. У дослідженні на моделі ЦД 1-го типу в мишей безперервна інфузія інсуліну зумовила дозозалежне підвищення маркерів кісткоутворення та зниження маркерів резорбції, а також покращення кортикальних і трабекулярних параметрів стегнової кістки та її механічних властивостей, попри збереження гіперглікемії на рівні, значно вищому за нормоглікемічний.
В осіб із ЦД 2-го типу застосування метформіну, інгібіторів дипептидилпептидази-4 (іДПП-4) й агоністів рецепторів глюкагоноподібного пептиду-1 (арГПП-1) має нейтральний або сприятливий вплив на МЩКТ і ризик переломів. Інкретинові препарати (іДПП-4 й арГПП-1) здатні безпосередньо стимулювати кісткоутворення та гальмувати резорбцію кісткової тканини. Показано, що ліраглутид запобігає втраті кісткової маси та сприяє підвищенню рівнів маркерів кісткоутворення після застосування низькокалорійної дієти в жінок з ожирінням без ЦД. Дослідження інкретинової терапії в пацієнтів із ЦД 2-го типу є особливо важливими з огляду на супутній ефект зниження маси тіла та неглікемічні переваги.
Завдяки серцево-судинним і нефрозахисним ефектам дедалі частіше застосовуються іНЗКТГ-2. Однак у дослідженні CANVAS, присвяченому оцінюванню серцево-судинних наслідків терапії канагліфлозином, було зафіксовано підвищений ризик ампутацій нижніх кінцівок і переломів. Водночас подальше дослідження CREDENCE підвищеного ризику переломів не виявило, як і дослідження емпагліфлозину EMPA-REG і дапагліфлозину DECLARE-TIMI 58. Узагальнений аналіз даних також не виявив впливу терапії будь-яким іНЗКТГ-2 на ризик переломів.
Із підвищеним ризиком переломів пов’язані тіазолідиндіони, препарати сульфонілсечовини (ПСС) та інсулін. Тіазолідиндіони впливають на експресію генів, що призводить до порушення диференціації остеобластів і зниження утворення кісткової тканини. Їх приймання асоціюється зі зменшенням МЩКТ і підвищеним ризиком переломів, особливо в жінок. Своєю чергою, ПСС пов’язані з підвищеним ризиком невертебральних переломів, але не рентгенологічно підтверджених переломів хребців у літніх чоловіків (дослідження MrOS). Імовірно, ці невертебральні переломи були зумовлені падіннями внаслідок гіпоглікемії на тлі інсулінотерапії. Загалом у більшості досліджень терапія інсуліном у разі ЦД 2-го типу асоціюється з підвищеним ризиком переломів. З огляду на анаболічні ефекти інсуліну це може бути пов’язано з тяжким станом пацієнтів, які потребують терапії інсуліном, та/або з падіннями, зумовленими гіпоглікемією.
Висновки
Підвищена крихкість кісток на тлі ЦД є гетерогенною та супроводжується значним навантаженням на систему охорони здоров’я. Аналіз опублікованої літератури виявив істотну нестачу інформації щодо діагностики та ведення пацієнтів з діабетичною хворобою кісток. Загалом метаболічна дисфункція асоціюється з несприятливими наслідками для скелетної системи, тому до оцінки стану кісткової тканини доцільно включати специфічні для діабету параметри (рис. 2). Крім того, існує потреба в проведенні інтервенційних досліджень, що аналізують як кісткові, так і метаболічні аспекти лікування пацієнтів із ЦД.
Література
Sheu A., White C.P., Center J.R. Bone metabolism in diabetes: a clinician’s guide to understanding the bone-glucose interplay. Diabetologia. 2024; 67: 1493-1506. doi: 10.1007/s00125-024-06172-x.