Фітотерапія цукрового діабету 2-го типу: розкриваючи сучасні можливості з позиції доказової медицини
Підготувала канд. мед. наук Тетяна Можина
Фітотерапія має багатовікову історію використання, однак лише останніми роками її ефективність почала отримувати вагому доказову підтримку. Традиційний підхід до використання лікарських рослин, які наші предки підбирали інтуїтивно, тепер підтверджується сучасними фітохімічними та клінічними дослідженнями. Це формує надійну наукову базу, що обґрунтовує доцільність клінічного застосування природних засобів. На сьогодні підтверджено ефективність і безпечність використання лікарських рослин у лікуванні різноманітних захворювань, включаючи цукровий діабет (ЦД) 2-го типу. Багато з них мають вагомі доказові досьє, що включають результати рандомізованих клінічних досліджень (РКД), систематичних оглядів і метааналізів.
ЦД та фітотерапія: дані доказової медицини
Фітотерапія займає особливе місце в лікуванні ЦД 2-го типу, зважаючи на підтверджену ефективність гіпоглікемічних властивостей низки рослин. Зокрема, такі відомі рослини, як імбир і базилік, демонструють значний потенціал у модулюванні рівня глюкози в крові. Також є менш відомі, але не менш ефективні рослини, як-от азадирахта індійська, пікрорхіза куроа, сизигіум ямболан, камедь коміфори та мумійо гімалайське. Кожному з цих фітозасобів притаманні різні механізми зниження рівня цукру в крові. Імбир, наприклад, модулює вивільнення інсуліну, покращує кліренс глюкози в інсуліночутливих периферичних тканинах, стимулює поглинання глюкози інсуліночутливими адипоцитами [22]. Азадирахта індійська, відома як «дерево ХХІ століття», за версією ООН, не тільки знижує рівень глікемії [20] й активність окислювального стресу [12], але й сприяє регенерації підшлункової залози [20] та демонструє нейропротекторну активність [12]. Пікрорхіза куроа зменшує рівень глікемії натще завдяки механізмам, схожим на ті, що використовуються в сучасних протидіабетичних препаратах, демонструючи здатність інгібувати α-глюкозидазу й α-амілазу [16], а також зменшувати ознаки діабетичної нефропатії [17].
У Європі протягом декількох років провідні позиції серед протидіабетичних рослин займають момордика гірка (Momordica charantia L.) та джимнема сильвестра (Gymnema sylvestre): вони впевнено утримують лідерські позиції в списку найефективніших природних гіпоглікемічних засобів, що використовуються в терапії ЦД 2-го типу.
Момордика гірка
Далекий родич огірка та кавуна, M. charantia, фрукт із дуже цікавим виглядом і гірким смаком, протягом останніх років став справжнім хітом у Європі: його застосовують не тільки хворі на ЦД, але й спортсмени й охочі схуднути через його здатність покращувати метаболізм глюкози, регулювати рівень глікемії, уповільнювати старіння клітин і покращувати роботу м’язів. Таке зростання прихильності зумовлено доведеною фізико-хімічною й фармакологічною активністю, клінічною ефективністю та безпекою.
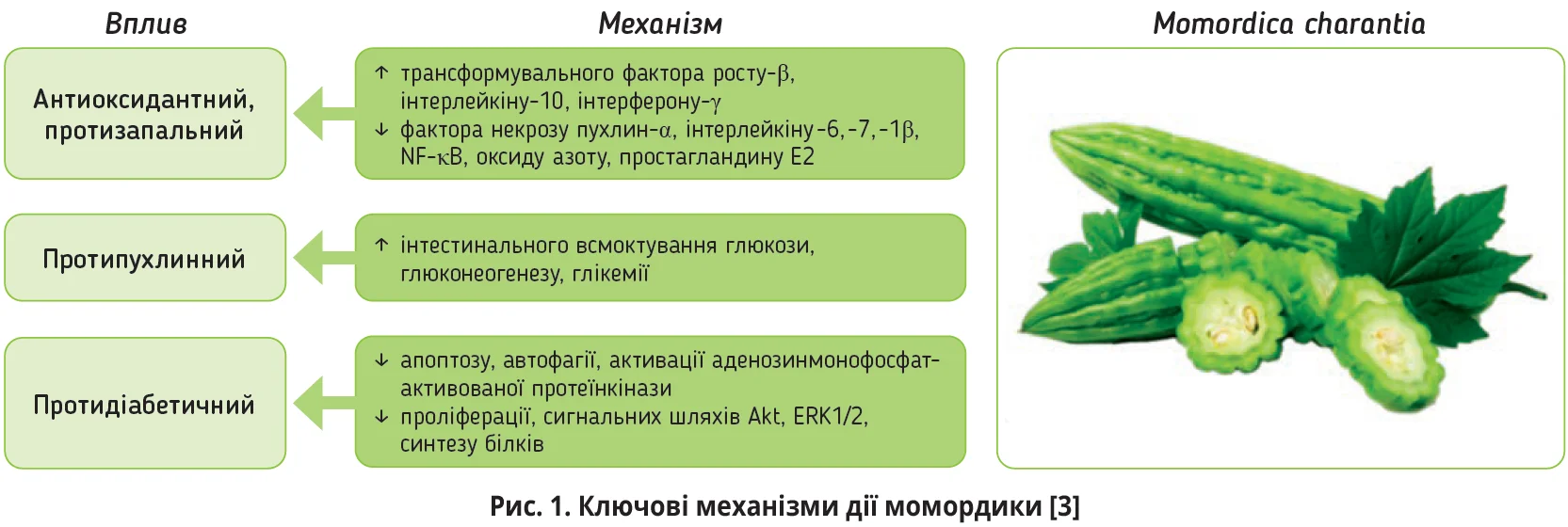
Фітохімічний аналіз листя, плодів M. charantia продемонстрував наявність великої кількості біологічно активних речовин у її складі: білків й амінокислот, фенолів і вітаміну С, вуглеводів, мінералів (кальцій, натрій, залізо, калій, мідь, марганець, цинк, фосфор) і β-каротинів, дубильних речовин й алкалоїдів, декількох жирних кислот (пальмітинова, олеїнова, стеаринова, α-елеостеаринова, γ-ліноленова), тритерпеноїду кукурбітацину [13, 22]. Різноманіття активних речовин є підґрунтям багатогранної фармакологічної активності M. charantia, якій притаманні гіпоглікемічна, антиоксидантна, знеболювальна, протизапальна, імуномодулювальна, антидепресивна, противиразкова, протимікробна, протидіарейна, антигельмінтна, протисудомна, антиангіогенна, протиракова, гепато-, нефро- та кардіопротекторна властивості (рис. 1).
M. charantia має нейропротекторні властивості, які пояснюють здатністю рослини інгібувати транскрипційний фактор NF-κB, ацетилхолінестеразу, індуцибельну синтазу оксиду азоту, циклооксигеназу та запальні цитокіни [3, 11]. Саме тому M. charantia використовують для лікування діабетичної ретинопатії [11], нейродегенеративних захворювань (хвороба Альцгеймера) [3, 21] та розглядають доцільність її призначення при діабетичній нейропатії.
M. charantia довела свою здатність нормалізувати рівень глікемії як у пацієнтів із переддіабетом, так і у хворих на ЦД 2-го типу з легким і помірним перебігом хвороби. В одному плацебо-контрольованому перехресному РКД осіб із переддіабетом (n=52) рандомізували для прийому 2,5 мг екстракту M. charantia на добу протягом 8 тижнів. Призначена терапія сприяла зменшенню рівня глікемії натще на 0,31 ммоль/л (р≤0,01) і мала тенденцію до нормалізування глікозильованого гемоглобіну (HbA1c; р=0,05) порівняно з плацебо [9].
Крім зіставлення гіпоглікемічної дії момордики з плацебо, її здатність нормалізувати вміст цукру в крові порівнювали з різними протидіабетичними препаратами. В одному подвійному сліпому РКД хворих на ЦД (n=95) рандомізували для прийому M. charantia (2 чи 4 г/день) або глібенкламіду (5 мг/день) протягом 10 тижнів [19]. Призначення різних доз M. charantia забезпечувало не лише вірогідне зниження HbA1с (відповідно, р≤0,05 і р≤0,02 порівняно з глібенкламідом), рівня глікемії натще (р≤0,05 і р≤0,04), але й на відміну від глібенкламіду сприяло покращенню деяких відомих чинників ризику серцево-судинних захворювань (уміст атерогенних фракцій ліпідів, коефіцієнт атерогенності, маса тіла, систолічний артеріальний тиск) [19].
Нині накопичено велику доказову базу клінічної ефективності момордики, що зробило можливим проведення систематичних оглядів і метааналізів. В одній з таких робіт, заснованій на даних 9 РКД (n=414), доведено здатність M. charantia не тільки вірогідно знижувати рівень глікемії натще (середня різниця (СР) -0,03; 95% довірчий інтервал (ДІ) від -0,38 до 0,31) та HbA1c (СР -0,12%; 95% ДІ від -0,35 до 0,11), а й зменшувати вміст ліпопротеїнів високої та низької щільності (ЛПНЩ), загального холестерину (ЗХС) [10]. Крім цього, 4-16-тижневий прийом момордики сприяв достовірному зменшенню маси тіла й індексу маси тіла, а також систолічного та діастолічного артеріального тиску [10]. Висока гіпоглікемічна та гіполіпідемічна активність M. charantia поєднується з добрим профілем безпеки: автори метааналізу підкреслили, що прийом фітозасобу не супроводжувався вірогідною зміною АЛТ, АСТ, креатиніну порівняно з плацебо [10].
Інший метааналіз 8 РКД, у якому взяли участь хворі на ЦД (n=423), навів подібні дані: M. charantia забезпечує вірогідне зниження рівня глікемії натще (р=0,005), постпрандіальної глікемії (р=0,0001), HbA1c (р=0,0001), ЗХС [24].
Згідно з даними метааналізу 10 досліджень (n=1045) призначення M. charantia хворим на ЦД супроводжується зниженням середнього рівня глікемії натще на 0,72 ммоль/л, постпрандіальної глікемії – на 1,43 ммоль/л, HbA1c – на 0,26% [18]. Особи з переддіабетом, які приймали момордику, змогли знизити рівень глікемії натще в середньому на 0,31 ммоль/л [18]. Отримавши такі разючі результати, науковці припустили, що «M. charantia може бути потенційною альтернативою для хворих на ЦД 2-го типу, особливо для пацієнтів з підвищеним рівнем ЗХС» [24].
Джимнема сильвестра
 Не можна не згадати про ще одну лікарську рослину, дослівна назва якої означає «вбивця солодкого» – джимнема сильвестра (G. sylvestre).
Не можна не згадати про ще одну лікарську рослину, дослівна назва якої означає «вбивця солодкого» – джимнема сильвестра (G. sylvestre).
Ця вічнозелена сильно гілляста деревна ліана споконвічно використовувалася індійцями для лікування «медової сечі», тобто ЦД. Фотохімічний аналіз різних частин джимнеми підтверджує наявність у її складі сапонінів, холіну, флавоноїдів, бетаїну, антрахіону, гурмарину та джимнемової кислоти, які забезпечують інгібування надходження глюкози з кишківника в кров, блокують рецептори солодкого, розташовані на язику, та знижують смакові відчуття [15]. Глікозиди (гімнемозиди, джимнемова кислота) позитивно впливають на вуглеводний обмін, знижують рівень глікемії, збільшують секрецію інсуліну β-клітинами підшлункової залози, уповільнюють усмоктування глюкози та жирних кислот у кишківнику.
Гіпоглікемічну дію G. sylvestre пояснюють потужним інгібуванням α-глюкозидази й α-амілази, що призводить до вповільнення всмоктування складних вуглеводів у тонкому відділі кишківника та призупинення розщеплення складних вуглеводів (крохмалю) до ди- та трисахаридів і, власне, глюкози [15]. Завдяки таким особливостям джимнема сприяє вивільненню інсуліну, зниженню рівня постпрандіальної глікемії, підтримує вміст інсуліну в β-клітинах, стимулюючи супутнє збільшення транскрипції генів інсуліну та підтримуючи масу β-клітин, захищаючи їх від апоптозу [4].
Джимнемагенін, основна біологічно активна сполука джимнеми, покращує метаболізм ліпідів шляхом збільшення гідролізу тригліцеридів (ліполізу) завдяки посиленню експресії генів ліпаз Lipe та Lpl, регуляції ключового гена адипогенезу Pparg і збільшенню експресії протизапального адипокіну; зазначені особливості дії науковці розцінюють як упевнені докази протидіабетичної та масонормалізувальної дії джимнеми [5]. Експериментальні дослідження свідчать, що введення екстракту джимнеми лабораторним тваринам сприяє достовірному (p<0,05) підвищенню секреції інсуліну, причому гіпоглікемічний ефект джимнеми визнано зіставним з таким метформіну [7].
У нещодавно опублікованому РКД доведено, що G. sylvestre знижує рівні ЗХС (p=0,03), ЛПНЩ (p=0,04), тригліцеридів (р=0,03), масу тіла (p=0,03) порівняно з плацебо; на підставі отриманих даних автори РКД вважають, що застосування джимнеми може бути допоміжною та безпечною стратегією контролю ліпідного профілю у хворих на ЦД 2-го типу [14].
Ефективність джимнеми підтверджено на найвищому рівні доказової медицини. Систематичний огляд 6 досліджень доводить, що прийом джимнеми забезпечує вірогідне зниження рівнів глікемії натще (p<0,001), тригліцеридів (p<0,001), ЗХС (p<0,001), ЛПНЩ (p<0,001), а також діастолічного артеріального тиску (p=0,003) [23].
Нещодавно опублікований метааналіз 23 статей, у яких в умовах in vivo й in vitro досліджували протидіабетичні властивості момордики та джимнеми, навів переконливі дані, що застосування цих лікарських рослин забезпечує зниження рівня глікемії натще, зменшення резистентності до інсуліну [8]. У цьому метааналізі також проведено порівняння гіпоглікемічного ефекту джимнеми та глібенкламіду, яке довело перевагу рослинного екстракту над похідним сульфонілсечовини [8].
Метааналіз 10 досліджень (n=419) довів здатність G. sylvestre істотно знижувати рівні глікемії натще (p<0,0001) та після прийому їжі (p<0,0001), HbA1c (p<0,0001) порівняно з вихідними значеннями. Підкреслено гіпохолестеринемічну активність G. sylvestre: прийом цієї рослини значно знижує рівні тригліцеридів (p<0,0001) і ЗХС (p<0,0001) порівняно з вихідними значеннями [6].
Глібофіт – сучасний фітозасіб для нормалізації глікемії
На українському ринку представлено фітозасіб Глібофіт (компанія «Ананта Медікеар Лтд.», Велика Британія), що містить стандартизовані дози рослинних екстрактів і природні речовини: екстракт листя джимнеми звичайної (G. sylvestre) – 100 мг, екстракт плодів момордики (M. charantia) – 100 мг, екстракт листя азадирахти індійської (Azadirachta indica) – 80 мг, камедь коміфори (Commiphora mukul) – 50 мг, екстракт насіння сизигіуму ямболану (Syzygium cumini) – 50 мг, мумійо гімалайське (Asphaltum) – 40 мг, кореневище імбиру (Zingiber officinale) – 40 мг, насіння гуньби сінної (Trigonella foenum-graecum) – 35 мг, екстракт кореневища пікрорхізи куроа (Picrorhiza kurroa) – 30 мг, екстракт листя базиліку (Ocimum sanctum) – 15 мг [2]. Окрім багатокомпонентного складу, Глібофіт має ще декілька важливих характеристик: уміст екстрактів момордики та джимнеми з потужними гіпоглікемічними властивостями є оптимальним для реалізації протидіабетичної активності – по 100 мг кожної [2]; така концентрація момордики та джимнеми значно перевищує вміст цих екстрактів у подібних фітокомплексах. Нині Глібофіт є єдиним комбінованим фітозасобом на фармацевтичному ринку України з клінічно обґрунтованим умістом момордики (100 мг) і джимнеми (100 мг), що виграшно виділяє його серед інших фітозасобів для лікування ЦД. Такий уміст момордики та джим-неми є запорукою розвитку гіпоглікемічного й гіполіпідемічного ефектів, притаманних цим лікарським рослинам і доведеним за допомогою найкращих інструментів доказової медицини – систематичних оглядів і метааналізів.
Іншою вагомою відмінною рисою Глібофіту є різноманітність механізмів гіпоглікемічної дії його компонентів. Метформіноподібну дію демонструють джимнема, момордика, азадирахта й сизигіум: знижуючи синтез глюкози в печінці та її абсорбцію в кишківнику, вони покращують утилізацію глюкози периферичними тканинами, зменшують інсулінорезистентність [2]. Ключові компоненти Глібофіту – момордика, джимнема, а також сизигіум, коміфора, базилік і пікрорхіза – подібно до препаратів сульфонілсечовини стимулюють вивільнення інсуліну β-клітинами підшлункової залози [2].
Здатність момордики покращувати толерантність до глюкози розцінюють як прояв цукрознижувальної дії, подібної до такої інгібіторів дипептилпептидази-4 [2].
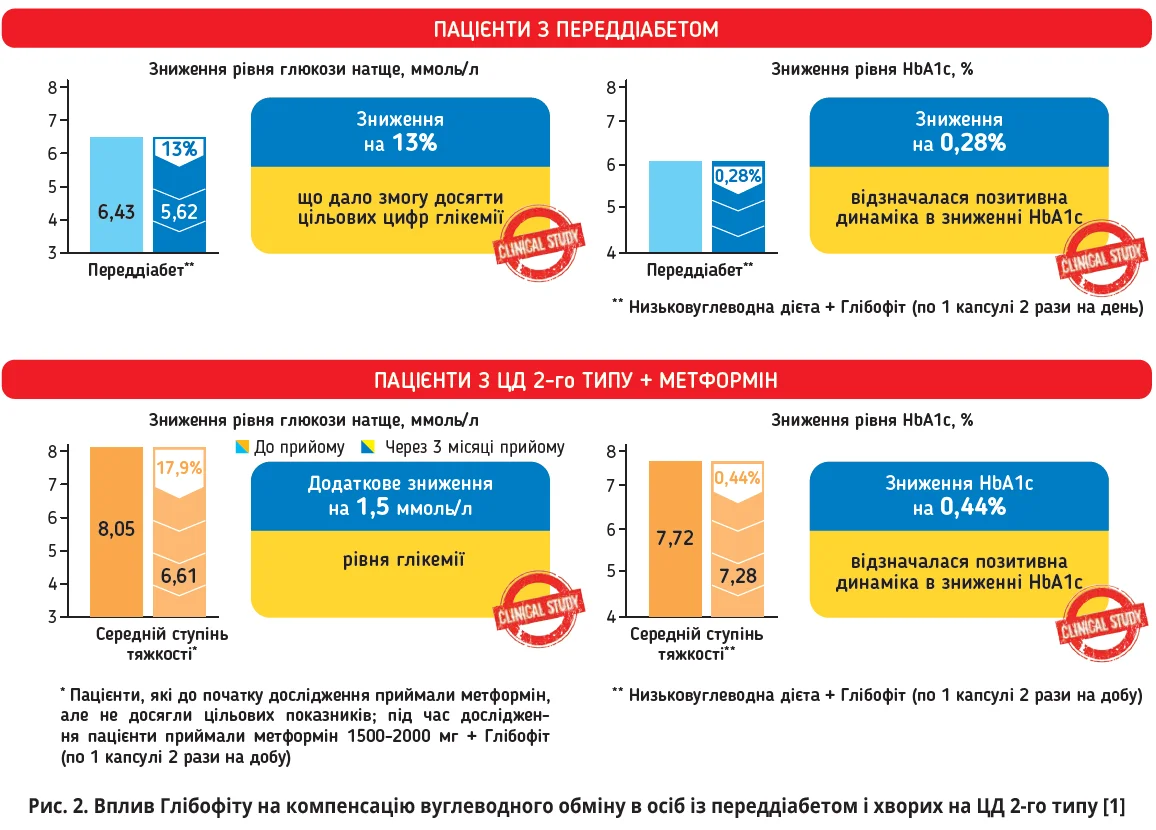
Ефективність Глібофіту підтверджено клінічними випробуваннями. У роботі, виконаній під керівництвом І.А. Бондарець, узяли участь хворі на ЦД 2-го типу (n=50), які приймали метформін (1500-2000 мг/добу), й особи з переддіабетом (n=20) [1]. Хворих розподілили на групи залежно від ступеня компенсації ЦД: середньої тяжкості (1-ша група; n=40), легкого ступеня (2-га група; n=10), особи з переддіабетом (3-тя група; n=20); усі пацієнти приймали Глібофіт по 1 капсулі 2 р/добу протягом 3 місяців. Комбінована терапія метформіном і Глібофітом забезпечила вірогідне зниження рівня глікемії натще у хворих 1-ї, 2-ї та 3-ї груп, відповідно, на 17,9; 25,6 та 13,3%, HbA1c – на 0,44; 0,54 та 0,28% (рис. 2), а також сприяла нормалізуванню рівня ЗХС [1].
Зважаючи на доведені дані щодо особливостей протидіабетичної дії його рослинних компонентів, можна припустити, що Глібофіт підсилював гіпоглікемічний вплив метформіну завдяки стимулюванню вивільнення інсуліну β-клітинами та пригнічення активності α-амілази, що не супроводжувалося виникненням додаткових побічних ефектів і давало змогу подовжити застосування метформіну в меншому дозуванні [1].
Тримісячний прийом Глібофіту сприяв зниженню рівня ЗХС у пацієнтів із переддіабетом і ЦД 2-го типу середнього ступеня тяжкості, а також виявив позитивну динаміку зазначеного показника в осіб із ЦД 2-го типу легкого ступеня, що підтверджує його ефективність у корекції показників ліпідного обміну [1].
Слід зауважити, що різноманітний спектр дії складових Глібофіту й наявність антиоксидантної, протизапальної, нейро- та нефропротекторної властивостей значно розширюють діапазон його застосування. Можна припустити, що Глібофіт доцільно застосовувати для профілактики й, імовірно, в схемах комплексного лікування діабетичної нейро-, ретино- та нефропатії [3, 11, 21].
Глібофіт рекомендовано для нормалізації вуглеводного й ліпідного обміну в осіб із переддіабетом і хворих на ЦД 2-го типу [2]; мінімальний курс лікування Глібофітом становить 90 днів, по 1 капсулі 2 р/добу. Доцільною також є комбінація Глібофіту з пероральними цукрознижувальними засобами (метформін), що сприяє досягненню цільових значень глікемії [1].
Висновки
Сучасна фітотерапія ґрунтується на засадах доказової медицини. Лікарські рослинні екстракти широко використовуються для профілактики та лікування різноманітних захворювань, у тому числі ЦД 2-го типу. Момордика, джимнема, азадирахта, базилік, пікрорхіза, імбир переконливо довели свою здатність нормалізувати вуглеводний обмін завдяки різноманітним механізмам дії. Перелічені рослинні компоненти з доведеною гіпоглікемічною дією входять до складу фітокомплексу Глібофіт, доступного на українському фармацевтичному ринку вже протягом 8 років. Клінічні дослідження довели здатність Глібофіту ефективно знижувати рівні глікемії натще, HbA1c, ЗХС у пацієнтів із переддіабетом і ЦД 2-го типу.
Доцільним є подальше дослідження терапевтичних властивостей Глібофіту, особливо його ретино-, нефро- та нейропротекторних властивостей на тлі супутнього ЦД.
Література
- Бондарець І.А. Застосування рослинного комплексу Глібофіт для корекції показників вуглеводного та ліпідного обміну в пацієнтів з предіабетом і цукровим діабетом 2-го типу. Ліки України. 2017; 9-10: 1-7.
- Глібофіт. Інструкція для застосування [Електронний ресурс]. – Режим доступу: https://anantamedicare.com.ua/ua/produkti/zasobi–prirodnogo–pohodzhennya/glibofit3.
- Adarmanabadi S.M.H.H., Abadi O.J.K., Amiri A., et al. Pharmacotherapeutic potential of bitter gourd (Momordica charantia) in age-related neurological diseases. J. Integr. Neurosci. 2024; 23 (4): 86. doi: 10.31083/j.jin2304086.
- Al-Romaiyan A., Persaud S.J., Jones P.M. Identification of potential plant-derived pancreatic beta-cell-directed agents using new custom-designed screening method: Gymnema sylvestre as an example. Molecules. 2023; 29 (1): 194. doi: 10.3390/molecules29010194.
- DasNandy A., Patil V.S., Hegde H., et al. Elucidating type 2 diabetes mellitus risk factor by promoting lipid metabolism with gymnemagenin: an in vitro and in silico approach. Front. Pharmacol. 2022; 13: 1074342. doi: 10.3389/fphar.2022.1074342.
- Devangan S., Varghese B., Johny E., et al. The effect of Gymnema sylvestre supplementation on glycemic control in type 2 diabetes patients: a systematic review and meta-analysis. Phytother. Res. 2021; 35 (12): 6802-6812. doi: 10.1002/ptr.7265.
- Kashif M., Nasir A., Gulzaman, et al. Unlocking the anti-diabetic potential of Gymnema sylvestre, Trigonella foenum-graecum, and their combination thereof: an in-vivo evaluation. Food Sci. Nutr. 2023; 11 (12): 7664-7672. doi: 10.1002/fsn3.3685.
- Krawczyk M., Burzynska-Pedziwiatr I., Wozniak L.A., et al. Evidence from a systematic review and meta-analysis pointing to the antidiabetic effect of polyphenol-rich plant extracts from Gymnema montanum, Momordica charantia and Moringa oleifera. Curr. Issues Mol. Biol. 2022; 44 (2): 699-717. doi: 10.3390/cimb44020049.
- Krawinkel M.B., Ludwig C., Swai M.E., et al. Bitter gourd reduces elevated fasting plasma glucose levels in an intervention study among prediabetics in Tanzania. J. Ethnopharmacol. 2018; 216: 1-7. doi: 10.1016/j.jep.2018.01.016.
- Laczkó-Zöld E., Csupor-Löffler B., Kolcsár E.B., et al. The metabolic effect of Momordica charantia cannot be determined based on the available clinical evidence: a systematic review and meta-analysis of randomized clinical trials. Front. Nutr. 2024; 10: 1200801. doi: 10.3389/fnut.2023.1200801.
- Liu J., Liu Y., Sun J., et al. Protective effects and mechanisms of Momordica charantia polysaccharide on early-stage diabetic retinopathy in type 1 diabetes. Biomed. Pharmacother. 2023; 168: 115726. doi: 10.1016/j.biopha.2023.115726.
- Mirahmad M., Mohseni S., Tabatabaei-Malazy O., et al. Antioxidative hypoglycemic herbal medicines with in vivo and in vitro activity against C-reactive protein; a systematic review. Phytomedicine. 2023; 109: 154615. doi: 10.1016/j.phymed.2022.154615.
- Mohammed F.S., Babu D., Irfan Z., et al. A review on the traditional uses, nutritive importance, pharmacognostic features, phytochemicals, and pharmacology of Momordica cymbalaria Hook F. Peer J. 2024; 12: e16928. doi: 10.7717/peerj.16928.
- Nani A., Bertuzzi F., Meneghini E., et al. Combined inositols, α-lactalbumin, Gymnema sylvestre and zinc improve the lipid metabolic profile of patients with type 2 diabetes mellitus: a randomized clinical trial. J. Clin. Med. 2023; 12 (24): 7650. doi: 10.3390/jcm12247650.
- Nganso Ditchou Y.O., Leutcha P.B., Miaffo D., et al. In vitro and in silico assessment of antidiabetic and antioxidant potencies of secondary metabolites from Gymnema sylvestre. Biomed. Pharmacother. 2024; 177: 117043. doi: 10.1016/j.biopha.2024.117043.
- Nisar J., Shah S.M.A., Akram M., et al. Phytochemical screening, antioxidant, and inhibition activity of Picrorhiza kurroa against α-amylase and α-glucosidase. Dose Response. 2022; 20 (2): 15593258221095960. doi: 10.1177/15593258221095960.
- Pal S., Yellurkar M.L., Das P., et al. A network pharmacology, molecular docking and in vitro investigation of Picrorhiza kurroa extract for the treatment of diabetic nephropathy. J. Biomol. Struct. Dyn. 2024; 1-12. doi: 10.1080/07391102.2024.2314259.
- Peter E.L., Kasali F.M., Deyno S., et al. Momordica charantia L. lowers elevated glycaemia in type 2 diabetes mellitus patients: systematic review and meta-analysis. J. Ethnopharmacol. 2019; 231: 311-324. doi: 10.1016/j.jep.2018.10.033.
- Rahman I.U., Khan R.U., Rahman K.U., et al. Lower hypoglycemic but higher antiatherogenic effects of bitter melon than glibenclamide in type 2 diabetic patients. Nutr. J. 2015; 14: 13. doi: 10.1186/1475-2891-14-13.
- Rehman G., Umar M., Shah N., et al. Green synthesis and characterization of silver nanoparticles using Azadirachta indica seeds extract: in vitro and in vivo evaluation of anti-diabetic activity. Pharmaceuticals (Basel). 2023; 16 (12): 1677. doi: 10.3390/ph16121677.
- Richter E., Geetha T., Burnett D., et al. The effects of Momordica charantia on type 2 diabetes mellitus and Alzheimer’s disease. Int. J. Mol. Sci. 2023; 24 (5): 4643. doi: 10.3390/ijms24054643.
- Yedjou C.G., Grigsby J., Mbemi A., et al. The management of diabetes mellitus using medicinal plants and vitamins. Int. J. Mol. Sci. 2023; 24 (10): 9085.doi: 10.3390/ijms24109085.
- Zamani M., Ashtary-Larky D., Nosratabadi S., et al. The effects of Gymnema sylvestre supplementation on lipid profile, glycemic control, blood pressure, and anthropometric indices in adults: a systematic review and meta-analysis. Phytother. Res. 2023; 37 (3): 949-964. doi: 10.1002/ptr.7585.
- Zhang X., Zhao Y., Song Y., Miao M. Effects of Momordica charantia L. supplementation on glycemic control and lipid profile in type 2 diabetes mellitus patients: a systematic review and meta-analysis of randomized controlled trials. Heliyon. 2024; 10 (10): e31126. doi: 10.1016/j.heliyon.2024.e31126.