Стеатотична хвороба печінки, метаболічні ризики та сучасні терапевтичні можливості їх корекції
Автор: Олена Михайлівна БАКА, завідувачка гастроентерологічного відділення Центру інноваційних медичних технологій (м. Київ)
 Метаболічну дисфункцію розглядають як надзвичайно важливий чинник ризику розвитку та прогресування захворювань печінки. Саме метаболічна дисфункція вважається наріжним каменем стеатотичної хвороби печінки (СХП), СХП, асоційованої з метаболічною дисфункцією (СХПМД), СХПМД з уживанням високих доз алкоголю (МетАХП). Сучасні погляди на лікування СХП, СХПМД потребують пошуку нових рішень в організації лікування пацієнтів, у тому числі застосуванні комплексного підходу з обов’язковою корекцією метаболічних ризиків. Корекція одного із зовнішніх чинників ризику СХПМД – дефіциту адеметіоніну – за допомогою препарату Гептрал® є ефективним способом покращення стану пацієнтів із внутрішньопечінковим холестазом (ВПХ), поліпшення біохімічних показників і стану печінки за даними ультразвукового дослідження.
Метаболічну дисфункцію розглядають як надзвичайно важливий чинник ризику розвитку та прогресування захворювань печінки. Саме метаболічна дисфункція вважається наріжним каменем стеатотичної хвороби печінки (СХП), СХП, асоційованої з метаболічною дисфункцією (СХПМД), СХПМД з уживанням високих доз алкоголю (МетАХП). Сучасні погляди на лікування СХП, СХПМД потребують пошуку нових рішень в організації лікування пацієнтів, у тому числі застосуванні комплексного підходу з обов’язковою корекцією метаболічних ризиків. Корекція одного із зовнішніх чинників ризику СХПМД – дефіциту адеметіоніну – за допомогою препарату Гептрал® є ефективним способом покращення стану пацієнтів із внутрішньопечінковим холестазом (ВПХ), поліпшення біохімічних показників і стану печінки за даними ультразвукового дослідження.
Вступ, або Еволюція розвитку
Цьогоріч лікарі-гастроентерологи всього світу стали свідками значної події – перегляду ставлення до однієї з поширених гастроентерологічних патологій, що суттєво вплинуло на розуміння етіології, патофізіології не тільки цього захворювання, а й декількох інших нозологій. Ідеться про жирову хворобу печінки, яка послідовно змінила декілька назв, пройшовши шлях від жирової дегенерації печінки, жирової хвороби печінки, неалкогольної жирової хвороби печінки (НАЖХП) до метаболічно-асоційованої жирової хвороби печінки (МАЖХП). Саме цю дефініцію та діагностичні критерії було запропоновано групою світових експертів у 2020 р. (рис. 1) [4].
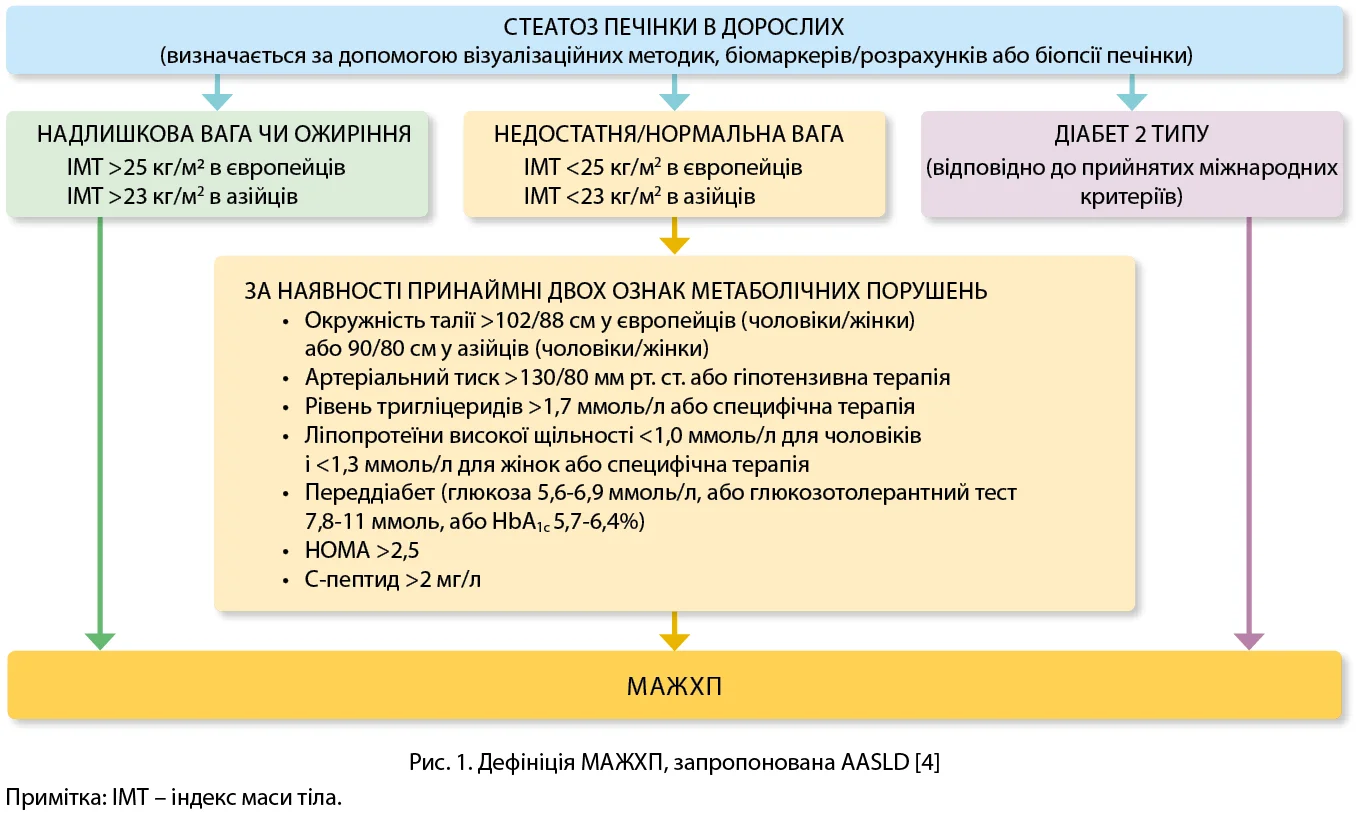
На цьому еволюція дефініції МАЖХП не завершилась. На Міжнародному конгресі EASL 2023 у Відні (Австрія) провідними представниками міжнародних гепатологічних асоціацій: європейської (European Association for the Study of the Liver, EASL), латиноамериканської (Asociación Latinoamericana para el Estudio del Hígado, ALEH), американської (American Association for the study of Liver Diseases, AASLD) була представлена нова номенклатура.
НАЖХП: масштабні зміни
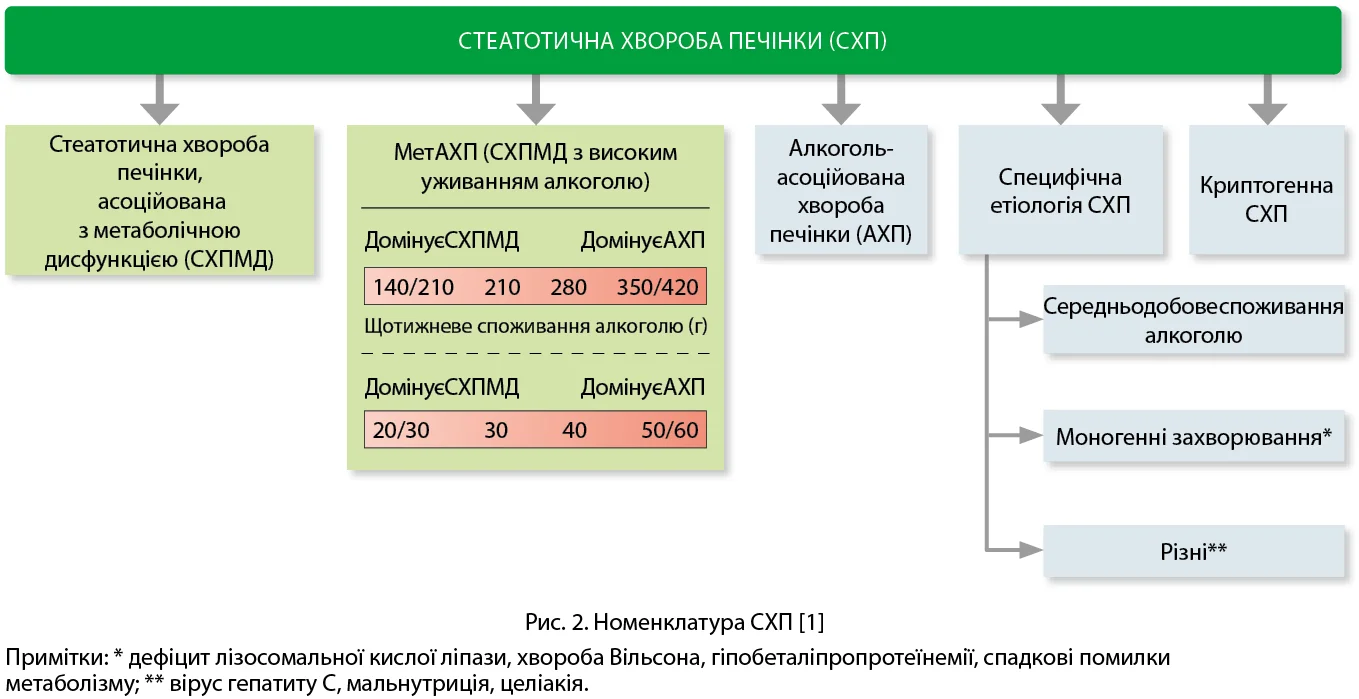
Зміни, одностайно запропоновані AASLD, EASL, ALEH, стали ще вагомішими; вони були презентовані всьому світові на сайтах, у журналах і додаткових публікаціях перелічених організацій [1, 7]. Зміни торкнулися декількох позицій. По-перше, тепер ця патологія називається СХП і має зовсім іншу структуру (рис. 2). До складу СХП входять захворювання печінки, при яких стеатоз асоційований з метаболічними порушеннями, вживанням алкоголю або з іншими захворюваннями.
Отже, структура СХП представлена СХПМД, МетАХП, алкоголь-асоційованою хворобою печінки (АХП), СХП зі специфічною етіологією, криптогенною СХП. Під уживанням високих доз алкоголю розуміють щотижневе вживання жінками 140-350 г алкогольних напоїв, чоловіками – 210-420 г (середньодобове вживання – 20-50 г для жінок, 30-60 г для чоловіків).
По-друге, зазнали певних змін критерії, що використовуються для встановлення кардіометаболічної дисфункції (табл.).
Представники провідних міжнародних гепатологічних товариств пропонують у разі виявлення ознак стеатозу печінки під час інструментального/гістологічного дослідження застосовувати алгоритм дій, наведений на рисунку 3.
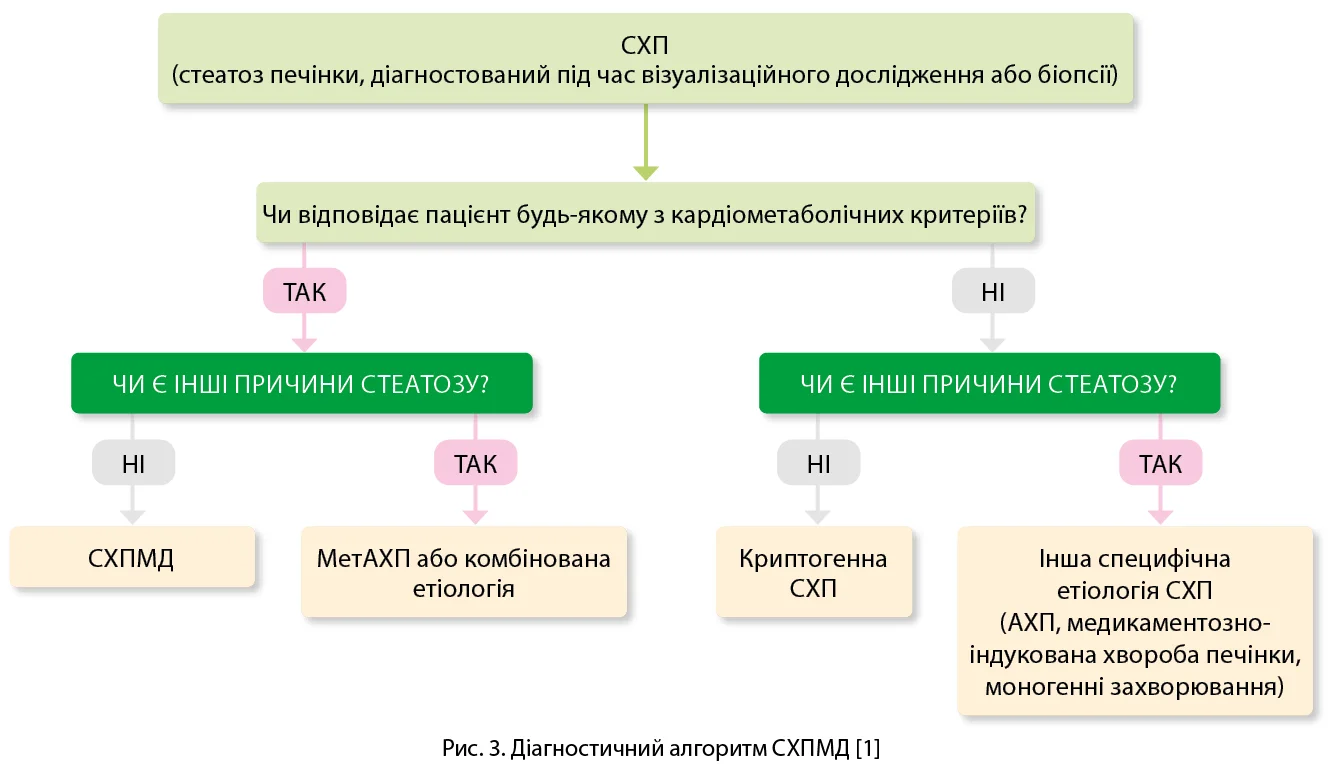
За наявності кардіометаболічних критеріїв (табл.) варто припустити СХПМД, якщо відсутні інші причини стеатозу печінки. Якщо виявлено додатковий етіологічний чинник, варто призначити комбіновану терапію. У разі вживання великої кількості алкоголю діагноз варто змінити на МетАХП. За відсутності кардіометаболічних чинників потрібно виключити інші захворювання, перебіг яких може супроводжуватися розвитком стеатозу печінки (інфікування вірусом гепатиту С, мальнутриція, целіакія); якщо інші причини неідентифіковані, встановлюється діагноз криптогенної СХП. У деяких клінічних випадках причиною стеатозу насправді може бути СХПМД, але для підтвердження цього діагнозу можуть знадобитися періодичні повторні обстеження та персоніфікований підхід до кожного пацієнта. Підкреслюється, що в центрі СХПМД – метаболічна дисфункція, котра також відзначається при різноманітних захворюваннях: ожирінні, ЦД 2 типу, артеріальній гіпертензії, гіпертригліцеридемії, метаболічному синдромі.

СХПМД: незмінні уявлення
Незважаючи на оновлення дефініції та внесення суттєвих змін у номенклатуру СХП, уявлення щодо природного перебігу СХПМД та прогресування захворювання залишаються незмінними: патологічний процес, який стартував зі стеатозу, прогресує в неалкогольний стеатогепатит (НАСГ), потім трансформується в цироз печінки та гепатоцелюлярну карциному (ГЦК). Отже, НАСГ являє собою прогресивне метаболічне захворювання, що чинить системний вплив на весь організм. Причинами багатосистемних змін є інсулінорезистентність (ІР), системне запалення та фібротичні зміни, які спричиняють виникнення патологічних змін у судинах, серці, підшлунковій залозі, нирках із розвитком, відповідно, артеріальної гіпертензії, серцево-судинних захворювань (ССЗ), серцевої недостатності, ЦД, неалкогольної жирової хвороби підшлункової залози, хронічної хвороби нирок. Такі різноманітні супутні захворювання спричиняють 32% смертей у загальній популяції [9], зумовлюючи зростання кардіоваскулярного ризику в популяції осіб, хворих на СХПМД [8].
Доведено, що між виникненням супутніх захворювань і СХПМД існує своєрідне хибне коло: СХПМД створює умови для розвитку супутньої патології, як-от ЦД 2 типу, а ЦД, своєю чергою, спричиняє виникнення СХПМД [3]. Відомо, що перебіг СХПМД асоційований із посиленням ІР, прогресування котрої ускладнює підтримання контролю над умістом глікемії / перебігом ЦД, зумовлює посилення атерогенної дисліпідемії, погіршення перебігу ССЗ, що в підсумку призводить до зростання ймовірності виникнення ЦД 2 типу у 2-6 разів. Наявний ЦД 2 типу підвищує ризик розвитку СХПМД у 2,2 раза та прогресування захворювання в НАСГ, цироз і ГЦК [3].
СХПМД: від патогенезу до лікування
Провідні дослідження підкреслюють багатофакторність, складність патофізіології СХПМД та дають зрозуміти, що її патогенез остаточно не вивчений. Виявлено кілька варіантів генів, які визначають генетичну схильність до СХПМД; серед інших чинників виділяють ліпотоксичність, ІР у скелетних м’язах / жировій тканині, патологічні зміни мікробіоти кишківника, які разом змінюють печінковий метаболізм ліпідів, спричиняючи виникнення та прогресивне накопичення жирів, ініціювання запального процесу в печінці (рис. 4).
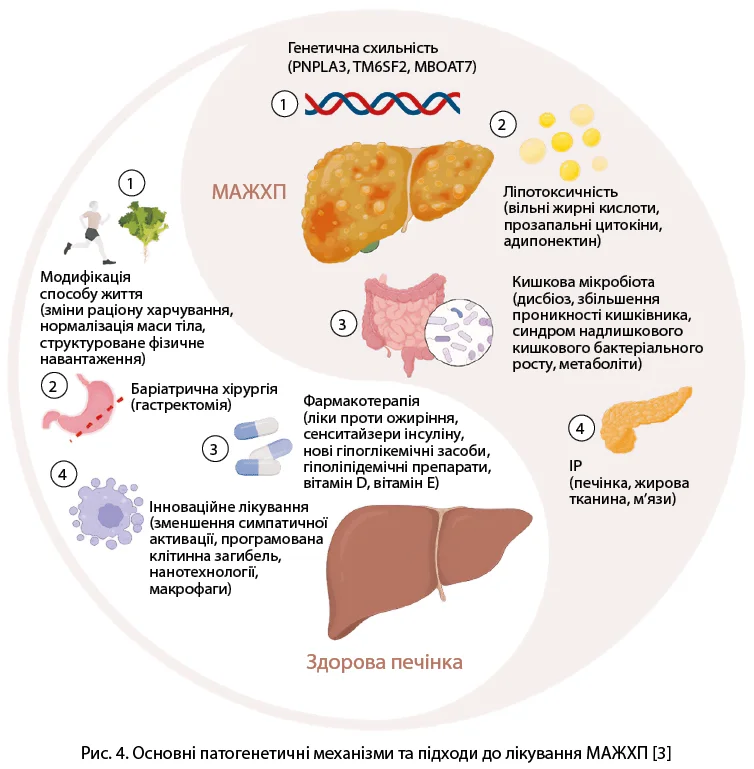
СХПМД є системною патологією, за якої ССЗ вважаються основною причиною смерті. Вважають, що ліки, здатні покращувати стан кардіоваскулярної системи, можуть зменшити смертність від ССЗ у пацієнтів із МАЖХП [3].
Тактика ведення пацієнтів із СХПМД ґрунтується на трьох стовпах: контроль ожиріння (модифікація способу життя, проведення баріатричного втручання), зменшення ризику розвитку ССЗ (лікування ЦД 2 типу та чинників ризику ССЗ – гіперглікемії, дисліпідемії, гіпертензії, відмова від паління), зниження активності НАСГ [3]. Модифікація способу життя передбачає вплив на кардіометаболічні чинники ризику, нормалізацію маси тіла, раціоналізацію харчового раціону, завдяки чому створюються умови для зменшення ризику розвитку ССЗ, корекції вмісту глікемії, зниження ризику фіброзування та показників серцево-судинної смертності в довгостроковій перспективі.
Значення амінокислот у лікуванні СХПМД
Оскільки одним із провідних чинників, які зумовлюють розвиток СХПМД, є порушення метаболічних можливостей макроорганізму, стало очевидним, що велике значення мають дії, спрямовані на покращення функцій і структури печінки як центру метаболічного обміну [2]. Тож призначення лікарського засобу, який здатний сприяти відновленню ліпідного й вуглеводного обмінів, антиоксидантному захисту, зменшенню запалення в печінці, має переваги серед тих гепатотропних препаратів, які не проявляють таких властивостей.
Як яскравий приклад можна навести есенціальну амінокислоту метіонін та її біологічно активний метаболіт S-адеметіонін, порушення синтезу якого розвивається на тлі різноманітних хронічних захворювань печінки. Замісна терапія екзогенним S-адеметіоніном широко використовується при різній гепатологічній патології, в тому числі СХПМД та ВПХ.
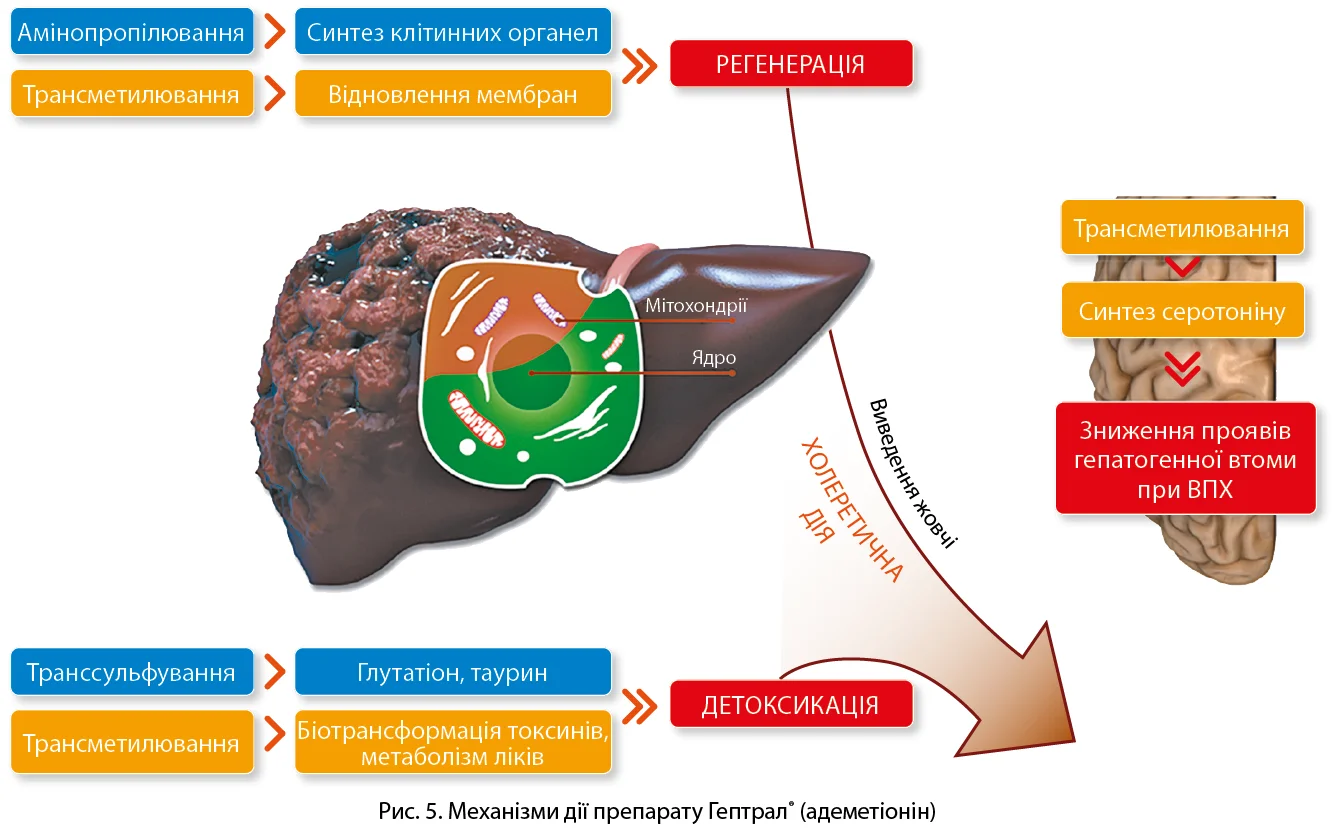
Ключову роль адеметіоніну в розвитку СХПМД пояснює той факт, що зниження його рівня в гепатоцитах зумовлює запуск каскаду біохімічних реакцій і активацію прозапальних цитокінів; запобігти таким негативним змінам можна за допомогою додаткового введення адеметіоніну. Адеметіонін є донатором метильних груп, необхідних для реакцій трансметилювання; він широко представлений у різних клітинах і бере участь у багатьох біохімічних процесах в організмі. Під час вивчення метаболізму адеметіоніну встановлено, що ця амінокислота є незамінним фактором синтезу в печінці глутатіону – одного з найважливіших клітинних антиоксидантів. Дефіцит S-адеметіоніну спричиняє прогресування захворювань печінки, тоді як зниження активності трансметилювання або транссульфування індукує розвиток стеатогепатиту та ГЦК. Поновлення рівня адеметіоніну в печінці покращує ліпідний обмін (поліпшує гомеостаз ліпідів і жовчних кислот, сприяє виведенню тригліцеридів із печінки), чинить гепатопротективну й антихолестатичну дії (завдяки відновленню мікротекучості цитоплазматичних мембран), відновлює синтез тіолових груп, які беруть участь в ендогенних процесах детоксикації, сприяє зниженню рівня запалення в пошкодженій печінці (знижує активність прозапальних цитокінів, підвищує рівень протизапальних – фактора некрозу пухлини й інтерлейкіну-10), прискорює регенерацію гепатоцитів (через синтез власного фосфатидилхоліну) [10-13].
На українському фармацевтичному ринку оригінальний препарат адеметіоніну представляє компанія Abbott під торговою назвою Гептрал® [12]. Доведено, що Гептрал® (S-адеметіонін) поліпшує процеси амінопропілювання, трансметилювання та транссульфування, завдяки чому посилюються регенеративні процеси, активується холерез і покращується детоксикація, знижується прояв патологічної втоми при ВПХ, що є частим і неспецифічним проявом хронічного захворювання печінки (рис. 5). Саме завдяки таким ефектам адеметіоніну зменшуються клінічні прояви захворювання, нормалізуються лабораторні маркери холестазу, знижується вираженість стеатозу печінки за даними ультразвукового дослідження та поліпшується ліпідний профіль [12].
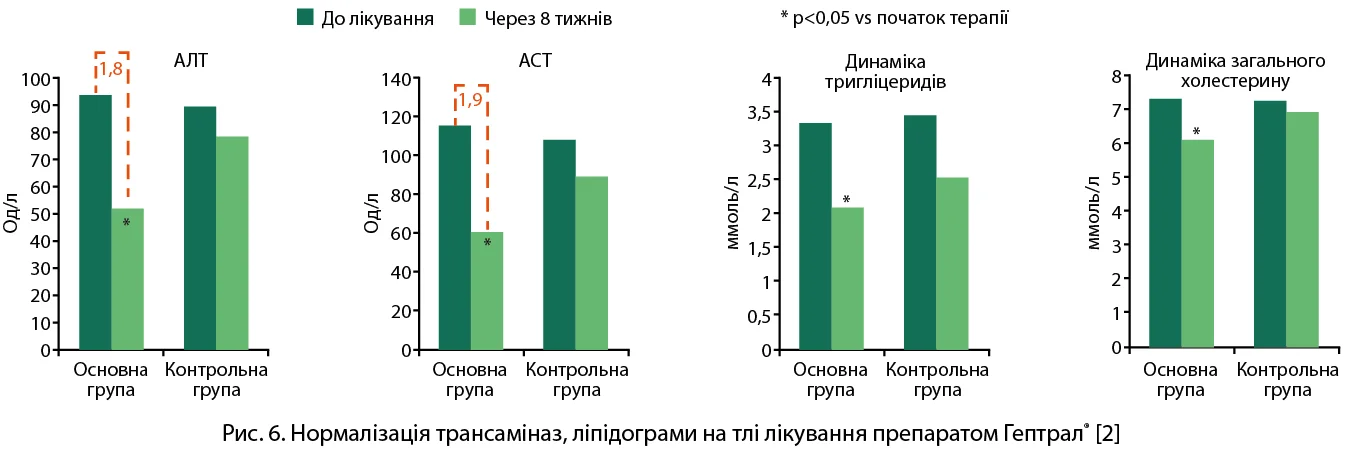
Клінічна ефективність препарату Гептрал® оцінювалася в різноманітних дослідженнях. В одному з них хворих на НАЖХП (n=62) та ВПХ рандомізували для 8-тижневого перорального прийому Гептрал® (адеметіоніну; n=31) або вітаміну Е (n=31) [2]. Пацієнтам основної групи призначали адеметіонін у дозі 500 мг 2 рази на добу, хворі контрольної групи отримували вітамін Е 200 мг 3 рази на добу. Терапія препаратом Гептрал® (адеметіоніном) сприяла вірогідному зниженню трансаміназ, нормалізації ліпідного профілю (рис. 6) порівняно з групою контролю.
Автори дослідження визначали загальний рівень результативності терапії на підставі аналізу ефективності кожного препарату: в групі Гептрал® (адеметіоніну) він становив 90,3%, у контрольній групі – 32,3% (р<0,05) [2]. Цей показник свідчить про високу клінічну ефективність препарату.
Згідно з інструкцією при призначенні лікарського засобу Гептрал® слід застосовувати покрокову терапію: спочатку, протягом 2 тижнів, використовувати парентеральну форму (вводити препарат внутрішньом’язово або внутрішньовенно 1-2 флакони по 500 мг на добу) з наступним застосуванням пероральної форми протягом 2 місяців (2-3 таблетки по 500 мг на добу) [12] або ж застосовувати відразу таблетовану форму – починати з 3 таблеток на добу для швидкого зменшення дефіциту ендогенного адеметіоніну (2 тижні), а далі підтримувальною дозою в 1000 мг на добу (2 таблетки) досягати курсової терапії протягом наступних 2 місяців.
Гептрал® має дозозалежний ефект, який було доведено в дослідженні Ю.А. Барановського [13]. Значною перевагою препарату Гептрал® (адеметіоніну) вважають збереження досягненого стійкого терапевтичного ефекту протягом 3 місяців після скасування [14]. Терапія препаратом Гептрал® (адеметіоніном) асоційована зі зниженням смертності у 2,5 раза в пацієнтів з алкогольним цирозом печінки [6].
Висновки
Метаболічну дисфункцію розглядають як надзвичайно важливий чинник ризику розвитку та прогресування захворювань печінки. Сучасні погляди на лікування СХП, СХПМД потребують пошуку нових рішень в організації лікування пацієнтів, у тому числі застосуванні комплексного підходу з обов’язковою корекцією метаболічних ризиків. Корекція одного із зовнішніх чинників ризику СХПМД – дефіциту адеметіоніну – за допомогою препарату Гептрал® є ефективним способом покращення стану пацієнтів із ВПХ, поліпшення біохімічних показників і стану печінки за даними ультразвукового дослідження.
Література
- American Association for the Study of Liver Diseases; Latin American Association for the Study of the Liver; European Association for the Study of the Liver. A call for unity: The path towards a more precise and patient-centric nomenclature for NAFLD. Ann. Hepatol. 2023 Jul-Aug; 28 (4): 101115. doi: 10.1016/j.aohep.2023.101115.
- Boming L. Observation of efficacy of ademetionine for treating non-alcoholic fatty liver disease. Chinese Hepatol. 2011; 16 (4): 350-1.
- Budd J., Cusi K. Role of agents for the treatment of diabetes in the management of nonalcoholic fatty liver disease. Curr. Diab. Rep. 2020; 20: 59. doi: 10.1007/s11892-020-01349-1.
- Eslam M., Newsome P.N., Sarin S., et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J. Hepatol. 2020; 73 (1): 202-209. doi: 10.1016/j.jhep.2020.03.039.
- Frezza M., Surrenti C., Manzillo G., et al. Oral S-adenosylmethionine in the symptomatic treatment of intrahepatic cholestasis. A double-blind, placebo-controlled study. Gastroenterology. 1990; 99 (1): 211-5. doi: 10.1016/0016-5085(90)91250-a.
- Mato J.M., Cámara J., Fernández de Paz J., et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial. J. Hepatol. 1999; 30 (6): 1081-9. doi: 10.1016/s0168-8278(99)80263-3.
- Rinella M.E., Lazarus J.V., Ratziu V., et al. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. Ann. Hepatol. 2023; 24: 101133. doi: 10.1016/j.aohep.2023.101133.
- Wong C.R., Lim J.K. The association between nonalcoholic fatty liver disease and cardiovascular disease outcomes. Clin. Liver Dis. (Hoboken). 2018; 12 (2): 39-44. doi: 10.1002/cld.721.
- World Health Organization 2021: Cardiovascular Disease Factsheet. Available at: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds).
- Mao H. Hepatoprotective effect of S-ademetionine in the treatment of intrahepatic cholestasis through farnesoid X receptor mechanism in rats. J. Biomol. Res. Ther. 2019; 8: 176. doi: 10.35248/2167-7956.19.8.176.
- Губергриц Н.Б., Фоменко П.Г., Голубова О.А. и др. «Роковая цепочка» и адеметионин. Современная гастроэнтерология. 2014; 4: 106-120.
- Інструкція з медичного застосування лікарського препарату Гептрал® (адеметіонін) [Електронний ресурс]. – Режим доступу: https://compendium.com.ua/info/275614/336607.
- Барановский А.Ю., Райхельсон К.Л., Марченко Н.В. Применение S-аденозилметионина (Гептрал®) в терапии больных неалкогольным стеатогепатитом. Клинические перспективы гастроэнтерологии, гепатологии. 2010; 1-6.
- Подымова С.Д. Адеметионин: фармакологические эффекты и клиническое применение препарата. РМЖ. 2010; 13.
UKR2296835
