Лікування цукрового діабету у хворих на діалізі: перешкоди та виклики
Переклала й адаптувала канд. мед. наук Тетяна Можина
Поширеність цукрового діабету (ЦД) значно зросла в усьому світі насамперед через збільшення захворюваності на ЦД 2 типу, підвищення рівня життя. Нині хворі на ЦД живуть довше, ніж у додіалізну еру. Прогнозується збільшення кількості дорослих хворих на ЦД 2 типу до 642 млн до 2040 р. Зростання середньої чисельності пацієнтів із ЦД провокує розвиток діабетичної хвороби нирок; у майбутньому очікується значне збільшення її поширеності разом із великим соціально-економічним тягарем [1, 2]. Діабетична хвороба нирок уражає майже 20-40% хворих на ЦД, провокуючи розвиток термінальної хронічної ниркової недостатності (ТХНН), що робить її глобальною проблемою для громадського здоров’я зі значною захворюваністю та смертністю.
Гомеостаз глюкози у хворих на термінальну стадію захворювання нирок, які перебувають на діалізі
Гомеостаз глюкози значно змінюється у хворих на хронічну хворобу нирок (ХХН): у них може розвиватись як гіперглікемія, так і гіпоглікемія через багатофакторні механізми, пов’язані з дисфункцією нирок, уремічним середовищем і самою процедурою діалізу, що призводить до зростання захворюваності та смертності в цій групі пацієнтів [96]. У хворих на ЦД, які перебувають на діалізі, може відбуватися спонтанне розрішення гіперглікемії з нормальним умістом глікозильованого гемоглобіну (HbA1c) незалежно від терапії. Такий феномен часто спостерігається та відомий як «діабет вигорання», що спричиняє часті епізоди гіпоглікемій у хворих на діалізі (ХнД) [61]. Діабет вигорання пов’язаний із мальнутрицією, втратою білків, діабетичним гастропарезом, який часто розвивається в ХнД та може підвищити ризик розвитку гіпоглікемії [61]. Крім того, знижуються деградація та кліренс екзогенного інсуліну нирками одночасно з порушенням функції нирок, що призводить до подовження періоду напіввиведення інсуліну [97, 98]. Спостерігається зниження печінкового кліренсу інсуліну при ХХН на додаток до інсулінорезистентності (ІР) [99]. Іншим чинником є зменшення маси нефронів і погіршення функції нирок, що зумовлює зниження ниркового глюконеогенезу [100]. Накопичення деяких уремічних токсинів, як-от сполуки гуанідину, здатних діяти подібно до терапії бігуанідами, сприяє зникненню гіперглікемії [71, 96].
З іншого боку, гіперглікемія та порушення толерантності глюкози можуть виникнути в ХнД з різних причин. По-перше, можуть знижуватися фільтрація й екскреція глюкози нирками [71]. По-друге, їх виникнення може бути пов’язане з ІР, зниженням секреції інсуліну. Механізм ІР у ХнД остаточно не вивчений, але запалення й уремічні токсини можуть бути причинними факторами [99]. Вторинний гіперпаратиреоз, дефіцит вітаміну D здатні погіршити секрецію інсуліну, тоді як надлишок вітаміну D покращує секрецію інсуліну незалежно від його впливу на паращитоподібні залози [99, 101]. Пацієнти на перитонеальному діалізі піддаються більшому глюкозному навантаженню через використання діалізованих рідин, у яких уміст глюкози може досягати 1360-3860 мг/дл, особливо якщо для досягнення адекватної ультрафільтрації потрібно застосовування діалізних концентратів із високим умістом глюкози [75].
Лікування ЦД у хворих на підтримувальному діалізі
Існує багато суперечок щодо ведення хворих на ЦД, які перебувають на підтримувальному діалізі, тому що діаліз та уремія здатні ускладнювати контролювання глікемії разом зі зміною фармакокінетики багатьох цукрознижувальних препаратів через ниркову недостатність. Окрім того, значення звичайних методів моніторингу глікемії (HbA1c, фруктозамін і глікозильований альбумін) можуть змінюватися на тлі лабораторних відхилень, супутніх захворювань, асоційованих із ТХНН. Тому в кожного хворого на ЦД, який перебуває на підтримувальному діалізі, потрібно належно контролювати глікемію для запобігання розвитку віддалених діабетичних ускладнень, збереження оптимального контролю глікемії без індукції гіпоглікемії.
Фармакологічна терапія
Інсулінотерапія
Відфільтрований інсулін переважно реабсорбується в проксимальних канальцях нирок і меншою мірою в перитубулярних клітинах, де він розпадається на пептидні фрагменти. Зі зниженням швидкості фільтрації хворі на ХХН мають меншу швидкість розпаду інсуліну, а отже, меншу потребу в інсуліні. З іншого боку, ХХН вважається ІР-станом, який покращується після ініціації діалізу [97]. Згідно з рекомендаціями KIDOQI, потрібно заохочувати використання інсуліну в пацієнтів, які перебувають на діалізі, особливо в тих, що мають мінімальні зміни фізіології. Пероральні цукрознижувальні препарати (ПЦЗП) слід використовувати з обережністю та не в усіх пацієнтів [113]. ХнД можуть потребувати або монопризначення базального інсуліну або базального інсуліну як частини багаторазових щоденних ін’єкцій [114, 115]. Рекомендується зменшити ініціальну дозу інсуліну приблизно до 50% від дозування, що отримують предіалізні хворі; дозування інсуліну можна титрувати завдяки самостійному визначенню рівня глікемії або вмісту HbA1c [97, 100, 116].
Пацієнти, які тільки починають лікування перитонеальним діалізом, можуть продовжувати прийом ПЦЗП за умови контролювання рівня глікемії; проте необхідно додати інсулін для полегшення підтримки глікемічних цілей (рис. 1). Інсулін можна вводити підшкірно або внутрішньоочеревинно (в/о); в/о шлях потребує вищих доз інсуліну, оскільки діалізат адсорбується на пластиковій поверхні мішка для діалізного розчину [117]. Дослідження довели, що необхідні дози інсуліну при в/о введенні можуть удвічі перевищувати такі при підшкірному введенні [118]. Крім того, в/о введення інсуліну асоційоване з підвищенням ризику бактеріальних інфекцій, проліферації фібробластів, субкапсулярного стеатонекрозу печінки [61, 119]. Іншим недоліком в/о введення є коливання дози інсуліну [120].

Пероральні гіпоглікемічні препарати
Терапевтичний арсенал, що використовується для лікування ЦД, значно збільшився протягом останнього десятиліття. Проте значна кількість цукрознижувальних препаратів з їхніми активними метаболітами метаболізується та виводиться нирками, тому потрібно корегувати дозування або уникати їх застосування в ХнД (рис. 2). ПЦЗП також можуть використовуватися в ХнД.
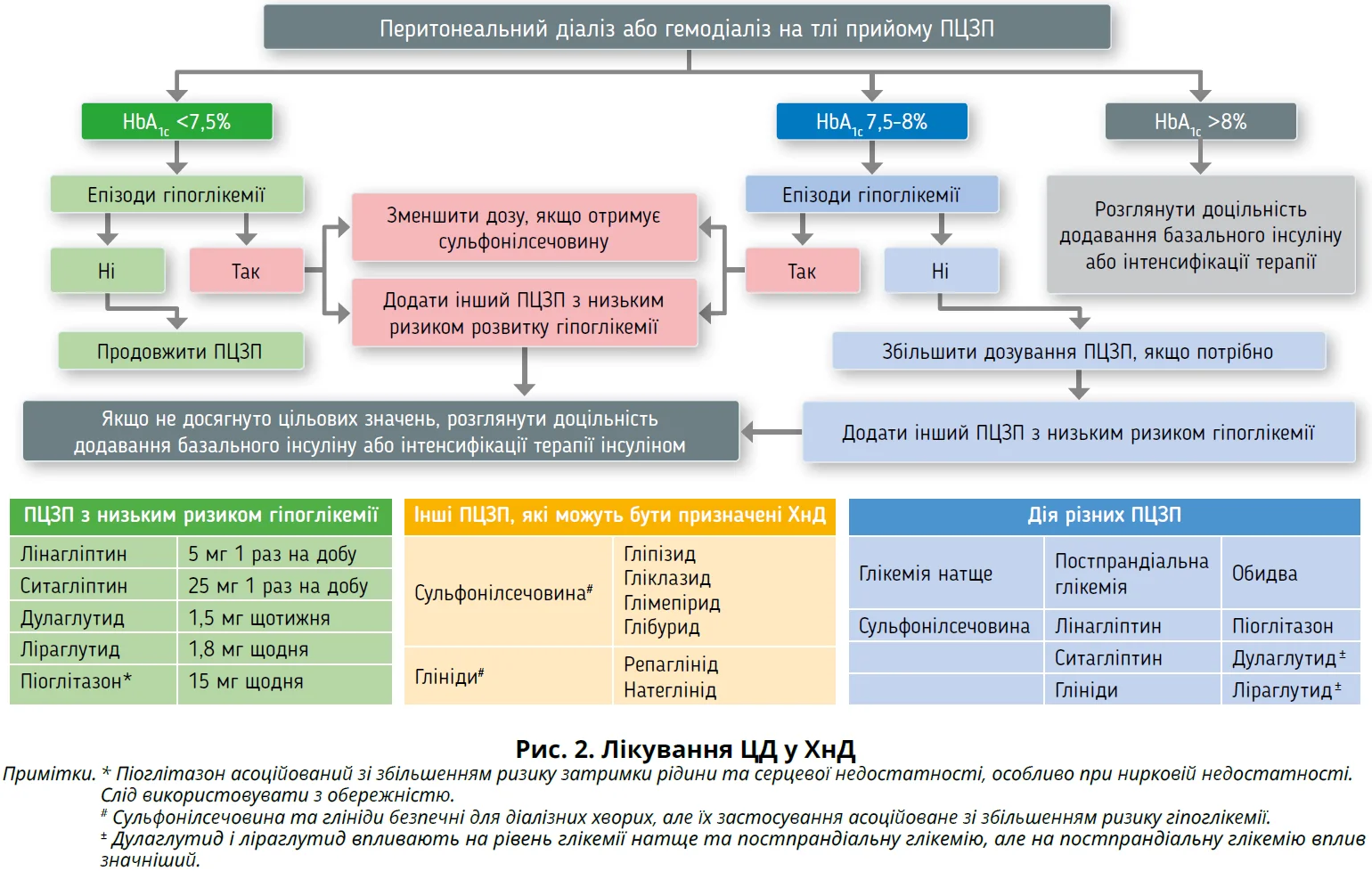
Препарати сульфонілсечовини. Препарати сульфонілсечовини 1-го покоління включають ацетогексамід, толбутамід, хлорпропамід і толазамід; вони не рекомендовані через тривалий період напіввиведення та підвищений ризик розвитку гіпоглікемії. Рекомендується використовувати препарати сульфонілсечовини 2-го покоління, наприклад гліклазид, який метаболізується в печінці й асоційований зі зниженням ризику гіпоглікемії [121, 122].
Глініди. Репаглінід є найкращим препаратом у цьому класі, оскільки метаболізується в печінці; його неактивні метаболіти виводяться із сечею. Отже, його застосування пов’язано з меншим ризиком гіпоглікемії. Натеглінід дещо поступається, оскільки його метаболіти, на відміну від репаглініду, є досить активними; тобто існує ризик гіпоглікемії [97, 122].
Тіазолідиндіони (ТЗД). ТЗД метаболізуються в печінці, й ні самі препарати, ні їхні метаболіти не виводяться нирками. Основним побічним ефектом ТЗД є затримка рідини, що призводить до перевантаження рідиною, набряків і застійної серцевої недостатності. TЗД-асоційоване перевантаження рідиною пов’язане з PPARγ-стимульованою реабсорбцією натрію в дистальних канальцях. Цей побічний ефект є неактуальним для ХнД з олігурією або анурією [123, 125]. Застосування ТЗД у ХнД асоційоване з меншим ризиком гіпоглікемії, покращенням ліпідного профілю, зменшенням запалення [126]. Новітні дані свідчать, що піоглітазон сприяє покращенню виживання діалізних пацієнтів [128].
Інгібітори дипептидилпептидази-4 (ДПП-4). Інгібітори ДПП-4 загалом безпечні для ХнД. Деякі препарати потребують корегування дози в ХнД із ХХН [97, 121]. Лінагліптин мінімально виводиться із сечею та переважно екскретується із жовчю; він може бути призначений ХнД без корекції дози [129]. Ситагліптин, своєю чергою, виводиться із сечею, його рекомендована доза для ХнД становить 25 мг на добу per os. Саксагліптин і його основний активний метаболіт виводяться під час гемодіалізу, тому цей препарат слід використовувати в зниженому дозуванні (2,5 мг 1 раз на добу per os) після діалізу [97, 129]. Дозу вілдагліптину потрібно зменшити до 50 мг на добу при помірній (розрахункова швидкість клубочкової фільтрації, рШКФ – 30-50 мл/хв) і тяжкій ХХН (рШКФ <30 мл/хв) [130]. Тенелігліптин, інгібітор ДПП-4, який було схвалено в Японії у 2012 р. та потім у Кореї у 2014 р., відрізняється тим, що метаболізується різними шляхами, включаючи метаболізм у печінці цитохромом P450 3A4 та флавіновмісною монооксигеназою-3 або нирковою екскрецією в незміненій формі [131, 132]. Ця унікальна властивість дає змогу використовувати його без корегування дози навіть у ХнД [131, 132].
Аналоги глюкагоноподібного пептиду-1 (ГПП-1). Аналоги ГПП-1 затримують спорожнення шлунка та сприяють швидкому насиченню, зниженню маси тіла [97]. Ексенатид і ліксисенатид виводяться нирками та не рекомендовані при рШКФ <30/мл/хв/1,73 м2.
Ліраглутид не метаболізується та не виводиться нирками; дані щодо використання ліраглутиду в ХнД обмежені. Виробники застерігають від його застосування при помірній і тяжкій дисфункції нирок; але деякі автори вважають, що корекція дози у хворих на ТХНН не потрібна [133, 134]. Дулаглутид є аналогом ГПП-1 тривалішої дії, тому його вводять 1 раз на тиждень. Виробники рекомендують використовувати цей препарат до IV стадії ХХН і дуже обережно при V стадії ХХН без корегування дози [135].
Інгібітори натрійзалежного котранспортера глюкози 2 типу (НЗКТГ-2). Використання інгібіторів НЗКТГ-2 асоційоване зі значними перевагами для серцево-судинної системи та нирок, але ці переваги не доведені для пацієнтів із ≥IV стадією ХХН (ШКФ <29 мл/хв/1,73 м2), оскільки вони не досліджувалися в клінічних випробуваннях. Згідно з положенням KDIGO (2020), у разі ХХН рекомендується застосування інгібіторів НЗКТГ-2 у пацієнтів із рШКФ >30 мл/хв/1,73 м2, але не нижче, оскільки бракує доказів їхньої ефективності та безпеки.
Настанови також передбачають продовження прийому інгібіторів НЗКТГ-2 пацієнтами, які вже їх приймають, до проведення діалізу. Ці рекомендації, найімовірніше, будуть переглянуті після публікації результатів клінічних випробувань [137].
Інгібітори α-глюкозидази. Інгібітори α-глюкозидази (акарбоза, міглітол) зменшують усмоктування глюкози після прийому їжі. Менш ніж 2% акарбози та її активних метаболітів присутні в сечі. У пацієнтів із ХХН сироватковий рівень акарбози та її метаболітів значно вище. Міглітол має вищу системну абсорбцію з ренальною екскрецією понад 95%. Рекомендується уникати призначення міглітолу при ШКФ <25 мл/хв/1,73 м2. Ці препарати не досліджувалися в пацієнтів із термінальною стадією захворювання нирок, тому слід уникати їх використання в зазначеній популяції [138].
Гіпоглікемія та варіабельність глікемії
Процедура гемодіалізу пов’язана з обміном рідини, метаболітів і електролітів. Отже, концентрації глюкози у хворих на ЦД значно нижчі в дні проведення діалізу порівняно з такими в дні без діалізу. Зазвичай найнижчий рівень глікемії визначають після сеансів діалізу. Крім того, рівень глюкози в крові вище в дні без діалізу, оскільки глюкоза має тенденцію до накопичення в крові, незважаючи на прийом цукрознижувальних препаратів, що призводить до значної варіабельності глікемії, яка може бути не виявлена під час вимірювання HbA1c. Варіабельність глікемії описують як «у межах доби», тобто коливаннями протягом 24 годин, або «протягом тижня», що зумовлена відмінностями рівня глікемії від доби до доби.
Крім того, ХнД притаманне зниження усвідомлення ризику гіпоглікемії. Отже, клініцисти мають консультувати хворих на ЦД, які перебувають на підтримувальному гемодіалізі, та розглянути доцільність зменшення дозування гіпоглікемічних засобів у дні проведення діалізу [13, 52, 61] (рис. 3).

Висновки
Ведення хворих на ЦД, які перебувають на підтримувальному діалізі, є справжнім викликом і потребує мультидисциплінарного підходу. В ідеалі терапію потрібно персоніфікувати для кожного хворого на ЦД, який перебуває на діалізі, з метою зменшення ризику розвитку ЦД-асоційованих ускладнень, мінімізації побічних ефектів, збільшення рівня виживання. Трансплантація нирок з/без одночасної трансплантації підшлункової залози залишається першочерговою замісною терапією у хворих на ЦД із ТХНН; вона покращує якість життя пацієнта порівняно з діалізною терапією. Проте часто це неможливо внаслідок різноманітних супутніх захворювань, обмеженої доступності донорських органів.
Література
Alalawi F., Bashier A. Management of diabetes mellitus in dialysis patients: Obstacles and challenges. Diabetes Metab. Syndr. 2021. doi: 10.1016/j.dsx.2021.05.007.
