Гігантська інсулінома – вкрай рідкісна пухлина, що спричиняє гіпоглікемію
Підготувала Ганна Гаврюшенко
Інсуліноми є одним із найчастіше діагностованих підтипів функціональних нейроендокринних пухлин. Зазвичай діаметр інсуліном не перевищує 3 см, однак у літературі описано 44 випадки гігантських інсуліном із діаметром більш ніж 9 см. Патофізіологія гігантських інсуліном залишається нез’ясованою, проте ймовірний їхній зв’язок із множинною ендокринною неоплазією 1 типу (MEN1), спорадичними соматичними мутаціями в гені YY1, а також можливим переходом об’ємних нефункціональних нейроендокринних пухлин підшлункової залози до функціонального фенотипу. Великі інсуліноми зазвичай є більш злоякісними й інвазивними. У цьому матеріалі описано клінічний випадок неметастазувальної інсуліносекретувальної гігантської нейроендокринної пухлини підшлункової залози (PanNET) у 38-річної пацієнтки, а також подано сучасну інформацію щодо патогенезу, діагностики та лікування гігантських інсуліном.
Інсуліноми – це нейроендокринні пухлини з частотою діагностування 1-4 випадки на 1 мільйон населення на рік, що переважно вражають жінок віком 30-50 років. Патологоанатомічні дослідження демонструють значно вищу частоту виявлення інсуліном, що свідчить про їх недостатнє прижиттєве діагностування. Виникнення інсуліном може бути спорадичним чи генетично детермінованим, наприклад пов’язаним із MEN1 або втратою гетерозиготності ділянки 11q13. Синдром MEN1 характеризується поєднанням первинного гіперпаратиреозу, аденоми гіпофіза та пухлин шлунка чи підшлункової залози, як-от гастриноми й інсуліноми. У дуже рідкісних випадках інсуліноми можуть бути пов’язані з туберозним склерозом або нейрофіброматозом 1 типу.
У більшості пацієнтів з інсуліномою спостерігається гіпоглікемія, проте діагностика невеликих пухлин може бути ускладненою, враховуючи те що в 95% випадків діаметр цих пухлин не перевищує 3 см. «Червоним прапорцем» для діагностики інсуліноми є тріада Віппла, до якої належать гіпоглікемія, нейроглікопенічні симптоми та полегшення стану пацієнта після прийому глюкози. Діагностувати інсуліному допомагає поєднання таких змін показників крові, як підвищення рівнів інсуліну, проінсуліну та С-пептиду, що супроводжується зниженням рівня глюкози в крові.
Лікування інсуліном включає хірургічне втручання та медикаментозну терапію, зокрема застосування діазоксиду або аналогів соматостатину (наприклад, октреотиду) для полегшення симптомів та індукції регресування пухлини. Інші варіанти лікування включають використання інгібіторів mTOR (наприклад, еверолімусу, особливо за злоякісних інсуліном) або інгібіторів тирозинкінази (наприклад, сунітинібу), оскільки ріст інсуліном залежить від залучення інсуліноподібного фактора росту-1 (ІФР-1) через рецепторні шляхи mTOR і тирозинкінази. Нещодавно описано випадки успішного лікування віддалених метастазів за допомогою пептидної рецепторної радіонуклідної терапії.
Інсуліноми зазвичай є доброякісними пухлинами, проте великі інсуліноми переважно демонструють більшу злоякісність, частоту метастазування й агресивний перебіг. За результатами когортного дослідження Sada та співавт., середній розмір доброякісних інсуліном становив близько 1 см, тоді як у злоякісних інсуліном цей показник дорівнював 4 см.
Опис клінічного випадку
38-річна пацієнтка була госпіталізована в Університетську лікарню м. Діжон (Франція) у зв’язку з множинними епізодами нездужання, втомлюваності та зомління протягом останніх 3 місяців. Пацієнтка непритомніла зазвичай перед обідом і наприкінці дня, перед прийомом їжі. Додаткові перекуси в певні часові проміжки між основними прийомами їжі полегшували симптоми. В анамнезі – апендектомія та використання внутрішньоматкової спіралі. У сімейному анамнезі – рак передміхурової залози в одного з дідусів. На момент встановлення діагнозу хвора не приймала ліки, проте регулярно палила. При надходженні маса тіла пацієнтки становила 58,2 кг.
Через зниження рівня глюкози в капілярній крові натще до 1,99 ммоль/л (35,8 мг/дл) пацієнтку перевели до ендокринологічного відділення.
За даними дообстеження було виявлено порушення секреції інсуліну: рівень С-пептиду становив 2,01 нг/мл, проінсуліну – 91,56 пмоль/л, інсуліну натще – 13,6 мМО/л. Печінкові проби, рівні гемоглобіну (13 г/дл), альбуміну (37 г/л), креатиніну (63 мкмоль/л) і кальцію (2,44 ммоль/л) були в нормі. Загальний білірубін (26 мкмоль/л) був дещо підвищеним (норма – від 1,71 до 20,5 мкмоль/л) через прямий і непрямий. Рівень С-реактивного білка був низьким. Рівні тиреотропного гормону (0,65 мМО/л), тироксину (16,5 пмоль/л), адренокортикотропного гормону (29 нг/л) і кортизолу, а також паратгормону, ІФР-1 і пролактину були в межах норми. Генетичне дослідження синдрому MEN1 не проводилося.
За результатами комп’ютерної томографії (КТ) органів черевної порожнини було виявлено гетерогенне об’ємне утворення розміром 88×73 мм у лівому підребер’ї, розташоване між хвостом підшлункової залози та селезінкою, без ознак інфільтрації тканин або інвазії периферичних лімфатичних вузлів (рис. 1). За даними позитронно-емісійної томографії (ПЕТ) було виявлено ізольований гіперметаболізм підшлункової залози. Враховуючи підозру на інсуліносекретувальну пухлину, пацієнтці було призначено 100 мг діазоксиду тричі на день перед кожним прийомом їжі, що значно підвищило рівень глюкози в капілярній крові натще. З метою видалення пухлини було виконано лапароскопічну дистальну панкреатектомію зі спленектомією. Резектовані тканини, що включали в себе підшлункову залозу (35×30×10 мм) і селезінку (130×90×45 мм) із великим сальником (140×70×5 мм), були відправлені у відділення патології Університетської лікарні Діжона. При зовнішньому огляді пухлина розташовувалася у хвості підшлункової залози та мала розміри приблизно 90×85×50 мм, на розрізі була білувато-сірого кольору, гомогенної консистенції (рис. 2А).
При розтині перипанкреатичної жирової клітковини було виявлено 7 лімфатичних вузлів діаметром від 3 до 13 мм. Для подальшого гістопатологічного аналізу було проведено широкий забір біоптатів. Результати гістопатологічного дослідження подано на рисунку 2.

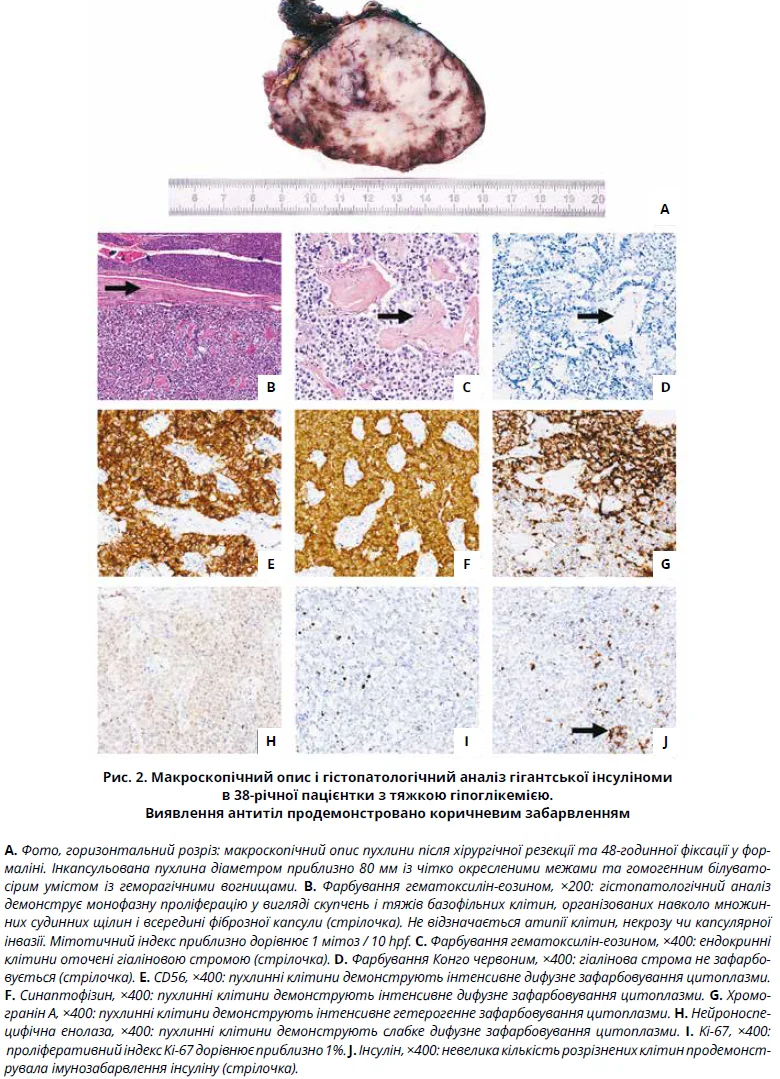
Відповідно до класифікації Всесвітньої організації охорони здоров’я 2019 року було встановлено остаточний діагноз: функціональна високодиференційована нейроендокринна пухлина підшлункової залози низького ступеня злоякісності (G1) / інсулінома. Гістопатологічне дослідження лімфатичних вузлів було в нормі. Наприкінці 16-місячного періоду спостереження після видалення пухлини пацієнтка важила 54 кг (втрата ваги – 4,2 кг). Рівні інсуліну, проінсуліну та С-пептиду, а також глюкози в капілярній крові натще повернулися до нормальних значень. Рівень глікованого гемоглобіну (HbA1c) та хромограніну А в крові під час госпіталізації не визначався. Після лікування пацієнтка не мала специфічних скарг, також не спостерігалося рецидивів захворювання та/або метастазування. Через 6 місяців після операції було проведено 68Ga-DOTATATE-ПET-сканування, результати якого були в межах норми.
Обговорення
Інсуліноми є вкрай рідкісними нейроендокринними пухлинами, що призводять до гіперсекреції інсуліну та гіпоглікемії. У літературі гігантські інсуліноми визначають як інсуліносекретувальні пухлини діаметром приблизно 9 см. У 2013 році Callacondo та співавт. описали 35 випадків гігантських інсуліном, з яких 50% метастазували в печінку. Співвідношення чоловіків і жінок серед пацієнтів становило 1,5 (21 чоловік, 14 жінок). Переважна частина пухлин демонстрували низькі проліферативні та мітотичні показники, а також ознаки амілоїдної строми.
Від моменту публікації розлогого огляду Callacondo та співавт., окрім поданого в цьому матеріалі клінічного випадку, в літературі було описано ще 9 випадків. Співвідношення чоловіків і жінок у цій когорті становило 1,3 (4 чоловіки, 3 жінки). Крім того, 30% пацієнтів мали метастази на момент установлення діагнозу. Попередні дослідження показали, що результати ПЕТ із 18F-фтордезоксиглюкозою (ПЕТ-ФДГ) корелюють із гістологічним класом інсуліноми й допомагають передбачити прогноз іще до проведення операції, що дає змогу покращити післяопераційне спостереження. Використання ПЕТ-сканування з 18F-фтордезоксиглюкозою на передопераційному етапі може допомогти відрізнити пухлини G1/2 від пухлин G3. До того ж пухлини з позитивним результатом ПЕТ-ФДГ є зазвичай більшими й агресивнішими, ніж пухлини з негативним результатом. Незалежно від розміру пухлини за підозри на злоякісність інсуліноми потрібний ретельний моніторинг виникнення метастатичного процесу, особливо метастазів у печінку та лімфатичні вузли, з використанням методів візуалізації, як-от ПЕТ-ФДГ та 68Ga-DOTATATE-ПЕТ-сканування.
Патофізіологічні механізми, що лежать в основі виникнення гігантських інсуліном, не визначені через малу кількість описаних спорадичних випадків, але існують певні гіпотези. Наприклад, активація шляху mTOR може пояснити розростання й потенційну трансформацію гігантських інсуліном. Гігантські інсуліноми можна розглядати як пухлини, що погано продукують інсулін і повільно ростуть протягом багатьох років, не спричиняючи симптомів, поки не досягнуть великих розмірів. Хвіст підшлункової залози є ідеальною локалізацією для гігантських інсуліном, оскільки там є більше простору для росту пухлини протягом тривалого періоду. Іншою гіпотезою виникнення гігантських інсуліном може бути унікальний альтернативний молекулярний шлях, що призводить до росту пухлини, проліферації клітин і розвитку «амілоїдоподібної» строми, особливо з огляду на те, що амілоїдна строма утворюється завдяки секреції амілоїдного острівцевого поліпептиду підшлункової залози. Трансформація фенотипових ознак нефункціональних PanNET (NFPanNET) та інсуліном у процесі пухлинного росту може пояснити перетворення NFPanNET на інсуліноми внаслідок їхнього збільшення. Випадки набуття NFPanNET 1/2 ступеня «гормоносекретувального» фенотипу було описанов літературі. Можна припустити, що перетворення NFPanNET на інсуліному та секреція гормонів під час прогресування хвороби можуть бути результатом диференціації внутрішньопухлинних плюрипотентних стовбурових клітин у «інсуліносекретувальний» фенотип, особливо під впливом гормонів гіпофіза, як це було описано при аденомах гіпофіза.
Висновки
Гігантські інсуліноми є вкрай рідкісними пухлинами з унікальними гістопатологічними особливостями й дуже обмеженими знаннями про їх патогенез. Подальші міжнародні інтегративні дослідження із застосуванням транскриптомного аналізу та культур клітин гігантських інсуліном можуть прояснити патогенез цих гігантських пухлин, що зазвичай мають гірший прогноз і потребують ризикованих хірургічних процедур для повного видалення. Гігантські інсуліноми мають вищу частоту метастазування, злоякісності й інвазії в навколишні тканини, ніж пухлини менших розмірів. Це вказує на необхідність ретельного постопераційного спостереження за пацієнтами з використанням методів функціональної візуалізації (як-от ПЕТ-ФДГ та 68Ga-DOTATATE-ПЕТ) для виключення метастатичного процесу, особливо в печінці та лімфовузлах.
Література
Tarris G., Rouland A., Guillen K., et al. Front. Endocrinol. 10 May 2023. Sec. Neuroendocrine Science; Vol. 14-2023. doi: 10.3389/fendo.2023.1125772.
