Синдром мінеральних і кісткових порушень, асоційованих із хронічною хворобою нирок: від експериментальних досліджень до ліжка хворого
Підготувала канд. мед. наук Лариса Стрільчук
Порушення кісткового та мінерального обміну у хворих на хронічну хворобу нирок (ХХН) раніше вважали захворюванням кісток і паращитоподібних залоз. Однак нині ці аномалії визнають системним розладом, який впливає на широкий спектр систем організму, включаючи серцево-судинну систему, і називають синдромом мінеральних і кісткових порушень, асоційованим із ХХН (СМКП-ХХН).
Аномальні рівні фосфору, кальцію та паратиреоїдного гормону (ПТГ) у сироватці асоціюються з підвищеним ризиком захворюваності та смертності в пацієнтів, які перебувають на гемодіалізі (ГД), і різні дані підтверджують, що гіперфосфатемія тісно пов’язана з вищим ризиком серцево-судинних подій і смерті. Продовжує зростати доказова база того, що підвищений рівень сироваткового фактора росту фібробластів-23 (ФРФ-23) асоціюється з гіпертрофією лівого шлуночка, кальцифікацією судин, інфекцією, анемією та запаленням у пацієнтів на ГД. Оскільки рівні ПТГ і ФРФ-23 у сироватці крові зростають у відповідь на фосфатне навантаження, зниження вмісту фосфору в сироватці крові та зменшення фосфатного навантаження мають вирішальне значення для лікування СМКП-ХХН у пацієнтів на ГД.
СМКП-ХХН включає біохімічні зміни, порушення метаболізму кісткової тканини та кальцифікацію судин, які можуть спричинити серцево-судинні події, переломи кісток та інші тяжкі ускладнення, що зрештою призводять до смерті пацієнтів із ХХН, у тому числі тих, які перебувають на ГД.
Фосфатний дисбаланс і СМКП-ХХН
Контроль сироваткового вмісту фосфору є важливою складовою лікування СМКП-ХХН у зв’язку з вагомою роллю перевантаження фосфором у розвитку цього розладу та незалежним зв’язком між гіперфосфатемією та серцево-судинними захворюваннями (ССЗ). Контроль метаболізму фосфору знижує ризик кальцифікації судин, вторинного гіперпаратиреозу (ВГПТ) і недостатнього вироблення ФРФ-23, таким чином сповільнюючи прогресування СМКП-ХХН і знижуючи серцево-судинну смертність. Однак перешкодою для ефективного контролю рівня фосфору з метою лікування СМКП-ХХН є відсутність терапевтичних стратегій, які можна використовувати для підтримки концентрації фосфору в межах норми (<5,5 мг/дл у пацієнтів на ГД).
Як фармакологічний засіб для лікування гіперфосфатемії нещодавно розпочали використовувати фосфатозв’язувальні речовини (фосфатні біндери – ФБ). Однак ФБ зв’язують лише частину харчових фосфатів і змушують пацієнтів приймати багато таблеток під час їди, тому прихильність до належного режиму вживання ФБ є низькою. Ефективність ФБ й обмеження фосфору в раціоні додатково знижує дезадаптивна регуляція всмоктування фосфору.
Нові стратегії контролю вмісту фосфору в сироватці крові повинні враховувати новітнє розуміння адсорбції фосфору, а саме те, що домінувальним шляхом кишкового всмоктування фосфору є парацелюлярний шлях. Нещодавно було розроблено новий інгібітор поглинання фосфору – тенапанор. Клінічні дослідження продемонстрували, що цей засіб знижує концентрацію фосфору в сироватці крові та добре переноситься, тому він може стати основою нового підходу до лікування СМКП-ХХН.
СМКП-ХХН як чинник ризику серцево-судинної смертності
СМКП-ХХН є поширеною супутньою патологією й основною причиною серцево-судинної смертності у хворих на ГД. Поряд зі зниженням функції нирок прогресивне порушення метаболізму кальцію та фосфору асоціюється зі змінами вмісту циркулювальних гормонів (ПТГ, ФРФ-23) і зниженням умісту кальцитріолу (рис.).
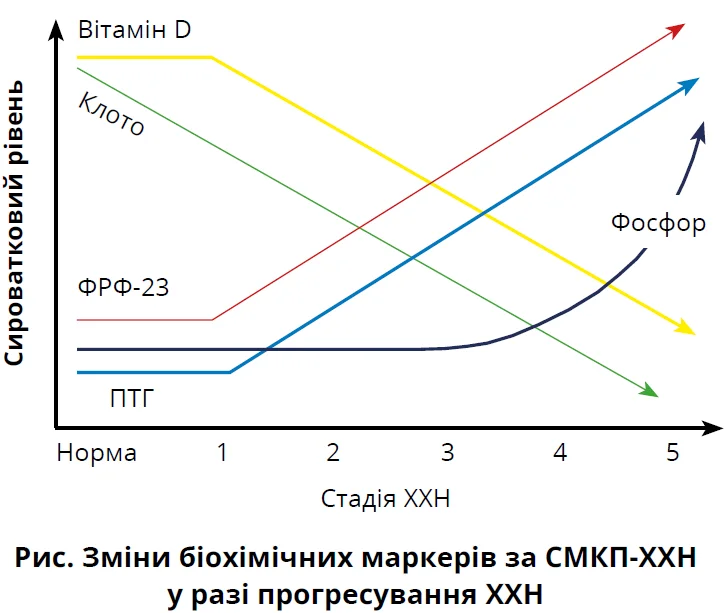
Відомо, що різні компоненти СМКП-ХХН, як-от гіперфосфатемія, кальцифікація судин і підвищений уміст ФРФ-23, достовірно асоціюються зі збільшенням серцево-судинної захворюваності та смертності. У 2021 р. ССЗ спричинили 45% смертей серед японських пацієнтів на ГД. Традиційні чинники ризику серцево-судинної смертності (артеріальна гіпертензія, цукровий діабет) не пояснюють вищої серцево-судинної захворюваності та смертності в пацієнтів, які перебувають на ГД, а відомі стратегії корекції цих чинників ризику не забезпечують належного покращення ситуації. Для покращення клінічних наслідків та якості життя пацієнтів на ГД, а також для зниження смертності може бути потрібний кращий контроль рівня фосфору.
Терапевтичні підходи до СМКП-ХХН, здатні знизити серцево-судинну смертність, включають удосконалення методів діалізу, зменшення запалення та покращення контролю вмісту фосфору в сироватці крові. Корекція гіперфосфатемії є дуже важливим аспектом, оскільки аномальна концентрація фосфору виступає незалежним чинником ризику серцево-судинної захворюваності та смертності в пацієнтів на ГД. Було також виявлено лінійну кореляцію між підвищенням концентрації фосфору в сироватці крові та прогресуванням кальцифікації вінцевих судин.
Патогенез кальцифікації судин та її зв’язок із СМКП-ХХН
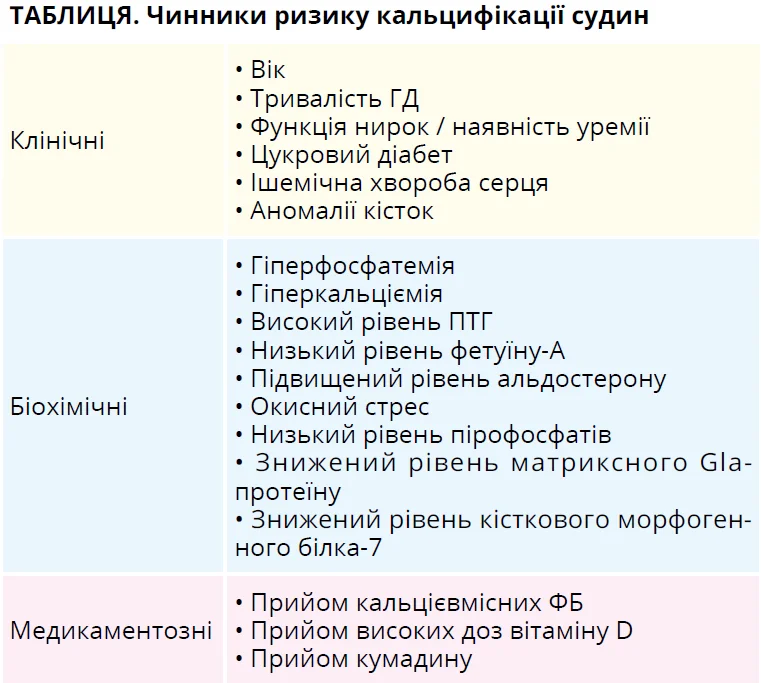
Кальцифікація судин є поширеним ускладненням ХХН і асоціюється зі збільшенням серцево-судинної захворюваності та смертності. Раніше кальцифікацію судин розглядали як пасивний дегенеративний процес відкладення кальцію в стінці судини, але тепер її визнано активно регульованим клітинним процесом. Чинники ризику кальцифікації судин у пацієнтів на діалізі наведено в таблиці.
Проведені протягом останнього десятиліття фундаментальні дослідження показали, що кальцифікація судин опосередкована складними клітинними механізмами, включаючи апоптоз гладком’язових клітин судин або їх трансдиференціювання в остеобластоподібні клітини, деградацію позаклітинного матриксу, утворення й вивільнення кальцифікувальних матриксних везикул, а також формування та дозрівання кальципротеїнових частинок (КПЧ). КПЧ містять кальцій, неорганічний фосфор, фетуїн-A й інші білки та збільшуються у відповідь на зростання фосфорного й кальцієвого навантаження, зумовлюючи запальні реакції в лейкоцитах, моноцитах, клітинах ниркових канальців і гладком’язових клітинах судин. За великої кількості КПЧ вони потрапляють у внутрішньоклітинний простір гладком’язових клітин судин та індукують внутрішньоклітинне перевантаження кальцієм із розвитком апоптозу, зміненої автофагії та кальцифікації позаклітинного матриксу.
Іще одним аспектом патогенезу кальцифікації судин є дисбаланс між індукторами й інгібіторами кальцифікації в бік зростання впливу індукторів і зниження – інгібіторів.
Протидія кальцифікації судин залишається складним питанням, але фундаментальні дослідження надали деякі ідеї щодо запобігання її прогресуванню при ХХН. Зокрема, в експериментальному дослідженні обмеження фосфору в раціоні та лікування ФБ запобігало уремічній кальцифікації судин або призупиняло її прогресування. Застосування антиоксидантів також уповільнює прогресування кальцифікації судин, а застосування іонів магнію пригнічує утворення та дозрівання КПЧ, водночас запобігаючи васкулярному запаленню й кальцифікації. Загалом кальцифікація судин вважається необоротним біохімічним явищем, хоча повідомлялося, що деякі терапевтичні втручання призводять до її регресу. Отже, наразі профілактика кальцифікації судин є доцільною стратегією ведення пацієнтів із ХХН, у тому числі осіб на ГД.
Біомаркери оцінки СМКП-ХХН
Із прогресуванням ХХН швидкість клубочкової фільтрації знижується, що призводить до затримки фосфору. На ранніх стадіях ХХН концентрації ПТГ і ФРФ-23 постійно зростають, тоді як концентрації фосфору є стабільними. Натомість спочатку виникають інші порушення мінерального обміну (ВГПТ, зниження вмісту вітаміну D). Підвищення ПТГ і ФРФ-23, гіпокальціємія та низькі концентрації вітаміну D пов’язані з підвищеним ризиком розвитку ССЗ.
На IV і V стадіях ХХН концентрації фосфору починають зростати, незважаючи на підвищення рівнів ФРФ-23 і ПТГ; це вказує на те, що компенсаторні механізми більше не здатні підтримувати баланс фосфору та запобігати гіперфосфатемії. Пацієнти з ХХН із погано керованим метаболізмом фосфору мають майже на 30% більший ризик смерті, ніж ті, хто досягає нормальної його концентрації та постійно її підтримує. Крім того, гіперфосфатемія безпосередньо пов’язана з артеріальною гіпертензією – основним чинником ризику ССЗ. Отже, контроль фосфору може стати основною терапевтичною мішенню для зниження смертності пацієнтів із ХХН.
Ключовими регуляторами метаболізму фосфору є ФРФ-23 та ПТГ, концентрації яких збільшуються у відповідь на затримку фосфору. Підвищення рівня ФРФ-23 є найбільш ранньою аномалією мінерального обміну, яка спостерігається в пацієнтів із ХХН. Затримка фосфору призводить до прогресивного зростання вмісту ФРФ-23, який спричиняє розвиток гіпертрофії лівого шлуночка та застійної серцевої недостатності. Доведено, що висока концентрація ФРФ-23 незалежно пов’язана з підвищеним ризиком серцево-судинних подій. Підвищена концентрація ПТГ також асоціюється з низкою несприятливих ефектів, зокрема посиленням резорбції кісткової тканини, зниженням серцевого індексу та середнього артеріального тиску, розвитком фіброзу міокарда.
Ведення пацієнтів із СМКП-ХХН
СМКП-ХХН є мультифакторним захворюванням, лікування котрого ґрунтується на кількох стратегіях, спрямованих на профілактику несприятливих ускладнень унаслідок ВГПТ. Поточна настанова Ініціативи з покращення глобальних наслідків хвороб нирок (KDIGO) рекомендує лікування ВГПТ на основі повторних вимірювань біохімічних маркерів, включаючи сироватковий рівень кальцію, фосфору та ПТГ, оскільки аномальний метаболізм фосфору та кальцію є основною характеристикою СМКП-ХХН, яка асоціюється з клінічно значущою кальцифікацією судин і підвищеною смертністю. Для лікування СМКП-ХХН запропоновано низку інноваційних препаратів (цинакальцету гідрохлорид, лантану карбонат і залізовмісні ФБ).
На підставі аналізу даних >128 тисяч пацієнтів на ГД було встановлено цільовий діапазон умісту фосфору в сироватці крові – 3,5-6,0 мг/дл. У настанові з клінічної практики Робочої групи з покращення якості наслідків хвороб нирок (KDOQI) діапазон умісту фосфору в сироватці крові для пацієнтів на ГД було встановлено на рівні 3,5-5,5 мг/дл, а рекомендації KDIGO з лікування СМКП-ХХН (2009) радять знижувати концентрацію фосфору в сироватці крові, якщо вона перевищує референсне значення.
Цільовий діапазон концентрації кальцію в сироватці крові, за рекомендаціями KDOQI, становить 8,4-9,5 мг/дл, а згідно з рекомендаціями KDIGO – в межах норми для відносно здорових осіб.
Рекомендації Японського товариства пацієнтів на ГД вказують, що найбільший пріоритет варто віддавати контролю сироваткового вмісту фосфору. Наступні за пріоритетністю позиції посідають, відповідно, контроль сироваткового вмісту кальцію та цільового діапазону ПТГ (за допомогою активаторів рецепторів вітаміну D чи цинакальцету гідрохлориду).
Для контролю рівня фосфору можна застосовувати різні ФБ. Слід пам’ятати, що деякі препарати мають різну ефективність залежно від часу прийому: наприклад, севеламеру гідрохлорид, біксаломер і сукроферичний оксигідрат варто приймати до їди, а CaCO3, лантану карбонат і заліза цитрату гідрат – одразу після їди.
Препарати для лікування СМКП-ХХН потрібно розглядати з погляду не лише контролю вмісту фосфору та кальцію, а й прогнозу. Низка обсерваційних когортних досліджень свідчить, що активатори рецепторів вітаміну D асоціюються з нижчою серцево-судинною смертністю та смертністю від усіх причин незалежно від сироваткових рівнів фосфору, кальцію чи ПТГ.
Цинакальцету гідрохлорид запобігає прогресуванню кальцифікації судин і покращує прогноз, оскільки цей препарат одночасно знижує сироваткові рівні фосфору, кальцію та ПТГ. Показано, що за умови застосування цинакальцету гідрохлориду знижується ризик госпіталізацій, пов’язаних зі станом судин, смертність від усіх причин і кардіоваскулярна смертність. Однак нещодавнє дослідження EVOLVE виявило, що цинакальцет достовірно не знижує ризику смерті або значущих серцево-судинних подій у пацієнтів на ГД із помірно тяжким або тяжким ВГПТ.
Т. Isakova та співавт. (2009) повідомили, що ризик смерті є нижчим у пацієнтів, які отримували ФБ, ніж у пацієнтів, які їх не отримували. Зважаючи на важливість уникнення кальцієвого перевантаження, адекватним верхнім порогом дози CaCO3 є близько 3 г/добу. У разі виразної кальцифікації судин, підозри на адинамічну хворобу кісток і стало низького рівня ПТГ слід розглянути зменшення дози CaCO3 або перехід на безкальцієвий ФБ.
Тісний зв’язок між залізодефіцитом, анемією ниркового походження та СМКП-ХХН став підґрунтям для застосування залізовмісних ФБ. Ефективність заліза цитрату гідрату та сукроферичного оксигідроксиду виявилися аналогічними показникам севеламеру, але для визначення подальшої долі цих препаратів потрібне порівняння їхньої фармакоекономічної доцільності з іншими ФБ.
Висновки
СМКП-ХХН – поширене ускладнення ХХН, яке збільшує серцево-судинну смертність. Важливо розуміти, що затримка фосфору спричиняє збільшення вмісту КПЧ, ФРФ-23 та PTH, що асоціюється з кардіоваскулярними хворобами. Обмеження фосфору в раціоні ускладнене наявністю в харчових добавках неорганічного фосфору, а застосування багатьох препаратів утруднює контроль концентрації фосфору в пацієнтів із СМКП-ХХН на ГД, оскільки діаліз здатен усунути лише 900-1200 мг фосфору на добу. У зв’язку з цим основним видом фармакотерапії гіперфосфатемії та кальцифікації судин виступають ФБ, включаючи залізовмісні. Якщо ФБ недостатньо для підтримки нормального вмісту фосфору, пацієнтам із СМКП-ХХН і ВГПТ призначається комбінація низьких доз активаторів рецепторів вітаміну D із цинакальцету гідрохлоридом. Інноваційним препаратом для пригнічення всмоктування фосфору є тенапанор, який діє на основний шлях абсорбції та забезпечує новий підхід до лікування гіперфосфатемії.
Література
Nitta K., Hanafusa N., Akiyama K., Kawaguchi Y., Tsuchiya K. Chronic Kidney Disease – Mineral and Bone Disorder (CKD-MBD), from Bench to Bedside. Kidney and Dialysis. 2023; 3 (1): 46-55. doi: 10.3390/kidneydial3010004.
