Агоністи рецепторів глюкагоноподібного пептиду-1 у сучасному лікуванні цукрового діабету 2 типу. Акцент на ліраглутид: коли, кому та як?
Переклала й адаптувала канд. мед. наук Ольга Королюк
Цукровий діабет (ЦД) 2 типу залишається глобальною проблемою охорони здоров’я. Швидкий економічний розвиток та урбанізація призвели до зростання поширеності хвороби в більшості частин світу [1, 2]. Діабет впливає на функціональні можливості та якість життя, зумовлює втрату працездатності, тяжкі ускладнення, інвалідність і передчасну смерть.
Одним із чинників значної поширеності ЦД 2 типу є старіння населення. Проте на сьогодні захворюваність зростає в усіх вікових групах, а пік припадає на вік 55 років [2]. Останніми десятиліттями спостерігається тривожна тенденція зростання захворюваності серед молодих людей [2]. У пацієнтів із раннім початком ЦД 2 типу (до 45 років) частіше трапляються такі чинники ризику, як малорухливий спосіб життя, ожиріння, дисліпідемія, куріння та хронічне запалення [3]. Особливе занепокоєння викликає той факт, що більш ніж третина пов’язаних із діабетом смертей нині припадає на людей працездатного віку – до 60 років [4]. Вартість лікування ЦД 2 типу щонайменше в 3,2 раза перевищує середні витрати на охорону здоров’я на душу населення; за наявності ускладнень витрати зростають у 9,4 раза [5]. Отже, змінилася парадигма лікування – від досягнення глікемічних цілей до їх постійної підтримки з одночасним впливом на чинники ризику, забезпечення органопротекції, запобігання та відтермінування ускладнень і смерті шляхом застосування препаратів, які доказово мають такі властивості. Цей меседж був ключовим у консенсусному звіті Американської діабетичної асоціації та Європейської асоціації з вивчення діабету (ADA/EASD, 2022) [6].
Ще у 2018 р. агоністи рецептора глюкагоноподібного пептиду-1 (арГПП-1) та інгібітори натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2) розглядалися пріоритетними в пацієнтів із ЦД 2 типу з високим ризиком для зниження частоти основних несприятливих серцево-судинних подій (MACE), госпіталізації з приводу серцевої недостатності (СН), серцево-судинної смерті та прогресування хронічної хвороби нирок (ХХН), незалежно від початкового або індивідуального цільового рівня глікованого гемоглобіну (HbA1c) [7, 8]. Консенсусний звіт ADA/EASD (2022) наголошує на важливості цілісного персоніфікованого підходу (рис. 1), інтенсифікації лікування з раннім призначенням комбінованої терапії для уникнення терапевтичної інертності. Метформін більше не є терапією першої лінії для всіх людей, а в осіб із високим ризиком призначення арГПП-1 й іНЗКТГ-2 треба розглядати незалежно не лише від початкового та цільового рівнів HbA1c, а й від застосування метформіну. Досягнення й підтримка цільових показників глікемії та маси тіла однаково важливі, їх оцінка й менеджмент проводяться одночасно зі зниженням кардіоренального ризику [6].
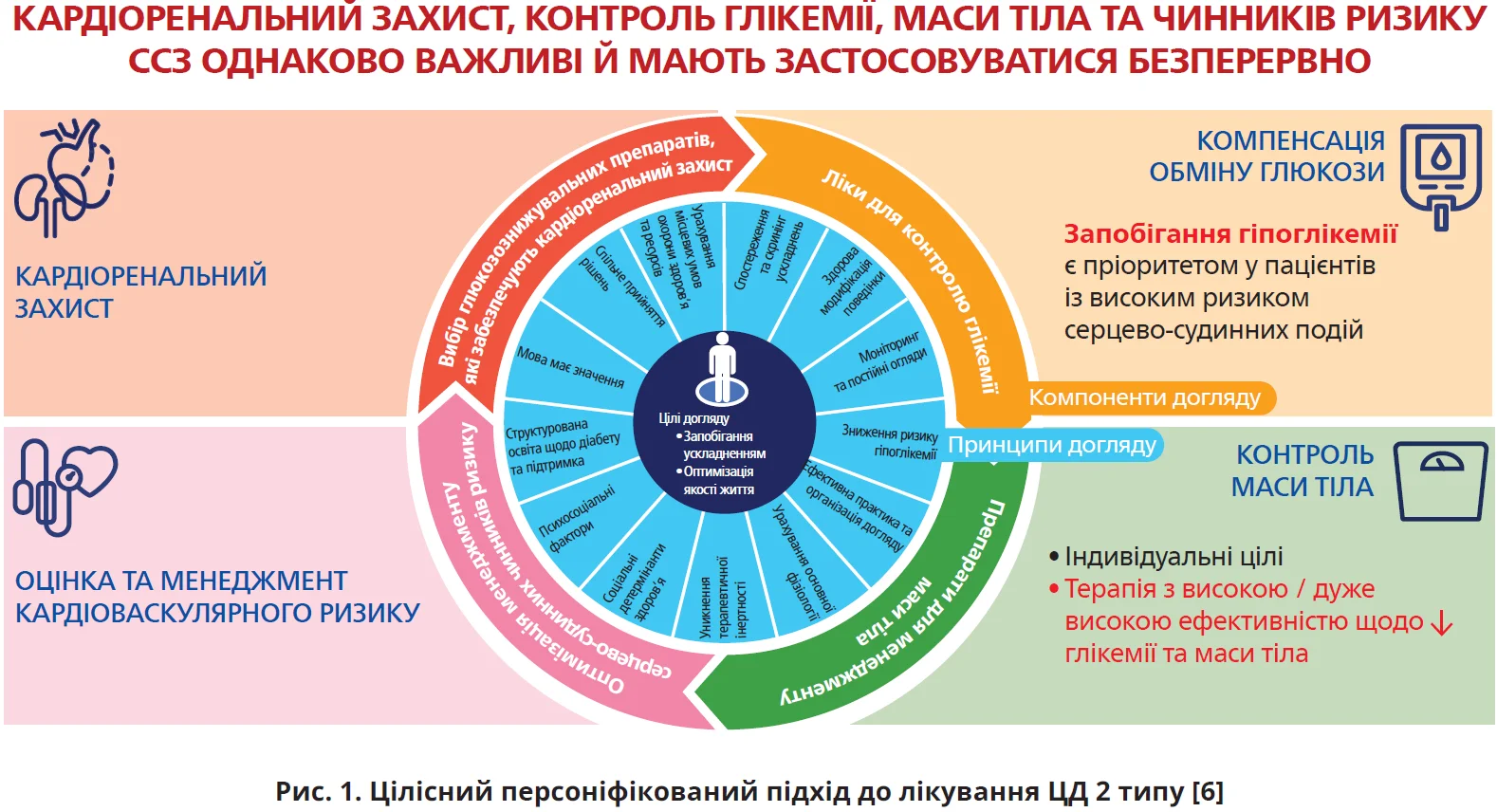
Кому доцільно якомога раніше призначити арГПП-1?
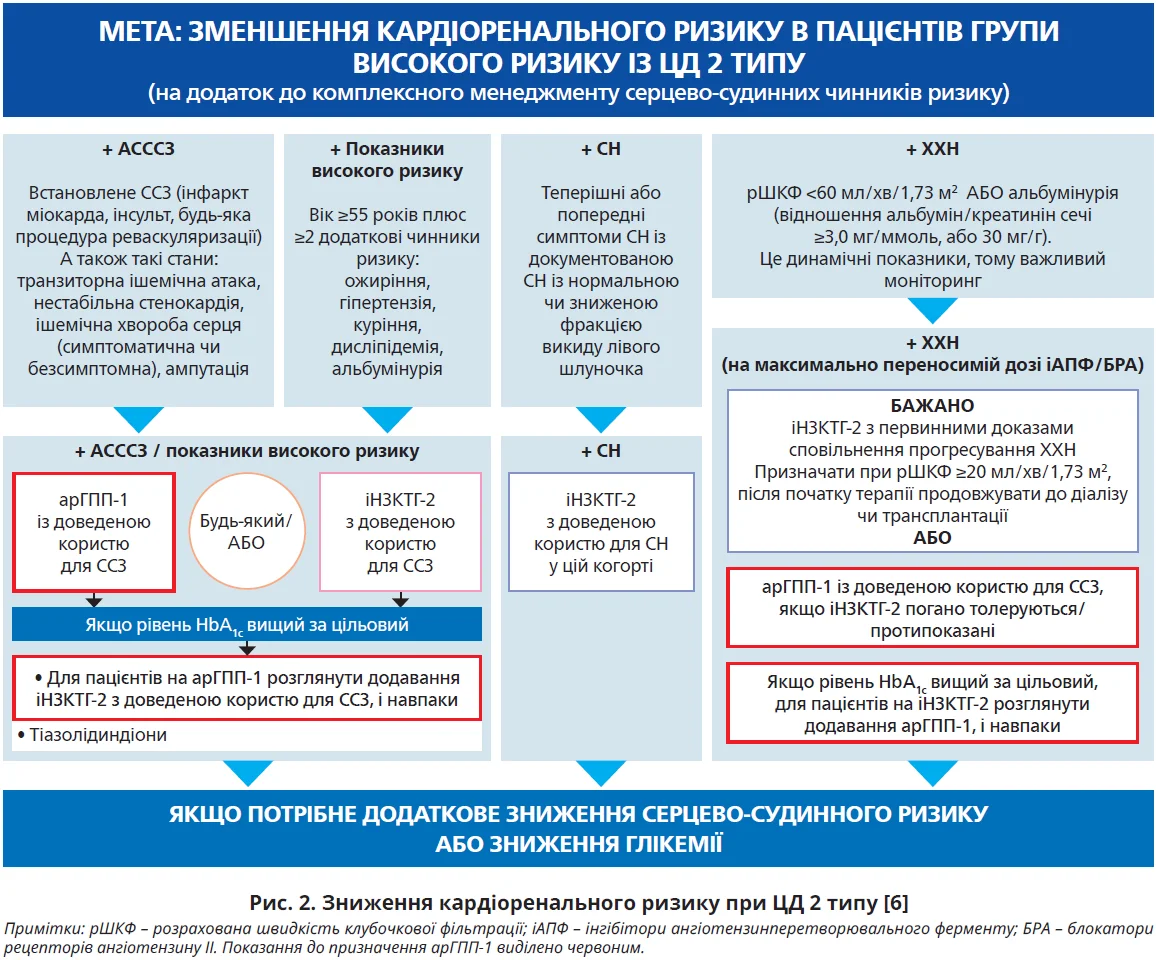
Насамперед пацієнтам зі встановленим атеросклеротичним серцево-судинним захворюванням (АСССЗ) – інфаркт міокарда чи процедура реваскуляризації в анамнезі, інсульт або транзиторна ішемічна атака, нестабільна стенокардія, симптоматична чи безсимптомна ішемічна хвороба серця, ампутація кінцівки. Потенційними кандидатами є також пацієнти з дуже високим ризиком. До них відносять осіб віком ≥55 років із принаймні двома додатковими чинниками ризику, як-от ожиріння, гіпертензія, куріння, дисліпідемія й альбумінурія. У цих когортах арГПП-1 можуть бути як засобом першого вибору, так і наступним кроком після або в комбінації з іНЗКТГ-2 з доведеною користю для ССЗ (рис. 2) [6].
У хворих на ЦД 2 типу смертність, пов’язана із ССЗ, удвічі вища, ніж у загальній популяції, особливо вразливими є представники виробничих професій: рівень смертності в них удвічі-втричі вищий, аніж у менеджерів, письменників і художників [9, 10]. Поширеність ССЗ у пацієнтів із ЦД 2 типу нещодавно вивчало дослідження CAPTURE у 13 країнах (Австралія, Китай, Японія, Чехія, Франція, Угорщина, Італія, Аргентина, Бразилія, Мексика, Ізраїль, Саудівська Аравія та Туреччина) на п’яти континентах. Загалом дослідження включало 9823 дорослих із ЦД 2 типу, серед них 54,17% отримували спеціалізовану допомогу, решта – допомогу на рівні первинної ланки. Медіана тривалості діабету становила 10,7 року (міжквартильний діапазон – 5,6-17,9 року), медіана HbA1c – 7,3% (міжквартильний діапазон – 6,6-8,4%). Поширеність ССЗ становила 34,8%, причому 31,8% припадало на АСССЗ, зокрема 17,7% – на ішемічну хворобу серця, 8,4% – на ураження коронарних артерій, 7,2% – на цереброваскулярні хвороби, по 4,2% – на аритмії та захворювання периферичних артерій, 2,4% – на СН та 0,4% – на захворювання аорти. Проте лише 21,9% учасників (21,5% із ССЗ та 22,2% без ССЗ) використовували глюкозознижувальні засоби з доведеними серцево-судинними перевагами. Отже, можна стверджувати, що станом на 2019 р. кожний третій дорослий із ЦД 2 типу мав встановлене ССЗ, але лише п’ята частина пацієнтів лікувалася відповідно до сучасних настанов [10].
Що стосується пацієнтів із ХХН (рис. 2), то призначення арГПП-1 обов’язкове за умови зниження показників рШКФ <60 мл/хв/1,73 м2 або за наявності альбумінурії – співвідношення альбумін/креатинін сечі ≥3,0 мг/ммоль (30 мг/г), особливо в разі, коли іНЗКТГ-2 протипоказані або погано толеруються. Якщо арГПП-1 розглядають як терапію другої лінії, то їх призначають як замість, так і в поєднанні з іНЗКТГ-2 з первинними доказами сповільнення прогресування ХХН, якщо попередня терапія не забезпечила досягнення цільових рівнів HbA1c [6].
Наявність ХХН у пацієнтів із ЦД 2 типу асоціюється з підвищеним ризиком термінальної ниркової недостатності, ССЗ та смерті. Поширеність ХХН у пацієнтів із ЦД 2 типу й особливості лікування нещодавно вивчали в дослідженні CREDO, проведеному в Канаді. Учасниками були 14 873 дорослих із ЦД 2 типу (59% – чоловіки); середні показники віку – 67 років, індексу маси тіла – 31 кг/м2, HbA1c – 7,6%, тривалості діабету – 16 років. У ретроспективній частині дослідження встановлено, що поширеність ХХН становила 47,9%; коморбідність включала артеріальну гіпертензію (76%), дисліпідемію (71%), ожиріння (51%) та встановлені ССЗ (22%). Близько 76% учасників застосовували іАПФ/БРА, 48% – іНЗКТГ-2, 30% – арГПП-1 і 3% – антагоністи мінералокортикоїдних рецепторів. У проспективній частині опитування лікарів показало, що для первинного лікування ХХН найчастіше призначали іАПФ/БРА (33%) та іНЗКТГ-2 (12%). Лише 4% пацієнтів призначали антагоністи мінералокортикоїдних рецепторів, а клас арГПП-1 узагалі не використовували!
Дослідники дійшли висновку: незважаючи на високу поширеність ХХН і супутніх захворювань, препарати з доведеним ренопротективним впливом – іАПФ/БРА, іНЗКТГ-2 й арГПП-1 – використовуються недостатньо [11].
Патогенетичні механізми підвищення ризику ССЗ в осіб із ЦД дуже складні. Вони включають дисглікемію, систему гормона росту, окисний стрес, ендотеліальну дисфункцію, запалення, дисліпідемію та гіперкоагуляцію [12]. Сприятливий вплив ГПП-1 на більшість указаних механізмів, а також вплив на діурез і натрійурез (рис. 3) пояснює механізми кардіоренального захисту арГПП-1 у хворих на ЦД 2 типу [13, 14].

Надзвичайно цікаві результати продемонстрував нещодавній метааналіз досліджень щодо наслідків застосування арГПП-1 на серцево-судинні та ниркові ускладнення (рис. 4). Проаналізовано вісім досліджень, які загалом включали 60 080 пацієнтів. Встановлено, що арГПП-1 знижували ризик MACE (серцево-судинна смерть, інсульт й інфаркт міокарда) на 14%, ризик смерті від усіх причин – на 12% (p=0,0001), госпіталізацію з приводу СН – на 11% (p=0,013) [15].
Аналіз ниркових результатів проведено на підставі шести досліджень за участю 47 425 пацієнтів (рис. 4), а комбінований результат включав появу макроальбумінурії, подвоєння рівня креатиніну в сироватці крові або зниження рШКФ принаймні на 40%, потребу замісної ниркової терапії або смерть унаслідок ХХН. Встановлено, що сумарний ризик ниркових ускладнень знижувався на 21% (p<0,0001). Дуже важливо, що зменшення як серцево-судинних, так і ниркових подій під впливом арГПП-1 не супроводжувалося збільшенням ризику тяжкої гіпоглікемії, ретинопатії або побічних ефектів із боку підшлункової залози [15].

Варто вказати на роль і місце арГПП-1 в інших настановах. Зокрема, рекомендації щодо діабету, предіабету та ССЗ Європейського товариства кардіологів (ESC) спільно з EASD (2019) вказують, що в пацієнтів із встановленим ССЗ та високим або дуже високим ризиком, які раніше не отримували лікування ЦД 2 типу, препаратами вибору є арГПП-1 або іНЗКТГ-2 (рис. 5). Починати з метформіну доцільно лише за відсутності вказаних станів. Якщо ж пацієнти вказаних груп уже приймають метформін, їм треба додати арГПП-1 або іНЗКТГ-2, незалежно від досягнення цільового рівня НbA1c [16].

Пацієнтам із ЦД 2 типу та високим / дуже високим ризиком або встановленим ССЗ для зниження ризику серцево-судинних подій ESC рекомендує ліраглутид, семаглутид або дулаглутид (клас доказів І, рівень А), для зменшення ризику смерті – лише ліраглутид (клас доказів І, рівень В) [16]. Доказовість ліраглутиду забезпечило дослідження LEADER, яке включало 9340 пацієнтів із тривалим анамнезом ЦД 2 типу та високим серцево-судинним ризиком (81% із встановленим ССЗ). Учасники були рандомізовані до лікування ліраглутидом 0,6-1,8 мг 1 раз на день проти плацебо як доповнення до інших цукрознижувальних препаратів, тривалість спостереження становила 3,1 року. Лікування ліраглутидом на 13% зменшило ризик настання комбінованої первинної кінцевої точки, яка включала серцево-судинну смерть, нефатальні інфаркт міокарда чи інсульт. Окрім того, ліраглутид значно знизив загальну та серцево-судинну смертність – на 15 і 22% відповідно [17]. Подальший аналіз показав нижчі темпи виникнення та прогресування ХХН у разі застосування ліраглутиду порівняно з плацебо [18].
Рекомендації Американської асоціації серця й Американської асоціації інсульту (АНА/ASA, 2021) щодо профілактики інсульту в пацієнтів з інсультом і транзиторною ішемічною атакою вказують на потребу додавання до метформіну саме арГПП-1, незалежно від рівня HbA1c, пацієнтам із встановленим АСССЗ, включно з ішемічним інсультом, коли пріоритетом є профілактика подальших судинних подій [19]. Останнім часом з’являється дедалі більше доказів нейропротективної здатності арГПП-1.
Відомо, що ГПП-1 діє як нейромедіатор і трофічний фактор, модулюючи проліферацію клітин, нейрогенез й апоптоз в осі кишечник – мозок [20, 21].
Певні представники класу арГПП-1, як-от ліраглутид, альбіглутид і ліксисенатид, можуть проникати крізь гематоенцефалічний бар’єр подібно до природного ГПП-1, потенціюючи нейрогенез і когнітивні функції [22, 23]. Імовірно, ці ефекти опосередковані впливом на рецептор інсуліноподібного фактора росту-1 (IGF-1R) [24, 25]. Наприклад, у моделі ішемії-реперфузії мозку системне введення продукту розпаду ГПП-1 – пептиду (9-36) сприяло функціональному відновленню післяінсультного пошкодження головного мозку, а дефіцит IGF-1R нівелював цей ефект [26]. In vitro пептид (9-36) зменшував зумовлене гіпоксією запалення астроцитів, але протизапальної дії не спостерігалося в астроцитах із генетичною делецією IGF-1R [26]. Ці дані вказують, що нейропротективні впливи арГПП-1, імовірно, реалізуються через IGF-1R [27].
Довгострокова підтримка цільових рівнів глікемії
Користь від застосування арГПП-1 не обмежується лише органопротекцією. У багатьох випадках важливо не тільки досягнути цільових рівнів глікемії, а й довгостроково їх підтримувати. Попри доступний нині широкий арсенал протидіабетичних засобів навіть у розвинених країнах приблизно половина пацієнтів із ЦД 2 типу не досягає доброго глікемічного контролю. Як свідчить проведене в США дослідження NHANES (National Health and Nutrition Examination Survey), частка пацієнтів, які досягли рівнів НbA1c <7% у період із 2007 по 2010 р. знизилася від 57,4 до 50,5% у період із 2015 по 2018 р. [28].
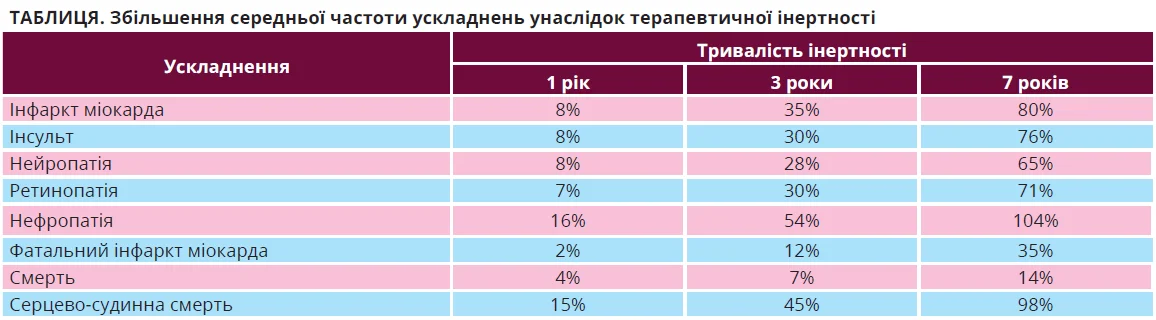
Чим загрожує терапевтична інертність і яку ціну платить за це пацієнт? Відповідь на це запитання нещодавно шукали вчені зі США (табл.). Встановлено, що 1 рік терапевтичної інерції збільшує кількість інфарктів міокарда, інсультів або нейропатії в середньому на 8%. Однак якщо інертність триватиме 3 роки, то частота вказаних ускладнень становитиме 35, 30 і 28% відповідно, а в 7-річній перспективі ці показники зростуть до 80, 76 та 65%. Тобто 7 років поганого лікування збільшують ризик ускладнень у 8-10 разів [29].
Інша група вчених із Чикаго вказує на особливу важливість досягнення цільових рівнів глікемії та їх підтримки відразу після встановлення діагнозу ЦД 2 типу. Зокрема, серед пацієнтів із вперше діагностованим діабетом рівень HbA1c ≥6,5% протягом першого року після встановлення діагнозу асоціювався з гіршими результатами щодо мікро- та макросудинних подій, а рівні HbA1c ≥7,0 – із вищим ризиком смерті порівняно з пацієнтами, які в цей період досягли рівнів HbA1c <6,5% [30].
У консенсусному звіті ADA/EASD (2022) для досягнення та підтримки цільових рівнів глікемії рекомендовано комбіновану терапію високої або дуже високої ефективності з низьким ризиком гіпоглікемії (рис. 6).

Цим вимогам цілком відповідає арГПП-1 ліраглутид. Дослідження GRADE (Glycemia Reduction Approaches in Diabetes: a Comparative Effectiveness Study), нещодавно проведене в США, порівнювало ефективність комбінації метформіну з чотирма часто вживаними глюкозознижувальними засобами щодо підтримки середнього рівня глікемії в цільовому діапазоні, запропонованому для зниження ризику довгострокових ускладнень (HbA1c <7%) з урахуванням впливу на ускладнення діабету та побічних ефектів. Серед препаратів було два пероральні засоби (похідне сульфонілсечовини глімепірид та іДПП-4 ситагліптин) і два ін’єкційні препарати (інсулін гларгін й арГПП-1 ліраглутид). Дослідження включало 5047 пацієнтів, яких рандомізували 1:1:1:1 у чотири вказані групи, середні показники віку учасників – 57 років, тривалості діабету – 4 роки, тривалості спостереження – 5 років, максимальна – понад 7 років. Найефективніше рівні HbA1c <7% підтримував ліраглутид: на 21 день довше, ніж інсулін гларгін, на 72 дні довше, ніж глімепірид, і на 185 днів довше, ніж ситагліптин, незалежно від статі, віку та раси. Лікування ліраглутидом і ситагліптином сприяло більшій втраті маси тіла, ніж лікування глімепіридом, тоді як пацієнти, котрі отримували інсулін гларгін, мали стабільну масу тіла. Лікування глімепіридом асоціювалося з вищим ризиком гіпоглікемії, як порівняти з іншими засобами. Відзначено відносну перевагу ліраглутиду порівняно з трьома іншими препаратами щодо зменшення частоти інфаркту міокарда, інсульту й інших серцево-судинних ускладнень [31].
Інтенсифікація гіпоглікемічної терапії – арГПП-1 чи інсулін?
Донедавна за відсутності ефекту від комбінованої пероральної терапії в пацієнтів із ЦД 2 типу для інтенсифікації контролю глікемії здебільшого рекомендували інсулін. На сьогодні концепцію змінено (рис. 7): у консенсусному звіті ADA/EASD (2022) призначення арГПП-1 рекомендується розглядати до початку інсулінотерапії [7]. Зауважимо, що при інтенсифікації терапії із застосуванням арГПП-1 рекомендовано припинення прийому іДПП-4 через перекриття механізмів дії [32].

Чим зумовлена така рекомендація? По-перше, на відміну від інсуліну гіпоглікемічний ефект арГПП-1 пояснюється декількома механізмами. Вплив на підшлункову залозу посилює глюкозозалежну секрецію інсуліну та пригнічує секрецію глюкагону. Вплив на шлунок зумовлює сповільнення його спорожнення, що разом зі впливом на печінку зменшує як глікемію натще, так і постпрандіальну гіперглікемію. Центральний вплив забезпечує зниження апетиту та втрату маси тіла. Крім того, ці молекули сприяють виживанню β-клітин шляхом посилення проліферації, новоутворення та стійкості до апоптозу [27, 33, 34].
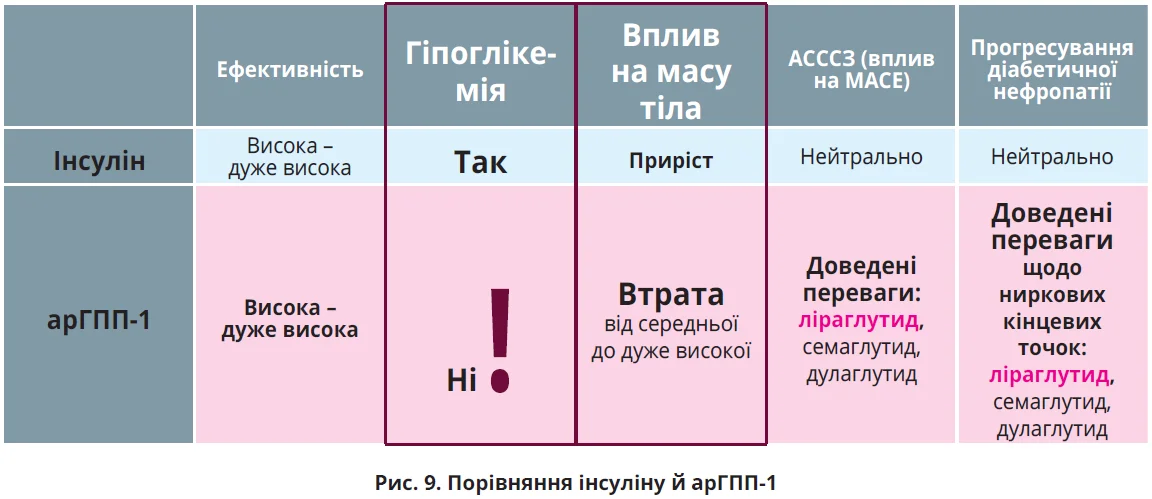
По-друге, на відміну від інсуліну, застосування котрого асоціюється зі збільшенням маси тіла, арГПП-1 сприяють її зниженню. Надмір маси тіла – один із найпотужніших чинників ризику ЦД 2 типу та встановлений чинник ризику ССЗ. Близько 90% пацієнтів із ЦД 2 типу мають надмірну масу тіла чи ожиріння [35]. Пацієнтам із ЦД 2 типу значно важче схуднути та підтримувати досягнуту втрату маси тіла. Це зумовлено найрізноманітнішими причинами: малорухливим способом життя, появою ускладнень (нейропатія, діабетична стопа, ССЗ), інсулінорезистентністю, зниженням глюкозурії, страхом гіпоглікемії з компенсаторним переїданням або підвищенням апетиту внаслідок гіпоглікемії, стресовим тягарем діабету та супутнім прийомом таких протидіабетичних засобів, як ТЗД і похідні сульфонілсечовини [36-39].
Контроль маси тіла є дуже вагомим компонентом цілісного персоніфікованого підходу до лікування ЦД 2 типу (рис. 8). Консенсусний звіт ADA/EASD (2022) наголошує, що вибір глюкозознижувальної терапії повинен мати подвійний вплив на глікемію й масу тіла високої та дуже високої ефективності [6].

Як свідчать нещодавні дослідження, аналог ГПП-1 ліраглутид має здатність підтримувати функцію β-клітин в осіб з ожирінням на ранніх стадіях ЦД 2 типу [40, 41]. У клінічному дослідженні, яке порівнювало впливи ліраглутиду та змін способу життя, група ліраглутиду досягла не лише схуднення, а й значного підвищення концентрації IGF-2 у плазмі крові. Зазначені зміни позитивно корелювали з β-індексом і супроводжувалися змінами розподілу жирової тканини зі зменшенням вісцерального жиру, який експресує рецептори до інсуліну й IGF-2 [41]. Ці результати вказують на новий сценарій дії ліраглутиду за участю адипоінсулярної осі, що пов’язує здатність до зниження маси тіла з тривалим захистом β-клітин від діабетогенних стресорів [27].
Окрім втрати маси тіла, ліраглутид продемонстрував інші позитивні впливи на серцево-судинні чинники ризику – здатність знижувати артеріальний тиск і позитивно впливати на ліпіди крові.
Нещодавній метааналіз, який включав 18 рандомізованих контрольованих досліджень за участю 7616 осіб у групі ліраглутиду та 6046 осіб у групі плацебо, вказує на значне зниження систолічного артеріального тиску під впливом ліраглутиду – на 3,18 мм рт. ст. (95% ДІ від -4,32 до -2,05; p<0,00001) без істотного впливу на діастолічний артеріальний тиск [42]. Встановлено також здатність ліраглутиду знижувати рівні загального холестерину, тригліцеридів і холестерину ліпопротеїнів низької щільності в сироватці крові [43, 44]. Можливими механізмами позитивного впливу ліраглутиду на ліпіди крові можуть бути покращення метаболізму ліпідів, зменшення накопичення ліпідів у печінці та посилення зворотного транспорту холестерину [44].
По-третє, на відміну від інсуліну застосування арГПП-1 не збільшує ризику розвитку гіпоглікемії [6]. Порівняльні характеристики інсуліну й арГПП-1 підсумовано на рисунку 9.
Врешті, як на початку, так і під час інтенсифікації інсулінотерапії потрібна всебічна освіта пацієнта щодо самоконтролю рівня глюкози крові, дієти, техніки ін’єкцій, самостійного титрування інсуліну, а також профілактики й адекватного лікування гіпоглікемії [6]. Застосування аналога ГПП-1 ліраглутиду (Віктоза®) є значно простішим порівняно з інсуліном. Препарат уводиться підшкірно в ділянку передньої черевної стінки, стегна чи плеча зручною шприц-ручкою з легко змінними одноразовими голками. Стійкість до дії ферментів ДПП-4 та нейтральної ендопептидази забезпечує тривалий період напіввиведення з плазми крові, що дає змогу вводити препарат 1 раз на добу в будь-який зручний час, незалежно від прийому їжі. Препарат Віктоза® легко дозувати (кожна шприц-ручка містить 3 мл розчину, що дає можливість увести 30 доз по 0,6 мг, 15 доз по 1,2 мг або 10 доз по 1,8 мг) і титрувати (початкова доза – 0,6 мг на добу, через 1-2 тижні – 1,2 мг на добу, за потреби через 1-2 тижні дозу можна збільшити до 1,8 мг на добу). Підбір дози не потребує постійного самомоніторингу рівня глюкози в крові. Особи похилого віку та пацієнти з легкими порушеннями функції нирок не потребують корекції доз.
Висновки
Цілісний особистісно-орієнтований підхід до лікування ЦД 2 типу передбачає чотири основні компоненти – кардіоренальний захист, контроль глікемії, маси тіла та чинників ризику ССЗ.
Усі компоненти однаково важливі та мають застосовуватися безперервно. Ліраглутид (Віктоза®) здатний забезпечити всі чотири компоненти. Згідно із сучасними настановами це препарат першого вибору в пацієнтів із високим і дуже високим ризиком ССЗ, встановленим АСССЗ та ХХН, який доцільно призначати якомога швидше незалежно від застосування метформіну. Терапевтична інертність збільшує ризик ускладнень і смерті, а раннє призначення комбінованої терапії дає змогу знизити ризики.
Для інтенсифікації терапії ліраглутид (Віктоза®) можна комбінувати з іншими протидіабетичними засобами, насамперед метформіном та/або іНЗКТГ-2. Ін’єкційна терапія арГПП-1 (препарат Віктоза®) рекомендується до початку інсулінотерапії, а також у комбінації з інсуліном, якщо цільові рівні НbA1c не досягнуто.
Література
- Onyango E.M., Onyango B.M. The rise of noncommunicable diseases in Kenya: an examination of the time trends and contribution of the changes in diet and physical inactivity. J. Epidemiol. Glob. Health. 2018; 8: 1-7. doi: 10.2991/j.jegh.2017.11.004.
- Khan M.A.B., Hashim M.J., King J.K., Govender R.D., Mustafa H., Al Kaabi J. Epidemiology of type 2 diabetes – global burden of disease and forecasted trends. J. Epidemiol. Glob. Health. 2020 Mar; 10 (1): 107-111. doi: 10.2991/jegh.k.191028.001.
- Bo A., Thomsen R.W., Nielsen J.S., Nicolaisen S.K., Beck-Nielsen H., Rungby J., et al. Early-onset type 2 diabetes: age gradient in clinical and behavioural risk factors in 5115 persons with newly diagnosed type 2 diabetes – results from the DD2 study. Diabetes Metab. Res. Rev. 2018; 34: e2968. doi: 10.1002/dmrr.2968.
- Alotaibi A., Perry L., Gholizadeh L., Al-Ganmi A. Incidence and prevalence rates of diabetes mellitus in Saudi Arabia: an overview. J. Epidemiol. Glob. Health. 2017; 7: 211-18. doi: 10.1016/j.jegh.2017.10.001.
- Al-Maskari F., El-Sadig M., Nagelkerke N. Assessment of the direct medical costs of diabetes mellitus and its complications in the United Arab Emirates. BMC Public Health. 2010; 10: 679. doi: 10.1186/1471-2458-10-679.
- Davies M.J., Aroda V.R., Collins B.S., Gabbay R.A., Green J., Maruthur N.M., Rosas S.E., Del Prato S., Mathieu C., Mingrone G., Rossing P., Tankova T., Tsapas A., Buse J.B.; Management of Hyperglycemia in Type 2 Diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022 Nov 1; 45 (11): 2753-2786. doi: 10.2337/dci22-0034.
- Davies M.J., D’Alessio D.A., Fradkin J., Kernan W.N., Mathieu C., Mingrone G., Rossing P., Tsapas A., Wexler D.J., Buse J.B. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018 Dec; 61 (12): 2461-2498. doi: 10.1007/s00125-018-4729-5. Erratum in: Diabetologia. 2019 May; 62 (5): 873.
- Buse J.B., Wexler D.J., Tsapas A., Rossing P., Mingrone G., Mathieu C., D’Alessio D.A., Davies M.J. 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2020 Feb; 63 (2): 221-228. doi: 10.1007/s00125-019-05039-w. Erratum in: Diabetologia. 2020 Aug; 63 (8): 1667.
- Carlsson S., Andersson T., Talbäck M., et al. Mortality rates and cardiovascular disease burden in type 2 diabetes by occupation, results from all Swedish employees in 2002-2015. Cardiovasc. Diabetol. 2021; 20: 129. doi: 10.1186/s12933-021-01320-8.
- Mosenzon O., Alguwaihes A., Leon J.L.A., et al.; CAPTURE Study Investigators. CAPTURE: a multinational, cross-sectional study of cardiovascular disease prevalence in adults with type 2 diabetes across 13 countries. Cardiovasc. Diabetol. 2021 Jul 27; 20 (1): 154. doi: 10.1186/s12933-021-01344-0.
- Chu L., Fuller M., Jervis K., Ciaccia A., Abitbol A. Prevalence of chronic kidney disease in type 2 diabetes: the Canadian REgistry of Chronic Kidney Disease in Diabetes Outcomes (CREDO) study. Clin. Ther. 2021 Sep; 43 (9): 1558-1573. doi: 10.1016/j.clinthera.2021.07.015. Epub 2021.
- Ferrannini G., Norhammar A., Gyberg V., Mellbin L., Rydén L. Is coronary artery disease inevitable in type 2 diabetes? From a glucocentric to a holistic view on patient management. Diabetes Care. 2020 Sep 1; 43 (9): 2001-2009. doi: 10.2337/dci20-0002.
- Drucker D.J. The cardiovascular biology of glucagon-like peptide-1. Cell Metab. 2016 Jul 12; 24 (1): 15-30. doi: 10.1016/j.cmet.2016.06.009.
- Muskiet M.H.A., Tonneijck L., Smits M.M., van Baar M.J.B., Kramer M.H.H., Hoorn E.J., Joles J.A., van Raalte D.H. GLP-1 and the kidney: from physiology to pharmacology and outcomes in diabetes. Nat. Rev. Nephrol. 2017 Oct; 13 (10): 605-628. doi: 10.1038/nrneph.2017.123.
- Sattar N., Lee M.M.Y., Kristensen S.L., Branch K.R.H., Del Prato S., Khurmi N.S., Lam C.S.P., Lopes R.D., McMurray J.J.V., Pratley R.E., Rosenstock J., Gerstein H.C. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials. Lancet Diabetes Endocrinol. 2021 Oct; 9 (10): 653-662. doi: 10.1016/S2213-8587(21)00203-5.
- Cosentino F., Grant P.J., Aboyans V., Bailey C.J., Ceriello A., Delgado V., Federici M., Filippatos G., Grobbee D.E., Hansen T.B., Huikuri H.V., Johansson I., Jüni P., Lettino M., Marx N., Mellbin L.G., Östgren C.J., Rocca B., Roffi M., Sattar N., Seferović P.M., Sousa-Uva M., Valensi P., Wheeler D.C.; ESC Scientific Document Group. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur. Heart J. 2020 Jan 7; 41 (2): 255-323. doi: 10.1093/eurheartj/ehz486.
- Marso S.P., Daniels G.H., Brown-Frandsen K., Kristensen P., Mann J.F., Nauck M.A., Nissen S.E., Pocock S., Poulter N.R., Ravn L.S., Steinberg W.M., Stockner M., Zinman B., Bergenstal R.M., Buse J.B.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and cardiovascular outcomes in type 2 diabetes. N. Engl. J. Med. 2016; 375: 311322.
- Mann J.F.E., Orsted D.D., Brown-Frandsen K., Marso S.P., Poulter N.R., Rasmussen S., Tornoe K., Zinman B., Buse J.B.; LEADER Steering Committee and Investigators. Liraglutide and renal outcomes in type 2 diabetes. N. Engl. J. Med. 2017; 377: 839848.
- Kleindorfer D.O., Towfighi A., Chaturvedi S., Cockroft K.M., Gutierrez J., Lombardi-Hill D., Kamel H., Kernan W.N., Kittner S.J., Leira E.C., Lennon O., Meschia J.F., Nguyen T.N., Pollak P.M., Santangeli P., Sharrief A.Z., Smith S.C. Jr., Turan T.N., Williams L.S. 2021 Guideline for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline from the American Heart Association / American Stroke Association. Stroke. 2021 Jul; 52 (7): e364-e467. doi: 10.1161/STR.0000000000000375.
- Perry T., Haughey N.J., Mattson M.P., Egan J.M., Greig N.H. Protection and reversal of excitotoxic neuronal damage by glucagon-like peptide-1 and exendin-4. J. Pharmacol. Exp. Ther. 2002; 302 (3): 881-8. doi: 10.1124/jpet.102.037481.
- Perry T., Lahiri D.K., Chen D., Zhou J., Shaw K.T.Y., Egan J.M., et al.. A novel neurotrophic property of glucagon-like peptide 1: a promoter of nerve growth factor-mediated differentiation in PC12 cells. J. Pharmacol. Exp. Ther. 2002; 300 (3): 958-66. doi: 10.1124/jpet.300.3.958.
- Bassil F., Canron M.-H., Vital A., Bezard E., Li Y., Greig N.H., et al. Insulin resistance and exendin-4 treatment for multiple system atrophy. Brain. 2017; 140 (5): 1420-36. doi: 10.1093/brain/awx044.
- Hunter K., Hölscher C. Drugs developed to treat diabetes, liraglutide and lixisenatide, cross the blood brain barrier and enhance neurogenesis. BMC Neurosci. 2012; 13: 33. doi: 10.1186/1471-2202-13-33.
- Pellecchia M.T., Pivonello R., Longo K., Manfredi M., Tessitore A., Amboni M., et al. Multiple system atrophy is associated with changes in peripheral insulin-like growth factor system. Mov. Disord. 2010; 25 (15): 2621-6. doi: 10.1002/mds.23320.
- Ubhi K., Rockenstein E., Mante M., Inglis C., Adame A., Patrick C., et al. Neurodegeneration in a transgenic mouse model of multiple system atrophy is associated with altered expression of oligodendroglial-derived neurotrophic factors. J. Neurosci. 2010; 30 (18): 6236-46. doi: 10.1523/JNEUROSCI.0567-10.2010.
- Huang J., Liu Y., Cheng L., Li J., Zhang T., Zhao G., et al. Glucagon-like peptide-1 cleavage product GLP-1 (9-36) reduces neuroinflammation from stroke via the activation of insulin-like growth factor 1 receptor in astrocytes. Eur. J. Pharmacol. 2020; 887: 173581. doi: 10.1016/j.ejphar.2020.173581.
- Cignarelli A., Genchi V.A., Le Grazie G., Caruso I., Marrano N., Biondi G., D’Oria R., Sorice G.P., Natalicchio A., Perrini S., Laviola L., Giorgino F. Mini review: effect of GLP-1 receptor agonists and SGLT-2 inhibitors on the growth hormone / IGF axis. Front. Endocrinol. (Lausanne). 2022 Feb 21; 13: 846903. doi: 10.3389/fendo.2022.846903.
- Fang M., Wang D., Coresh J., Selvin E. Trends in diabetes treatment and control in U.S. adults, 1999-2018. N. Engl. J. Med. 2021 Jun 10; 384 (23): 2219-2228. doi: 10.1056/NEJMsa2032271.
- Correa M.F., Li Y., Kum H.C., Lawley M.A. Assessing the effect of clinical inertia on diabetes outcomes: a modeling approach. J. Gen. Intern. Med. 2019 Mar; 34 (3): 372-378. doi: 10.1007/s11606-018-4773-3. Epub 2018 Dec 18.
- Laiteerapong N., Ham S.A., Gao Y., Moffet H.H., Liu J.Y., Huang E.S., Karter A.J. The legacy effect in type 2 diabetes: impact of early glycemic control on future complications (The Diabetes & Aging Study). Diabetes Care. 2019 Mar; 42 (3): 416-426. doi: 10.2337/dc17-1144. Epub 2018 Aug 13.
- Nathan D.M., et al. Results of the Glycemia Reduction Approaches in Diabetes – a Comparative Effectiveness (GRADE) study. American Diabetes Association (ADA) 81st Scientific Sessions Meeting 2021. Oral Presentation. Available at: https://professional.diabetes.org/scientific-sessions.
- American Diabetes Association. Pharmacologic approaches to glycemic treatment: Standards of Medical Care in Diabetes – 2022. Diabetes Care. 2022; 45 (Suppl. 1): S125-S143.
- Marrano N., Biondi G., Cignarelli A., Perrini S., Laviola L., Giorgino F., et al. Functional loss of pancreatic islets in type 2 diabetes: how can we halt it? Metab. Clin. Exp. 2020; 110: 154304. doi: 10.1016/J.METABOL.2020.154304.
- Tamura K., Minami K., Kudo M., Iemoto K., Takahashi H., Seino S. Liraglutide improves pancreatic beta cell mass and function in alloxan-induced diabetic mice. PLoS One. 2015; 10 (5): e0126003. doi: 10.1371/journal.pone.0126003.
- Nianogo R.A., Arah O.A. Forecasting obesity and type 2 diabetes incidence and burden: the ViLA-obesity simulation model. Front. Public Health. 2022 Apr 5; 10: 818816. doi: 10.3389/fpubh.2022.818816.
- Pi-Sunyer F.X. Weight loss in type 2 diabetic patients. Diabetes Care. 2005 Jun; 28 (6): 1526-7. doi: 10.2337/diacare.28.6.1526. PMID: 15920086.
- Russell-Jones D., Khan R. Insulin-associated weight gain in diabetes – causes, effects and coping strategies. Diabetes Obes. Metab. 2007 Nov; 9 (6): 799-812. doi: 10.1111/j.1463-1326.2006.00686.x.
- Kenkre J., Tan T., Bloom S. Treating the obese diabetic. Expert Rev. Clin. Pharmacol. 2013 Mar; 6 (2): 171-83. doi: 10.1586/ecp.13.5.
- Van Gaal L., Scheen A. Weight management in type 2 diabetes: current and emerging approaches to treatment. Diabetes Care. 2015 Jun; 38 (6): 1161-72. doi: 10.2337/dc14-1630.
- Ferrannini E., Camastra S., Gastaldelli A., Maria Sironi A., Natali A., Muscelli E., et al. Beta-cell function in obesity: effects of weight loss. Diabetes. 2004; 53 (Suppl. 3): S26-33. doi: 10.2337/diabetes.53.suppl_3.s26.
- Santilli F., Simeone P.G., Guagnano M.T., Leo M., Maccarone M.T., Di Castelnuovo A., et al. Effects of liraglutide on weight loss, fat distribution, and β-cell function in obese subjects with prediabetes or early type 2 diabetes. Diabetes Care. 2017; 40 (11): 1556-64. doi: 10.2337/dc17-0589.
- Zhao X., Huang K., Zheng M., Duan J. Effect of liraglutide on blood pressure: a meta-analysis of liraglutide randomized controlled trials. BMC Endocr. Disord. 2019 Jan 7;
19 (1): 4. doi: 10.1186/s12902-018-0332-5. - Aoki K., Kamiyama H., Takihata M., Taguri M., Shibata E., Shinoda K., Yoshii T., Nakajima S., Terauchi Y. Effect of liraglutide on lipids in patients with type 2 diabetes:
a pilot study. Endocr. J. 2020 Sep 28; 67 (9): 957-962. doi: 10.1507/endocrj.EJ19-0464. - Wu Y.R., Shi X.Y., Ma C.Y., et al. Liraglutide improves lipid metabolism by enhancing cholesterol efflux associated with ABCA1 and ERK1/2 pathway. Cardiovasc. Diabetol. 2019; 18: 146. doi: 10.1186/s12933-019-0954-6.
