Хвороба Грейвса: рухаючись уперед
Переклала й адаптувала канд. мед. наук Тетяна Можина
Хвороба Грейвса (ХГ) – це автоімунне захворювання, котре розвивається внаслідок того, що автоантитіла до рецепторів тиреотропіну (АТ-рТТГ) стимулюють рецептори тиреотропного гормону (ТТГ), які розташовані в щитоподібній залозі (ЩЗ). Взаємодія антитіл із рецептором призводить до надмірної секреції гормонів ЩЗ (гіпертиреоз). ХГ є найпоширенішою причиною гіпертиреозу в дітей і підлітків; зареєстровані показники захворюваності на ХГ у Великій Британії становлять 0,9 випадку на 100 тис. осіб віком менш як 15 років [1]. Поширеність ХГ у дитячій популяції в усьому світі має тенденцію до зростання; всесвітня захворюваність коливається в межах 1,5-6,5 випадку на 100 тис. осіб [2-4]. ХГ може виникнути на будь-якому етапі дитинства, хоча з віком частота захворювання зростає.
Традиційні варіанти лікування, що передбачають призначення антитиреоїдних препаратів (АТП), радіоактивного йоду (РЙ), проведення хірургічного втручання, майже не змінювалися протягом багатьох років, незважаючи на те що в більшості молодих пацієнтів після курсу АТП захворювання рецидивує, а хворі потребують довічної замісної терапії гормонами ЩЗ після радикального лікування (РЙ, оперативне втручання). На перший погляд, картина видається досить похмурою, але нещодавно досягнуто значного прогресу в розумінні найкращого лікування молодих пацієнтів із ХГ, а попит на сучасні терапевтичні стратегії сприяє розробленню імуномодулювальних способів лікування.
Цей огляд зосереджено на статтях, опублікованих протягом останніх 10 років, включаючи систематичні огляди, які містять додаткову інформацію щодо лікування та наслідків педіатричної ХГ.
Лікування неонатального тиреотоксикозу в цьому огляді не розглядається.
Діагностика ХГ
Клінічна картина
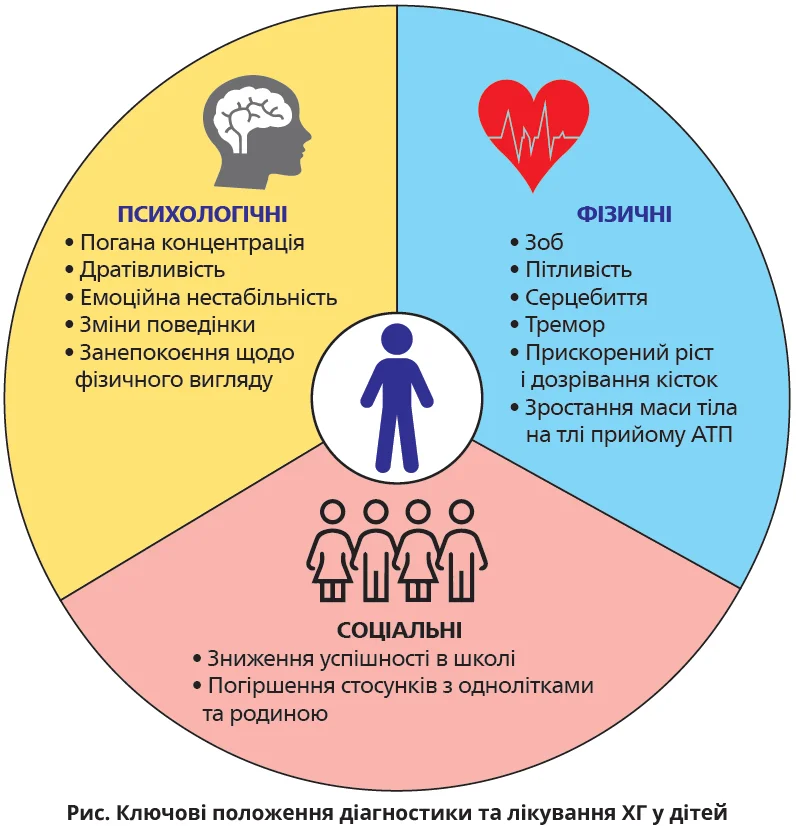
Фізичні та психологічні прояви ХГ є наслідками гіпертиреозу та включають зоб, пітливість, серцебиття, тремор, дратівливість, зміну поведінки, емоційну лабільність, низьку концентрацію та прискорений ріст і дозрівання кісток [5]. Екстратиреоїдні прояви у вигляді ураження очей (офтальмопатія Грейвса; ОГ) та шкіри (претибіальна мікседема) можуть виникати в дітей, хоча частіше спостерігаються в дорослих. Важливо мати на увазі соціальні або психологічні проблеми (рис.). Латентність зазначених симптомів одночасно з відносною рідкістю педіатричної форми ХГ призводить до помилкового ставлення до цього стану як до первинного психологічного розладу або кардіоваскулярного захворювання, патології шлунково-кишкового тракту. Отже, існує ймовірність пізньої діагностики, що може негативно вплинути на розвиток дитини, яка проходить обстеження.
Біохімічні/імунологічні дані
Діагноз ХГ потребує оцінки як біохімічних, так й імунологічних параметрів. Функціональні показники ЩЗ характеризуються пригніченням ТТГ, підвищенням концентрації вільного трийодтироніну (Т3вн) ± вільного тироксину (Т4вн). Підвищений рівень Т3вн є чутливішим маркером ХГ, ніж збільшений уміст Т4вн [5]. Високий титр АТ-рТТГ є ключовим компонентом для підтвердження діагнозу ХГ. Існують два типи аналізів для вимірювання АТ-рТТГ: тест на ТТГ-зв’язаний інгібувальний імуноглобулін, який визначає АТ-рТТГ (так звані рТТГ-специфічні антитіла) незалежно від того, чи є вони стимулювальними або блокувальними, та тест на тиреоїдостимулювальний імуноглобулін, який визначає тільки стимулювальні антитіла.
Потрібно визначити як АТ-рТТГ, так і антитіла до тиреопероксидази (ТПО), бо при нормативному вмісті АТ-рТТГ і підвищеному рівні ТПО явища тиреотоксикозу відображають транзиторне вивільнення надлишку тиреоїдних гормонів із ЩЗ, тобто основним патологічним процесом є деструкція залози, а не її стимуляція. Такий стан (транзиторний тиреотоксикоз) інколи називають хашитоксикозом. Якщо АТ-рТТГ й антитіла до ТПО не визначаються, то найімовірнішою причиною є неавтоімунна патологія, як-от вузловий зоб або синдром Мак-К‘юна – Олбрайта.
Візуалізаційні методи дослідження
У більшості випадків для діагностики ХГ достатньо даних біохімічних та імунологічних досліджень. Візуалізаційні методи дослідження доцільно застосовувати тоді, коли тиреоїдні антитіла не визначаються чи під час пальпації ЩЗ виявлено вузол або вузлові утворення. З метою зменшення радіаційного опромінення віддають перевагу ультразвуковому дослідженню (УЗД), а не сцинтиграфії [6]. Під час УЗД ЩЗ із доплерівською оцінкою кровотоку виявляють збільшену, гіперехогенну, гіперваскуляризовану залозу, тоді як сцинтиграфія констатує рівномірне поглинання ізотопу та дифузне збільшення обох часток ЩЗ. Візуалізаційні методи також допомагають ідентифікувати неавтоімунні причини гіпертиреозу, наприклад окремий «гарячий» вузол.
Чому розвивається ХГ?
Втрата імунної самотолерантності до рТТГ є центральною ланкою патогенезу ХГ. Механізми, які призводять до втрати толерантності, є результатом складної взаємодії впливу навколишнього середовища та генетичної/епігенетичної сприйнятливості. Нещодавно отримано дані щодо залучення мікробіому в зазначені процеси [7].
Чинники навколишнього середовища
Припускають, що тенденція до зростання захворюваності на ХГ, як й інших автоімунних захворювань, пов’язана зі впливом навколишнього середовища, наприклад інфекцій і дієти [4]. Ключовими чинниками навколишнього середовища, асоційованими з ХГ, є бактеріальні/вірусні інфекції, надмірне споживання йоду та селену, дефіцит вітаміну D, паління та стрес [8]. Деякі з цих чинників, як-от надлишок йоду, стимулюють автоімунітет ЩЗ, тоді як інші індукують його. Вплив навколишнього середовища й інфекцій гіпотетично може індукувати автоімунітет ЩЗ шляхом «молекулярної мімікрії» (перехресна реактивність між мікробними агентами або екзогенними агентами та рТТГ) або «активації в присутності свідка» (неантигеноспецифічна активація автореактивних лімфоцитів), що перетворює захисну імунну відповідь на автоімунну [9]. Вважають, що чинники навколишнього середовища запускають автоімунні реакції в ЩЗ завдяки епігенетичній дисрегуляції, яка модулює експресію генів у сприятливих осіб [10].
Генетичні чинники
Дослідження, проведені за участю цілих родин, свідчать, що майже 63% хворих мають схильність до ХГ через наявність певних генетичних чинників [11]. Нині з розвитком ХГ пов’язують декілька генетичних локусів, включаючи гени, асоційовані з імунною системою (MHC, CTLA4, PTPN22, CD40, FCRL3, PD-1, BAFF), та тиреоїдоспецифічні гени (гени рТТГ, тиреоглобуліну) [12, 13]. З’являється дедалі більше доказів впливу некодувальних генетичних варіантів на розвиток автоімунної патології, включаючи автоімунітет ЩЗ [14]. Дійсно, лейкоцитарний антигенний комплекс людини Р5, який кодує довгу некодувальну РНК, незалежно асоційований зі сприйнятливістю до ХГ, розвитку захворювання в молодому віці [15]. Інші некодувальні РНК, як-от мікроРНК, також спричиняють розвиток ХГ; передбачається їх потенційне використання як діагностичних і прогностичних біомаркерів [16].
Мікробіом
Нещодавно опубліковані дослідження припускають, що інтестинальний дисбіоз (дисбаланс мікроорганізмів кишківника), спровокований дієтою, палінням, стресом, застосуванням антибіотиків, впливом токсинів, спричиняє продукцію цитокінів та інших метаболітів, що призводить до порушення імунного гомеостазу та втрати толерантності до ХГ. У невеликому дослідженні, в якому взяли участь дорослі хворі на ХГ, зафіксовано зниження ризику рецидиву гіпертиреозу в осіб, що отримували пробіотик протягом курсу АТП [18].
Природний перебіг ХГ
Дослідження в дорослих продемонстрували, що патогенні АТ-рТТГ можуть з’являтися та зникати без видимого зв’язку з дисфункцією ЩЗ або клінічним фенотипом [19]. Спонтанна ремісія ХГ спостерігається в дорослих, але, ймовірно, менш притаманна дітям. Дітям із підтвердженою ХГ потрібно призначати відповідне лікування з метою запобігання розвитку таких серйозних ускладнень, як тиреоїдний шторм або небезпечні для життя аритмії. Гіпотиреоз розвивається в деяких пацієнтів із ХГ у довгостроковій перспективі, що, ймовірно, пов’язано з наявністю деструктивних антитіл до ТПО через коморбідну хворобу Хашимото.
Даних щодо перебігу ХГ у молодих пацієнтів бракує, але чверть дорослих пацієнтів, які досягли ремісії після АТП, потребують замісної терапії тироксином [20].
Лікування
Ключові положення щодо лікування молодих хворих на ХГ наведено в таблиці 1. Загальний підхід терапії передбачає призначення курсу АТП. Якщо його проведення неможливо або застосування не сприяє досягненню ремісії, потрібно розглянути доцільність радикального лікування (РЙ, тиреоїдектомія). Зрештою, провідними цілями лікування ХГ є відновлення еутиреозу в короткі терміни та збереження ендогенної функції ЩЗ у довготривалій перспективі без потреби застосування медикаментів. На жаль, наявні наразі методи лікування не роблять перелічені цілі лікування реалістичними для багатьох дітей.


Ініціальне лікування
Не всі тиреотоксикози або навіть автоімунні захворювання ЩЗ з асоційованим тиреотоксикозом являють собою ХГ. Тому важливо встановити основний патогенетичний механізм на ранній стадії захворювання. Якщо АТ-рТТГ підвищений, то тиреотоксикоз спричинений ХГ і навряд можна очікувати ремісію найближчим часом. Відсутність АТ-рТТГ за наявності антитіл до ТПО свідчить про виникнення тиреоїдиту, який може мати тенденцію до самообмеження. Отже, доцільним є моніторування функціональної активності ЩЗ протягом декількох тижнів перед корекцією АТП, якщо дитина не відчуває значного погіршення самопочуття з огляду на низький титр АТ-рТТГ [6]. Якщо дитина страждає на ХГ, то потрібно розпочати прийом АТП із метою запобігання негативному впливу на фізичний і психологічний стани на тлі тривалого надлишку гормонів ЩЗ.
Діти з ознаками ОГ мають бути оглянуті офтальмологом, бажано в комбінованій (офтальмологічна/терапевтична) очній клініці, яка спеціалізується на хворобах ЩЗ [6].
ББ
ББ (як-от пропранолол, атенолол) потрібно призначати пацієнтам з ознаками помірного або тяжкого надлишку тиреоїдних гормонів. Прийом ББ може бути завершений, якщо біохімічно підтверджено еутиреоз [6]. ББ протипоказані пацієнтам із бронхіальною астмою.
Тиреоїдний шторм
Тиреоїдний шторм (гострий тиреотоксичний криз) може виникнути в осіб із недіагностованою або погано контрольованою ХГ, але він дуже рідко виникає після застосування РЙ. ББ показані в разі тиреоїдного шторму; вони призначаються одночасно з АТП, глюкокортикоїдами, йодом.
АТП
Для лікування ХГ у дітей використовуються КБЗ або його активний метаболіт метимазол. КБЗ не потрібно приймати частіше ніж 1 раз на добу. ПТУ використовувався раніше, але нині його призначення дітям слід уникати через ризик розвитку печінкової недостатності [21].
Як гіпертиреоз, так і прийом АТП може асоціюватися зі зниженням умісту лейкоцитів і дисфункцією печінки. Тому перед початком терапії АТП потрібно перевірити клінічний аналіз крові, функціональні проби печінки [6].
Побічні реакції АТП
Майже у 20% дітей, які приймають АТП, розвинеться щонайменше одна побічна реакція (ПР) [23]. Діти молодшого віку мають більший ризик, при цьому ПР реєструють у 71% дітей препубертатного віку [24]. Найчастіше ПР проявляються ураженням шкіри, які можуть зникати самостійно або на тлі прийому антигістамінних засобів [25]. Досить рідко виникає печінкова дисфункція, котра має холестатичний характер і, на відміну від ПТУ, зникає при скасуванні терапії [26]. Більшість ПР виникає протягом перших 3 місяців лікування [27], хоча відома надзвичайно рідкісна, проте потенційно фатальна ПР – агранулоцитоз (абсолютна кількість нейтрофілів <0,5×109/л), який може виникнути через багато років [28].
Призначаючи АТП, слід повідомити дитину та її родину, що потрібно зупинити прийом ліків у разі виникнення болю в горлі або лихоманки до отримання результатів клінічного аналізу крові. За умови розвитку агранулоцитозу слід розпочати альтернативне лікування. Відносну нейтропенію (0,5-1,5×109/л) потрібно ретельно моніторувати 1-2 рази протягом тижня [6].
Титрування дози або «блокування та заміна»?
Існує дві основні стратегії призначення АТП. Метод титрування дози може бути використаний, коли доза АТП титрується відповідно до концентрації циркулювального ТТГ. Використовується також підхід «блокування та заміна», який передбачає повну блокаду синтезу гормонів ЩЗ шляхом екзогенного введення тироксину. Обидва підходи використовуються у Великій Британії, незважаючи на дані рандомізованого британського дослідження, котре продемонструвало відсутність вірогідної різниці між ними з погляду біохімічної стабільності [29]. Є дані, які демонструють, що високі дози АТП, котрі використовуються при підході «блокування та заміна», асоційовані з високою ймовірністю розвитку ПР; нещодавні рекомендації Європейської тиреоїдної асоціації (ETA) пропонують віддавати перевагу підходу «титрування дози» [6]. Можливо, що простий режим титрування дози (проводиться за допомогою одного, а не двох препаратів) сприяє швидшому нівелюванню гіпертиреоїдного стану [29]. Використання стратегії «блокування та заміна» є можливим у пацієнтів, які, наприклад, неодноразово мали біохімічні рецидиви під час прийому низької дози АТП.
Моніторинг відповіді на прийом АТП
Під час ініціального періоду лікування концентрацію гормонів ЩЗ потрібно перевіряти що 4 тижні до нормалізації вмісту тиреоїдних гормонів, після чого частоту моніторингу можна зменшити та проводити перевірку що 2-3 місяці [6]. Рівень ТТГ може залишатися низьким протягом значного періоду після початку лікування АТП; майже одна третина пацієнтів має низьку концентрацію ТТГ протягом 6 місяців після підтвердження діагнозу [29].
Ці дані підкреслюють важливість визначення вмісту тиреоїдних гормонів (Т3вн/Т4вн) для прийняття рішення щодо корекції дозування АТП протягом перших місяців. Після одного місяця лікування вміст Т4вн нормалізується майже в 50% пацієнтів, але протягом наступних 6 місяців він підвищується в 90% осіб. Діти молодшого та препубертатного віку часто страждають на тяжкий тиреотоксикоз і потребують більше часу для нормалізації вмісту тиреоїдних гормонів, аніж старші діти [24]. Особи перипубертатного віку можуть мати ізольоване підвищення Т3 (Т3-токсикоз), що підкреслює важливість вимірювання Т3вн [24]. Надмірне зростання маси тіла може відбуватися навіть на тлі відновлення еутиреозу [29]. Родину хворого слід повідомити про це та надати відповідні поради.
Тривалість лікування
Загальний рівень ремісії після 2 років прийому АТП у маленьких дітей становить 20-30% [30]. Нижчеперелічені клінічні та біохімічні чинники асоційовані з високим ризиком рецидиву (табл. 2). Ці чинники слід обговорити під час родинної консультації щодо ймовірності розвитку ремісії після завершення прийому АТП. Тривалість лікування АТП є одним із небагатьох модифікованих чинників ризику, який можна змінювати; нещодавній систематичний огляд наводить докази того, що тривале лікування збільшує ймовірність ремісії (табл. 3) [30].


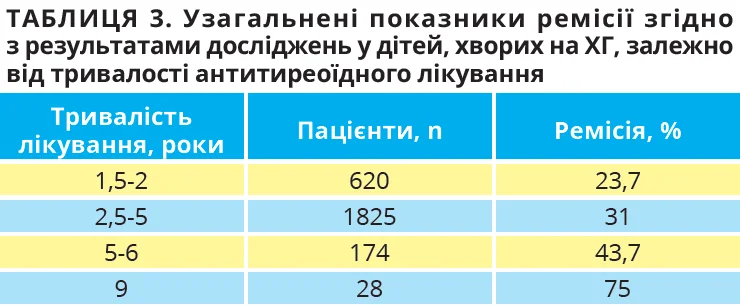
ETA рекомендує проводити лікування протягом щонайменше 3 років із метою мінімізації ймовірності ремісії, хоча зв’язок між тривалістю та наслідками не є високодостовірним. При розгляді питання доцільності завершення терапії АТП необхідно визначити рівень АТ-рТТГ: якщо він підвищений, імовірність ремісії дуже низка [31]. Рецидив захворювання зазвичай розвивається протягом перших 12 місяців після припинення терапії, тому скасування АТП слід уникати в ті періоди, коли рецидив буде особливо руйнівним, зокрема під час академічних іспитів. Одним із сигналів, які можуть вказувати на доцільність призначення пробної терапії АТП, є незмінений титр АТ-рТТГ у пацієнта з підвищеним умістом ТТГ на тлі прийому низьких доз АТП.
Радикальне лікування
У значної кількості молодих пацієнтів розвивається рецидив ХГ. У цьому випадку або в разі, коли АТП не можуть бути призначені чи погано переносяться, показано радикальне лікування. Метою терапії РЙ або тотальної тиреоїдектомії є абляція чи видалення функціональної тканини ЩЗ; у таких випадках потрібна довічна замісна терапія левотироксином.
Терапія радіоактивним йодом
РЙ призначається тільки перорально у вигляді капсул або розчину. Він швидко проникає в тканину ЩЗ із радіоактивним випромінюванням, яке руйнує клітини ЩЗ протягом декількох тижнів і призводить до розвитку гіпотиреозу.
Європейські рекомендації передбачають використання абляційних доз РЙ у дітей із метою відносно швидкого досягнення гіпотиреозу та мінімізації ризику рецидиву в майбутньому [6]. Призначення РЙ слід уникати дітям дуже маленького віку (<5 років) через великий теоретичний ризик подальшого розвитку злоякісної пухлини. Проте дані обсерваційних досліджень із 36-річним періодом спостереження за дітьми віком 3-19 років свідчать, що РЙ є безпечною й ефективною терапією [32, 33]. Проведення досліджень, які вивчають ризик розвитку злоякісних новоутворень після проведення терапії РЙ, ускладняється тим, що гіпертиреоз здатний збільшувати ризик солідних злоякісних новоутворень [34].
Дослідження в дорослій популяції продемонстрували, що РЙ може спровокувати розвиток або загострення наявної ОГ, тому цей метод лікування не слід застосовувати в дітей з активною ОГ [35]. Інколи може знадобитися повторна терапія РЙ, наприклад, якщо не виконана повна абляція ЩЗ, особливо пацієнтам із великим зобом (у таких випадках доречнішою є тиреоїдектомія).
Тиреоїдектомія
Тиреоїдектомія може бути доцільнішою, ніж призначення РЙ, у дітей молодшого віку за наявності великого зоба чи протипоказань до проведення терапії РЙ. Рівень смертності серед дітей, які перенесли тиреоїдектомію, є дуже низьким (<0,1%), але невелика кількість пацієнтів матимуть такі ускладнення, як гіпокальціємія (22%), рецидивне ураження гортанного нерва (5,4%) [36]. Ці патології зазвичай транзиторні, але можуть бути постійними [36]. Перед проведенням хірургічного втручання потрібно призначати достатні дози вітаміну D задля зменшення ризику післяопераційної транзиторної гіпокальціємії.
Тиреоїдектомія, виконана операторами з великим досвідом, має кращі наслідки з меншим рівнем післяопераційної смертності, тому тиреоїдектомію в дітей варто проводити у великих спеціалізованих центрах [6].
Література
Lane L.C., Wood C.L., Cheetham T. Graves’ disease: moving forwards. Archives of Disease in Childhood. Published online first: 2022, July 13. doi: 10.1136/archdischild-2022-323905.
