Конгрес Американської діабетологічної асоціації (2022): інновації в усіх напрямах діабетології
Підготувала канд. мед. наук Лариса Стрільчук
3-7 червня в Новому Орлеані відбувся 82-й науковий конгрес Американської діабетологічної асоціації – без перебільшень, головний захід світової діабетології. Формат заходу був гібридним, що дало охочим змогу взяти участь як очно, так і дистанційно. Доповідачі представили аудиторії близько 900 презентацій і понад 1200 постерних доповідей на тему інновацій і важливих відкриттів у галузі діагностики, профілактики та лікування цукрового діабету (ЦД), у тому числі результати нових рандомізованих клінічних досліджень (SURMOUNT-1 – щодо лікування ожиріння за допомогою тирзепатиду та CREATE TRIAL – на тему застосування автоматизованої доставки інсуліну за допомогою сенсорної помпи при ЦД 1 типу). Крім того, було проведено окремий брифінг із питань ЦД та коронавірусної хвороби (COVID-19). Як висловився головний науковець Американскої діабетологічної асоціації Robert Gabbay, представлені на конгресі теми охопили ключові питання діабетології, важливі для всіх учасників процесу медичної допомоги при ЦД. Організатори сподіваються, що наукові досягнення, представлені цьогоріч, зможуть трансформувати цю галузь медицини та покращити наслідки лікування для пацієнтів. У матеріалі представлено вибрані резюме доповідей цьогорічного конгресу.
Нові глюкозознижувальні препарати та ризик деменції: метааналіз досліджень кардіоваскулярних наслідків лікування (Tang H., Niu S., Brown J.D., et al.)
Наявні обсерваційні дослідження продемонстрували суперечливі результати застосування нових глюкозознижувальних препаратів (інгібіторів дипептидилпептидази-4 – ІДПП-4, агоністів рецепторів глюкагоноподібного пептиду-1 – арГПП-1 та інгібіторів натрій-глюкозного котранспортера-2 – ІНГКТ-2) щодо когнітивної функції та розвитку деменції, а окремі рандомізовані контрольовані дослідження (РКД) мають недостатню силу для вивчення цього впливу. Тому метою авторів стало визначення впливу нових глюкозознижувальних препаратів на ризик деменції за допомогою проведення метааналізу наявних РКД (n=21).
З’ясувалося, що ні ІДПП-4, ні арГПП-1, ні ІНГКТ-2 не мали достовірного зв’язку з розвитком деменції всіх етіологій. Однак для судинної деменції застосування ІНГКТ-2 асоціювалося з достовірним зниженням ризику порівняно з плацебо, на відміну від ІДПП-4 й арГПП-1, які такого ефекту не продемонстрували.
Висновок: ІНГКТ-2 можуть мати сприятливий вплив на ризик деменції судинного походження, але для підтвердження цих даних потрібні подальші РКД та/або порівняльні дослідження ефективності різних препаратів.
Гіпоглікемія на тлі глімепіриду й інсуліну гларгін у дослідженні GRADE (Phillips L.S., Seaquist E.R., Baker C., et al.)
Гіпоглікемія обмежує можливості досягнення глікемічного контролю за допомогою інсуліну та препаратів сульфонілсечовини (ПСС), але доказова база, отримана з прямих порівняльних досліджень, наразі відсутня. У порівняльному дослідженні ефективності GRADE взяли участь 5047 пацієнтів із ЦД 2 типу, в яких на тлі монотерапії метформіном спостерігався рівень глікованого гемоглобіну (HbA1c) в межах 6,8-8,5%. Учасників було рандомізовано в групи ПСС глімепіриду, інсуліну гларгін U-100, ситагліптину й ліраглутиду та проведено порівняння протягом 5,0±1,3 року періоду спостереження. Глімепірид розпочинали з дози 1-2 мг/добу, а гларгін – із дози 10-20 мг/добу, титруючи обидва препарати відповідно до алгоритмів на основі самостійного моніторингу рівнів глюкози. Протягом 4 років тяжку гіпоглікемію мали 2,3% осіб групи глімепіриду та 1,4% учасників групи гларгіну, але рідше пацієнти, які приймали ліраглутид (0,9%) та ситагліптин (0,7%), p=0,003. Через 3 місяці після рандомізації симптоми гіпоглікемії або рівень глюкози <70 мг/дл протягом попереднього місяця відзначалися в 33% пацієнтів групи глімепіриду та лише в 15% учасників групи інсуліну гларгін (p<0,001). Рівень HbA1c >7,5% задокументовано перевищили 50% осіб, що приймали глімепірид, і 39% учасників групи інсуліну гларгін (p<0,001).
Висновок: у пацієнтів із ЦД 2 типу, які лікуються метформіном, на тлі додавання ПСС глімепіриду спостерігаються більша частота розвитку гіпоглікемій і гірше дотримання глікемічного контролю, ніж за умови додавання інсуліну гларгін.
Ефективність добавок вітаміну D залежно від раси та маси тіла щодо показників сироваткового вітаміну D і ризику діабету в дослідженні D2d (Montgomery R.C., Davenport C.A., Johnson K.C., et al.)
Високий уміст 25-гідроксивітаміну D (25(OH)D) асоціюється з нижчою ймовірністю розвитку ЦД в осіб із предіабетом. Рівень 25(OH)D у крові може варіювати залежно від раси та маси тіла, і невідомо, чи вміст вітаміну D має однаковий вплив на ризик ЦД 2 типу для осіб негроїдної раси або пацієнтів з ожирінням. Рандомізоване клінічне дослідження D2d включало учасників із предіабетом високого ризику та надлишковою масою тіла / ожирінням, поділених на групи добавки вітаміну D3 (4000 МО/добу) та плацебо, за якими спостерігали протягом 2,5 років на предмет розвитку ЦД 2 типу. Автори порівняли вихідний і досягнутий під час дослідження рівень сироваткового 25(OH)D у групах відповідно до раси та маси тіла. Зв’язок між останнім показником і ризиком розвитку ЦД 2 типу виявляли методом Кокса. Вихідний рівень 25(OH)D був нижчим у осіб негроїдної раси (24,2±10,9 проти 29,6±9,5 нг/мл у осіб європеоїдної раси, p<0,001) та учасників із підвищеним індексом маси тіла (ІМТ) порівняно з особами з нормальною вагою. Аналогічні закономірності спостерігалися і для досягнутого на тлі прийому добавок вітаміну D показника 25(OH)D. Представники обох рас із сироватковим рівнем 25(OH)D ≥40 нг/мл мали достовірно нижчий ризик розвитку ЦД 2 типу. Це зниження, однак, не було відзначено в учасників з ІМТ >40 кг/м2.
Висновок: сироватковий рівень 25(OH)D ≥40 нг/мл асоціюється з достовірно нижчим ризиком розвитку ЦД 2 типу в осіб європеоїдної та негроїдної рас з ІМТ <40 кг/м2. Досягнення цільового показника сироваткового 25(OH)D ≥40 нг/мл може оптимізувати профілактику ЦД 2 типу в осіб із предіабетом високого ризику.
Безпека й ефективність інсуліну аспарт порівняно з іншими болюсними інсулінами у вагітних із виниклим до гестації ЦД 1 типу: рost hoc аналіз дослідження EVOLVE (Mathiesen E., Alibegovic A.C., Anil G., et al.)
У цьому post hoc аналізі дослідження реальної клінічної практики EVOLVE (n=1434) оцінювався вплив болюсних інсулінів на наслідки для матері, вагітності та дитини.
У третьому триместрі на тлі інсуліну аспарт спостерігалися достовірно нижчі показники HbA1c, ніж за умови застосування інших болюсних інсулінів (стандартизована відмінність становила -0,16%, р=0,005). За ризиком несприятливих наслідків (тяжка гіпоглікемія матері, викидні, передчасні пологи, прееклампсія, велика маса тіла для гестаційного віку, значні вроджені вади, перинатальна та неонатальна смертність) відмінностей між інсуліном аспарт й іншими болюсними інсулінами не спостерігалося.
Висновок: порівняно з іншими болюсними інсулінами, інсулін аспарт асоціюється з достовірно нижчим рівнем HbA1c під час третього триместру вагітності на тлі однакового ризику несприятливих наслідків.
Дексаметазон-індукована гіперглікемія в осіб без ЦД із COVID-19 (Rhou Y.J.J., Hor A., Wang M., et al.)
Дексаметазон покращує прогноз у разі COVID-19, але докладні дані щодо глікемічного профілю пацієнтів, що отримують дексаметазон із приводу COVID-19, відсутні.
У закладі, де працюють автори, рекомендовано рутинний моніторинг рівня глюкози крові для пацієнтів із COVID-19, які отримують дексаметазон у дозі 6 мг/добу. У дослідженні оцінювали дані осіб без анамнезу ЦД, госпіталізованих не до відділень інтенсивної терапії. Постдексаметазонову гіперглікемію визначали як рівень глюкози ≥10 ммоль/л. Із 277 учасників (52% чоловіків, середній вік – 52±18 років) гіперглікемія після застосування дексаметазону спостерігалася в 51%; максимальний рівень глюкози становив 12,4±2,3 ммоль/л. Коливання глюкози були найвищими через 7-9 годин після введення дексаметазону (рис. 1).
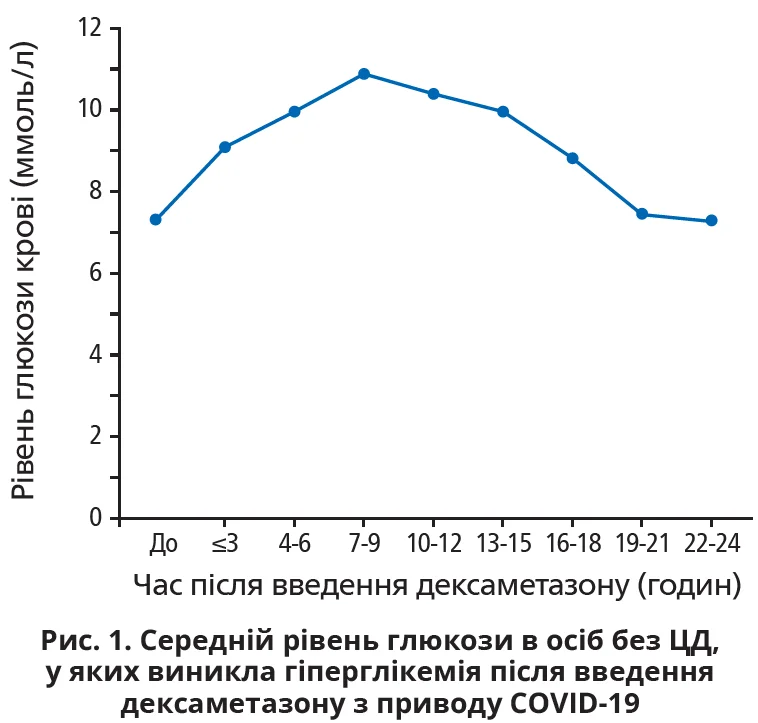
Особи, в яких виникла гіперглікемія, характеризувалися старшим віком (58±17 проти 45±7 років, p<0,001), вищими вихідними показниками HbA1c (6,1±1,0 проти 5,6±0,9%, p<0,001) та глюкози венозної крові (6,7±1,7 проти 6,0±1,5 ммоль/л, p<0,001), нижчою швидкістю клубочкової фільтрації, вищими рівнем С-реактивного білка та показником смертності. Вік, рівні HbA1c та C-реактивного білка виявилися незалежними предикторами гіперглікемії.
Висновок: дексаметазон спричиняв гіперглікемію в половини пацієнтів без ЦД, госпіталізованих із приводу COVID-19. Пікове підвищення відзначалося через 7-9 годин після введення дексаметазону. Предикторами гіперглікемії були старший вік і вищі показники HbA1c та С-реактивного білка.
Інсулінозберігальні ефекти перорального семаглутиду: аналіз даних PIONEER 8 (Aroda V.R., Abildlund M.T., Agesen R., et al.)
Дослідження PIONEER 8 продемонструвало значущу глюкозознижувальну ефективність перорального семаглутиду порівняно з плацебо в пацієнтів із ЦД 2 типу, який не вдалося адекватно контролювати за допомогою інсуліну. Крім того, наприкінці лікування (52-й тиждень) пацієнти, рандомізовані в групи перорального семаглутиду (7 або 14 мг/добу), застосовували меншу загальну дозу інсуліну порівняно з вихідною, на відміну від хворих, що отримували плацебо. Виявлений результат свідчить про інсуліно-зберігальний ефект. Цей post hoc аналіз результатів дослідження PIONEER 8 мав на меті охарактеризувати результати додавання арГПП-1 до інсулінотерапії та чисельно визначити зниження загальної дози інсуліну при додаванні перорального семаглутиду. При рандомізації пацієнтам рекомендували до 8-го тижня знизити загальну щоденну дозу інсуліну на 20%. Серед пацієнтів групи перорального семаглутиду (будь-яка доза) більшого зниження дози інсуліну на 26-й тиждень змогла досягнути більша частка пацієнтів, аніж у групі плацебо (рис. 2).
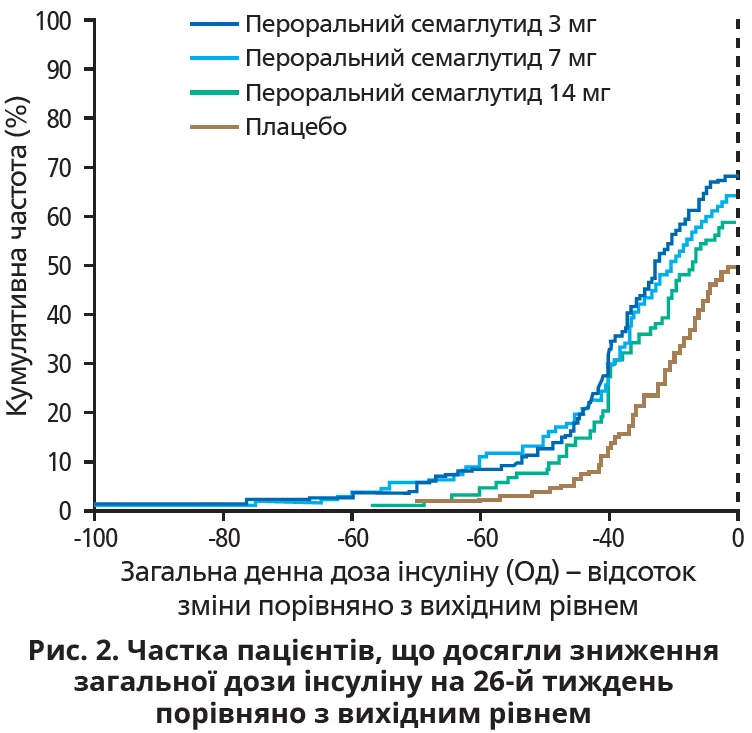
Зниження дози інсуліну на ≥20% досягла достовірно більша частка пацієнтів, які приймали 3, 7 та 14 мг семаглутиду, ніж у групі плацебо. Ця закономірність спостерігалася і на 26-й, і на 52-й тиждень (27,5; 28,9; 31,2% для різних доз семаглутиду проти 12,4% для плацебо та 19,5; 25,0; 32,0% для різних доз семаглутиду проти 5,7% для плацебо відповідно).
Висновок: додавання перорального семаглутиду до лікування пацієнтів із ЦД 2 типу дає змогу достовірно знизити дозу інсуліну, що може забезпечити додаткові довгострокові переваги на кшталт нижчого ризику гіпоглікемії та збільшення маси тіла.
Чи є поширеність гіпоглікемії, індукованої ПСС, перебільшеною? (Vyas T.C., Saboo B.D., Chennamsetti K., et al.)
Метою цього дослідження стала оцінка ризику гіпоглікемії в осіб із ЦД, які приймають ПСС і мають рівень HbA1c у межах 7-8%. ПСС є потужними глюкозознижувальними агентами та, як відомо, підвищують ризик гіпоглікемії. Для оцінки цього ризику було застосовано безперервне моніторування рівня глюкози та ретроспективний аналіз даних 300 пацієнтів із ЦД 2 типу. З’ясувалося, що гіпоглікемія була відсутня в 74% учасників. Лише 26% осіб мали гіпоглікемію 1 ступеня з часом перебування нижче рекомендованого діапазону (time below range, TBR) менше як 5%. У 2% осіб відзначалася гіпоглікемія з TBR більш як 5%, і лише один учасник із цих 2% повідомив про симптоми тяжкої гіпоглікемії.
Висновок: на противагу поширеному переконанню, виправдане застосування ПССне підвищує ризик розвитку гіпоглікемії та показник TBR у осіб із ЦД 2 типу.
ЕКСПЕРТНА ДУМКА
 Любов Костянтинівна Соколова
Любов Костянтинівна Соколова
доктор медичних наук, керівник відділу діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ)
Друзі, маємо можливість ознайомитися з основними моментами найбільшої конференції з діабету – 82-ї наукової сесії Американської діабетичної асоціації (ADA). Цьогорічний захід охоплював багато важливих тем, було представлено результати досліджень, які висвітлювали нові розробки щодо технологій лікування діабету, ліки для запобігання пов’язаним із цим захворюванням ускладненням і зниження рівня НbA1c, оновлену інформацію про харчування та багато іншого.
Учасники конференції ADA 2022 розглядали різні питання діагностики, лікування та профілактики, загалом життя з діабетом, включаючи автоматизовану доставку інсуліну, час у цільовому діапазоні, надзвичайно перспективні препарати, що розробляються, нетрадиційні ускладнення діабету та рекомендації щодо дієти.
Перед вами – основні теми, які ми крок за кроком обговоримо під час найближчих заходів Школи ендокринолога.
Технології лікування діабету
- Вражаючі результати основного дослідження iLet Bionic Pancreas
- Обізнаність і доступ до Time in Range: можливості для вдосконалення
- Інсулін у разі цукрового діабету 2 типу: використання технологій
- Дієта та фізичні вправи з автоматизованою доставкою інсуліну
Терапія діабету
- Варіанти препаратів для лікування хронічної хвороби нирок і гіперкаліємії
- Ліки, які варто приймати за ризику розвитку інсульту
- Семаглутид 2,4 мг (Wegovy) може запобігти діабету 2 типу
- На горизонті – щотижневий інсулін, пероральний інсулін, розумний інсулін і біоподібні препарати
Ускладнення діабету
- Захворювання печінки при цукровому діабеті – невраховане ускладнення
- Як діабет впливає на пізнання
- Забуті ускладнення: що вам слід знати
- Лікування до невдачі: подолання терапевтичної інертності при діабеті 2 типу
- Що їсти, коли їсти: нові знання про харчування
- Неусвідомлення гіпоглікемії: погляди пацієнта та клініциста
- Профілактика діабету: оновлення стандартів медичної допомоги ADA (2022)
- Підтримка підлітків із діабетом 2 типу
- Втрата ваги через часові обмеження в їжі
- Управління ожирінням як основна мета лікування діабету 2 типу: настав час змінити парадигму
- Жінки з діабетом: переваги та перешкоди для фізичних вправ
На сторінках нашого журналу ЕндоPractice – найактуальніша інформація сучасної ендокринології. Будьмо в тренді!
