Прийняття рішень у разі субклінічних захворювань щитоподібної залози
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
Усупереч рекомендаціям фахових товариств визначення функції щитоподібної залози (ЩЗ) стає всюдисущим у сучасній медицині [1, 2]. Унаслідок цього поширеним клінічним сценарієм стало виявлення незначних відхилень від норми рівня тиреотропного гормону (ТТГ).
Виражена дисфункція ЩЗ, окрім змін ТТГ, характеризується відхиленням від норми рівня тиреоїдних гормонів: тироксину (T4) та трийодтироніну (T3). Така картина трапляється набагато рідше, ніж аномальний рівень ТТГ у сполученні з нормальними рівнями гормонів ЩЗ, який часто вважають свідченням субклінічних захворювань ЩЗ (рис.) [3, 4].
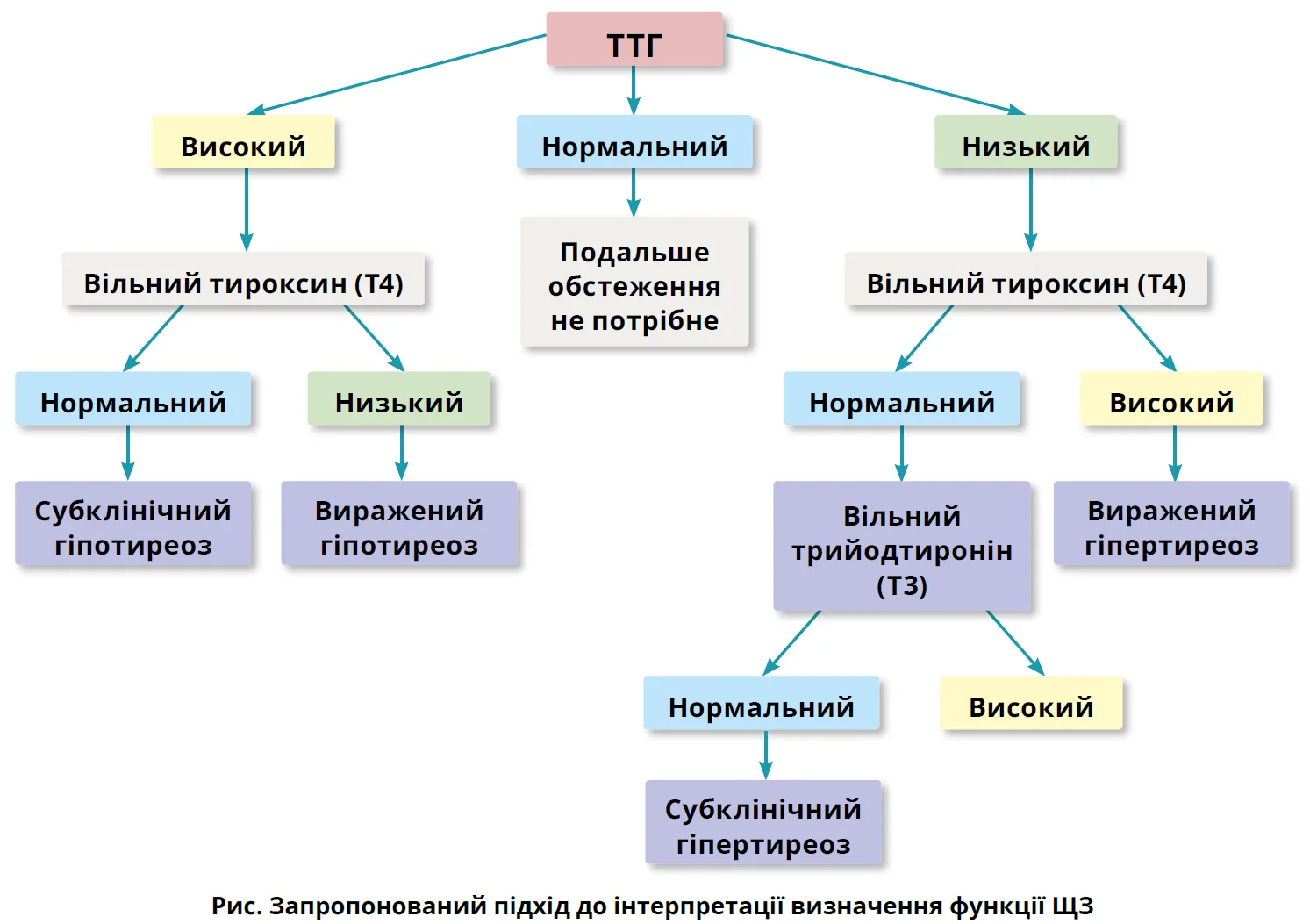
Епідеміологічні дослідження свідчать, що поширеність субклінічного гіпо- та гіпертиреозу в загальній популяції США становить 4,0-9,0 та 1,8-2,1% відповідно, причому дещо вищі показники спостерігаються в жінок і осіб похилого віку [5, 6]. У цьому огляді узагальнено наявну доказову базу щодо субклінічних захворювань ЩЗ та надано практичні вказівки для прийняття клінічних рішень і ведення таких пацієнтів.
Фізіологія субклінічних захворювань ЩЗ та референсні значення ТТГ
Вироблення й секреція гормонів ЩЗ регулюються петлею зворотного зв’язку: гіпоталамічний тиреоїд-рилізинг гормон стимулює продукцію передньою часткою гіпофіза ТТГ, який, своєю чергою, впливає на рецептори в ЩЗ [13]. Наявність субклінічних форм хвороб ЩЗ можна пояснити тим, що діапазон нормальних рівнів гормонів для кожної окремої людини є вужчим, аніж загальний референсний діапазон для всієї популяції [7, 14, 15].
Щодо оптимального референсного діапазону рівня ТТГ продовжують точитися дискусії [3, 16]. При проведенні сучасних імунометричних аналізів верхню межу нормальних значень ТТГ встановлюють на рівні 4,0-5,0 мМО/л. Але слід зауважити, що протягом доби вміст ТТГ може значно – до 50% середнього значення – коливатися [2, 17]. Із віком відзначається тенденція до зростання рівня ТТГ: у 14% здорових осіб віком понад 80 років показник ТТГ перевищує 4,5 мМО/л, а 97,5% довірчий інтервал (ДІ) для рівня ТТГ у цій популяції підвищується до 7,5 мМО/л [18, 19]. Попередні дослідження свідчать, що асоціація незначного субклінічного гіпотиреозу з підвищеним серцево-судинним ризиком після 80 років послаблюється [20, 21], а в осіб віком понад 85 років із рівнем ТТГ вище референсних значень спостерігаються кращі показники виживаності [22]. У зв’язку з цим деякі експерти рекомендують застосовувати вікові норми ТТГ [16, 23].
Субклінічний гіпотиреоз (СубГіпо)
Причини СубГіпо та клінічно вираженого гіпотиреозу є однаковими. Найчастішою причиною зниження функції ЩЗ у США є автоімунний, або лімфоцитарний, тиреоїдит [7, 15]. СубГіпо часто поділяють на нетяжкий, або гіпотиреоз 1 ступеня (при рівні ТТГ <10 мМО/л), і тяжкий, або гіпотиреоз 2 ступеня (при рівні ТТГ ≥10 мМО/л) [8, 11, 15, 24]. У більшості випадків СубГіпо вихідний рівень ТТГ є меншим за 10 мМО/л [25].
Природний перебіг хвороби зазвичай залежить від вихідного підвищення ТТГ. У дослідженні L. Somwaru та співавт. (2012) протягом 2 років спостереження за групою дорослих віком ≥65 років із вихідним рівнем ТТГ 4,5-7 мМО/л у 46% рівень ТТГ нормалізувався, а прогресування до клінічно вираженого гіпотиреозу відзначалося лише в 1% випадків. Натомість у групі осіб із вихідним рівнем >10 мМО/л нормалізація спостерігалася лише в 7%, а прогресування – в 10% [25].
При виявленні змін ТТГ слід визначати вільний тироксин. Якщо цей показник у нормі, аналіз потрібно повторити впродовж 1-3 місяців, причому в осіб із СубГіпо 2 ступеня – дещо швидше, ніж у осіб із незначним гіпотиреозом [8, 15]. Деякі дослідження продемонструвати, що прогресування до клінічно вираженого гіпотиреозу є ймовірнішим за наявності антитіл до тиреоїдної пероксидази (АТПО). Наявність цих антитіл підтверджує автоімунну причину хвороби [25-27].
Серцево-судинні захворювання (ССЗ)
Вплив СубГіпо на ліпідний метаболізм однозначно не визначений [3, 30]. Деякі крос-секційні дослідження продемонстрували підвищення рівня загального холестерину та ліпопротеїнів низької щільності на тлі СубГіпо [6, 31], натомість інші, включаючи NHANES III, зв’язку не виявили [32, 33]. Аналогічно деякі старіші дослідження свідчать, що СубГіпо може асоціюватися з погіршенням показників роботи серця, включаючи систолічну та діастолічну функції лівого шлуночка [28, 29], хоча великі когортні дослідження зв’язку СубГіпо із ССЗ не виявили [34, 35]. Зокрема, в когорті дорослих віком ≥65 років не спостерігалося жодної асоціації між СубГіпо та ризиком серцево-судинних подій, серцевої недостатності (СН) або серцево-судинної смертності навіть за умови ТТГ >10 мМО/л [34]. Однак нещодавнє когортне дослідження на основі даних NHANES (n=9020) виявило, що після стандартизації груп за віком, статтю, расовою/етнічною приналежністю, рівнем освіти, анамнезом куріння, наявністю раку та швидкістю клубочкової фільтрації СубГіпо асоціювався з підвищеним показником смертності від усіх причин (відношення ризиків (ВР) 1,90; 95% ДІ 1,14-3,19) [36].
Подальший метааналіз показав, що рівень ТТГ >10 мМО/л асоціюється з достовірно вищим ризиком розвитку СН (ВР 1,86; 95% ДІ 1,27-2,72), серцево-судинних подій (ВР 1,89; 95% ДІ 1,28-2,80) та смертності від ССЗ (ВР 1,58; 95% ДІ 1,10-2,27).
З останнім показником асоціювався також рівень ТТГ у межах 7-9,9 мМО/л (ВР 1,42; 95% ДІ 1,03-1,95) [37, 38]. Отже, СубГіпо 2 ступеня може супроводжуватися підвищеним ризиком ССЗ та смертності.
Остеопороз і переломи
C.D. Wirth і співавт. (2014) провели метааналіз високоякісних досліджень і не виявили зв’язку між СубГіпо та переломами стегнової кістки чи іншими переломами поза хребтом [39]. Додатковий метааналіз не виявив також зв’язку СубГіпо з переломами хребців [40].
Погіршення когнітивних функцій і деменція
Асоціація СубГіпо з когнітивними розладами також є суперечливою. Нещодавнє проспективне когортне дослідження за участю осіб віком 70-79 років не виявило зв’язку між СубГіпо та деменцією [41]. Аналогічні дані отримали й кілька метааналізів [42, 43]. Однак стратифікований додатковий аналіз даних одного з досліджень виявив підвищений ризик деменції в осіб із СубГіпо віком менш як 75 років [44].
Лікування СубГіпо
Великі рандомізовані контрольовані дослідження (РКД) щодо оцінки впливу лікування СубГіпо на клінічні наслідки відсутні, тому невідомо, чи лікування здатне знизити підвищений серцево-судинний ризик, пов’язаний із СубГіпо. У ретроспективному когортному дослідженні було виявлено, що в осіб із СубГіпо віком 40-70 років лікування левотироксином асоціювалося з нижчим ризиком фатальних і нефатальних кардіоваскулярних подій (ВР 0,61; 95% ДІ 0,39-0,95) та смертності від усіх причин (ВР 0,36; 95% ДІ 0,19-0,66) навіть після стандартизації даних за віком, статтю, класичними чинниками кардіоваскулярного ризику та вихідним рівнем ТТГ.
У пацієнтів віком понад 70 років таких зв’язків не спостерігалося [45]. Ці результати варто трактувати обережно, оскільки дослідження було ретроспективним.
На противагу попередньому дослідженню, інше ретроспективне когортне випробування не виявило зв’язку між лікуванням СубГіпо та ризиком інфаркту міокарда чи кардіоваскулярної смерті, хоча в осіб віком менш як 65 років лікування асоціювалося зі зниженням смертності від усіх причин [46]. Відсутність впливу лікування на ризик виникнення фатальних і нефатальних кардіоваскулярних подій у осіб віком ≥65 років було виявлено
й у іншому дослідженні [47].
Невелике РКД за участю осіб із СубГіпо віком ≥65 років виявило, що терапія тиреоїдними гормонами не мала достовірного впливу на когнітивні функції [50]. У більшому РКД не було встановлено впливу лікування СубГіпо в осіб віком ≥65 років левотироксином на якість життя та ступінь втомлюваності [49]. Метааналіз підтвердив, що гормонотерапія не асоціюється з покращенням якості життя, зменшенням вираженості симптомів із боку ЩЗ, депресії, втомлюваності, а також не має впливу на рівень м’язової сили чи індекс маси тіла [48].
Враховуючи відсутність доказової бази щодо впливу лікування СубГіпо на кардіоваскулярний ризик чи якість життя, рекомендації з лікування ґрунтуються переважно на поглядах експертів. Більшість рекомендацій погоджуються з тим, що в осіб віком менш як 65-70 років лікування слід розпочинати при рівні ТТГ >10 мМО/л [2, 7, 11, 24], але рекомендації для старших осіб є більш варіабельними та вказують, що порогом для лікування може бути діапазон між верхньою межею норми та 10 мМО/л. Якщо рівень ТТГ перебуває в межах цього діапазону, Американська тиреоїдна асоціація рекомендує розглянути лікування в симптоматичних осіб (наприклад, із симптомами втомлюваності, нестачі енергії, закрепами), з високим ризиком прогресування (позитивними АТПО чи високим кардіоваскулярним ризиком) [2]. Рекомендації Європейської тиреоїдної асоціації є аналогічними, хоча вони не радять розпочинати лікування в осіб віком понад 70 років [24]. Деякі дослідники рекомендують розпочинати лікування в осіб із рівнем ТТГ у межах 7-9,9 мМО/л, особливо в молодших за 65 років [8, 51]. На відміну від цієї точки зору, рекомендації з клінічної практики, сформовані на основі метааналізу G.E. Bekkering (2019), не радять розпочинати лікування СубГіпо в більшості дорослих, окрім осіб із рівнем ТТГ >20 мМО/л і жінок, які планують вагітність.
Якщо було прийнято рішення розпочинати лікування, слід застосовувати левотироксин [2, 7, 53].
Оскільки СубГіпо являє собою субтотальний дефіцит гормонів ЩЗ, повноцінна доза замісної гормонотерапії (1,6 мг/кг/добу) може бути занадто великою. Натомість слід розпочати з дози 25-75 мг/день, особливо в осіб віком понад 65 років або з чинниками ризику ССЗ [2, 53]. Дозу потрібно коригувати на основі ТТГ 1 раз на 6-8 тижнів; цільовим рівнем ТТГ є досягнення показника в діапазоні референсних значень [24, 53]. Проте слід пам’ятати, що нормальні сироваткові рівні ТТГ у старшій популяції можуть бути дещо вищими, тому у віковій групі понад 70-80 років цільовим рівнем ТТГ можна вважати 4-6 мМО/л [53]. Приклади клінічних сценаріїв СубГіпо наведено в таблиці 1.

Субклінічний гіпертиреоз (СубГіпер)
Низький рівень ТТГ може бути наслідком низки хвороб, які слід виключити до встановлення діагнозу СубГіпер [8, 11]. Аналогічно СубГіпо, СубГіпер можна стратифікувати на ступінь 1 (рівень ТТГ – 0,1-0,4 мМО/л) і ступінь 2 (рівень ТТГ <0,1 мМО/л). Найкращим предиктором клінічного перебігу є вихідний рівень ТТГ: в осіб, у яких цей показник становить <0,1 мМО/л, ризик є більшим порівняно з особами з показником 0,1-0,4 мМО/л [54-56]. Пацієнтам зі зниженим рівнем ТТГ рекомендовано повторний аналіз через 1-3 місяці, причому особам із ТТГ <0,1 мМО/л – швидше, ніж особам із вищими показниками [8, 57]. Найімовірнішою причиною СубГіпер у молодих осіб і в регіонах із достатнім умістом йоду у воді та раціоні є хвороба Грейвса, а в осіб похилого віку й у йододефіцитних регіонах – токсичний багатовузловий зоб і токсична аденома [10, 11]. Алгоритм оцінки пацієнтів залежить від клінічного сценарію. Пацієнт із класичними ознаками хвороби Грейвса (гладенька, дифузно збільшена ЩЗ, шум при аускультації залози (thyroid bruit) та/або орбітопатія) може не потребувати додаткових обстежень. Коли ж вони потрібні, то високі показники чутливості та специфічності для цієї хвороби має визначення антитіл до рецепторів ТТГ або тиреоїдостимулювального імуноглобуліну. Якщо цих біомаркерів не виявлено, можна кількісно визначити захоплення йоду та візуалізувати його патерн за допомогою оцінки 24-годинного захоплення йоду та сцинтиграфії ЩЗ. Цей метод є цінним для диференційної діагностики гіперфункціонувальних вузлів і хвороби Грейвса, а також дає змогу ідентифікувати підгострий тиреоїдит, за якого спостерігається дуже низьке захоплення йоду [57]. Ультразвукове дослідження ЩЗ має значення для подальшого вивчення розмірів гіперфункціонувальних вузлів та оцінки «холодних» вузлів перед біопсією.
ССЗ
І популяційні дослідження, і метааналізи продемонстрували зв’язок між СубГіпер і фібриляцією передсердь (ФП) [58-62]. У найбільшому наразі популяційному дослідженні, проведеному в Данії, було виявлено, що ризик розвитку ФП прогресивно зростає паралельно зниженню рівня ТТГ, але досягає статистичної достовірності лише для осіб із ТТГ <0,1 мМО/л (ВР 1,41; 95% ДІ 1,25-1,59) [61]. Інші автори встановили, що серед осіб віком понад 65 років ризик є підвищеним за рівня ТТГ 0,1-0,44 мМО/л (ВР 1,85; 95% ДІ 1,14-3,00) [58].
Дослідження щодо зв’язку СубГіпер і ССЗ більш гетерогенні. Зокрема, дослідження Cardiovascular Health Study не виявило підвищеного ризику серцево-судинних подій або смерті [58], натомість інші популяційні дослідження продемонстрували асоціацію СубГіпер із ризиком нефатальних серцево-судинних подій [35, 62] та серцево-судинною смертністю [63]. Зв’язок СубГіпер і смертності від ССЗ підтвердив і метааналіз T.H. Collet і співавт. (2012), але стратифікація за рівнем ТТГ виявила підвищений ризик ССЗ лише в осіб із ТТГ <0,1 мМО/л, а при стандартизації за іншими чинниками серцево-судинного ризику асоціація взагалі зникла [59]. Інший метааналіз з’ясував, що СубГіпер із ТТГ <0,1 мМО/л асоціюється з достовірним підвищенням імовірності СН [37].
Остеопороз і переломи
Враховуючи вплив гормонів ЩЗ на кістковий метаболізм, існує значне занепокоєння щодо ризику остеопорозу та переломів у пацієнтів із СубГіпер. У метааналізі C.D. Wirth і співавт. (2014) спостерігалася тенденція до підвищення ризику переломів стегнової кістки й інших нехребцевих переломів, яка, проте, не досягла рівня статистичної достовірності. Подальший метааналіз, опублікований у 2015 році, виявив, що порівняно з еутиреоїдною групою контролю СубГіпер асоціювався з підвищеним ризиком усіх переломів (ВР 1,28;
95% ДІ 1,06-1,53) та переломів стегна (ВР 1,36;
95% ДІ 1,13-1,64) [40].
Погіршення когнітивних функцій і деменція
C. Rieban і співавт. (2016) виявили асоціацію СубГіпер із когнітивними розладами [40]. Це підтвердили й результати дослідження Health, Aging, and Body Composition Study, в якому протягом 10 років спостерігали за пацієнтами віком 70-89 років, виявивши достовірно вищий ризик деменції на тлі ТТГ <0,1 мМО/л [41].
Лікування СубГіпер
Якісна доказова база щодо сприятливих впливів лікування СубГіпер на описані вище наслідки відсутня, тому рекомендації ґрунтуються на експертній думці та є дуже схожими між собою [8, 11, 57, 65]. Якщо рівень ТТГ є стійко нижчим за 0,1 мМО/л, лікування рекомендовано особам віком менш як 65 років і пацієнтам із високим ризиком ускладнень (остеопорозу, аритмій і ССЗ). Для пацієнтів віком менш як 65 років без симптомів або чинників ризику зі стійким зниженням ТТГ до <0,1 мМО/л лікарям запропоновано приймати рішення на власний розсуд. У осіб віком ≥65 років і пацієнтів із чинниками ризику при стійкому рівні ТТГ у межах від 0,1 мМО/л і нижньою межею норми експертні думки здебільшого свідчать на користь лікування. Натомість для асимптоматичних осіб віком менш як 65 років з аналогічним рівнем ТТГ прийнятним є спостереження.
Вибір лікування (протитиреоїдні препарати, радіоактивний йод або хірургічне втручання) залежить від фонового захворювання й уподобань пацієнта. Токсичному багатовузловому зобу не притаманна спонтанна ремісія, тому перевагу зазвичай віддають радіоактивному йоду або хірургічному втручанню [57, 65]. Для пацієнтів із хворобою Грейвса, особливо молодих, переважно застосовуються тіонаміди. Через 12-18 місяців такого лікування ремісія відзначається в 40-50% пацієнтів [66]. Приклади сценаріїв СубГіпер наведено в таблиці 2.

Висновки
Субклінічні хвороби ЩЗ є поширеною клінічною проблемою. Хоча існує деяка непевність, СубГіпо асоціюється з підвищеним ризиком розвитку ССЗ, особливо при ТТГ >10 мМО/л, а СубГіпер – із підвищеним ризиком розвитку ФП та остеопорозу, а при ТТГ <0,1 мМО/л – ще й із підвищеною ймовірністю ССЗ.
Великі РКД щодо впливу лікування субклінічних хвороб ЩЗ на значущі клінічні наслідки відсутні, тому загалом лікування СубГіпо слід розглянути за рівня ТТГ >10 мМО/л і в молодих осіб із рівнем ТТГ вище верхньої межі норми та нижче 10 мМО/л із симптомами СубГіпо, позитивними АТПО чи високим ризиком розвитку ССЗ. Лікування СубГіпер доцільно призначати особам віком ≥65 років і пацієнтам із високим ризиком розвитку ССЗ чи остеопорозу.
Література
Evron J.M., Papaleontiou M. Decision making in subclinical thyroid disease. Med. Clin. North. Am. 2021; Nov; 105 (6): 1033–1045. doi: 10.1016/j.mcna.2021.05.014.
