Застосування інсуліну гларгін у дітей та підлітків із ЦД 1 типу: відповідь на виклик
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
Хоча з часу виділення Ф. Бантінгом та Ч.Г. Бестом інсуліновмісних екстрактів минуло вже 100 років подальших досліджень інсулінотерапії, цукровий діабет (ЦД) залишається однією з провідних причин захворюваності та смертності в усьому світі, а його вплив на стан здоров’я населення планети продовжує зростати (Hartman I. et al., 2008), у тому числі серед дітей.
Відповідно до Атласу Міжнародної федерації діабету (IDF Atlas, 2021), у світі налічується 1 219 900 дітей та підлітків (віком до 19 років) із ЦД 1 типу, а щорічна захворюваність у цій віковій категорії становить 149 500 випадків.
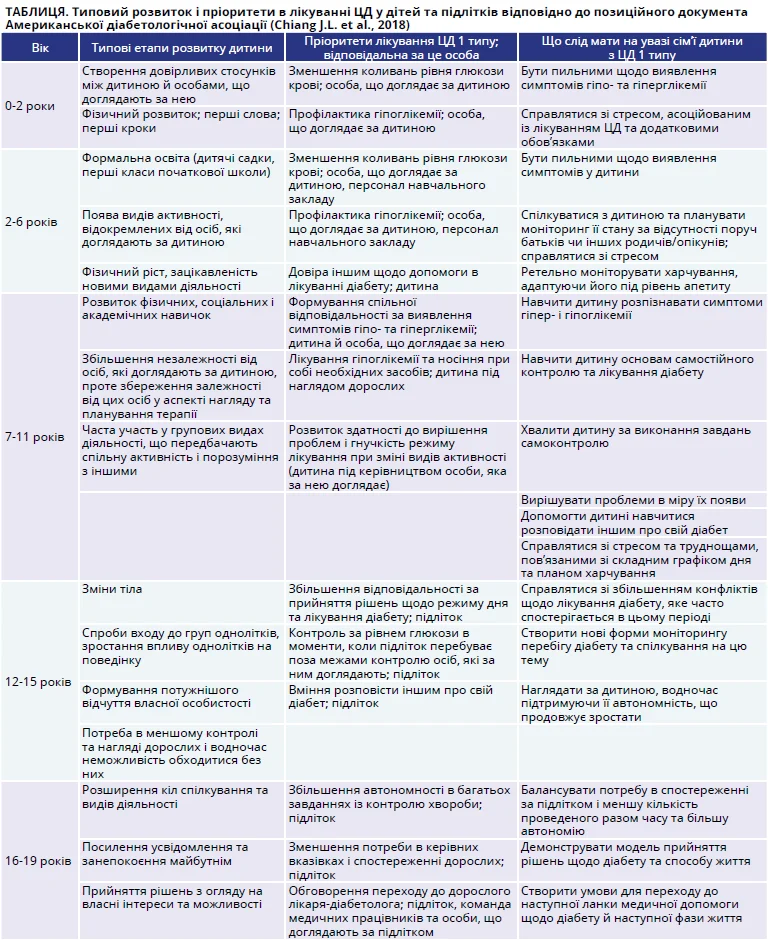
Лікуючи дітей із ЦД, слід пам’ятати, що діти не є маленькими за розміром дорослими. Кожна вікова група дитячо-підліткового періоду має власні особливості, потреби та пріоритети в лікуванні діабету (табл.).
Суворий глікемічний контроль здатен відтермінувати початок або сповільнити розвиток мікро- та макросудинних ускладнень у осіб із ЦД 1 типу (Nathan D. M. et al., 2013). Це особливо важливо в дітей та підлітків, оскільки в цих вікових групах гіперглікемія може асоціюватися зі змінами в сірій та білій речовинах мозку (Barnea-Goraly N. et al., 2014; Mauras N. et al., 2015).
Впровадження аналогів інсулінів тривалішої та швидшої дії дає змогу досягти більшої гнучкості лікування та кращого контролю хвороби, особливо в дітей та підлітків. Остання категорія є дуже вразливою до гіпоглікемій у зв’язку з особливостями способу життя й поведінки (Gummerson I., 2006; Raine J. E. et al., 2006). Тому, обираючи лікування, потрібно мінімізувати ризик гіпоглікемії, бо цей стан асоціюється з низкою ускладнень, включаючи зміни автономних відповідей організму, випадки зомління, кому, судомні напади, порушення просторової пам’яті та навіть синдром раптової смерті під час сну (dead-in-bed syndrome) (Abraham M. B. et al., 2018; Tsalikian E. et al., 2009; Hershey T. et al., 2005; Gagnum V. et al., 2017). Навіть сам страх гіпоглікемії є небезпечним, оскільки здатен викликати тривожність і перешкоджати досягненню еуглікемії (Frier B. M., 2008). Утричі більша частота гіпоглікемій, асоційована з інтенсивним лікуванням ЦД, залишається провідною проблемою досягнення хорошого глікемічного контролю в підлітків (The Diabetes Control and Complications Trial Research Group, 1994). Окремими проблемами є асимптоматична та нічна гіпоглікемії. Зокрема, нічна гіпоглікемія відзначається приблизно в 70% дітей та 50% підлітків із ЦД 1 типу (Deiss D. et al., 2007).
Отже, оптимальна інсулінотерапія для дітей та підлітків із ЦД має забезпечувати ефективний глікемічний контроль водночас із мінімізацією ймовірності гіпо- та гіперглікемії. Порівняно з нейтральним протаміном Хагедорна аналоги базального інсуліну забезпечують більш передбачуваний ефект із меншою варіабельністю (Robertson K. J. et al., 2007), що обумовлює доцільність їх застосування, в тому числі в педіатричній практиці.
Інсулін гларгін являє собою аналог інсуліну, що характеризується меншою розчинністю при фізіологічному рівні рН порівняно з природним інсуліном людини. Ця зменшена розчинність забезпечує сповільнення всмоктування після підшкірного введення та, відповідно, стабільне надходження базального інсуліну впродовж 24 годин і навіть більше (Liu M. et al., 2016). У відкритому рандомізованому багатоцентровому дослідженні M. Liu та співавт. (2016) 162 дітей віком 6–18 років було розподілено в групи інсуліну гларгін і нейтрального протаміну Хагедорна на термін 24 тижні.
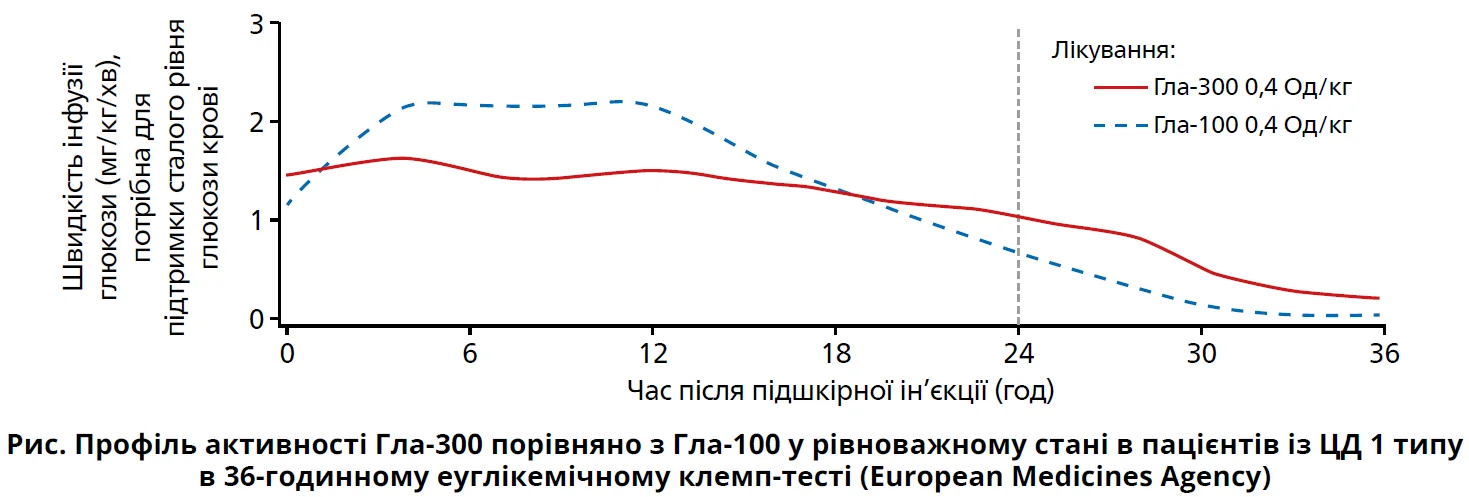
Як болюсний інсулін в обох групах застосовувався інсулін аспарт. Зниження рівня глікованого гемоглобіну (HbA1c) та частка осіб, яким удалося досягти цільового рівня HbA1c, в обох групах були приблизно однаковими, проте в групі інсуліну гларгін спостерігалася достовірно менша частота симптоматичних гіпоглікемій, аніж у групі нейтрального протаміну Хагедорна (24,3±45,8 проти 32,3±43,2 випадку на пацієнто-рік). Автори зробили висновок, що застосування інсуліну гларгін здатне допомогти дітям із ЦД 1 типу безпечно знизити рівень HbA1c. Інсулін гларгін 100 Од/мл (Гла‑100) є аналогом людського інсуліну тривалої дії, схваленим для застосування в дітей у США та Європі, а інсулін гларгін 300 Од/мл (Гла‑300) — аналогом базального інсуліну другого покоління з покращеними фармакокінетичними та фармакодинамічними властивостями порівняно з Гла‑100, який також було схвалено для застосування в дітей віком понад 6 років (Becker R.H.A. et al., 2015; Steinstraesser A. et al., 2014). Гла‑300 було створено з метою збільшення тривалості дії цього аналога інсуліну порівняно з Гла‑100. При підшкірній ін’єкції за умови фізіологічного рН інсулін гларгін преципітується й агрегується з утворенням локального депо, з якого поступово вивільняється інсулін. Розмір цього преципітату залежить від концентрації розчину, тобто Гла‑300 формує менше за розміром депо, ніж Гла‑100 (Clements J. N. et al., 2017). Оскільки вивільнення молекул інсуліну гларгін є пропорційним до площі поверхні депо препарату, менший розмір преципітату Гла‑300 забезпечує вивільнення меншої кількості молекул інсуліну за одиницю часу, а отже, тривалішу дію та стабільніший рівень глюкози протягом доби порівняно з Гла‑100.
Іншими перевагами Гла‑300 над Гла‑100 є низька варіабельність перепадів рівня глюкози в кожного пацієнта та високий рівень відтворюваності результатів лікування, тобто стабільний прогнозований глюкозознижувальний ефект. Менш виражений пік дії теоретично здатний також забезпечити більш поступове зниження рівня глюкози крові та менший ризик гіпоглікемії, ніж на тлі Гла‑100 (Vargas-Uricoechea H. et al., 2018).
Ефективність і безпека Гла‑300 у дорослих були підтверджені в серії рандомізованих клінічних досліджень EDITION, а в дітей та підлітків віком 6–17 років – у EDITION JUNIOR. Дослідження EDITION JUNIOR являло собою відкрите рандомізоване міжнародне випробування фази 3b з паралельними групами, в якому порівнювали Гла‑300 і Гла‑100 у дітей та підлітків із ЦД 1 типу. У цьому дослідженні взяли участь 463 дитини й підлітка зі 105 клінічних центрів 24 країн. Критеріями включення були вік 6–17 років, наявність ЦД 1 типу протягом ≥1 року, попереднє лікування базальним інсуліном у поєднанні з інсуліном швидкої дії та рівень HbA1c від ≥7,5 до ≤11,0%. Дозу Гла‑100 або Гла‑300 розраховували з огляду на попередню дозу базального інсуліну й титрували до досягнення самостійно визначеного рівня глюкози плазми крові натще (ГПКН) у межах 5,0–7,2 ммоль/л (Danne T. et al., 2020).
Вихідні рівні HbA1c та ГПКН у групах лікування не відрізнялися. Середнє зниження HbA1c в обох групах через 26 тижнів було однаковим і становило 0,40±0,06%; найвираженіші зміни спостерігалися протягом перших 12 тижнів. Ефективність інсуліну гларгін була однаковою в різних клінічних підгрупах. Частки осіб, які через 26 тижнів лікування досягли цільового показника HbA1c (<7,5%), у групах Гла‑300 і Гла‑100 також були зіставними й становили 26,2 та 23,5% відповідно. Рівень ГПКН у групі Гла‑300 через 26 тижнів лікування знизився на 0,56±0,37 ммоль/л, а в групі Гла‑100 – на 0,55±0,37 ммоль/л. Частка осіб, які досягли цільового рівня ГПКН (≤7,2 ммоль/л), у групах Гла‑300 і Гла‑100 дорівнювала 27,5 та 26,5% відповідно. Частота епізодів тяжкої або задокументованої гіпоглікемії в групах Гла‑300 і Гла‑100 була однаковою (97,0 та 97,8%). При порівнянні різних вікових підгруп відмінностей також не спостерігалося. Частота тяжких гіпоглікемій у групі Гла‑300 становила 6,0%, а в групі Гла‑100 – 8,8% (відносний ризик 0,68; 95% довірчий інтервал 0,35–1,30). Частота всіх побічних ефектів протягом 6-місячного періоду лікування також була приблизно однаковою (65,2% у групі Гла‑300 та 65,8% у групі Гла‑100). Найчастішими побічними явищами в обох групах були назофарингіт, головний біль, інфекції верхніх дихальних шляхів і кетоз. Автори дійшли висновку, що Гла‑300 не поступається Гла‑100 за зміною HbA1c порівняно з вихідним рівнем. Як і очікувалося, майже в усіх (близько 98%) учасників відзначався щонайменше один епізод гіпоглікемії. Хоча різниця виявилася незначущою, в групі Гла‑300 спостерігалася дещо менша частота тяжких гіпоглікемій протягом перших 6 місяців лікування. Профіль безпеки Гла‑300 загалом відповідав такому Гла‑100, але менші показники частоти гіперглікемій із кетозом і тяжких гіпоглікемій є багатонадійними. Висновки дослідження EDITION JUNІОR були представлені на 45-й щорічній конференції Міжнародного товариства діабету в дітей та підлітків у Бостоні, США (2019).
У фармакокінетичних/фармакодинамічних дослідженнях за участю дорослих Гла‑300 забезпечував нижчі та більш відтерміновані в часі пікові показники концентрацій, таким чином забезпечуючи меншу варіабельність глікемії (Owens D. R., 2016). Для підтвердження цих результатів у дітей потрібні подальші клінічні дослідження.
Висновки
- Лікування ЦД 1 типу в дітей та підлітків потребує уникнення не лише гіперглікемії, а й гіпоглікемій, у тому числі асимптоматичних і нічних.
- Використання аналогів інсуліну дає змогу досягти кращого контролю хвороби, ніж застосування нейтрального протаміну Хагедорна.
- Інсулін гларгін 300 Од/мл є ефективним і безпечним препаратом для лікування ЦД 1 типу, який пройшов випробування в дітей та підлітків у дослідженні EDITION JUNIOR.
- Застосування інсуліну гларгін 300 Од/мл дає змогу досягти стабільного рівня глюкози протягом доби та зменшити варіабельність глікемії порівняно з інсуліном гларгін 100 Од/мл. Багатонадійними також є менші показники частоти тяжких гіпоглікемій і гіперглікемій із кетозом на тлі інсуліну гларгін 300 Од/мл.
Література
- Hartman I. Insulin analogs: impact on treatment success, satisfaction, quality of life and adherence. Clin. Med. Res. 2008; 6: 54–67. doi: 10.3121/cmr.2008.793.
- IDF Diabetes Atlas [Електронний ресурс]. — Режим доступу: https://diabetesatlas.org/atlas/tenth-edition.
- Chiang J. L., Maahs D. M., Garvey K. C., Hood K. K., Laffel L. M., Weinzimer S. A., Wolfsdorf J. I., Schatz D. Type 1 diabetes in children and adolescents: a position statement by the American Diabetes Association. Diabetes Care. 2018 Sep; 41 (9): 2026–2044. doi: 10.2337/dci18–0023. Epub 2018 Aug 9. PMID: 30093549; PMCID: PMC6105320.
- Nathan D. M., Bayless M., Cleary P., et al.; DCCT/EDIC Research Group. Diabetes Control and Complications Trial / Epidemiology of Diabetes Interventions and Complications study at 30 years: advances and contributions. Diabetes. 2013; 62: 3976–3986.
- Barnea-Goraly N., Raman M., Mazaika P., et al.; Diabetes Research in Children Network (DirecNet). Alterations in white matter structure in young children with type 1 diabetes. Diabetes Care. 2014; 37: 332–340.
- Mauras N., Mazaika P., Buckingham B., et al.; Diabetes Research in Children Network (DirecNet). Longitudinal assessment of neuroanatomical and cognitive differences in young children with type 1 diabetes: association with hyperglycemia. Diabetes. 2015; 64: 1770–1779.
- Gummerson I. An update on insulin analogues. Pharm. J. 2006 Aug; 277: 169–172.
- Raine J. E., et al. Practical endocrinology and diabetes in children. 2nd ed. 2006. doi: 10.1002/9780470994856.
- Abraham M. B., Jones T. W., Naranjo D., et al. ISPAD Clinical Practice Consensus Guidelines 2018: assessment and management of hypoglycemia in children and adolescents with diabetes. Pediatr. Diabetes. 2018; 19 (Suppl. 27): 178–192.
- Tsalikian E., Tamborlane W., Xing D., et al.; Diabetes Research in Children Network (DirecNet) Study Group. Blunted counterregulatory hormone responses to hypoglycemia in young children and adolescents with well-controlled type 1 diabetes. Diabetes Care. 2009; 32: 1954–1959.
- Hershey T., Perantie D. C., Warren S. L., Zimmerman E. C., Sadler M., White N. H. Frequency and timing of severe hypoglycemia affects spatial memory in children with type 1 diabetes. Diabetes Care. 2005; 28: 2372–2377.
- Gagnum V., Stene L. C., Jenssen T. G., et al. Causes of death in childhood-onset type 1 diabetes: long-term follow-up. Diabet. Med. 2017; 34: 56–63.
- Frier B. M. How hypoglycaemia can affect the life of a person with diabetes. Diabetes Metab. Res. Rev. 2008; 24: 87–92.
- Diabetes Control and Complications Trial Research Group. Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes Control and Complications Trial. J. Pediatr. 1994 Aug; 125 (2): 177–188. doi: 10.1016/s0022–3476(94)70190–3. PMID: 8040759.
- Deiss D., Kordonouri O., Hartmann R., Hopfenmüller W., Lüpke K., Danne T. Treatment with insulin glargine reduces asymptomatic hypoglycemia detected by continuous subcutaneous glucose monitoring in children and adolescents with type 1 diabetes. Pediatr. Diabetes. 2007 Jun; 8 (3): 157–162. doi: 10.1111/j.1399–5448.2007.00252.x. PMID: 17550426.
- Robertson K. J., Schoenle E., Gucev Z., Mordhorst L., Gall M. A., Ludvigsson J. Insulin detemir compared with NPH insulin in children and adolescents with type 1 diabetes. Diabet. Med. 2007 Jan; 24 (1): 27–34. doi: 10.1111/j.1464–5491.2007.02024.x. PMID: 17227321.
- Liu M., Zhou Z., Yan J., et al. A randomised, open-label study of insulin glargine or neutral protamine Hagedorn insulin in Chinese paediatric patients with type 1 diabetes mellitus. BMC Endocr. Disord. 2016; 16: 67. doi: 10.1186/s12902–016–0146–2.
- Becker R. H.A., Dahmen R., Bergmann K., Lehmann A., Jax T., Heise T. New insulin glargine 300 units·mL‑1 provides a more even activity profile and prolonged glycemic control at steady state compared with insulin glargine 100 Units·mL‑1. Diabetes Care. 2015; 38: 637–643.
- Steinstraesser A., Schmidt R., Bergmann K., Dahmen R., Becker R. H.A. Investigational new insulin glargine 300 U/ml has the same metabolism as insulin glargine 100 U/ml. Diabetes Obes. Metab. 2014; 16: 873–876.
- Clements J. N., Threatt T., Ward E., Shealy K. M. Clinical pharmacokinetics and pharmacodynamics of insulin glargine 300 U/mL. Clin. Pharmacokinet. 2017 May; 56 (5): 449–458. doi: 10.1007/s40262–016–0464–6. PMID: 27699623.
- European Medicines Agency [Електронний ресурс]. — Режим доступу: https://www.ema.europa.eu/en/medicines/human/EPAR/toujeo-previously-optisulin.
- Vargas-Uricoechea H. Efficacy and safety of insulin glargine 300 U/mL versus 100 U/mL in diabetes mellitus: a comprehensive review of the literature. J. Diabetes Res. 2018 Feb 12; 2018: 2052101. doi: 10.1155/2018/2052101. PMID: 29619381; PMCID: PMC5830021.
- Danne T., Tamborlane W. V., Malievsky O. A., et al. Efficacy and safety of insulin glargine 300 Units/mL (Gla‑300) versus insulin glargine 100 Units/mL (Gla‑100) in children and adolescents (6–17 years) with type 1 diabetes: results of the EDITION JUNIOR randomized controlled trial. Diabetes Care. 2020; 43 (7): 1512–1519. doi: 10.2337/dc19–1926.
- Owens D. R. Pharmacokinetics and pharmacodynamics of insulin glargine 300 U/mL in the treatment of diabetes and their clinical relevance. Expert Opin. Drug Metab. Toxicol. 2016 Aug; 12 (8): 977–987. doi: 10.1080/17425255.2016.1202916. PMID: 27453980.
