Лікування цукрового діабету при хронічній хворобі нирок (за рекомендаціями KDIGO, 2020)
Переклала й адаптувала канд. мед. наук Ольга Королюк
Поширеність хронічної хвороби нирок (ХХН) істотно збільшується. Цукровий діабет (ЦД) є не лише найчастішою причиною ХХН і ниркової недостатності, а й вагомим чинником серцево-судинного ризику. Лікування ЦД у пацієнтів із ХХН є проблемним через невелику кількість інформативних досліджень. Поява доказових даних щодо переваг нових класів лікарських засобів у цій когорті зумовила потребу оновлення рекомендацій 2018 року. Повна версія, що включає 12 рекомендацій і 48 практичних настанов, доступна за посиланням: https://kdigo.org/guidelines/diabetes-ckd. Пропонуємо реферативний огляд основних практичних моментів рекомендацій 2020 року.
Комплексний догляд
Зважаючи на значну поширеність поліморбідності в цій когорті, лікування потребує мультидисциплінарного підходу із залученням лікарів первинної ланки, нефрологів, ендокринологів, кардіологів і дієтологів. Комплексна терапія має включати зміни способу життя та лікування супутньої патології. Такий підхід сповільнює прогресування ХХН і знижує ризик розвитку серцево-судинних захворювань (ССЗ). Вибір фармакотерапії залежить від тяжкості ХХН і може потребувати модифікації за умови погіршення функції нирок.
Блокада ренін-ангіотензинової системи
Пацієнтам із ЦД, артеріальною гіпертензією (АГ) й альбумінурією рекомендовано інгібітор ангіотензинперетворювального ферменту (іАПФ) або блокатор рецепторів ангіотензину II (БРА) з титруванням до максимально переносної дози (1B).
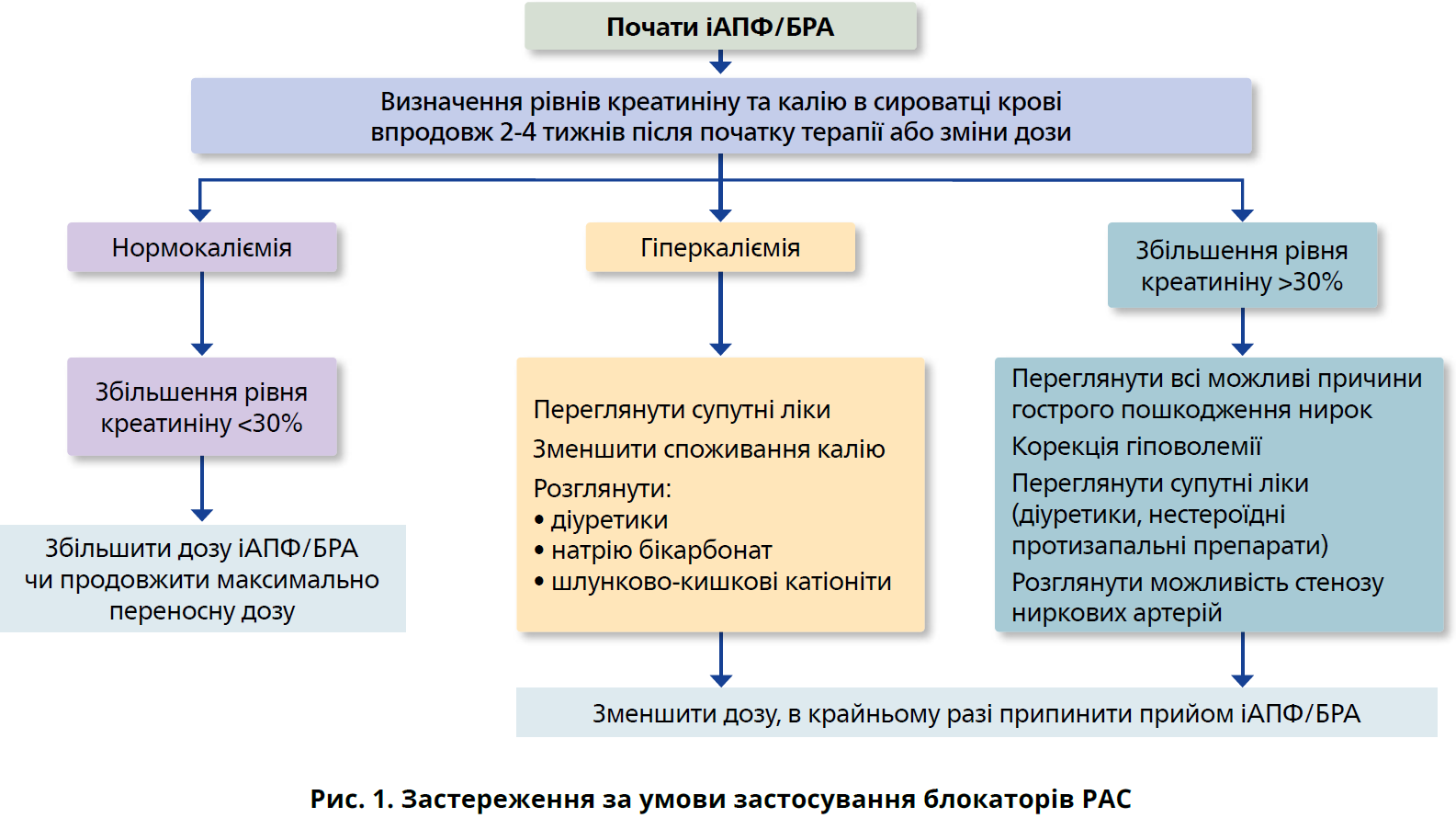
Інгібітори ренін-ангіотензинової системи (РАС) уповільнюють прогресування ХХН в осіб з АГ й альбумінурією незалежно від впливу на артеріальний тиск. Отже, пацієнтам із ЦД, АГ й альбумінурією (відношення альбумін/креатинін у сечі >30 мг/г) показаний інгібітор РАС, який титрують до максимально переносної дози з ретельним моніторингом рівнів калію та креатиніну в сироватці крові впродовж 2-4 тижнів від початку лікування або зміни дози (рис. 1).
Комбінація іАПФ + БРА шкідлива, її призначення пацієнтам із ХХН і ЦД треба уникати. При резистентній АГ доцільно додавати антагоніст мінералокортикоїдних рецепторів (АМР). Нещодавнє дослідження FIDELIO продемонструвало, що додавання селективного АМР фінеренону до блокатора РАС сповільнює прогресування ХХН і знижує ризик серцево-судинних подій у пацієнтів із ЦД 2 типу. Сильний зв’язок між альбумінурією та прогресуванням ХХН і ССЗ дає змогу розглядати призначення блокатора РАС пацієнтам із ЦД, альбумінурією навіть за відсутності АГ. Проте за відсутності альбумінурії інгібітори РАС не мають захисних ниркових ефектів, а для зниження ризику розвитку ССЗ можна використовувати інші антигіпертензивні засоби.
Загалом інгібітори РАС добре переносяться пацієнтами з ХХН і ЦД. Виникнення кашлю під час лікування іАПФ обґрунтовує перехід на БРА. Гіперкаліємія на початку терапії або під час титрування потребує зменшення споживання калію, призначення діуретиків, а також бікарбонату натрію та шлунково-кишкових катіонітів пацієнтам із метаболічним ацидозом. На початку терапії в період титрування можлива азотемія. Проте якщо підвищення не досягає 30% від початкового рівня, лікування блокатором РАС можна продовжити. Дозу треба зменшити за таких обставин: гостре пошкодження нирок, симптоматична гіпотензія та стійка гіперкаліємія (рис. 1).
Цілі та контроль глікемії
Показник глікованого гемоглобіну (HbA1c) рекомендовано використовувати для глікемічного контролю (1C).
Рівень HbA1c — основний інструмент моніторингу глікемії в пацієнтів із ХХН і ЦД. Порівняно з прямим вимірюванням глікемії точність і надійність цього методу залишаються задовільними до рівня розрахованої швидкості клубочкової фільтрації (рШКФ) 30 мл/хв/1,73 м2. У пацієнтів із нижчими рівнями рШКФ зменшення тривалості життя еритроцитів занижує значення HbA1c, особливо в осіб, які перебувають на діалізі й отримують еритропоетинстимулювальні засоби. Тож інтерпретація показників HbA1c потребує врахування вказаних обмежень в осіб із низькими рівнями рШКФ, особливо <15 мл/хв/1,73 м2.
Альтернативним методом контролю, на який не впливає ХХН, є безперервний моніторинг глюкози крові. Як і самоконтроль глікемії, цей метод особливо корисний, коли показники HbA1c не відповідають паралельно виміряним рівням глікемії або клінічним симптомам.
Пацієнтам, які не перебувають на діалізі, рекомендовано індивідуальні цільові показники HbA1c у діапазоні від <6,5 до <8,0% (1C).
Цільові рівні глікемії мають бути індивідуалізовані та можуть коливатися від <6,5 до <8% залежно від індивідуальних чинників ризику гіпоглікемії. Збільшення доступності лікарських засобів із низьким ризиком гіпоглікемії, як-от інгібітор натрійзалежного котранспортера глюкози 2 типу (іНЗКТГ-2), агоністи рецепторів глюкагоноподібного пептиду‑1 (арГПП‑1) та інгібітори дипептидилпептидази‑4, дає змогу досягнути жорсткіших цілей.
Відмова від куріння
Пацієнтам, які вживають тютюнові вироби, рекомендовано відмовитися від куріння (1D).
Куріння є однією з основних причин смертності й асоціюється з прогресуванням ХХН і ССЗ. Потенційні переваги відмови від куріння в пацієнтів із ЦД та ХХН вивчали лише в декількох дослідженнях. Утім, переконлива користь для здоров’я й економічні переваги припинення куріння серед населення загалом обумовлюють доцільність цієї рекомендації.
Модифікація способу життя
Дієта
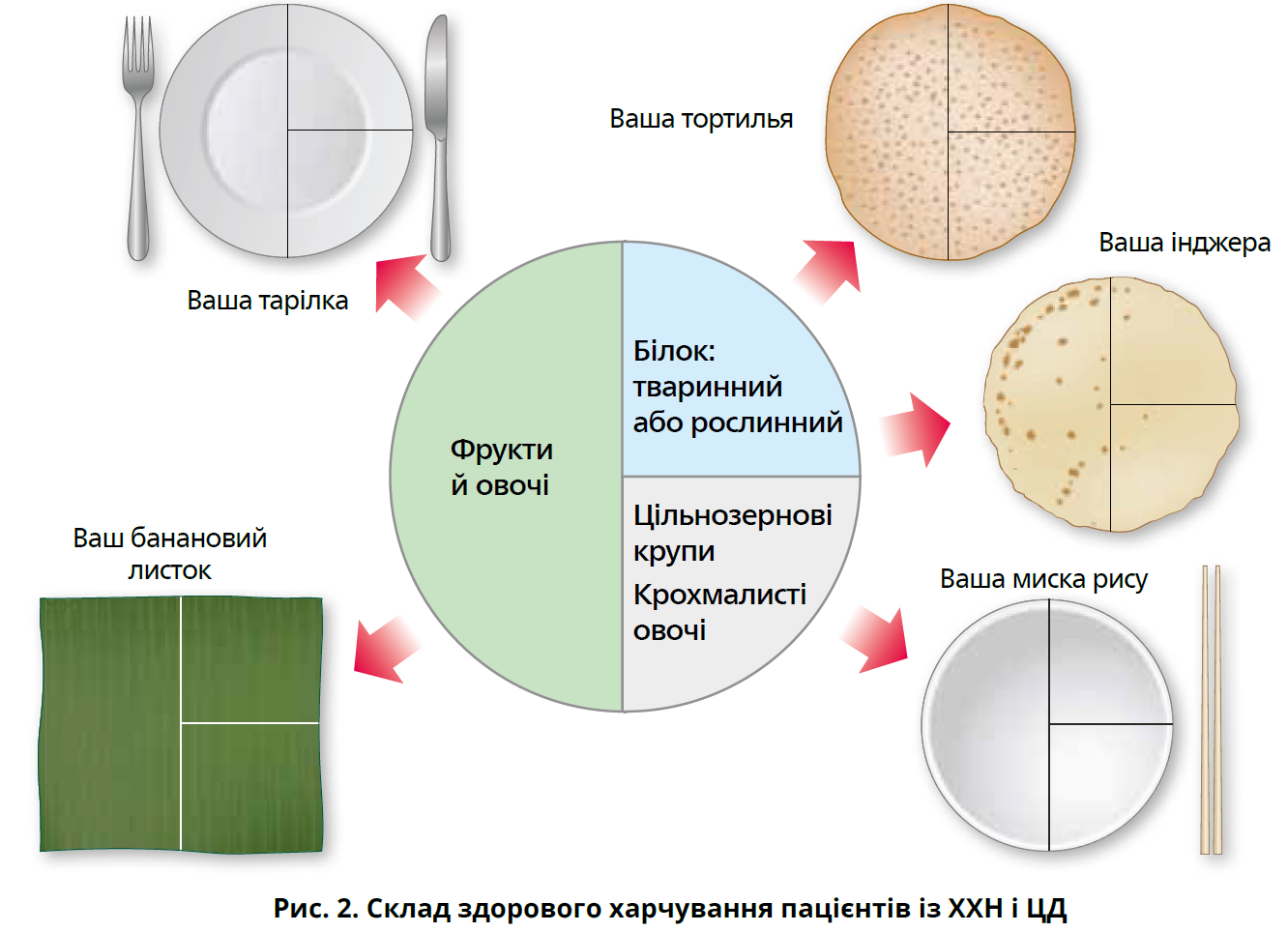
На відміну від загальної популяції та хворих на ЦД з нормальною функцією нирок, пацієнти з ХХН часто потребують корекції харчування, а саме збільшення або обмеження споживання певних поживних речовин. Нерідко цьому перешкоджають культурні або особисті цінності й уподобання пацієнтів. Харчування має бути здоровим і збалансованим із високим умістом овочів, фруктів, цільного зерна, клітковини, бобових, рослинних білків, ненасичених жирів, горіхів та обмеженням готових м’ясних виробів, рафінованих вуглеводів і підсолоджених напоїв (рис. 2).
Для пацієнтів із ХХН і ЦД, які не перебувають на діалізі, рекомендовано споживання білка 0,8 г/кг/добу (2C).
Припущення про те, що обмеження харчових білків здатне зменшити клубочкову гіперфільтрацію та сповільнити прогресування ХХН, не підтверджено результатами клінічних досліджень.
Отже, добове споживання білка треба підтримувати на рівні, рекомендованому Всесвітньою організацією охорони здоров’я для загальної популяції (≈0,8 г/кг маси тіла). Потреби пацієнтів на замісній
терапії, насамперед перитонеальному діалізі, можуть бути вищими (до 1,0–1,2 г/кг) для компенсації катаболізму та негативного азотного балансу.
Рекомендоване споживання натрію становить <2 г/добу, тобто <5 г/добу хлориду натрію (2C).
Зниження функції нирок посилює затримку натрію, що призводить до АГ, подальшої дисфункції нирок і вищого ризику виникнення серцево-судинних ускладнень.
Фізична активність
Пацієнтам із ХХН і ЦД рекомендовано фізичну активність помірної інтенсивності тривалістю ≥150 хв/тиждень або відповідно до серцево-судинної та фізичної толерантності (1D).
Пацієнти з ХХН і ЦД часто ведуть малорухливий спосіб життя з нижчим рівнем фізичної активності, ніж у загальній популяції. Гіподинамія асоціюється з несприятливими клінічними наслідками. Дані клінічних досліджень щодо ефектів різних програм фізичної активності в цій когорті обмежені. Ймовірно, у хворих на ЦД підвищення фізичної активності забезпечує кардіометаболічні, ниркові та когнітивні переваги, покращує загальне самопочуття та якість життя.
Протидіабетична фармакотерапія
Цукровий діабет 1 типу
Досліджень щодо оцінки нових пероральних протидіабетичних засобів у поєднанні з різними схемами введення інсуліну в пацієнтів із ХХН і ЦД 1 типу недостатньо. Отже, протидіабетична терапія має відповідати прийнятим міжнародним настановам із лікування діабету 1 типу.
Цукровий діабет 2 типу
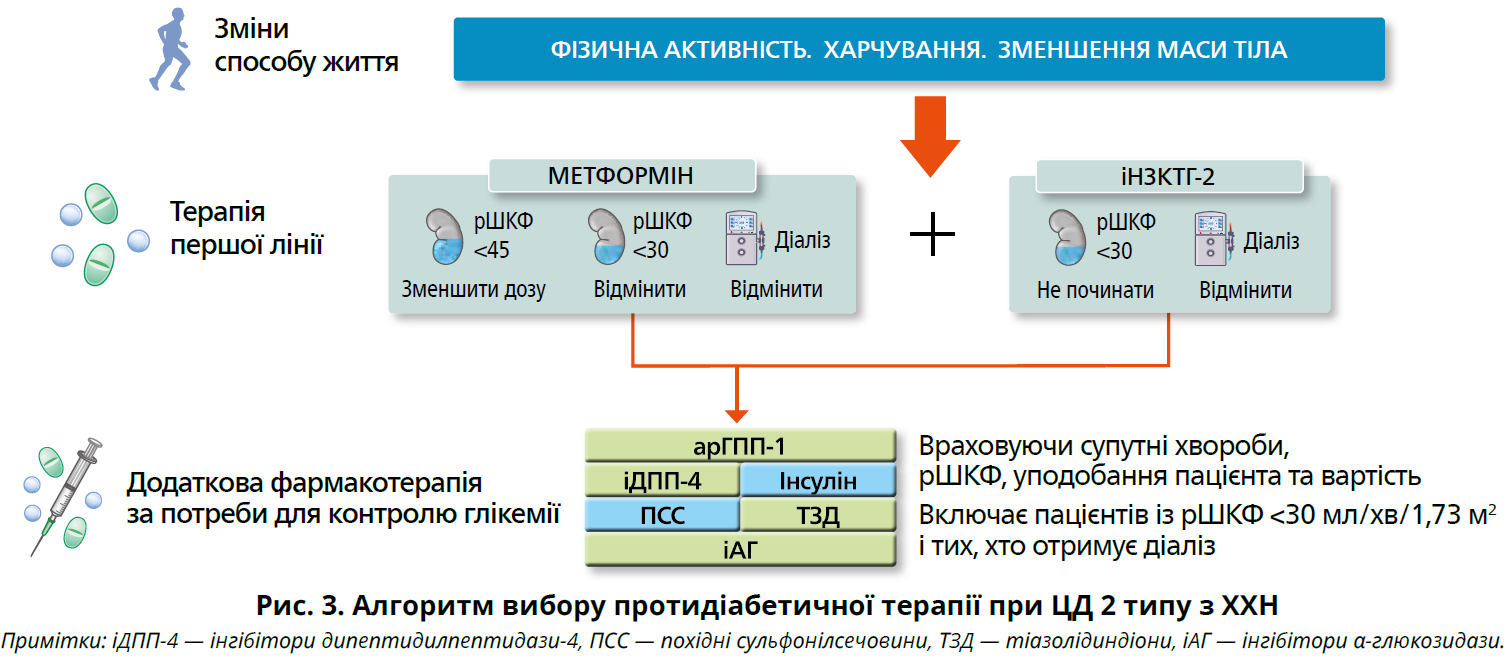
Пацієнтам із ХХН і ЦД 2 типу з показниками рШКФ ≥30 мл/хв/1,73 м2 рекомендовано метформін (1B) або іНЗКТГ-2 (1A).
Протидіабетична терапія включає модифікацію способу життя та застосування засобів першої лінії — метформіну або іНЗКТГ-2 у пацієнтів із показниками рШКФ ≥30 мл/хв/1,73 м2. Метформін — недорогий засіб, що ефективно знижує рівень глюкози та загалом добре переноситься. Його тривале застосування (>4 років) може спричиняти дефіцит вітаміну В12, що зумовлює потребу в контролі рівня кобаламіну крові. Зниження функції нирок іноді призводить до накопичення метформіну та підвищує ризик лактатацидозу, хоча абсолютний ризик цього ускладнення дуже низький. Пацієнтам, які приймають метформін, показано контроль рШКФ і зменшення дози при показниках <45 мл/хв/1,73 м2; скасування при рШКФ <30 мл/хв/1,73 м2 або нирковій недостатності (рис. 3).
Препарати класу іНЗКТГ-2 сповільнюють прогресування ХХН і суттєво знижують ризик серйозних несприятливих серцево-судинних подій. Доведено також здатність до зменшення ризику серцево-судинної смерті та госпіталізації з приводу серцевої недостатності в пацієнтів зі зниженою фракцією викиду, зокрема й у тих, які приймали блокатори РАС. Указані позитивні впливи спостерігалися в усіх категоріях альбумінурії (включно з нормальною екскрецією альбуміну) та ХХН (рШКФ від 30 до 44 мл/хв/1,73 м2), незважаючи на меншу гіпоглікемічну активність в осіб із нижчими рівнями рШКФ. Отже, позивні ефекти іНЗКТГ-2 не пропорційні до зниження HbA1c та не пояснюються виключно гіпоглікемічною дією. З практичного погляду іНЗКТГ-2 можна додавати до інших протидіабетичних засобів, коли цільові рівні глікемії не досягнуті або коли їх можна ще більше знизити без ризику гіпоглікемії. Ризик гіпоглікемії особливо високий у пацієнтів, які лікуються похідними сульфонілсечовини або інсуліном, тому додавання іНЗКТГ-2 може потребувати зниження доз або відміну цих засобів.
На початку терапії іНЗКТГ-2 усіх пацієнтів треба проінформувати про потенційні побічні ефекти. Часто виникають гіповолемія, зниження артеріального тиску та втрата маси тіла. Пацієнтам із високим ризиком гіповолемії варто пояснити симптоми гіповолемії та гіпотензії, а також розглянути можливість зменшення доз діуретиків. У перші тижні терапії можливе помірне транзиторне зниження рШКФ гемодинамічного характеру, яке зазвичай не є підставою для відміни препарату. Навіть коли рШКФ знижується <30 мл/хв/1,73 м2, лікування можна продовжити, доки воно добре переноситься та не потрібен діаліз. Важливе значення має подальший моніторинг глікемії, об’ємного статусу й інших побічних ефектів, зокрема грибкових інфекцій сечостатевих шляхів і діабетичного кетоацидозу. В одному
дослідженні висловлено занепокоєння щодо підвищення ризику ампутації нижніх кінцівок.
Пацієнтам, які не досягли індивідуальних цільових показників глікемії під впливом вказаних засобів або не можуть їх використовувати, рекомендовано арГПП‑1 тривалої дії (1B).
Якщо препарати першої лінії недоступні, погано переносяться або не забезпечують досягнення індивідуальних цільових рівнів глікемії, показано додаткову терапію, яку обирають з огляду
на рШКФ, наявність супутніх захворювань, уподобання пацієнта та вартість (рис. 4). Загалом бажаними додатковими засобами є арГПП‑1 через доведену здатність до зниження ризику серцево-судинних подій, особливо серед пацієнтів з атеросклеротичним ССЗ, і потенціал запобігання макроальбумінурії та подальшому зниженню рШКФ. Насамперед це стосується ін’єкційних арГПП‑1 тривалої дії.
Хоча клінічні дослідження не проводилися виключно в популяціях із ХХН, вони включали пацієнтів із рШКФ аж до 15 мл/хв/1,73 м2.
Література
Navaneethan S.D., Zoungas S., Caramori M.L., et al. Diabetes management in chronic kidney disease: synopsis of the 2020 KDIGO Clinical Practice Guideline. Ann. Intern. Med. 2021 Mar; 174 (3): 385-394. doi: 10.7326/M20-5938.
Освітньо-практичний журнал Ендо Practise №1 2022